磷脂与食品中蛋白质相互作用机制及对蛋白质特性的影响研究进展
吴劲轩,夏文银,夏川林,蒲 军,郭俊英,冯 俊,王香君,殷 浩
(四川省农业科学院蚕业研究所,四川南充 637000)
磷脂是一类含有磷酸基类脂的总称,广泛存在于动植物组织中,是重要的两性表面活性剂,具有乳化作用、形成胶团作用、界面吸附作用等,在食品加工中具有广泛应用[1]。磷脂与蛋白质、谷物和淀粉结合之后,能够极大改善食品的可食用品质,增强其营养价值,磷脂现已广泛用于烘焙食品、速溶产品(奶粉)、保健品、医药、化妆品等行业中[2]。磷脂可在食品乳浊液中以乳化剂形式存在,与其他稳定剂结合发挥乳化作用,如乳制品。磷脂可用作食用香料的微胶囊壁材,与脂质体形成微胶囊。磷脂也可以充当速溶剂从而改善豆奶粉等粉末产品在液体中的速溶效果[3]。
食品是含有很多成分的复杂体系,研究磷脂与食品中其他组分间的相互作用对于调控食品品质、优化配料配方等方面具有重要作用[4]。磷脂与蛋白质之间的相互作用已有很多报道,这些相互作用会影响富含蛋白质产品的品质。Mantovani等[5]研究发现添加卵磷脂分别提高了大豆蛋白和乳清蛋白乳液的稳定性。本文介绍了食品中大豆蛋白、酪蛋白、乳清蛋白、肌原纤维蛋白等蛋白质与磷脂相互作用机制及其对蛋白质功能特性的影响等,以期为深入了解磷脂与蛋白质间的相互作用,提高富含蛋白制品如乳制品、豆制品、肉糜制品等食品品质提供一定的理论依据。
1 磷脂概述
磷脂(phospholipid),也称为磷脂类、磷脂质,是组成动植物细胞膜、核膜及各种细胞器膜结构的基本成分,在人体生命活动中发挥着重要作用[6],主要存在于大豆、花生、棉籽等油料种子以及蛋黄中。按照来源,可分为动物来源、植物来源和微生物来源:动物磷脂主要来自蛋黄、脑组织、牛奶、肝脏及肌肉组织等;植物磷脂主要来源于大豆、棉籽、亚麻籽、菜籽、葵花籽及花生等油料种子[3];微生物来源的磷脂主要是细菌和酵母菌等[7]。磷脂根据化学结构分为甘油磷脂和神经鞘磷脂两类。鞘磷脂是神经醇磷脂的典型代表之一,是神经氨基醇与磷酸、脂肪酸、胆碱形成的物质,只存在于动物来源的磷脂,不存在于大豆磷脂中[5]。甘油磷脂是磷酸、甘油、脂肪酸等化合物的衍生物,根据分子上的磷基团位于甘油骨架Sn-1和Sn-2位,可以分为α-和β-磷脂。通常自然界存在的磷脂为L-α-型[3],其结构通式如图1:

图1 磷脂结构式
式中R1,R2是碳数14~18的饱和脂肪酸或不饱和脂肪酸。根据不同的取代基-X,磷脂可分为磷脂酰胆碱(Phosphatidylcholine,PC)、磷脂酰乙醇胺(Phosphatidyl ethanolamine,PE)、磷脂酰肌醇(Phosphatidylinositol,PI)以及磷脂酰丝氨酸(Phosphatidylserine,PS)等[3]。磷脂最重要的特征是具有两亲的分子结构,具有亲水性和亲脂性,胆碱和磷酸等基团为亲水基,两个脂肪酸链为疏水基[8],常作为两性表面活性剂、乳化剂。磷脂是构成动物肌内脂肪的重要物质,约占肌内脂肪50%以上(亦称为肌内磷脂),大多与肌肉膜蛋白结合紧密[9],肌内磷脂含有丰富的多不饱和脂肪酸,如花生四烯酸、亚麻酸和长链脂肪酸,易水解和氧化,是肉中脂肪水解氧化的主要底物,也是主要的风味前体物质[10],与肉制品风味和品质的形成密切相关[11]。
2 磷脂与蛋白质的相互作用
2.1 磷脂与大豆蛋白的相互作用机制
大豆蛋白因具有凝胶性、乳化性和起泡性等功能特性,广泛应用于食品加工中,其主要组分包括β-伴大豆球蛋白7S(β-conglycinin)和大豆球蛋白11S(glycinin)[12]。但是天然的大豆蛋白很难满足食品加工对其功能特性的各种需求,所以需要进行适当的改性。磷脂作为一种两性离子表面活性剂,经常被用于降低乳液的界面张力,用于保证食品级乳状液的稳定性[13]。磷脂与大豆蛋白之间的相互作用研究较多,磷脂可以通过与大豆蛋白之间的相互作用来改善蛋白质的乳化特性[14],对大豆蛋白在食品加工中的应用有重要的作用。Ohtsuru等[15]提出了磷脂酰胆碱与大豆蛋白的两种相互作用方式:一种是磷脂酰胆碱或其形成的片层结构与蛋白质的疏水区域通过疏水相互作用结合(图2a),另一种是磷脂头部的极性基团与蛋白质之间的静电相互作用(图2b),并提出了磷脂与大豆蛋白结合的模型,如图2c所示。Mantovani等[16]研究发现卵磷脂和大豆蛋白可以直接通过疏水作用和静电作用结合,从而引起蛋白质构象变化,从而改善蛋白质的功能特性。Li等[17]研究发现在纳米乳液中磷脂酰胆碱对大豆分离蛋白(SPI)的荧光猝灭方式为静态猝灭,即在基态时形成了SPI-PC复合物,且疏水相互作用是稳定复合物的主要作用力。磷脂与大豆两种球蛋白11S和7S之间的相互作用程度是不同的。Li等[18]研究发现卵磷脂对大豆11S和7S蛋白荧光的猝灭方式均为静态猝灭,均形成了络合物,疏水相互作用为主要作用力,在结合过程中蛋白质结构展开,使更多的Trp和Tyr包埋于二者相结合而形成的疏水区域里,且11S与磷脂的结合更容易引起Trp和Tyr微环境以及多肽骨架结构的变化,与磷脂结合更容易,更牢固[3]。
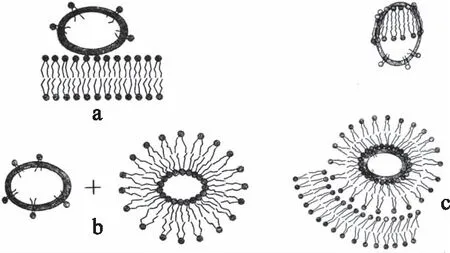
图2 磷脂与大豆蛋白的相互作用
2.2 磷脂与乳蛋白的相互作用机制
乳蛋白主要包括乳清蛋白(whey protein)、酪蛋白(casein)和脂肪球膜蛋白等[19]。在实际生产中,热处理是乳制品工业的关键环节,用以保证乳制品的质量,但加热过程中会促使乳清蛋白变性,酪蛋白胶束结构改变,导致蛋白聚集和胶凝[20],继而出现脂肪上浮、蛋白质沉淀等现象,使乳液热稳定性降低,因而加入适量的表面活性剂是形成稳定的乳液的有效方法之一。大豆磷脂常用作表面活性剂,对牛奶乳状液的热稳定性有重要影响。大豆磷脂通过疏水相互作用与乳蛋白结合使蛋白的构象发生改变,增加乳状液中粒子间的斥力,抑制巯基的氧化,从而提高了乳状液的热稳定性[21]。Le等[22]研究发现在牛奶热处理期间产生的热聚沉现象是因为乳清蛋白和酪蛋白胶束相互作用,并证实了在牛奶加热过程中,水解大豆磷脂或羟基化大豆磷脂会优先结合到乳清蛋白表面,导致乳清蛋白不能和酪蛋白再结合,进而避免酪蛋白胶束发生聚沉现象,模拟过程如图3所示。同时大豆磷脂和酪蛋白结合可以保护新生的脂肪球表面,改变脂肪球结构,并降低热处理过程中吸附的总界面蛋白含量[23],进而提高乳液的热稳定性。Gallier等[24]利用磷脂-酪蛋白单层膜作为模型系统,以模仿天然牛乳脂肪小球膜的结构,研究发现静电和疏水相互作用是膜系统中磷脂和酪蛋白间的主要作用力。在乳制品加热过程中,磷脂与乳清蛋白的相互作用更加值得研究。大豆磷脂主要通过疏水相互作用改变乳清蛋白的二级结构,降低了热诱导过程中蛋白质分子间的相互作用,在一定程度上阻止乳清蛋白热诱导的凝胶形成,从而防止了热诱导的蛋白质聚集[25-26]。同时,Yi等[27]研究发现乳清蛋白可以通过静电作用、疏水相互作用和氢键与脂质体(由大豆磷脂和胆固醇制备)发生相互作用,导致乳清蛋白二级结构发生改变,使无规则卷曲含量增加,α-螺旋含量减少,从而进一步优化含乳清蛋白产品的热稳定性。

图3 牛奶加热过程中磷脂与乳清蛋白的相互作用
2.3 磷脂与肌原纤维蛋白的相互作用机制
肌原纤维蛋白(myofibrillar protein,MP)是总肌肉蛋白(55%~65%)的主要成分,不仅是肌细胞中具有收缩功能的肌纤维的重要组成部分,还是一类具有重要生物学功能的结构蛋白质群[28]。MP主要包括肌球蛋白、肌动蛋白、肌动球蛋白和调节蛋白(原肌球蛋白、肌钙蛋白)等[29]。在肉糜制品加工过程中,MP加热后形成凝胶的能力对肉制品的品质和加工特性有重要影响,特别是加工肉制品的质构特性、保水性和感官特性[30]。肌内磷脂是组成动物肌内脂质的主要成分(约占50%以上),富含不饱和脂肪酸,是肉制品中风味化合物的重要前体[11]。Xia等[31]研究发现磷脂对MP的猝灭方式主要是静态猝灭,表明MP与磷脂在基态时相互作用生成了复合物。在复合凝胶体系中,磷脂与MP主要相互作用力是疏水相互作用和氢键,而磷脂的添加会抑制MP二硫键的形成,从而影响热诱导凝胶网络结构的形成。磷脂亲水性头部可通过氢键与蛋白质结合,而其疏水性脂肪酸链可在凝胶形成过程中通过疏水相互作用与蛋白疏水性区域结合,这种作用促使MP凝胶形成更为紧密的网络结构,从而改善其凝胶特性,其互作机制如图4所示。磷脂与MP通过疏水相互作用结合后,磷脂附着于蛋白表面,自由基优先攻击磷脂,降低了蛋白质氨基酸侧链被攻击的几率,抑制蛋白氧化[32]。Marín等[33]将不同的大豆磷脂酰胆碱脂质体添加到肌肉中有助于增加系统的水结合力并提高蛋白质的热稳定性,脂质体(水分散体)通过促进蛋白质结构的展开而诱导其快速凝胶化,进而干扰肌原纤维蛋白的热凝胶作用。
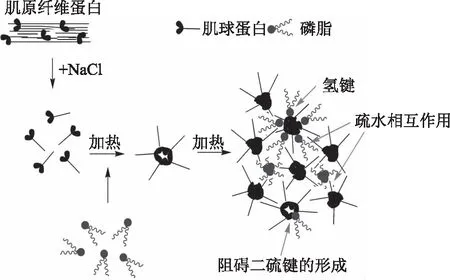
图4 磷脂与肌原纤维蛋白在凝胶形成过程的互作机制
2.4 磷脂与其他蛋白的相互作用
除了上述的几种蛋白质与磷脂存在相互作用之外,食品中其他蛋白如麦醇溶蛋白、谷蛋白、热休克蛋白等也会与磷脂发生相互作用。张牧焓等[34]研究了PC和热休克蛋白90(Hsp90)的互作机制,结果发现PC对Hsp90的内源荧光有较强的静态猝灭作用,主要通过氢键和范德华力结合,且PC的极性头部和脂肪酸链均可与Hsp90发生稳定的结合。在面团发酵过程中,磷脂与麦醇溶蛋白或谷蛋白发生相互作用,磷脂和面筋蛋白在发酵过程中具有协同作用,从而稳定气体,形成了更强的面筋网络[35]。Yang等[36]制备了负载姜黄素(Cur)的麦醇溶蛋白-卵磷脂纳米颗粒,研究发现Cur与麦醇溶蛋白和卵磷脂之间的主要作用力为氢键、静电作用和疏水相互作用。玉米醇溶蛋白被广泛用于制造包埋Cur、叶黄素等功能性成分的纳米颗粒,Dai等[37]制备了负载Cur的玉米醇溶蛋白-卵磷脂纳米颗粒,研究发现在磷脂浓度相对较低时,磷脂的烷基链可能嵌入玉米蛋白的疏水颗粒的区域,从而减少了部分展开的疏水区域并导致复合纳米颗粒的聚集,而玉米蛋白、卵磷脂和Cur之间的相互作用随着磷脂浓度的增加而增加。磷脂的烷基链主要通过疏水相互作用、氢键和静电作用与玉米醇溶蛋白和Cur相互作用(图5),形成更致密的结构,并抑制纳米颗粒的聚集。孙禹凡等[38]研究发现在Oleosin蛋白和PC制备的乳液中,PC与Oleosin蛋白可能发生疏水相互作用,改变蛋白的表面活性,使其蛋白结构以及表面电荷发生变化,甚至可能将蛋白包裹于PC形成的囊泡和胶束中,在油水界面形成相对稳定的界面膜,促进重组油体的稳定。

图5 负载姜黄素的玉米醇溶蛋白-卵磷脂复合纳米颗粒的形成机理
2.5 磷脂与蛋白质相互作用的影响因素
磷脂和蛋白质之间的相互作用会受其自身特性和外界条件的影响,主要分为内在因素和外界因素。内在因素主要有磷脂类型、蛋白质的种类及浓度等,外在因素主要包括pH、离子强度、温度、加工条件等。
2.5.1 内在因素 磷脂与蛋白质间的相互作用因磷脂和蛋白质的种类以及浓度不同而有所差异,这主要与磷脂和蛋白质的结构特性及作用强度不同有关。磷脂的极性头部基团以及其脂肪酸组成是调控磷脂诱导的蛋白变性过程的决定性因素,与磷脂的极性有关。磷脂属于两性离子活性剂,在不同pH介质中可表现出阳离子或阴离子表面活性剂的性质。阴离子表面活性剂与蛋白质发生强烈的相互作用,形成蛋白质-表面活性剂复合物,并诱导蛋白质结构的展开,而非离子表面活性剂结合作用较弱。磷脂与乳清蛋白主要通过疏水作用结合,其作用力随磷脂疏水链长度增加而增加[25]。Wang等[39]通过对不同浓度的大豆磷脂对乳清蛋白分离物(WPI)乳液的影响研究,发现乳状液的稳定性取决于磷脂和WPI在界面上的相互作用,在磷脂浓度较低时,乳液的液滴大小、Zeta电位和粘弹性显著降低,磷脂和WPI在界面上的协同作用可以赋予乳液良好的特性。而在高磷脂浓度下,由于竞争性吸附机制,乳液平均粒径几乎没有变化,Zeta电位有所增加,并在乳液储存过程中出现明显的乳化。
蛋白质的浓度与类型对磷脂与蛋白质的相互作用影响较大,大豆蛋白、乳蛋白和肌原纤维蛋白等分别与磷脂的相互作用类型均不同,大豆蛋白和乳清蛋白主要通过疏水相互作用与磷脂结合,静电作用次之,而MP与磷脂之间的相互作用主要是疏水相互作用、氢键及二硫键,并且其作用强度与蛋白浓度有关。适宜配比的蛋白质与磷脂能发生疏水相互作用使乳化层保持致密完整,而在蛋白质含量较低时液滴直径大小差异较大,当蛋白质含量过高时,乳液产生不规则的非球状,对乳液的均一有负面影响[40]。不同大豆蛋白(7S和11S)与磷脂之间相互作用强度不同,其疏水相互作用越强,乳液界面张力越低,乳液界面膜越稳定,乳滴粒径减小,从而增强乳液稳定性。乳液活性主要受到乳液液滴的粒径大小的影响,乳化稳定性主要与蛋白与卵磷脂之间的结合量及相互作用强弱有关[12]。
2.5.2 外界因素 外界环境因素会影响磷脂与蛋白质的相互作用,从而导致复合体系功能特性的变化。pH是影响大豆蛋白和卵磷脂乳化活性的重要因素,大豆蛋白制备的乳液对离子电荷的变化敏感,大豆分离蛋白-Lec水包油型乳状液的液滴大小和乳化率随pH的变化而变化[2],在不接近蛋白质等电点时,该乳化体系在乳化过程显示出更高的稳定性,而大豆蛋白-磷脂复合乳化体系在pH≥7时,乳化体系最稳定,此时的豆制品性能较好[41]。热变性大豆蛋白和磷脂间的相互作用变强,磷脂-蛋白乳化体系在热处理后其乳化特性增强[42]。MP属于盐溶性蛋白,离子强度对其影响较大。磷脂的亲水性头部有利于保留MP表面的水分子,能抑制MP在高盐浓度(0.7 mol/L)下产生的盐析效应[31],增加NaCl浓度会使磷脂-乳清蛋白乳液粒径增大,容易导致油滴聚集从而使乳液稳定性降低[40]。李秋慧等[43]研究发现将磷脂经过适度酶解时间(4 h),酶解改性后的产物会促进其与大豆分离蛋白的相互作用,在水油界面形成相对稳定的界面膜,提高乳液的乳化特性。不同物理处理对磷脂与蛋白质间相互作用的影响较大,如高压均质[44]、超声波[45]、射流空化[46]等,均可在一定程度上提高蛋白表面疏水性,暴露其疏水性基团,从而增强蛋白质与磷脂之间的相互作用强度,改善复合乳液的功能特性,并且高压均质作用的影响显著强于超声处理[44]。在液体介质中高压均质的动态搅拌和高速剪切等作用,会导致大豆蛋白的空间结构改变,诱导磷脂结构变化,促进大豆蛋白与磷脂间的融合与交互[47]。
3 磷脂与蛋白质相互作用对蛋白特性的影响
3.1 对蛋白质溶解度的影响
蛋白质的溶解度是衡量蛋白质结构变化的重要指标,是蛋白质最重要的功能特性之一[48]。当蛋白质如大豆蛋白作为食品加工中的添加剂时,要求其具有良好的溶解性与分散性。蛋白质溶解度对乳化性有重要的影响,蛋白质溶解度越高,其乳化活性越高,乳化稳定性越好。磷脂与蛋白质通过疏水相互作用结合后会使蛋白表面活性、乳液的结构和表面电荷发生改变,由于磷脂具有双亲结构,使复合物具有更多的亲水基团,可以提高蛋白在水中的分散性,使蛋白溶解度提高,降低复合乳液的絮凝及聚集现象[42]。李菊芳[3]研究发现复合磷脂与大豆蛋白粉相互作用后,大豆蛋白粉的溶解性显著提高,随着复合比例的增加,蛋白粉溶解性进一步增加。在肌原纤维蛋白凝胶形成过程中,添加磷脂后复合体系暴露了更多的酪氨酸残基或充当氢键受体,导致氢键作用增强,磷脂对蛋白质表面水分子的保护作用增强,从而抑制高盐浓度下的盐析效应,使蛋白溶解性提高[31]。
3.2 对蛋白质乳化特性的影响
蛋白质的乳化特性主要包括乳化稳定性和乳化活性,是表征乳液体系特性的重要指标。磷脂作为一种天然的两性表面活性剂,具有良好的乳化性,磷脂的疏水性脂肪酸链可以通过疏水相互作用与蛋白质结构中的疏水区域结合,而其亲水性基团则朝向水表面,这种磷脂-蛋白复合物在稳定乳浊液方面具有协同促进作用,有助于减少O/W乳液界面的张力,进一步提高乳液的热稳定性[14]。蛋白质与磷脂之间的相互作用会导致蛋白质的结构和乳液界面性质发生改变,提高乳液体系的乳化能力。蛋白-磷脂复合乳液的乳液活性主要与液滴的粒径大小有关,而乳化稳定性主要受到蛋白与磷脂之间的结合量及相互作用强弱的影响。蛋白与磷脂间相互作用的增强有利于形成更稳定的界面膜,增加乳液滴之间的静电斥力,使乳液界面张力降低,降低乳滴粒径[12]。同时由于磷脂与蛋白之间存在疏水相互作用,诱导蛋白质构象变化,使其乳化活性增加,磷脂的双亲性可使蛋白在水中的分散性能提高,防止形成的乳状液发生絮凝和聚集,提高了乳液体系的稳定性。Yi等[27]研究发现乳清蛋白通过静电作用、疏水相互作用以及氢键与脂质体(由大豆磷脂和胆固醇制备)发生相互作用,使乳清蛋白的乳化能力显著提高。李秋慧等[49]研究发现在SPI中添加一定量的溶血磷脂会促进磷脂与SPI的相互作用,降低其界面张力,在油-水界面形成比较稳定的界面膜,提高乳液体系的乳化性,使乳液粒径分布更加均匀,从而提高复合乳状液稳定性。但当磷脂添加量过高时,乳液体系的稳定性变差,这与界面上蛋白吸附含量降低、相互作用减弱、粒径分布不均匀有关。
3.3 对蛋白质凝胶特性的影响
凝胶特性是食品中蛋白质的重要功能特性之一,是形成食品特有的感官品质以及风味的决定性因素之一。蛋白质凝胶是蛋白质和蛋白质-溶剂间斥力和引力(疏水相互作用、氢键、二硫键等)之间相互平衡从而形成稳定有序的三维网络结构[50]。磷脂与蛋白质之间的相互作用对食品凝胶体系的流变性及微观结构等有很大的影响。在大豆蛋白中加入磷脂有利于凝胶网络结构的形成,李菊芳[3]将磷脂与大豆分离蛋白复合物制成凝胶,发现添加磷脂后蛋白凝胶的硬度降低,内聚性略有提高,同时热凝胶的弹性显著增强,大豆蛋白与磷脂的结合程度与其组分11S和7S有关,其中11S与磷脂相互作用较强,结合强度高于7S,其形成的凝胶特性也更好。毕爽等[51]研究发现SPI-磷脂复合体系构象的变化是影响复合体系凝胶特性的主要因素,磷脂与蛋白质的疏水区域结合后,促使蛋白质结构展开,改变SPI-磷脂复合体系中二级结构的组成,进一步暴露其疏水基团,促进体系的相互作用,使蛋白质-磷脂凝胶网络结构更加致密牢固。乳清蛋白与磷脂相互作用使磷脂结合于乳清蛋白凝胶网络结构中,从而使凝胶强度增强[50]。肌肉蛋白凝胶是决定肉制品品质的关键,在很大程度上影响肉制品的感官品质、质构、保水性等。Xia等[31]研究发现添加磷脂不会改变肌原纤维蛋白的流变模式,但在热诱导凝胶形成过程中,复合体系更多的肌原纤维蛋白疏水基团暴露并与磷脂疏水性尾部结合,氢键和疏水相互作用增强,有利于肌原纤维蛋白凝胶网络结构的增强,从而使复合凝胶的弹性和内聚性增加,同时磷脂可以抑制二硫键的形成,减少蛋白质的交联,从而降低复合凝胶的硬度和咀嚼性,有利于形成紧密有序的三维网络,从而提高了复合凝胶的持水能力。
4 磷脂与蛋白质相互作用表征方法
目前研究蛋白质和磷脂相互作用的方法较多,主要有荧光光谱法、拉曼光谱法、圆二色谱法、核磁共振技术、动态光散射、原子力显微镜、分子模拟等。荧光光谱法具有灵敏度高、用样量少等特点,是研究蛋白质与各种配体分子相互作用的常用方法[52]。Bourassa等[53]利用荧光光谱法和分子建模等方法研究了牛奶中α-酪蛋白和β-酪蛋白与脂质的相互作用,结果发现脂质主要通过疏水相互作用与酪蛋白结合形成更稳定的复合物,结合位点数为0.7~1.1,并且该相互作用改变了酪蛋白构象,使部分蛋白展开。拉曼光谱法、圆二色谱法以及红外光谱法均是研究蛋白质结构的常用光谱法。拉曼光谱技术属于振动光谱的一个分支,是红外光谱的有效补充,在保证样品完整性基础上,可以提供分子的振动或转动信息,从而反映磷脂与蛋白质复合体系空间构象的变化[54]。毕爽等[51]利用拉曼光谱研究发现超声波处理使复合体系结构发生变化,改变了色氨酸、酪氨酸所处的微环境,促进了大豆蛋白与卵磷脂发生疏水相互作用。核磁共振波谱技术是能够在原子分辨率下研究生物大分子三维结构的方法[55],其在蛋白质-小分子相互作用过程中应用广泛。低场脉冲核磁共振技术可估计凝胶体系中由蛋白质部分固定的水分子的不同部分的流动性和结构特性[56],Miklos等[57]利用核磁共振研究了肌原纤维蛋白和脂质复合凝胶中水和脂肪的流动性,结果发现脂肪酸组成和酰基甘油结构的差异显著影响肌原纤维蛋白的乳化能力。核磁共振可以更直接地评估蛋白质表面活性剂的相互作用。此外原子力显微镜技术、激光共聚焦显微镜以及一些基于计算机的结构模拟和预测技术等方法也常用来进行小分子和蛋白质的相互作用研究。分子对接技术主要利用计算机模拟对已知三维结构的蛋白质受体以及配体,不断优化受体的位置、构象、氨基酸残基侧链及骨架等,寻求配体与受体分子之间最佳的结合构象,从而分析受体和配体的相互作用[58]。随着研究的深入,蛋白质和磷脂相互作用的研究也应从多角度多方面进行,这样更能全面系统地研究蛋白质与磷脂复杂体系。
5 结语
在食品加工过程,磷脂和蛋白质的相互作用会影响牛奶、豆奶、肉制品等食品的品质,研究其互作机制能够为改善该类食品品质提供理论依据。目前在磷脂与乳蛋白以及大豆蛋白相互作用机制的研究较多,但对于磷脂与食品中其他蛋白相互作用的研究深度不足,还不够全面,比如磷脂与谷蛋白、肌球蛋白等,其互作机制还没有形成完整的体系。由于研究技术的局限性,磷脂和蛋白质的种类繁多,分子间作用的复杂性,现在大部分相互作用的研究停留在磷脂与蛋白质疏水相互作用、静电作用等非共价作用上,但对于磷脂-蛋白二元复合体系里加入其它物质(多酚、多糖等)的研究很少,加入多酚后是否会产生共价作用也值得进一步研究。此外,磷脂与蛋白质间的相互作用可以改善蛋白质的功能特性,如何合理地将其应用到食品加工、医药等领域,充分发挥磷脂的功能特性还有待更深入系统的探究。

