一种简单经济提取小鼠大量肾小球的实验方法
李艳秋,刘晓丹,范秋灵,田淑艳,刘雪,王力宁,姚丽
(中国医科大学附属第一医院 肾脏内科,辽宁 沈阳 110001)
慢性肾脏病的发生率在逐年增加,对其发病机制的研究日益重要[1-2]。目前肾脏病的研究多集中在外周血、尿液、肾皮质等,而肾脏病的真正发生部位肾小球却鲜有报道。随着科学的进步,提取肾小球的方法逐渐出现。如激光捕获显微切割技术[3-4]、微分筛选[5]、磁珠灌注肾脏技术等[6-7],其中磁珠获得大量肾小球的方法受到大家的普遍欢迎。但是磁珠价格不菲,有些实验动物本身价格就比较昂贵,一些要求获取较多肾小球的实验预算就会增多,导致其中部分有创意和有意义的实验设计难以实现,使其使用受到一定的限制。本实验对该技术略微进行改变,使磁珠的使用量大大减少,同时仍可获得大量的肾小球,希望该简单经济实用的实验方法为广大的科研工作者提供方便。
1 材料与方法
1.1 实验动物
无特定病原体(SPF)级雌性12 周龄C57BL/6小鼠,购自中国北京维通利华实验动物技术有限公司,许可证号:2016102。饲养在中国医科大学动物部SPF 级动物房,温度(23±3)℃,湿度(50±20)%,予以12 h 交替照明,根据国家标准(GB 14925-2001)的规定,所有小鼠均可自由进食、饮水。NZB/WF1 雌性小鼠(购自美国Jackson 实验室),从8 周开始饲养至28 周。本研究获得中国医科大学动物保护与利用委员会批准。动物饲养至28 周龄。
1.2 实验方法
1.2.1 经胸主动脉行肾脏磁珠灌流术1%戊巴比妥钠(30 ~40 mg/kg)经腹腔注射麻醉。开腹以暴露腹部器官,结扎远端腹主动脉及下腔静脉,结扎肠系膜上动脉和腹腔动脉。开胸后,于胸主动脉上1/3 处插入静脉留置针(24 GA,0.75IN,BD),用手术缝线固定留置针。于下腔静脉靠近结扎处近心端用剪刀剪开0.3 cm 开口。将4℃磷酸盐缓冲液(PBS)经留置针灌注肾脏,确定流出口无血液流出。经上述过程后,先将4×108磁珠/ml(美国Dynal 公司)按照说明书进行清洗,然后将4℃磁珠工作液(不同浓度磁珠)经静脉留置针灌注肾脏。
1.2.2 摘取肾脏和磁珠收集肾小球取下双侧肾脏,去掉被膜,剪去肾盂肾盏,剩余肾脏于冰上剪碎至 1 mm×1 mm×1 mm 小块。加入相应体积胶原酶A 工作液,震荡,置于恒温箱(37℃)30 min,每5 min 振荡混合,进行充分消化。于筛网上轻压(3、4 次)再次消化,使肾组织通过100 μm 筛网,边压边用5 ml 4℃ PBS 冲洗网面至烧杯中,重新取1 个筛网再重复1 次。肾小球悬液离心(250 r/min,4℃、10 min),小心吸去上清液,将肾小球沉淀移至1.5ml 离心管,加入1 ml 4℃ PBS,置于磁力架上。
1.2.3 去除磁珠加入110μl 蛋白裂解液,将含有磁珠的肾小球于冰上裂解30min,离心(2000r/min,4℃、10min),可吸出108μl 含蛋白上清液并移至1.5ml 离心管中,进行肾小球蛋白的纯化、定量。
1.2.4 肾小球蛋白的纯化和浓度的定量2-D Quant kit 试剂盒定量,方法按试剂盒操作说明。采用紫外分光光度计,于480nm 波长处测定样本和标准品的吸光度值。以得到的吸光度值绘制标准曲线,将样本与标准曲线进行比较,得到样本蛋白质的浓度。
1.2.5 肾小球分离效果的观察①经磁珠分离肾小球纯度:将从C57BL/6 和NZB/WF1 小鼠肾脏获得的肾小球用1ml PBS 稀释,取10 μl 于玻片上观察,分别由2 个实验者计数4 次,取平均值。②用磁珠灌注C57BL/6 和NZB/WF1 小鼠肾脏,立即留取肾脏皮质,FAA 固定液固定,行HE 染色,万能显微镜下观察肾小球中磁珠的分布情况。③用磁珠灌注C57BL/6 和NZB/WF1 小鼠肾脏,收集分离出的含有磁珠的肾小球于2.5%戊二醛中固定,扫描电镜下观察分离出的肾小球超微结构。
1.2.6 检测不同浓度磁珠提取的肾小球蛋白浓度分别配置4×105和4×106磁珠/ml 和参考TAKEMOTO[6]配置8×107磁珠/ml 磁珠浓度。先参考文献[6]用40 ml 3种磁珠浓度提取,检测提取的肾小球蛋白浓度。再用10、20 和30 ml 筛选出的合适磁珠浓度提取,检测提取的肾小球蛋白浓度。
1.3 统计学方法
数据分析采用SPSS 17.0 统计软件,计量资料以均数±标准差(±s)表示,比较用方差分析,两两比较用SNK-q法,P<0.05 为差异有统计学意义。
2 结果
2.1 肾小球分离效果
2.1.1 万能显微镜下的观察结果可见含有磁珠的肾小球分布于满视野,偶可见少量的肾小管组织(见图1)。28 周龄C57BL/6 小鼠肾小球的分离纯度为(95.7±2.3)%,而同龄的NZB/WF1 小鼠的分离纯度略为降低,是(86.35±3.57)%。
2.1.2 HE 染色显示的肾小球的分离结果光学显微镜下可见几乎所有的C57BL/6 小鼠肾小球含有5 ~6个以上的磁珠,其主要分布在入球和出球动脉,肾小球周围组织偶可见。见图2。
2.1.3 扫描电镜显示的肾小球的分离结果磁珠灌注C57BL/6 小鼠后分离出的含有磁珠的肾小球在扫描电镜下观察,可见结构较完整,无破坏的痕迹。见图3。
2.2 不同浓度磁珠浓度提取小鼠肾小球蛋白浓度比较
4×106磁珠/ml 和8×107磁珠/ml 提取的肾小球蛋白含量接近(见表1),磁珠用量为40ml。再用4×106磁珠/ml,10、20 及30ml 磁珠对小鼠进行实验。浓度为4×106磁珠/ml 的10ml 磁珠提取小鼠的肾小球最少,而20 和30ml 提取的肾小球无差异(见表2)。所以用20ml 浓度为4×106磁珠/ml 获取的蛋白含量最恰当。而病理鼠NZB/WF1 由于血管条件的差异,获取的蛋白会稍有差异,但与C57BL/6 小鼠的蛋白含量比较,差异无统计学意义(P>0.05)。

图1 用磁珠分离C57BL/6 小鼠的肾小球
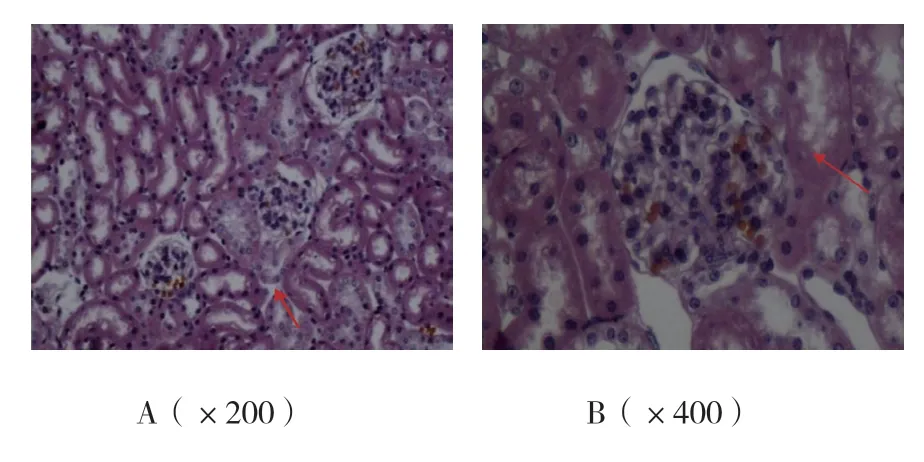
图2 磁珠灌流C57BL/6 小鼠肾脏后(HE 染色)

图3 含有磁珠的肾小球的扫描电镜(×2 000)
表1 不同磁珠浓度提取肾小球蛋白含量比较 (μg,±s)
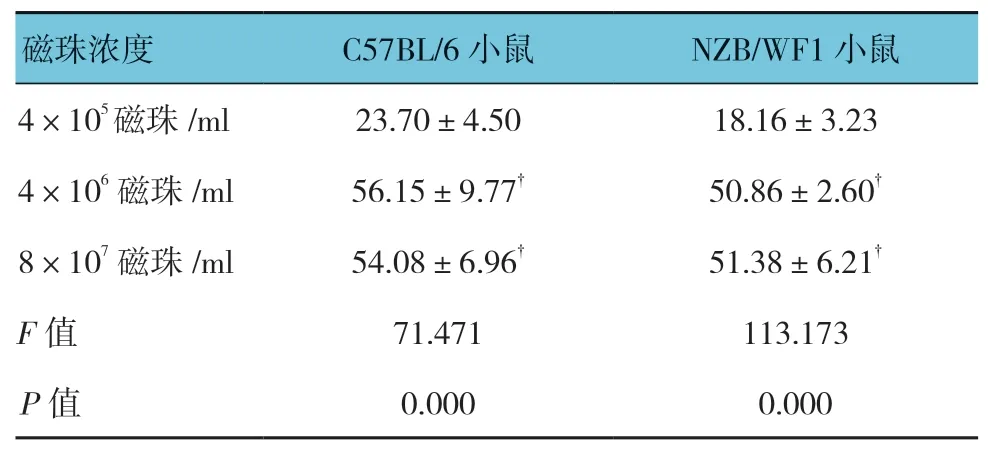
表1 不同磁珠浓度提取肾小球蛋白含量比较 (μg,±s)
注:†与4×105(磁珠/ml)浓度比较,P <0.05。
磁珠浓度 C57BL/6 小鼠 NZB/WF1 小鼠4×105 磁珠/ml 23.70±4.50 18.16±3.23 4×106 磁珠/ml 56.15±9.77† 50.86±2.60†8×107 磁珠/ml 54.08±6.96† 51.38±6.21†F 值 71.471 113.173 P 值 0.000 0.000
表2 浓度为4×106 磁珠/ml 的不同体积磁珠提取 肾小球蛋白含量比较 (μg,±s)
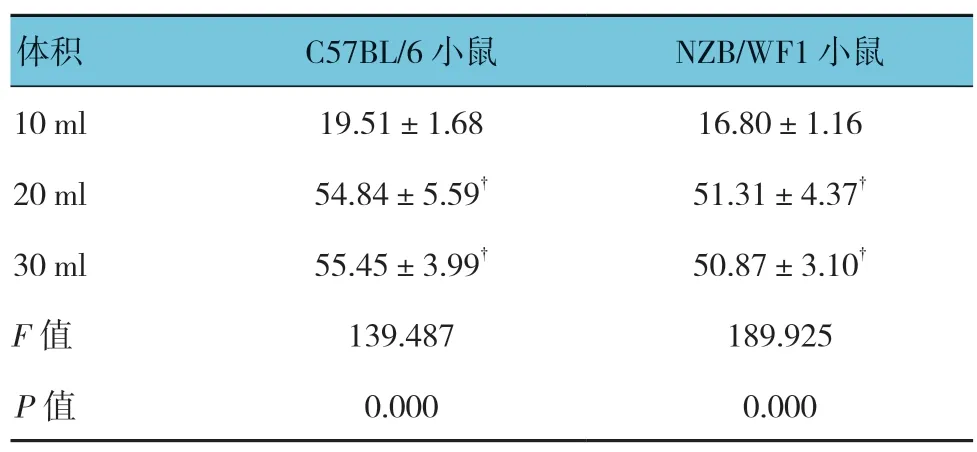
表2 浓度为4×106 磁珠/ml 的不同体积磁珠提取 肾小球蛋白含量比较 (μg,±s)
注:†与10 ml 体积/小鼠比较,P <0.05。
体积 C57BL/6 小鼠 NZB/WF1 小鼠10 ml 19.51±1.68 16.80±1.16 20 ml 54.84±5.59† 51.31±4.37†30 ml 55.45±3.99† 50.87±3.10†F 值 139.487 189.925 P 值 0.000 0.000
3 讨论
近年来,随着人类基因组学、蛋白组学、代谢组学等领域的深入研究,科学家意识到,蛋白质是最终实现编码基因和非编码基因功能的分子,即蛋白才是生物功能的直接实现者[8-9]。而蛋白质谱技术和蛋白质组学信息的发展又促使科学家对蛋白本身的研究进一步加深[10]。目前有关肾脏病的蛋白组学研究的对象多是血液[11]、血浆[12]、尿液[13]、肾脏皮质[14]。筛选技术分离大鼠和兔肾小球的效果较好,而小鼠肾小球的直径与它们的肾小管相似,筛选技术提取的肾小球的纯度及蛋白的含量都不是非常理想。同时临床上又很难大量获得患者的肾小球以满足突飞猛进的医学研究需要,如何快速、大量、高纯度地获得小鼠肾小球是科研人员面临的首要挑战。
本实验主要对传统的心脏灌注方法进行改良。首先,传统的心脏灌流是将磁珠液直接注入心脏,而本实验直接从胸主动脉灌注磁珠液,磁珠不经过心脏,减少其在心脏的无效滞留。其次,结扎腹主动脉远端、肠系膜上动脉和腹腔动脉(该血管为肠和肝脏提供血液),能减少磁珠对其他重要脏器的灌注,以保证更多更有效的磁珠进入肾脏组织。所以本实验技术提高磁珠的有效利用率,减少磁珠的总用量,大大降低实验成本。笔者尝试通过腹主动脉,但由于动脉的孔径和弹性不同,并且受实验动物的应变、年龄或状态的影响,因此提取的肾小球数量没有胸主动脉稳定。
本实验分离的肾小球结构完整,纯度高,减少了磁珠的用量,降低了实验的成本,与TAKEMOTO等[6]比较,体现本实验技术的优点。
在一些疾病模型中,胸主动脉灌注具有较大的优势。与传统灌注相比,因为该疾病小鼠本身血管的病变较重,有时甚至呈现严重血管炎的表现,其腹主动脉的状态随年龄的增长状态更差,当插入导管时血管容易受损。如果导管插入胸主动脉,血管壁更厚,更容易处理。与同龄的C57BL/6 正常小鼠比较,NZB/WF1 肾小球提取的数量和蛋白含量略有减少,但是无差异。所以实验者可以根据其实验对象选择不同的实验方式。
本实验方法的优势:①获得的分离肾小球和蛋白的纯度很高,并与其他研究结果基本一致。在不同品系和年龄的小鼠中,尝试通过胸主动脉灌注肾脏,可以提高成功率,以免因腹主动脉的发育不成熟或者疾病影响实验的效果。②本实验室同样提取总RNA,RNA浓度为772.10 ~1 084.97 ng/μl,OD260/OD280 均大于2.07,完全可以适合目前任何热点的肾小球编码和非编码RNA 的研究(内容将在其他文章发表)。
总之,本实验提出一种分离高纯度小鼠肾小球的有效方法。这种方法在不影响蛋白纯度的情况下降低操作过程中的难度,更重要的是减少磁珠的用量,大大节约成本。对那些想要研究肾小球病变,包括足细胞、系膜细胞、内皮细胞的研究者都值得进行尝试。

