12C6+辐射对黄瓜光合色素含量及光合基因表达的影响
蔡世娟 秦垒 曹天光


摘要 以自交系黃瓜18C-1为辐射试验材料,探究不同剂量12C6+辐射胁迫对黄瓜光合色素及光合基因表达的影响。结果表明,光合色素各组分Chla、Chlb、Cv含量在低剂量(60 Gy)辐射胁迫下响应性下调,中、高剂量(80 ~120 Gy)辐射胁迫下响应性上调,且中、高剂量下Chla含量均高于对照,Chlb含量均低于对照;光合基因rbcL、rbcS、rca、psbA表达量均受抑制,其中rbcL、rbcS、rca基因表达量随辐射剂量增加呈“W”型响应变化,psbA表达量呈“马鞍”型响应变化。综上所述,12C6+辐射胁迫对黄瓜幼苗光合色素含量及光合基因表达水平产生影响。
关键词 12C6+辐射胁迫;光合色素;光合基因;马鞍型;W型
中图分类号 S-9 文献标识码 A
文章编号 0517-6611(2020)18-0059-04
Abstract The inbred cucumber 18C1 was used as radiation experiment material to explore the effects of different doses of 12C6+ radiation stress on the expression of photosynthetic pigment and photosynthetic genes in cucumber.The results showed that the Chla,chlb and Cv contents of photosynthetic pigment decreased in response to lowdose (60 Gy) radiation stress,and increased in response to medium and highdose (80-120 Gy) radiation stress,and the Chla contents were higher than those of the control,Chlb was lower than that of the control.The expression levels of rbcL,rbcS,rca and psbA genes were inhibited.The expression levels of rbcL,rbcS and rca genes showed a “W” response with the increase of radiation dose,and the expression levels of psbA showed a “saddle” response.In conclusion,12C6+ radiation stress had an effect on photosynthetic pigment contents and expression level of photosynthetic genes in cucumber seedlings.
Key words 12C6+ radiation stress;Photosynthetic pigments;Photosynthetic genes;Saddle;Type W
黄瓜(Cucumis sativus L)属喜光、冷敏感植物,是我国设施农业中产量最高的蔬菜品种之一,市场需求量大。光合作用是影响黄瓜产量和品质的主要因素,光合色素参与光能吸收、传递及光化学反应,光系统是碳固定的主要场所,为植物生长发育及能量供应提供动力,因此光合色素各组分含量及光系统结构显著影响植物光合作用过程。
核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco酶)是调控光合碳同化的关键酶,其活性高低直接影响光合速率大小。Rubisco活化酶RCA由核基因rca编码,能催化Rubisco酶达最大催化活性[1]。D1蛋白由质体基因psbA编码,是光系统Ⅱ(PSⅡ)中心蛋白之一,也是植物应对逆境胁迫的关键靶位。在胁迫环境中D1蛋白会迅速降解,生物体自身修复机制会合成新D1蛋白促进PSⅡ功能修复,增强自身抗性,当胁迫加剧时,D1蛋白降解速率超过自身修复速率,会损伤PSⅡ结构并抑制其活性造成植物光合速率降低[2-3],同时D1蛋白还介导初级电子供体和二级质体醌受体,对胁迫环境也更敏感。因此在植物逆境胁迫敏感性研究上Rubisco酶、RCA及D1蛋白的含量、活性及编码基因表达量均是重要研究指标。
在以往研究中,干旱胁迫抑制外源甜菜碱psbA基因表达[4]。盐胁迫明显抑制水稻叶绿体内psbA基因转录水平[5]。黄瓜在低温弱光胁迫下rbcL、rbcS、rca表达量均显著降低[6]。水稻在N+辐射胁迫下光合基因表达量发生变化[7]。De Micco等[8]研究发现12C6+辐射胁迫对电子传递载体、光合系统相关酶及补光天线复合物造成影响。但目前有关黄瓜在重离子12C6+辐射胁迫下Rubisco、RCA及D1蛋白编码基因rbcL、rbcS、rca、psbA表达量研究鲜有报道,因此,笔者以自交系黄瓜种子18C-1为试验材料,通过探究不同剂量辐射对幼苗光合色素各组分含量、Chla/Chlb比值及光合基因表达量的影响,初步明确黄瓜幼苗光合特性对不同剂量12C6+辐射胁迫的响应,并为后续12C6+辐射黄瓜的生物学效应研究奠定基础。
1 材料与方法
1.1 试验材料 河北工业大学理学院生物物理研究所选育的黄瓜自交系种子18C-1。试剂:80%丙酮,TIANGEN植物总RNA提取试剂盒(DP432),反转录试剂盒TaKaRa(RR037A),qPCR试剂盒TaKaRa(RR120Q)。仪器:HIRFL加速器,SPECORD250PLUS紫外可见分光光度计(UV-Vis spectrophotometer),CFX96 Touch。
1.2 试验方法 2019年3月9日在兰州重离子加速器国家实验室HIRFL加速器上进行辐射试验,将黄瓜种子单层固定到辐射器皿盘内并用封口膜包裹,采用12C6+为诱变源进行辐照试验(正常大气压和室温)。辐射物理参数:能量80 MeV/u,传能线密度30 keV/um,射程17 mm,剂量率60 Gy/min,剂量0、60、80、100、120 Gy。
1.3 光合色素测定 待幼苗生长24 d时用取样器(d=7.84 mm)从幼苗第二片真叶同一叶位取样后放置到(各组随机选取3株)5 mL 80%丙酮溶液的棕色瓶中,用锡箔纸包裹置黑暗处浸提,期间多次振荡,待样品变白,在紫外分光光度计下测定645、663 nm处OD值,按Arnon公式计算光合色素各组分含量。
1.4 荧光定量PCR 待幼苗生长24 d时从各组随机采摘3株幼苗叶片,ddH2O冲洗干净,提取样本总RNA。紫外分光光度计和1%的琼脂琼脂糖凝胶检测RNA浓度和质量。反转录合成cDNA。荧光定量PCR测定目的基因相对表达量。qPCR反应体系共25 μL,TB Green Premix Ex Taq(Tli RNaseH Plus)(2×) 12.5 μL,正向引物(10 μmol/L) 0.5 μL,反向引物(10 μmol/L) 0.5 μL,DNA模板+灭菌水 11.5 μL。反应程序:Step1:95 ℃ 30 s;Step2:PCR反应(40 Cycles);95 ℃ 5 s;60 ℃ 30 s;Step3:Melt Curve。供试引物由上海生物工程有限公司合成,纯化方式为HPLC,引物序列见表1。
1.5 数据处理 Arnon公式:Chl a=12.7OD663-2.69OD645;Chl b=22.9OD645-4.86OD663;CV(μg/mL)= Chl a + Chl b。以18S rRNA为内参引物,采用△△Ct法计算目的基因相对表达量:目的基因相对表达量= 2-△△Ct,△△Ct=△Ct Gene - △Ct Control,其中△Ct Gene =(目的基因Ct值)-(同一样本内参基因Ct值),△Ct Control =(对照组目的基因Ct值)-(内参基因Ct值);用Origin 9绘制柱状图。
2 结果与分析
2.1 辐射对光合色素各组分含量的影响
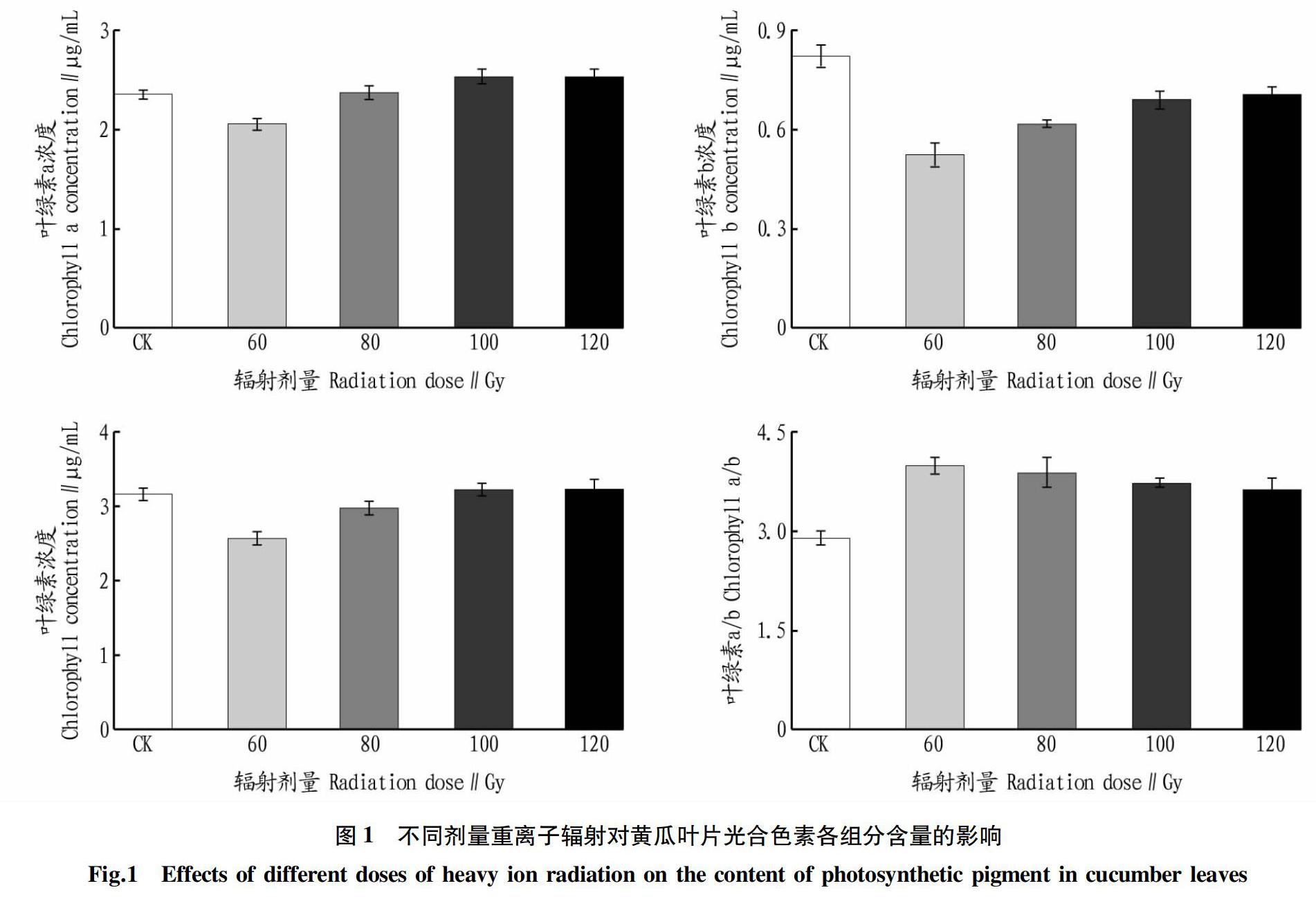
光合色素是植物光合作用的基础。由图1可知,不同剂量重离子辐射下Chla较对照依次变化-12.71%、0.88%、7.62%、7.60%;Chlb较对照依次变化-36.76%、-25.27%、-16.27%、-14.21%,表现为明显的辐射抑制作用;Cv较对照依次变化-18.92%、-5.87%、1.45%、1.97%;Chla/Chlb较对照依次变化38.03%、34.99%、28.52%、25.42%。
光合色素各组分含量均表现出明显的剂量效应关系,随辐射剂量增加Chla、Chlb、Cv含量呈先降后升变化趋势;Chla/Chlb则呈先升后降变化趋势。
2.2 辐射对光合基因表达量的影响
在高等植物中Rubisco酶由大亚基(rbcL基因编码)和小亚基(rbcS基因编码)组成,大亚基起催化功能,小亚基远离活性中心维持并稳定酶活化构象[9]。Rubisco酶催化效率很低,其分子伴侣RCA(rca基因编码)能催化Rubisco达最大催化活性。由图2可知,不同剂量重离子辐射下rbcL基因相对表达量较对照依次变化-53.81%、-35.20%、-57.13%、-37.72%,rbcS基因相对表达量依次变化-52.21%、-35.53%、-68.95%、-50.68%,rca基因相对表达量依次变化-40.92%、-20.89%、-35.66%、-9.77%,即辐射显著抑制rbcL、rbcS、rca的mRNA转录水平,此外,随辐射剂量增加rbcL、rbcS、rca基因相对表达量均呈“W”型变化趋势,表现出规律性的剂量效应关系。
D1蛋白由psbA基因编码是光合系统中最重要的结构、功能蛋白之一,其含量是表征植物抗逆能力的重要指标[10]。不同剂量重离子辐射下psbA相对表达量较对照依次变化-48.31%、-8.08%、-34.99%、-35.66%,即辐射抑制psbA表达量,其中60 Gy辐射下psbA相对表达量最低为0.516 86。此外随辐射剂量增加psbA基因相对表达量呈先降后升再降的“马鞍”型变化趋势。
3 结论与讨论
研究表明,重离子辐射破坏生物大分子DNA构象、构型及细胞器结构(类囊体扩张,基粒片层数量减少)并抑制光合色素及相关蛋白合成[11-15],同时产生大量自由基和活性氧,降解D1蛋白造成光系统结构损伤[16-17],从而影响植物光合作用。
在植物生长过程中,光合色素是吸收、传递、转化光能的基础,而叶绿素作为光合作用中主要色素,其各组分含量、Chla/Chlb是表征植物光合组织生理状况的重要指标,显著影响植物光合作用,因此一直是植物生理学研究的重点工作之一。此外,植物叶色变化在一定程度上反映叶绿素降解状况,并在一定范围内与植物光合作用呈正相关[18],对光合基因研究也发现rbcS、rbcL、rca仅在绿色组织中表达[19-20],而根、黄化苗中均不表达[21],即植物叶色变化在一定程度上影响光合色素含量及光合基因表达。辐射黄瓜田间试验表明,辐射组出现不等数量、不同程度的黄化苗、白斑苗及叶色(深绿、浅绿)变异苗,因此,从辐射黄瓜幼苗宏观生物学性状即可推断12C6+辐射对幼苗光合色素含量及光合基因表达量产生影响。
该研究中,低剂量(60 Gy)辐射下,Chla、Chlb、Cv含量均低于對照,即低剂量辐射对光合色素各组分含量有抑制作用,减弱幼苗光合作用和抗逆性,中、高剂量(80~120 Gy)下,Chla含量均高于对照,Chlb含量低于对照但呈上升趋势,即中、高剂量辐射增强幼苗光合作用和抗逆性,该结果与强继业等[22]对球根海棠(根)、仙客来研究结果相一致。与冯亮英[23]对甜高粱研究存在异同,相同之处:Chla在低剂量辐射下(40 Gy)低于对照,在中、高剂量辐射下表现为促进作用,Chlb含量在整个剂量范围内均低于对照,表现为明显的辐射抑制作用;差异之处:在相同剂量范围内(0~120 Gy)Chla含量呈先降后升再降的趋势,在40 Gy有最低值,80 Gy有最高值,100、120 Gy又明显下降,即变化趋势有所差异。与薛林贵等[24]、李雪虎等[25]研究结果不同。Chla/Chlb变化趋势与Chla、Chlb、Cv趋势相反,60 Gy辐射下有最高值,且各辐射组均高于对照。Chla/Chlb表征植物PSⅡ内聚光复合体LHCII在所有含叶绿素的结构中所占比例大小,此值与LHCII含量呈负相关[26],说明中、高剂量较低剂量能促进幼苗叶片中LHCII含量增加,确保植物能够捕获更多光能用于光合作用。
辐射胁迫抑制rbcL、rbcS、rca基因相对表达量,与Jiang等[27]研究黄瓜对低温、弱光胁迫响应结果相一致。此外辐射对rbcL、rbcS基因表达量抑制程度显著高于rca,即rbcL、rbcS较rca对胁迫更敏感,此结果与唐如航等[20]的研究结果相悖。psbA基因表达量显示,80 Gy辐射下,psbA基因表达量上调以提升幼苗抗逆能力,100、120 Gy辐射下psbA表达量下调,但仍高于60 Gy。
rbcL、rbcS、rca、psbA基因表达量均表现出明显的剂量效应关系。rbcL、rbcS、rca表现出先降后升再降再升的“W”型变化趋势;psbA表现出先降后升再降的“马鞍”型变化趋势,这种变化趋势与李多芳等[28]、顾建中等[29]提出的辐射损伤修复模型相一致。原因可能是低剂量辐射会抑制光合基因表达并对光系统结构造成损伤,表现在60 Gy辐射下rbcL、rbcS、rca、psbA表达量明显降低,但植物在进化过程中形成自身防御系统以应对逆境胁迫,如类囊体内可能存在破坏修复系统、活性氧清理机制等,其中新D1蛋白的合成与激活则会及时修复PSⅡ损伤;当辐射剂量达某一阈值时,则激发出植物自身防御系统促进光合蛋白编码基因的转录表达,表现80 Gy辐射下rbcL、rbcS、rca、psbA基因表达量上调,促进新D1蛋白合成并组装到降解D1蛋白反应中心,随后激活行使其功能[30],同时也促进Rubisco酶及活化酶RCA基因的转录表达以提升黄瓜幼苗的抗逆性,这种损伤修复机制是植物抵抗逆境胁迫的关键;当辐射剂量继续增大时,植物体受损严重远超过自身修复能力,基因表达量呈下降趋势,表现在100、120 Gy辐射下psbA基因表达量下调,预测当辐射剂量继续增大时会造成致死损伤,但rbcL、rbcS、rca基因相对表达量均呈现“W”型剂量效应关系,与psbA基因表达量的“马鞍”型变化趋势有所差异,即rbcL、rbcS、rca在120 Gy辐射下表达量有上调变化,原因可能是高剂量辐射(120 Gy)胁迫下,psbA基因转录水平显著下降,黄瓜幼苗通过上调rbcL、rbcS、rca表达量来提高幼苗逆境胁迫适应性。
综上所述,重离子12C6+辐射对黄瓜幼苗光合色素及光合基因表达的影响与以往研究结果存在异同之处,原因可能是辐射离子种类、剂量、能量、植物体自身敏感性及生长环境等诸多因素综合影响。此外,同一辐射剂量下不同基因表达量有上调变化,有下调变化,光合色素各组分含量、Chla/Chlb及rbcL、rbcS、rca、psbA基因表达水平的剂量效应关系也呈现出多种变化趋势,原因可能是调控植物光合作用的色素、基因数量众多,植物在适应胁迫环境过程中会统筹多方调控手段,以使调控结果最优化,减少植物所受损伤,同时也表明光合色素及光合基因在应对辐射胁迫时响应的复杂性。
参考文献
[1] 李卫芳,王忠,韩鹰,等.小麦Rubisco活化酶的纯化及其活性特性[J].中国农业科学,2002,35(8):929-933.
[2] YAMAMOTO Y,AMINAKA R,YOSHIOKA M,et al.Quality control of photosystem II:Impact of light and heat stresses[J].Photosynthesis research,2008,98(1/2/3):589-608.
[3] 赵鹏飞,王林华,赵会杰,等.水杨酸对高温强光胁迫下小麦叶绿体基因psbA表达的调节[J].植物生理学通讯,2010,46(6):537-540.
[4] 侯鹏飞,马俊青,赵鹏飞,等.外源甜菜碱对干旱胁迫下小麦幼苗叶绿体抗氧化酶及psbA基因表达的调节[J].作物学报,2013,39(7):1319-1324.
[5] CHATTOPADHAYAY M K,TIWARI B S,CHATTOPADHYAY G,et al.Protective role of exogenous polyamines on salinitystressed rice (Oryza sativa) plants[J].Physiologia plantarum,2002,116(2):192-199.
[6] 孙晓琦.黄瓜RubisCO活化酶基因(RCA)正义表达载体的构建及其遗传转化的研究[D].泰安:山东农业大学,2008.
[7] YA H,CHEN Q,WANG W,et al.Gene expression characteristics of growth-inhibited rice seedlings induced by lowenergy N+beam implantation[J].Genetics & molecular research,2014,13(3):6259-6271.
[8] DE MICCO V,ARENA C,PIGNALOSA D,et al.Effects of sparsely and densely ionizing radiation on plants[J].Radiation and environmental biophysics,2011,50(1):1-19.
[9] 梅楊,李海蓝,谢晋,等.核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)[J].植物生理学通讯,2007,43(2):363-368.
[10] EDELMAN M,MATTOO A K.D1protein dynamics in photosystem II:The lingering enigma[J].Photosynthesis research,2008,98(1/2/3):609-620.
[11] THIEDE M E,LINK S O,FELLOWS R J,et al.Effects of gamma radiation on stem diameter growth,carbon gain and biomass partitioning in Helianthus annuus[J].Environmental & experimental botany,1995,35(1):33-41.
[12] ROY S,BEGUM Y,CHAKRABORTY A,et al.Radiationinduced phenotypic alterations in relation to isozymes and RAPD markers in Vigna radiata(L.) Wilczek[J].International journal of radiation biology,2006,82(11):823-832.
[13] 桂仁意,刘亚迪,郭小勤,等.不同剂量137Cs-γ辐射对毛竹幼苗叶片 叶绿素荧光参数的影响[J].植物学报,2010,45(1):66-72.
[14] ABE T,MATSUYAMA T,SEKIDO S,et al.Chlorophylldeficient mutants of rice demonstrated the deletion of a DNA fragment by heavyion irradiation[J].Journal of radiation research,2002,43(S1):157-161.
[15] 王洁,李欣,孙永亮,等.碳离子辐照对四尾栅藻光合色素及抗氧化活性的影响[J].植物研究,2013,33(5):593-598.
[16] BOUROT S,SIRE O,TRAUTWETTER A,et al.Glycine betaineassisted protein folding in a lysAMutant of Escherichia coli[J].Journal of biological chemistry,2000,275(2):1050-1056.
[17] PRASAD K V S K,SARADHI P P .Enhanced tolerance to photoinhibition in transgenic plants through targeting of glycinebetaine biosynthesis into the chloroplasts[J].Plant science,2004,166(5):1197-1212.
[18] 郑洁,胡美君,郭延平.光质对植物光合作用的调控及其机理[J].应用生态学报,2008,19(7):1619-1624.
[19] WATILLON B,KETTMANN R,BOXUS P,et al.Developmental and circadian pattern of rubisco activase mRNA accumulation in apple plants[J].Plant molecular biology,1993,23(3):501-509.
[20] 唐如航,贾军伟,李立人.光和糖对水稻Rubisco活化酶基因表达的影响[J].植物生理学报,1997,23(4):337-341.
[21] LIU Z R,TAUB C C,MCCLUNG R.Identification of an Arabidopsis thaliana ribulose1,5bisphosphate carboxylase/oxygenase activase(RCA)minimal promoter regulated by light and the circadian clock[J].Plant physiology,1996,112(1):43-51.
[22] 强继业,陈宗瑜,李佛琳,等.60Coγ射线辐射对滇特色花卉生长速率及叶绿素含量的影响[J].中国生态农业学报,2003,11(4):21-23.
[23] 冯亮英.12C+6重离子束辐照对两种甜高粱生理生化指标的影响和早熟突变株KFJT-1的RAPD分析[D].兰州:兰州大学,2010.
[24] 薛林贵,徐俊泉,张红,等.12C6+离子束辐照对紫苏生理特性的影响[J].核技术,2011,34(4):267-272.
[25] 李雪虎,陆锡宏,辛志君,等.12C6+离子束辐照对大青叶生理生化特性的影响[J].激光生物学报,2013,22(6):515-520.
[26] FENG Y J,SHI B S,DONG G M,et al.The application of chlorophyll fluorescence kinetics in plant stress and fruit storage[J].Journal of Hebei Agricultural University,2003,26(S1):89-92.
[27] JIANG Z S,SUN X Q,AI X Z,et al.Responses of Rubisco and Rubisco activase in cucumber seedlings to low temperature and weak light[J].Chinese journal of applied ecology,2010,21(8):2045-2050.
[28] 李多芳,曹天光,耿金鵬,等.电离辐射致植物诱变效应的损伤-修复模型[J].物理学报,2015,64(24):415-422.
[29] 顾建中,李多芳,曹天光,等.电离辐射致植物诱变效应的损伤-修复模型[J].中国原子能科学研究院年报,2015(00):75.
[30] 郭连旺,沈允钢.高等植物光合机构避免强光破坏的保护机制[J].植物生理学通讯,1996,32(1):1-8.

