柑橘脉突病毒基因组全长cDNA克隆及其侵染性鉴定
许建建,王艳娇,段玉,马志敏,宾羽,周常勇,宋震
(西南大学/中国农业科学院柑桔研究所,重庆400712)
0 引言
【研究意义】柑橘脉突病毒(citrus vein enation virus,CVEV)是黄矮病毒科(Luteoviridae)豌豆耳突花叶病毒属(Enamovirus)的一种正义单链RNA病毒[1],可引起柑橘脉突病及木瘤病。目前,CVEV在亚洲的日本、印度、土耳其、伊朗,北美的美国,非洲的南非,南美的巴西、秘鲁,欧洲的西班牙,大洋洲的澳大利亚等多个国家均有报道[1-7],并对南美的秘鲁柑橘产业造成了严重破坏[8]。我国于20世纪90年代在浙江省台州市黄岩区首次检测出该病毒[9],随后在浙江省其他柑橘产区以及四川也检测到该病毒[10-11]。CVEV可以侵染大多数的柑橘品种,除通过嫁接传播外,还可由多种蚜虫如橘蚜(Toxopetera citricida)、棉蚜(Aphis gossypii)、桃蚜(Myzus pcrsicae)等以持久方式进行传播[12-13]。这些蚜虫在中国及世界范围内分布广泛,且种群数量大,因而致使CVEV具有较高的传播流行风险。构建CVEV侵染性克隆将为深入解析其分子特性及致病机理打下基础,对于CVEV的防控具有重要意义。【前人研究进展】1953年,WALLCE等在美国的California酸橙上首次发现柑橘脉突病,并初步证明该病由病毒引起。酸橙和墨西哥莱蒙感病后主要表现为叶片侧脉和支脉产生耳状小突起,叶背对应部位出现凹陷[14]。1959年,在澳大利亚发现一种能引起粗柠檬的根茎部出现木瘤的病害,初步证明该病和脉突病均由 CVEV引起[15-16]。CVEV基因组为正义单链RNA,包含5个开放阅读框(open reading frame,ORF)、5′端 207 nt和 3′端 198 nt的两个非翻译区(untranslated region,UTR)。其中,ORF0嵌合于ORF1,编码39 kD多肽(354 aa);ORF1编码100 kD蛋白(902 aa),包含S39肽酶家族特有的丝氨酸蛋白酶结构域和病毒末端结合蛋白;ORF2编码146或148 kD融合蛋白,包含解旋酶和多聚酶结构域包围的甘氨酸-天冬氨酸-天冬氨酸三肽基序;ORF3编码21 kD的外壳蛋白(191 aa),最近被证明是基因沉默抑制子;ORF5编码一个融合蛋白,可能与病毒在植株内的系统移动以及在蚜虫体内的滞留有关[1,17]。CVEV病毒粒子为等径对称多面体,大小约为25或28 nm[7]。CVEV的检测方法有传统指示植物鉴定法、常规反转录多聚酶链式反应RT-PCR法和实时荧光定量 RT-PCR法[18-19],但指示植物鉴定法繁琐且易受柑橘衰退病毒(citrus tristeza virus,CTV)干扰[20]。【本研究切入点】CVEV可引起柑橘脉突病,但其柯赫氏法则证明尚未完成。通过构建CVEV基因组全长cDNA克隆,经农杆菌介导接种柑橘,并通过 RT-PCR及生物学观察鉴定其侵染性,将为深入了解其病原分子生物学特性、研究其致病机理打下基础。【拟解决的关键问题】构建CVEV的病毒基因组全长 RT-PCR扩增体系,获得其侵染性克隆,实现其对柑橘的系统性侵染。
1 材料与方法
试验于 2017—2020年在西南大学柑桔研究所国家柑桔苗木脱毒中心实验室完成。
1.1 供试材料
CVEV毒源植株象山红(Citrus reticulata),柑橘实生苗摩洛哥酸橙(C. aurantium)、邓肯葡萄柚(C.paradisi)、尤力克柠檬(C. limon)、枳柚(C. paradisi× Poncirus trifoliata)、Rusk枳橙(P. trifoliata × C.sinensis)、枣阳小叶枳(P. trifoliata),基因沉默抑制子 HC-Pro表达质粒等均由西南大学柑桔研究所提供。pXT1双元表达载体由南京农业大学陶小荣教授惠赠。

表1 引物序列Table 1 Primer sequences
1.2 酶与试剂
限制性内切酶StuI、SmaI购自北京NEB公司;LA Taq® Polymerase、In-Fusion HD Cloning Kit、SMARTer® RACE 5′/3′ Kit购自大连 TaKaRa 公司;SuperScriptTMIV逆转录酶、Trizol试剂购自美国Invitrogen 公司;E.Z.N.A.TMPlasmid Mini ProtocolⅠ试剂盒、E.Z.N.A.TMGel Extraction试剂盒购自 Omega公司;大肠杆菌感受态细胞JM 109、农杆菌感受态细胞GV3101购自博迈德生物有限公司。
1.3 引物设计
根据NCBI中已报道的CVEV分离株VE-1基因组序列及5′端RACE测序结果,利用Primer 5软件设计扩增 CVEV基因组全长 cDNA的特异性引物EV25-F/EV5983-R,以及用于 RACE的 EV532R、EV414R。用于CVEV检测的VE16-F/VE17-R及其他引物见表1。
1.4 CVEV侵染性克隆构建
1.4.1 毒源植株叶片总RNA提取 按照Trizol试剂说明书提取毒源植株的总 RNA,琼脂糖凝胶电泳检测RNA完整性。
1.4.2 RACE扩增 提取毒源植株总 RNA,采用SMARTer® RACE试剂盒对CVEV 5′端序列进行扩增,然后通过常规克隆测序并进行序列分析。第一链cDNA合成:配置预混液RACE Buffer Mix:5×First-Strand Buffer 4.0 μL,SMARTer II A Oligonucleotide 1.0 μL,SMARTScribeTMReverse Transcriptase(100 U·μL-1)2.0 μL,dNTPs(20 mmol·L-1)1.0 μL,RNase Inhibitor(40 U·μL-1)0.5 μL,DTT(100 mmol·L-1)0.5 μL,总体积 9 μL。另取模板 RNA 1.75 μL,EV532R 1.0 μL,ddH2O(20 mmol·L-1)1.0 μL,混匀运行程序:72℃ 3 min,迅速置于冰上;加入预混液运行程序:42℃ 60 min;70℃ 10 min。反应所得cDNA备用。
第一轮PCR反应体系:PS Max Premix(2×)12.5 μL,UMP long 1.0 μL,EV532R 1.0 μL,前一步 cDNA 2.0 μL,PS Max Premix(2×)12.5 μL,ddH2O 8.5 μL,总体积25 μL;第一轮PCR程序:94℃ 2 min;94℃ 15 s,56℃ 15 s,72℃ 30 s,30 个循环;72℃ 5 min。
将上述所得PCR产物稀释50倍,取2.0 μL,再加入 EV414R 1.0 μL,NUP 1.0 μL,PS Max Premix(2×)12.5 μL,ddH2O补至总体积 25 μL,运行第二轮 PCR 程序:94℃ 2 min;94℃ 15 s,58℃ 15 s,72℃ 30 s,35 个循环;72℃ 5 min。
1.4.3 CVEV基因组全长 RT-PCR 以提取的总 RNA为模板,使用SuperScriptTMIV逆转录酶合成cDNA,反应体系:在冰上配置以下混合液,50 μmol·L-1random hexamers 1 μL,10 mmol·L-1dNTP Mix 1 μL,RNA 模板 9 μL,ddH2O 补至 13 μL;5×SSIV Buffer 4.0 μL,10 mmol·L-1dTT 1.0 μL,RNase OUTTMRecombinant RNase Inhibitor 1.0 μL,SuperScriptTMIV Reverse Transcriptase(200 U·μL-1)1.0 μL,混匀。运行程序:23℃ 10 min;53℃ 15 min。以产物cDNA为模板,使用引物EV25-F/EV5983-R进行PCR扩增。PCR 反应体系为 25 μL:ddH2O 4.0 μL,2×GC buffer I 12.5 μL,EV25-F/EV5983-R 各 1.0 μL,LA Taq 酶 0.5 μL,dNTP 4.0 μL,模板 2.0 μL。反应条件:94℃ 2 min;94℃ 30 s,65℃ 8 min,20个循环;94℃ 30 s,60℃ 30 s,65℃ 8 min,20 个循环;68℃ 10 min。
1.4.4 pXT1线性载体获取 使用NEB限制性内切酶SmaI和StuI酶切pXT1双元表达载体,获得pXT1线性载体,反应体系:双元表达载体pXT1质粒28 μL(1.0 μg),10×Cutsmart Buffer 5.0 μL,限制性内切酶SmaI 1.0 μL,ddH2O 16 μL。反应条件:25℃温育30 min。再加入1 μLStuI限制性内切酶,37℃温育30 min。电泳验证后利用E.Z.N.A.TMGel Extraction试剂盒进行产物回收。
1.4.5 CVEV全长 cDNA的 In-Fusion克隆 使用In-Fusion®HD Cloning Kit将获得的PCR产物与pXT1线性载体连接。反应体系:5×In-Fusion HD Enzyme Premix 2 μL,PCR 产物 2 μL,线性化 pXT1 载体 2 μL,ddH2O补足至10 μL。反应条件:50℃温育30 min。转化大肠杆菌 JM 109,挑选单克隆采用引物VE16-F/VE17-R[1]进行菌液 PCR,阳性克隆送华大基因公司测序。
1.5 序列分析
利用DNAMAN 7.0对测序后所得CVEV全长cDNA进行序列分析,利用MAGA X软件构建CVEV进化树(邻接法)。
1.6 农杆菌介导真空浸润接种柑橘
提取1.4.5所得阳性克隆质粒,电击法转化农杆菌感受态细胞 GV3101,均匀涂布到含有利福平(20 μg·μL-1)和卡那霉素(50 mmol·L-1)抗生素的 LB 固体培养基上,28℃培养约48 h。挑选阳性单克隆接种含相应抗生素的 LB液体培养基(20 mg·L-1Rif,50 mg·L-1Kan),200 r/min,28℃振荡培养12—16 h。离心收集菌体,用接种缓冲液悬浮(10 mmol·L-1MgCl2,10 mmol·L-1MES,200 μmol·L-1As),使其 OD600为0.8—1.0,同时加入沉默抑制子表达克隆,使样品OD≈1.0,沉默抑制子OD≈0.5,黑暗静置2 h备用。参照文献[21-22]报道的方法进行农杆菌介导真空浸润接种柑橘,即将柑橘实生苗浸入前步骤接种混合液并置于真空干燥仪,抽真空至压力-1.0—-0.8 kg·cm-2,保持5 min后快速释放压力并立即用无菌水冲洗,22℃暗处理24 h。转入正常光周期:22℃ 16 h;20℃ 8 h。一周后开始症状观察记录,并参照王艳娇[23]的方法开展RT-PCR检测。
2 结果
2.1 RACE分析
病毒基因组 5′端序列对于全长 cDNA侵染性克隆的构建具有重要影响,个别碱基突变就可能导致其侵染性降低,甚至失去侵染性。因此,在扩增克隆CVEV基因组之前首先采用 RACE技术确定其基因组5′端序列。
采集CVEV毒源象山红植株新展开的嫩叶,利用Trizol试剂提取总RNA,对CVEV的5′末端进行RACE(图1-A),获得大小约414 bp的目标条带。扩增产物经切胶回收、连接、转化大肠杆菌JM109,挑取单菌落进行菌液PCR验证(图1-B),获得阳性克隆。随机挑选3个PCR阳性克隆进行测序,并与已报道的CVEV分离株VE-1进行序列比对,在排除RACE试剂的3—5个碱基后,各阳性克隆基因序列及 VE-1的序列均为 ATATAAGCTATA AAAGAAAAGTGCGTTTACGCTTCCTT···, 说 明CVEV 5′端前70个碱基序列比较保守,这为利用该保守序列设计引物扩增CVEV全长cDNA,进而构建侵染性克隆打下基础。
2.2 CVEV基因组全长RT-PCR
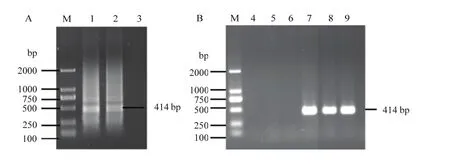
图1 CVEV 5′末端RACE及克隆Fig. 1 5′ rapid amplification of cDNA ends (RACE) and its cloning of CVEV
依据5′及3′端保守序列设计直接扩增CVEV基因组全长的引物 EV25-F/EV5983-R。以 2.1提取的总RNA为模板,进行CVEV的基因组全长RT-PCR。琼脂糖凝胶电泳结果显示(图2),PCR产物片段大小约5 983 bp,符合预期CVEV基因组全长大小,切胶回收备用。
2.3 CVEV基因组全长cDNA克隆、鉴定及序列分析
使用限制性内切酶SmaI和StuI酶切pXT1双元表达载体。将2.2获得的RT-PCR产物和pXT1线性载体切胶回收、In-Fusion HD Cloning Kit连接、转化大肠杆菌JM 109。挑取单菌落采用引物VE16-F/VE17-R进行菌液 PCR筛选,然后采用引物 EV25-F/EV5983-R进行CVEV全长cDNA初步PCR鉴定(图3),共计获得10个CVEV基因组全长cDNA克隆。
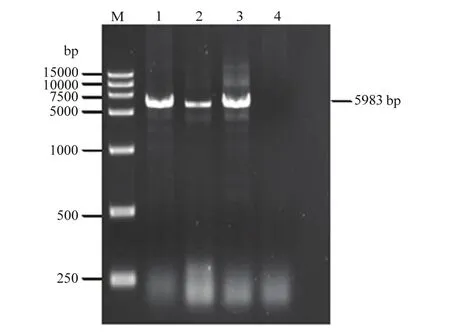
图2 CVEV的基因组全长RT-PCRFig. 2 RT-PCR for full-length genome of CVEV
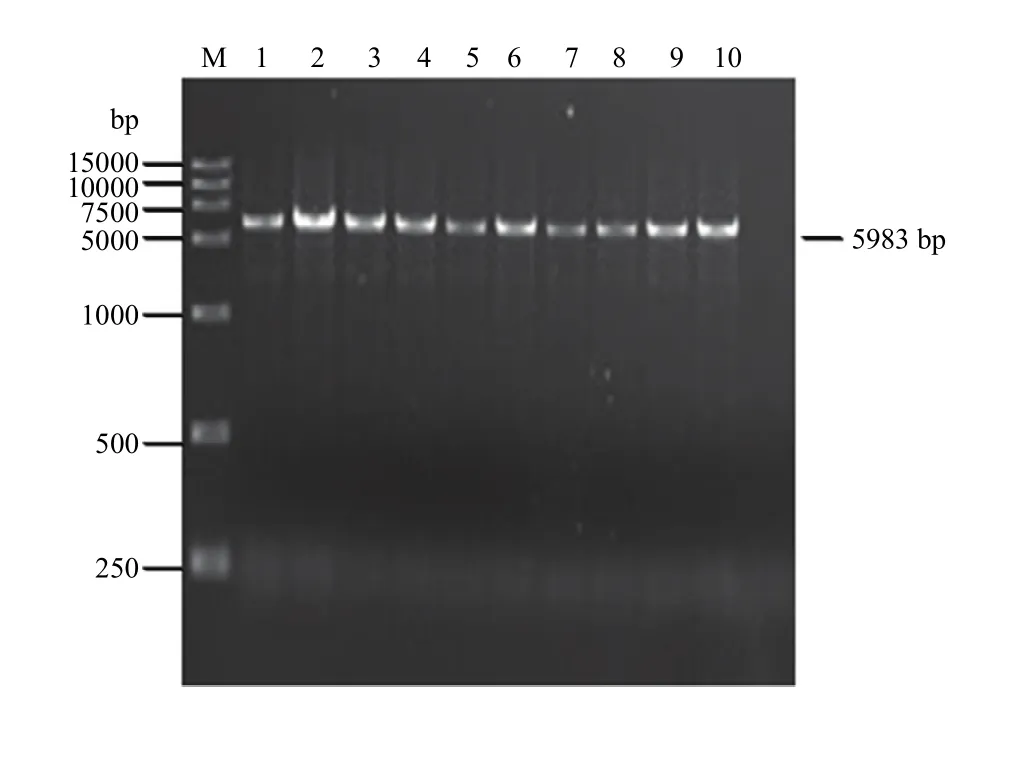
图3 CVEV全长cDNA克隆的PCR鉴定Fig. 3 Identification of CVEV full-length cDNA by PCR
随机选取 6个阳性克隆,命名为 CVEV1901—CVEV1906并进行序列测定。结果表明所获克隆均符合 CVEV基因组全长预期,序列之间的一致性为99.35%。其中,CVEV1901全长5 983 nt,由5个ORF、5′端207 nt和3′端198 nt的两个UTR以及在ORF2和ORF3之间的122 nt的基因间隔区组成。进一步分析显示,CVEV-1901与浙江分离株 XZG(登录号:MN596377)仅有一个碱基差异,第 1 375位碱基G→A,序列一致性99.98%,与四川SM分离株序列一致性 99.11%;与西班牙 VE-1分离株、美国加州VE701分离株和日本IBK分离株基因组序列一致性分别为98.61%、97.36%和96.89%;与同一属豌豆耳突花叶病毒(pea enation mosaic virus)和紫花苜蓿耳突病毒(alfalfa enamovirus)的序列一致性分别为90.46%和90.26%。
在利用 MEGA X构建的系统进化树上,CVEV1901与中国浙江分离株XZG关系最近,并与四川分离株SM一起聚为一簇;与西班牙分离株VE-1、美国加州分离株VE701、日本分离株IBK距离较近;而与同属的豌豆耳突花叶病毒和紫花苜蓿耳突病毒距离相对较远;与黄矮病毒科其他不同属病毒分居在不同的大分支上,这与序列分析结果一致(图4)。
2.4 CVEV基因组全长cDNA克隆的侵染性鉴定
2.4.1 尤力克柠檬接种 将获得的 CVEV全长cDNA克隆CVEV1901和CVEV1902分别转化农杆菌 GV3101,以 pTX1空载体为阴性对照,真空浸润接种尤力克柠檬实生苗。接种 30 d后,抽提系统新发叶片RNA进行RT-PCR检测,结果表明两株 CVEV1901接种的尤力克植株检测出 CVEV特异性条带(图5)。初步说明CVEV侵染性克隆构建成功。
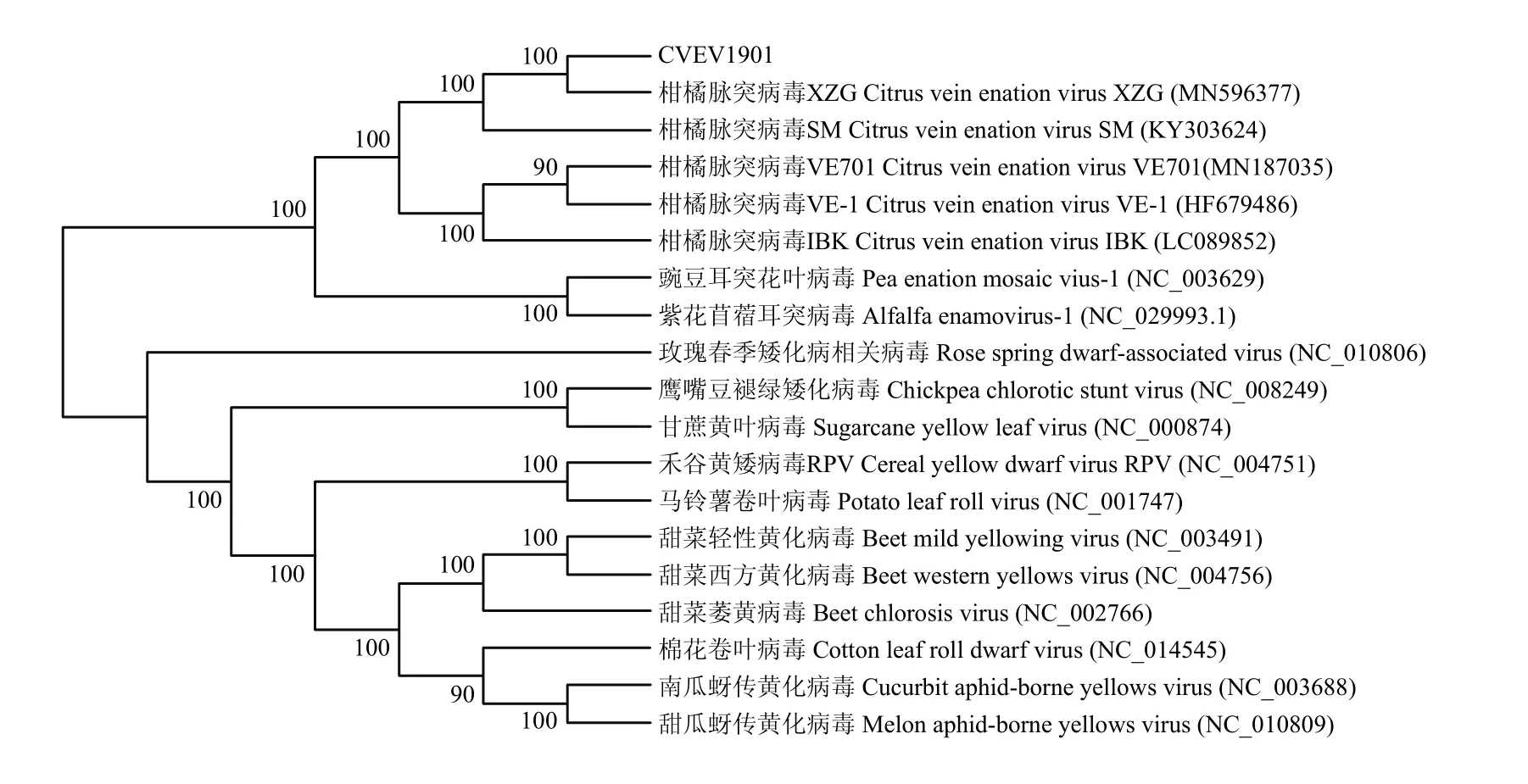
图4 CVEV与黄矮病毒科中其他病毒全长基因序列的系统进化树Fig. 4 Polygenetic tree of CVEV and other members of family Luteoviridae

图5 CVEV全长cDNA克隆接种尤力克柠檬的RT-PCR检测Fig. 5 RT-PCR detection of C. limon inoculated with full-length cDNA of CVEV
2.4.2 多品种柑橘接种 为进一步确认 CVEV1901的侵染性,通过农杆菌介导的真空浸润接种摩洛哥酸橙、邓肯葡萄柚、尤力克柠檬、枳柚、Rusk枳橙、枣阳小叶枳6个柑橘品种,并以pTX1空载体为阴性对照。结果发现部分CVEV1901接种的摩洛哥酸橙出现CVEV侵染的典型症状,叶片侧脉产生耳状小突起,叶背有相应的凹陷,叶片皱缩,部分邓肯葡萄柚和尤力克柠檬叶片出现皱缩现象(图6),而 pTX1空载体接种对照则无上述症状表现。CVEV1901接种后120 d的RT-PCR检测结果表明,摩洛哥酸橙、邓肯葡萄柚、尤力克柠檬、枳柚、Rusk枳橙和枣阳小叶枳的CVEV 阳性率分别为 16/17(94.12%)、12/14(85.71%)、16/21(76.19%)、15/19(78.95%)、13/14(92.86%)和0/18(0),而 pTX1空载体接种对照为0。这进一步表明CVEV1901为具有侵染性的CVEV基因组全长cDNA克隆。

图6 CVEV1901接种不同柑橘品种的症状Fig. 6 Symptoms on different citrus varieties inoculated with CVEV1901
3 讨论
侵染性克隆的构建是深入研究病毒分子生物学特性、致病机理及载体化利用的重要基础[24-29]。但相对于侵染草本植物的病毒,目前关于果树病毒侵染性克隆的报道较少,构建难度较大。本研究通过对CVEV病毒全长基因组的一次性 RT-PCR扩增,与 pXT1载体进行无缝重组克隆,获得了CVEV的侵染性克隆。本研究所获的侵染性克隆CVEV1901与我国已报道的XZG及SM分离株基因组长度一致,结构相同,同源性均高于 99%,通过农杆菌介导的真空浸润可以高效侵染多种柑橘品种。这不仅为研究CVEV分子生物学特性如复制、移动、基因功能等提供了单一遗传背景的材料,而且为深入研究CVEV的致病机制打下了坚实基础。在通过突变获取弱毒株系用于交叉保护,或改造为基因沉默载体方面也具有广阔的应用前景。
目前,植物 RNA病毒侵染性克隆的构建主要还是通过分段扩增、分段克隆来获得[30]。这种方法可能会造成获得的植物病毒全长cDNA为假重组体。本试验采用一步法RT-PCR扩增获得CVEV全长cDNA,则有效避免了这种情况。不过,该方法对RNA模板、反转录酶、DNA聚合酶等有比较严格的要求,尤其是模板质量和反转录酶及聚合酶的扩增和保真能力。多次试验表明,利用Trizol法提取柑橘叶片总RNA可以达到本试验需求,同时为防止RNA降解,提取RNA后立即进行第一链cDNA的合成。不同的反转录酶对于病毒基因组的全长扩增也有不同的影响,通过对不同类型反转录酶多次试验,发现采用 SuperScriptTMIV逆转录酶可成功扩增CVEV全长,CVEV1901与毒源植株XZG分离株的全基因组相比仅有一个碱基差异,与中国分离株的同源性高于99%,表明该酶的保真性能也有保证。最后,使用 In-Fusion重组连接线性化pXT1和CVEV全长cDNA,精确置于载体的35S后,在启动子与病毒5′端序列之间没有任何非病毒序列,保证了转录出的病毒的精确性,也为所获克隆具备侵染性打下了良好基础。
接种方式对病毒侵染性克隆成功接种具有重要的影响[22]。CVEV1901通过农杆菌介导的真空浸润可高效侵染多个柑橘品种。但在通过农杆菌介导的注射方式对烟草、豌豆、蚕豆、芸豆、昆诺藜等草本植物进行接种时,通过RT-PCR均未检测到CVEV阳性植株。表明CVEV1901可能无法通过注射方式成功侵染上述草本植物,当然部分植物也可能并非CVEV的有效寄主。这一现象在柑橘黄化脉明病毒(citrus yellow vein clearing virus)侵染性克隆接种时也曾出现[22],有待进一步研究。
4 结论
建立了CVEV的基因组全长RT-PCR扩增体系,获得CVEV基因组全长cDNA克隆。通过农杆菌介导的真空浸润接种,RT-PCR检测和生物学症状观察,证明CVEV1901为具有侵染性的CVEV基因组全长cDNA侵染性克隆。
致谢:南京农业大学陶小荣教授惠赠pXT1双元表达载体,在此表示感谢!

