紫花苜蓿MsDWF4的表达特性及耐盐性效应
崔苗苗,马琳,张锦锦,王筱,庞永珍,王学敏
(中国农业科学院北京畜牧兽医研究所,北京100193)
0 引言
【研究意义】紫花苜蓿(Medicago sativaL.)为豆科苜蓿属多年生牧草[1],茎叶中含有丰富的蛋白质、矿物质和维生素,因其高营养价值和高消化率等优点,被誉为“牧草之王”,是中国乃至世界上种植面积最大,种植范围最广的豆科牧草[1-3]。然而在中国,紫花苜蓿多种植在没有灌溉条件的瘠薄地和盐碱地[4],造成紫花苜蓿单位面积产量低、干草品质差、粗蛋白含量较低、种子细小和总量供应不足等问题[5],严重制约了苜蓿的产业化发展。海关统计数据显示中国苜蓿的进口量呈逐年上升趋势[6]。因此,加快培育高产抗逆紫花苜蓿是提高苜蓿产业化程度,尽快摆脱依赖进口局面的有效手段[7]。研究抗逆基因对紫花苜蓿抗逆性的调控作用,对于深入了解紫花苜蓿的抗逆机制,从而更好的指导紫花苜蓿抗逆育种具有非常重要的意义。油菜素内酯(brassionsterinds,BRs),又称为芸苔素内酯,因其强大的生理活性,被列为第六大类植物激素[8],参与并促进植物种子发芽、根茎伸长生长、光形态建成和生殖发育等过程和增强植物对高温、低温和高盐等逆境的抗逆性[9]。近年来,对BRs的研究较多,但对BRs相关基因调控植物抗逆性的分子机制研究相对较少,在紫花苜蓿中更缺乏相关内容的报道。DWF4编码的细胞色素氧化酶CYP90B1,是BRs合成的关键限速酶[10],在BRs的生物合成中催化C-22羟基化反应。挖掘紫花苜蓿中的DWF4,研究其对紫花苜蓿抗逆性的调控作用,对于在油菜素内酯合成途径方面了解紫花苜蓿的抗逆应答机制具有重要的意义。【前人研究进展】油菜素内酯是1970年由MITCHELL等[11]从油菜花粉中筛选和分离出来的具有高生物活性的物质,并命名为油菜素。1979年,GROVE等[12]解析出其化学结构为甾醇内酯,迄今为止,已经分离出了70多种类似的化合物,统称为油菜素甾醇类化合物[13]。通过对外源施加的标记中间产物和 BR突变体的研究,目前,BRs的合成途径已经日渐清晰:从起始物鲨烯,经过多个生物化学反应,最终合成BRs[14],这其中有众多的基因参与。DWF4编码的细胞色素P450家族的CYP90B1蛋白酶(一种细胞色素P450单加氧酶),是甾醇到brs2生物合成途径分支点的第一限速酶,起C-22羟化酶的作用[10,15],该步骤(图 1[10])是油菜素内酯(BRS)生物合成和内源性油菜素内酯水平反馈调控的关键[13]。1998年,CHOE等[13]和SHIMADA等[16]从拟南芥中鉴定得到第一个DWF4,该基因的突变体生长缓慢,植株矮小,叶片小而多,且高度不育,而超表达DWF4促使植物中油菜素内酯合成的增加,进而促进植物的生长并增强植物的抗逆性。进一步研究表明,在促进植物生长方面,超表达DWF4主要通过促进植物细胞的伸长和分裂进而促进转植株的生长[17]。此外DWF4还参与调控植物的分枝、花序、种子产量等,与野生型相比,超表达DWF4的转基因拟南芥的株高和种子产量均被显著提高,且超表达DWF4的转基因植株的二级分枝数[13,18]、鲜重和生物量[19]等均显著增加。DWF4的生理功能极其广泛,除了在生长发育中起作用,还能够显著提高植物的抗逆性。研究显示,超表达DWF4可以增强烟草对非生物胁迫的抗性[19],提高马铃薯的耐盐性[20]和芥菜的抗寒能力[21]。在生理学水平上,DWF4主要通过增加渗透调节物质的积累和提高抗氧化酶的活性增强植物对干旱、冷害和高温的抗性[22-23],研究证明,DWF4通过调控相关抗氧化防御系统的活性,以保护作物抵御盐害[24-27]。【本研究切入点】迄今为止,紫花苜蓿中油菜素内酯合成酶基因DWF4的功能研究鲜见报道,其调控紫花苜蓿抗逆性的机制还不是很清楚。【拟解决的关键问题】本研究从紫花苜蓿中克隆得到紫花苜蓿油菜素内酯合成酶基因MsDWF4,分析其序列特征,调查该基因对多种逆境与激素的响应,构建基因超表达紫花苜蓿材料,并开展耐盐性研究,为探索DWF4调控紫花苜蓿抗逆性的分子机制奠定基础。
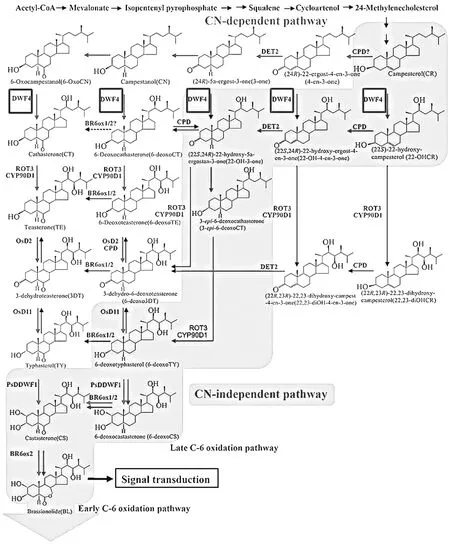
图1 油菜素甾醇的生物合成途径示意图[10]Fig. 1 A simplified brassinosteroid biosynthetic pathway [10]
1 材料与方法
1.1 试验材料
试验于2018年6月至2019年6月在中国农业科学院北京畜牧兽医研究所牧草资源实验室进行。试验所用植物材料为紫花苜蓿中苜1号(Medicago sativaL.cv. Zhongmu No.1),由中国农业科学院北京畜牧兽医研究所杨青川研究员惠赠。
1.2 植物的培养
将紫花苜蓿种子在预先铺好滤纸的培养皿中萌发,至种子露白后,移到1/2MS液体培养基中,在人工智能温室中培养。光照:16 h光/8 h黑暗,温度:25℃/23℃,光强 400 μmol·m-2·s-2。
1.3 组织表达特性
取紫花苜蓿根尖、花、嫩叶、茎、茎尖和子房等各组织,利用Eastep® Super总RNA提取试剂盒(北京华奥新创科技有限公司)提取各组织总RNA。利用Trans® Script All-in-One First-Strand cDNA Synthesis试剂盒(北京全式金生物技术有限公司)将 RNA反转录为cDNA。
1.4 逆境和激素处理
将紫花苜蓿中苜1号种子平铺于滤纸上,发芽4 d后移到1/2 MS营养液中,水培两周后,选取长势一致的幼苗进行各项处理。将紫花苜蓿幼苗材料分别移到含有 15% PEG、150 mmol·L-1NaCl、1 μmol·L-1生长素(IAA)、1 μmol·L-1油菜素甾醇(BR)、1 mmol·L-1脱落酸(ABA)和 0.1 mmol·L-1的茉莉酸(JA)的 1/2MS液体培养基中处理;高温处理时,将幼苗移入35℃培养箱;低温处理时,将幼苗放在 4℃培养箱中。以上处理,分别在0、2、4、6、8、12、24和48 h取地上部和根部样品,提取RNA,并反转录为cDNA。每个处理3次生物学重复。
1.5 DWF4的克隆
根据已有物种的DWF4序列信息,以 Noble Foundation(https://www.noble.org)网站上公布的紫花苜蓿基因序列为参照,设计cDNA全长引物ORF-F/R。以紫花苜蓿植株cDNA为模板,利用KOD-Plus高保真PCR酶(北京百灵克生物科技有限公司)进行PCR扩增。反应条件为10×Buffer for KOD-Plus 5 μL、2 mmol·L-1dNTP 5 μL、25 mmol·L-1MgSO42 μL、ORF-F 1.5 μL、ORF-R 1.5 μL、cDNA 2 μL、KOD-Plus 1 μL和 ddH2O 32 μL。PCR 反应程序为 94℃ 2 min;94℃ 15 s,56℃ 30 s,68℃ 2 min,共 32个循环;68℃ 5 min,4℃保存。将扩增后的PCR产物用AxyPrep DNA凝胶回收试剂盒(购自北京京哲永兴生物技术责任有限公司)回收,与pEASY-T1载体(购自北京全式金生物技术有限公司)连接,将重组质粒转化大肠杆菌DH5α感受态细胞,经分子检测后,阳性克隆菌液送生工生物工程(上海)股份有限公司测序。
1.6 生物信息学分析
对获得的序列进行生物信息学分析,生物信息学分析工具及用途见表1。

表1 本研究用到的生物信息学工具Table 1 Bioinformatics tools which were used in this research
1.7 MsDWF4的表达特异性分析
根据得到的紫花苜蓿DWF4的CDS序列设计实时荧光定量PCR特异引物qDF/R(表2),采用两步法,用ABI7500型荧光定量PCR仪(美国应用生物系统公司,美国)进行qRT-PCR反应扩增。反应体系为×SYBR qPCR Mix(Low Rox)5 μL、qDF(10 μmol·L-1)0.2 μL、qDR(10 μmol·L-1)0.2 μL、ddH2O 1.6 μL 和 cDNA3 μL。反应条件为 95℃ 2 min;95℃ 15 s,60℃ 30 s,40个循环。根据得到的Ct值,将各处理0 h作为对照,用2-△△Ct法[28]计算MsDWF4的相对表达量。以MsActin2为内参基因,每个试验3个样品,每个样品3次重复。
1.8 超表达载体的构建
利用 ClonExpressⅡOne Step 克隆试剂盒(北京京哲永兴生物技术责任有限公司),一步克隆法构建MsDWF4超表达载体。具体为:设计含有KpnⅠ和XbaⅠ酶切位点的引物pMsDWF4F/R(下划线部分表示酶切位点序列,表2)。用pMsDWF4-F/R引物扩增得到含有酶切位点的目的基因的开放阅读框,限制性内切酶KpnⅠ和XbaⅠ双酶切pCAMBIA1300植物表达载体质粒,将目的片段连接到载体上。在插入位点的上下游设计载体检测引物MDF/R,利用PCR和测序鉴定阳性载体质粒。
1.9 农杆菌转化及转基因植株的检测
将构建好的载体质粒,采用冻融法转化入农杆菌菌株GV3101,然后用农杆菌介导法转化紫花苜蓿[29]。用 CTAB法提取转基因植株基因组DNA,以基因组DNA为模板,以载体质粒为阳性对照(对照1),以非转基因紫花苜蓿基因组DNA和去离子水为阴性对照(对照2和对照3),MDF/R为上下游引物,进行PCR检测,筛选转基因阳性株系。
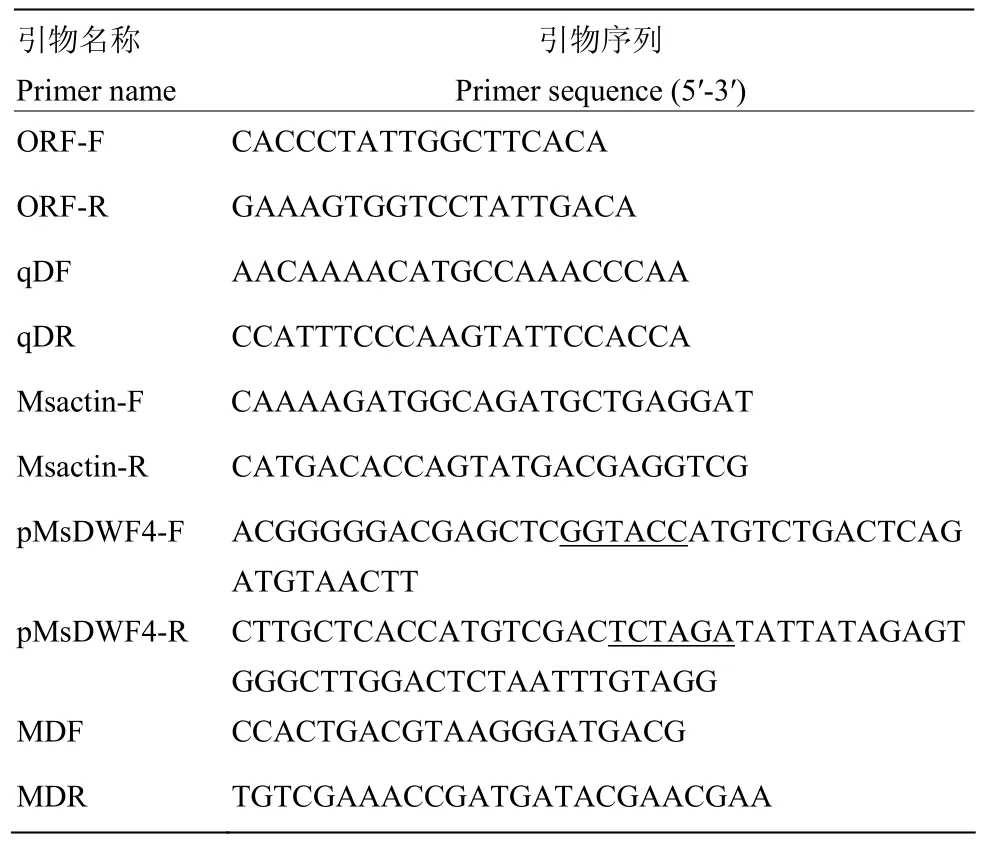
表2 本试验所用引物Table 2 Primers used in this research
1.10 转基因紫花苜蓿的耐盐性分析
提取转基因植株的RNA,逆转录为cDNA后,以qDF/R为引物,进行qRT-PCR检测,筛选出表达量高的株系。将筛选出的株系进行扦插培养,控制生长条件一致,每隔4周修剪一次,直至植株状态一致。12周后,用200 mmol·L-1NaCl处理转基因和对照植株(扦插处理同时进行),在处理0、6和12 h分别取各个材料的地上部组织,检测抗氧化酶过氧化氢酶(catalase,CAT,紫外分光光度法)、过氧化物酶(peroxidase,POD,可见分光光度法)和超氧化物歧化酶(superoxide dismutase,SOD,可见分光光度法)的活性,同时用qRT-PCR检测各材料中MsDWF4的表达水平。
2 结果
2.1 MsDWF4序列与生物信息学分析
应用同源克隆技术从紫花苜蓿中扩增得到一个完整的开放阅读框(ORF)(图2)。该序列的CDS区长度为1 470 bp,编码489个氨基酸。蛋白保守结构域的预测结果分析发现该基因编码的蛋白在第 1—486位氨基酸残基有一个特异性的保守结构域PLN02500(cytochrome P450 90B1),该蛋白属于 P450超家族。
多序列比对结果表明,该序列编码的蛋白质与其他物种的DWF4高度同源,同源性为61.0%—95.5%。其中与蒺藜苜蓿 DWF4(Medicago truncatula,MtDWF4)序列同源性高达95.5%(图3)。说明该序列可能是一个DWF4,将其命名为MsDWF4。
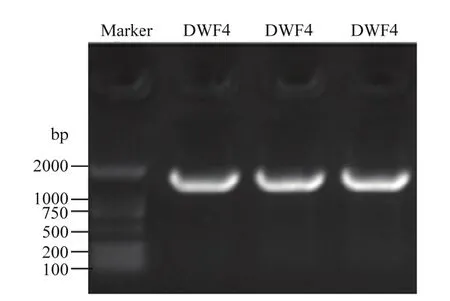
图2 MsDWF4的扩增结果Fig. 2 Amplification results of MsDWF4

图3 不同物种DWF4氨基酸序列比对结果Fig. 3 Amino acid sequence alignment results of DWF4 from different species
将 MsDWF4与其他物种的 DWF4蛋白,利用MEGA X构建系统发育树,结果表明,紫花苜蓿与豆科物种亲缘关系最近;与壳斗科、茜草科等的关系较远;而与玉米和普通小麦等禾本科物种的亲缘关系最远(图4)。
蛋白质理化性质分析结果可得出,MsDWF4蛋白分子量为55.69 kD,理论等电点(pI)为9.00。跨膜结构域的预测结果(电子附图1)显示,在MsDWF4的N端有1个跨膜螺旋(trans-membrane helix,TMHs)结构,位于第7—25位氨基酸;MsDWF4整条链中亲水性氨基酸残基多于疏水性氨基酸残基,表明MsDWF4可能为一个跨膜亲水蛋白(电子附图2)。
通过Swiss-model对MsDWF4进行三级结构同源建模,构建出MsDWF4的同源模型6a17.1.A(电子附图3)。6a17.1.A为拟南芥DWF4的三级结构。全局模型质量估计(global model quality estimation,GMQE)值为0.81,MsDWF4与模板相似性为76.29%,可见紫花苜蓿DWF4与拟南芥DWF4的蛋白三级结构高度相似,两者可能具有相似的蛋白功能。
激酶磷酸化修饰位点预测结果(图 5)发现MsDWF4蛋白有32个丝氨酸(Serine),18个位点较为活跃;有21个苏氨酸(Threonine),12个位点较为活跃;有14个酪氨酸(Tyrosine),4个位点较为活跃。
2.2 紫花苜蓿DWF4表达特性
2.2.1 紫花苜蓿DWF4组织表达特性分析MsDWF4组织特性分析结果(图6)表明,MsDWF4在根尖组织中的相对表达量最高,在花、嫩叶、茎尖和子房等组织中的表达量次之,其次是子房中的表达量,在成熟的茎中表达丰度最低。
2.2.2MsDWF4表达对逆境和外源激素的响应 为了明确MsDWF4对多种非生物逆境(35℃、4℃、15% PEG、150 mmol·L-1NaCl)和外源激素(1 μmol·L-1BR、1 μmol·L-1IAA、1 mmol·L-1ABA 和 0.1 mmol·L-1JA)的响应模式,利用qRT-PCR技术对MsDWF4在不同处理条件下的表达水平进行分析(图7和图8)。
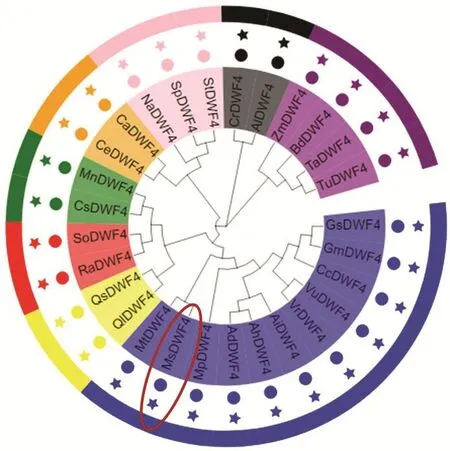
图4 不同物种DWF4系统发育树分析Fig. 4 Phylogenetic tree analysis of DWF4 in different species
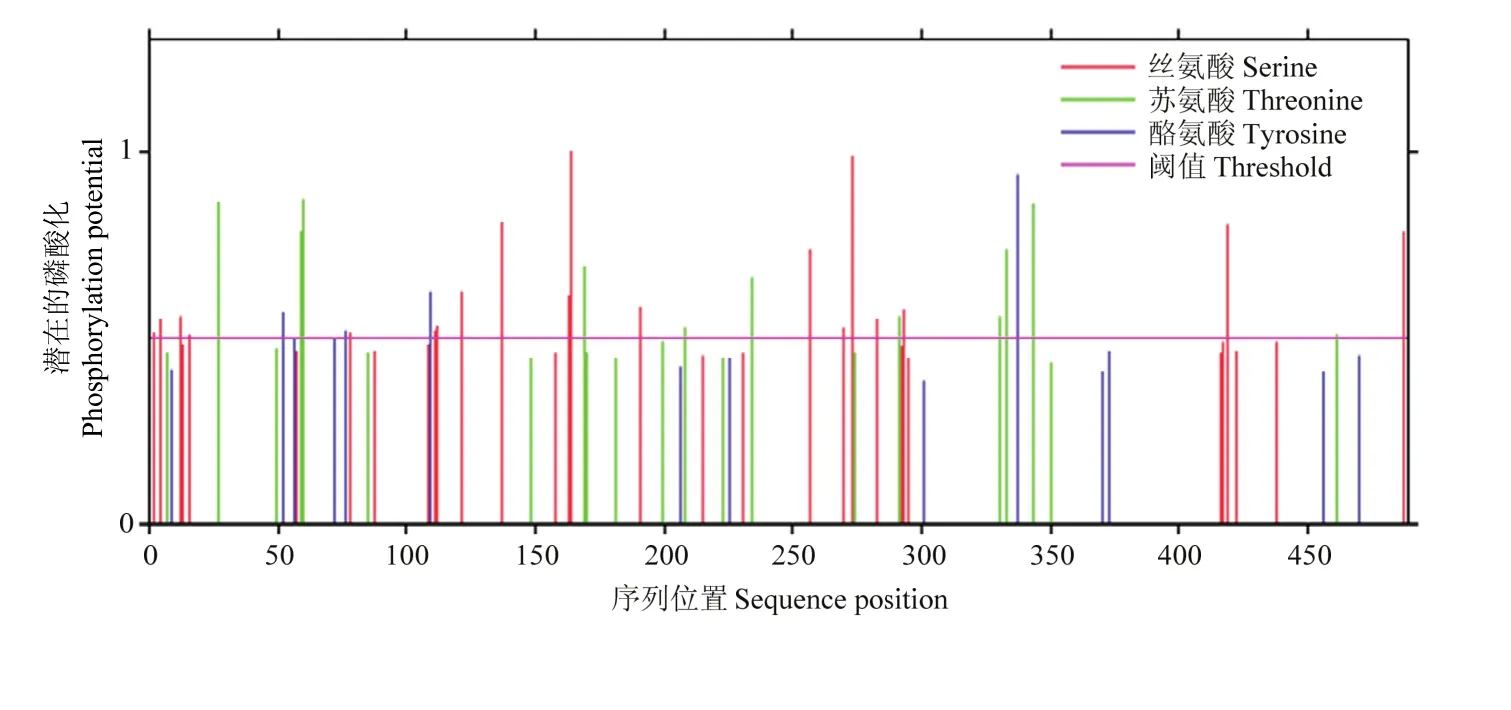
图5 MsDWF4激酶磷酸化修饰位点的预测Fig. 5 Prediction of kinase-specific phosphorylation sites of MsDWF4
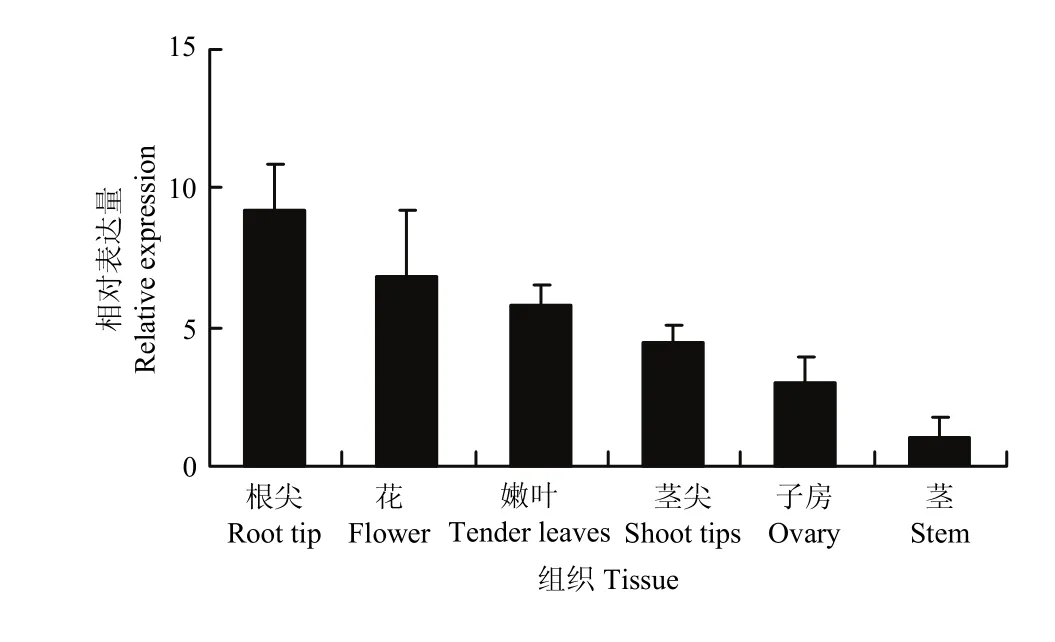
图6 MsDWF4组织特异性表达模式Fig. 6 Tissue-specific expression pattern of MsDWF4
结果显示,NaCl显著诱导基因在地上部和根部的表达,MsDWF4对盐胁迫的响应迅速,在处理2 h后地上部(图 7-A)的表达就达到极显著水平,然后在处理6 h后表达快速下降;根部(图7-B)的基因诱导表达水平整体上低于地上部。15% PEG处理下,MsDWF4在地上部(图7-C)被快速诱导,处理4 h表达水平达到峰值,随后表达丰度下降;在根部(图7-D)的表达呈先降低后升高的趋势,并在处理 12 h时达到峰值。35℃处理条件下,MsDWF4的相对表达量总体呈上升趋势,地上部(图7-E)和根(图7-F)中MsDWF4的表达量分别在处理6和48 h时达到峰值。低温(4℃)胁迫同样诱导MsDWF4表达显著上调,处理6 h时地上部(图7-G)和根部(图7-H)MsDWF4的相对表达量达到最高值,分别为对照的7.7倍和6.5倍。
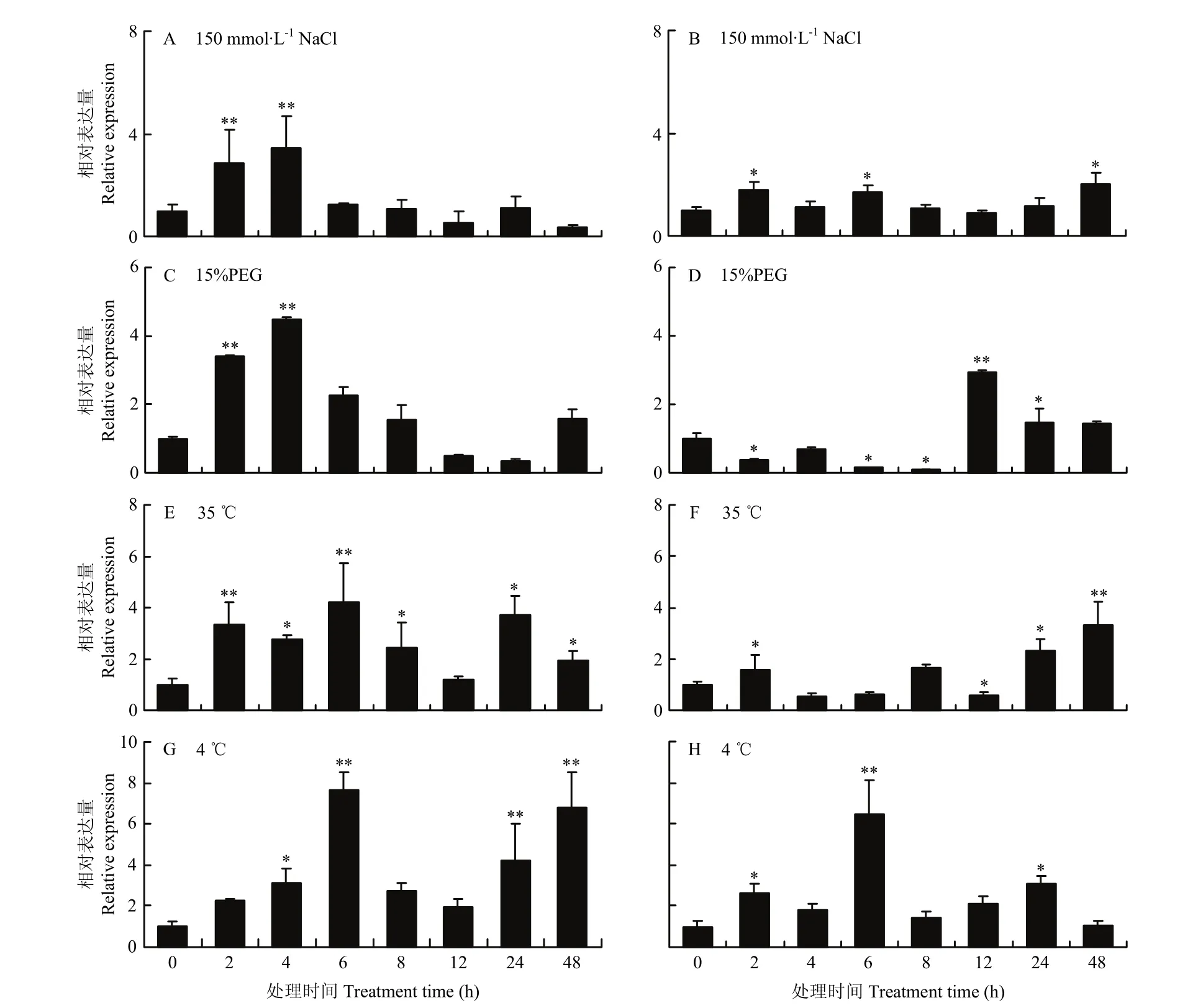
图7 不同逆境处理条件下MsDWF4的相对表达量Fig. 7 Relative expression of MsDWF4 gene under different stress treatments
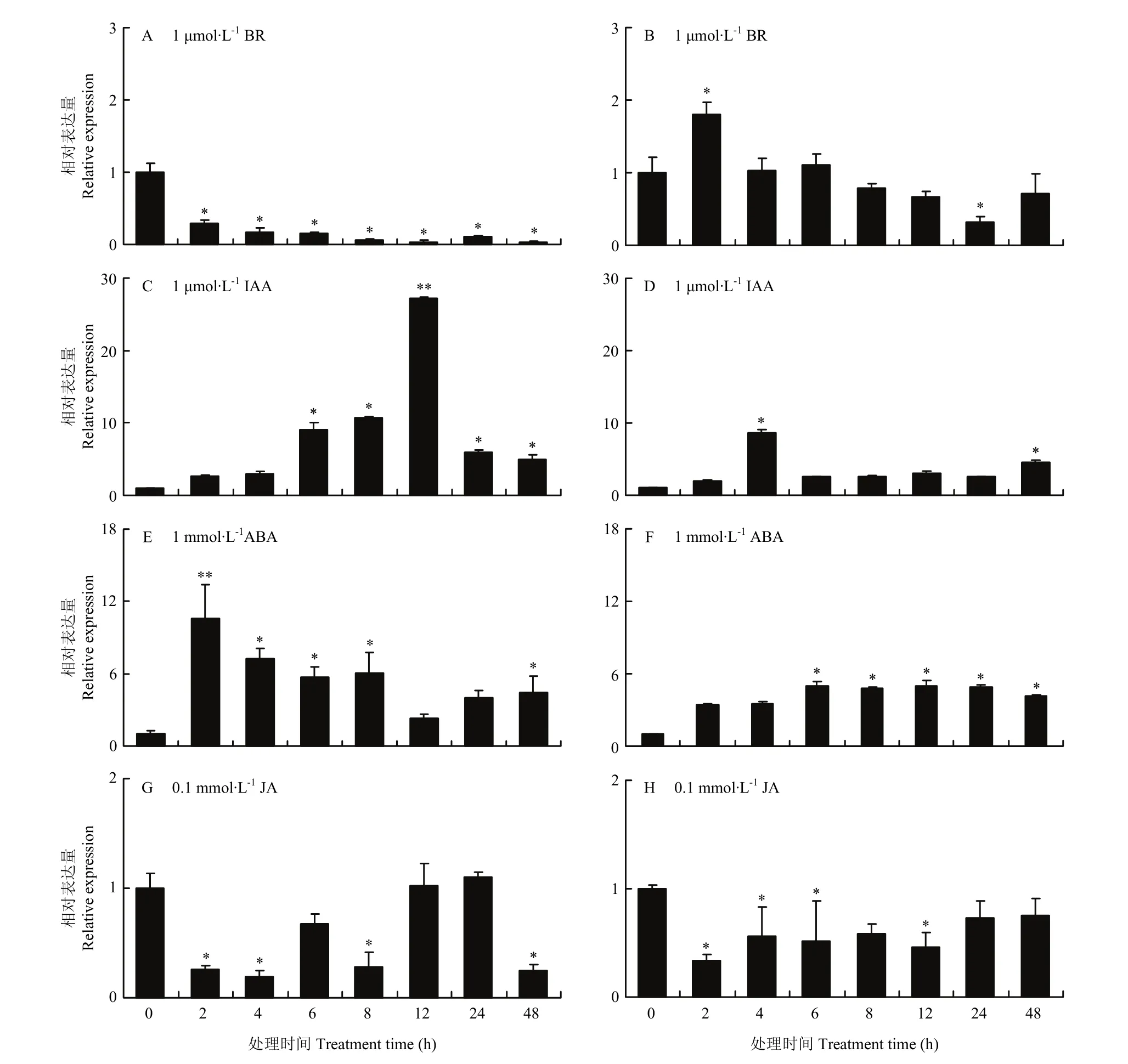
图8 不同激素处理下MsDWF4的相对表达量Fig. 8 Relative expression of MsDWF4 under different hormone treatments
MsDWF4对多种激素处理均有响应。外源油菜素内酯处理下,MsDWF4在地上部(图8-A)和根(图8-B)中的表达被抑制,且随着BR处理时间的延长,基因被抑制的程度不断增强。IAA处理下,植株中MsDWF4的表达被诱导且其表达量在处理12 h(地上部)(图8-C)和4 h(根部)(图8-D)达到峰值,分别为对照的10.78倍和8.69倍。ABA诱导MsDWF4表达上调,地上部(图8-E)和根部(图8-F)MsDWF4的表达量在ABA处理2和6 h时达到最高,分别为对照的6.03倍和5.01倍。JA抑制MsDWF4在植株中的表达,MsDWF4的表达在处理4 h(地上部)(图8-G)和2 h(根部)(图8-H)最低,为对照的19.23%和33.21%。
2.3 超表达MsDWF4转基因紫花苜蓿的检测
通过遗传转化,共获得11个超表达MsDWF4的转基因紫花苜蓿株系,并对其进行PCR检测,结果表明,株系2、株系6、株系7、株系8、株系10与株系11的PCR扩增片段长度与目标条带一致(图9),表明这些株系为阳性株系,超表达载体已经成功转化到紫花苜蓿中。
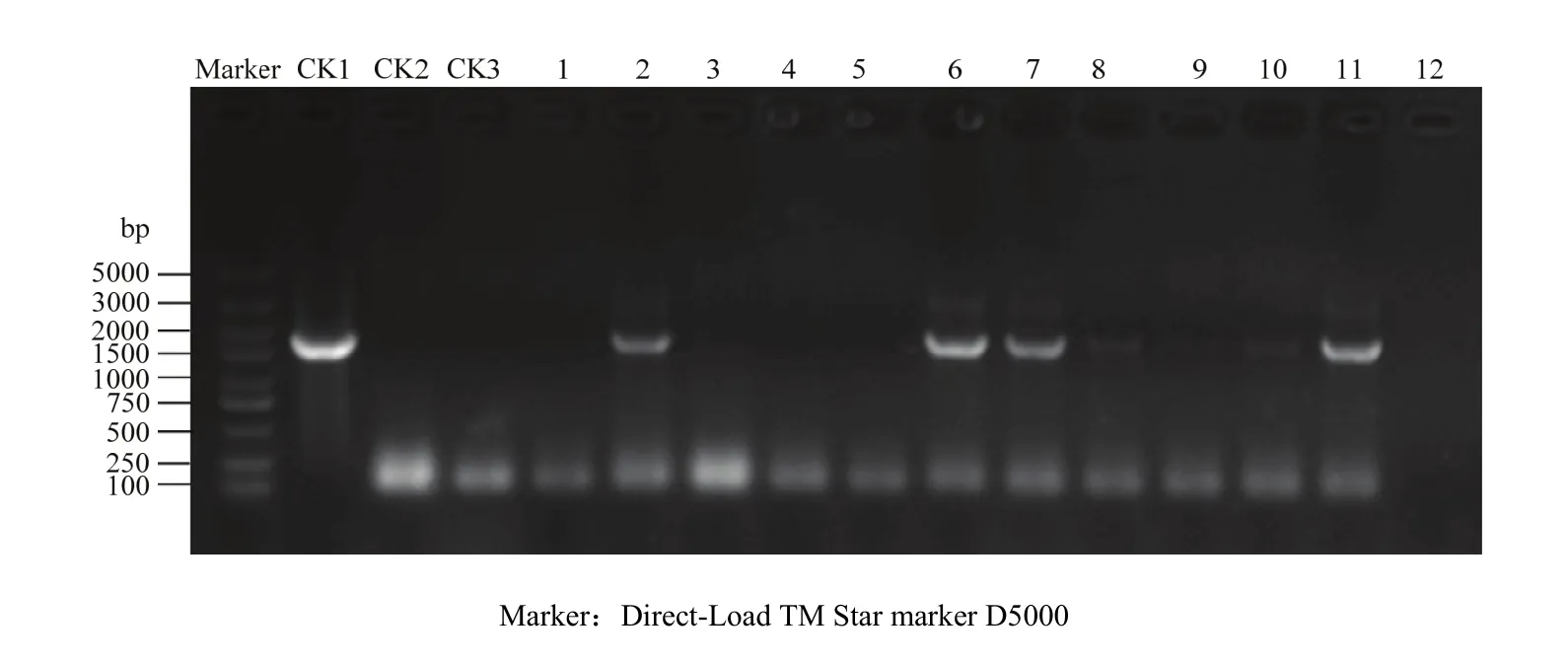
图9 转基因植株检测Fig. 9 Identification of positive transgenic lines
利用qRT-PCR检测这6个株系中MsDWF4的表达情况,结果显示,株系6和株系7表达量较高(图10),命名为L6和L7。
2.4 转基因紫花苜蓿的耐盐性检测
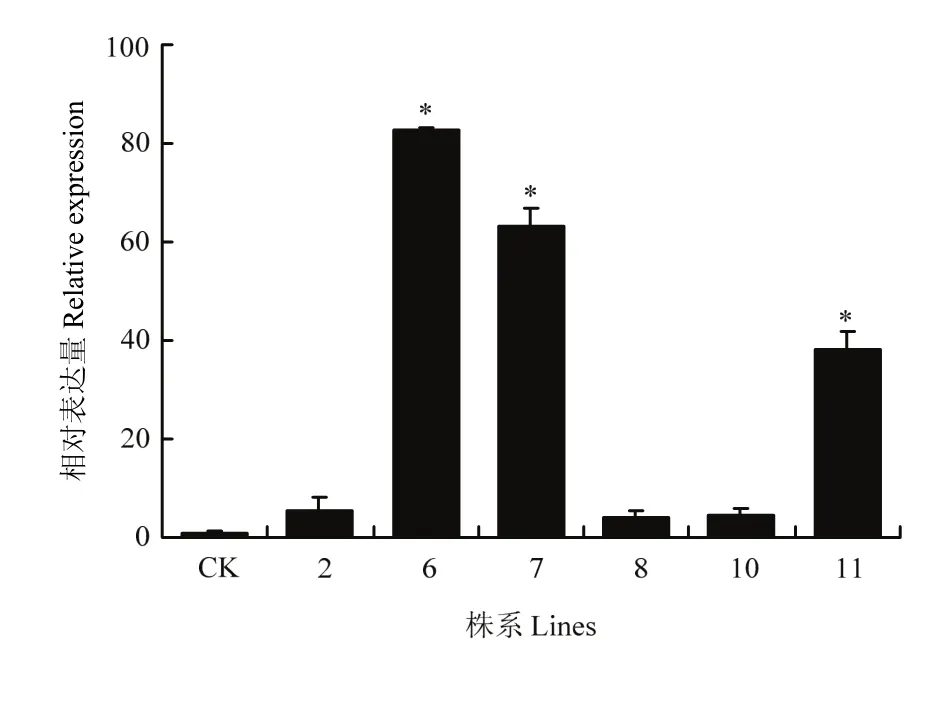
图10 超表达MsDWF4株系的qRT-PCR检测Fig. 10 Expression level analysis of MsDWF4 gene in overexpression lines by using qRT-PCR
为检测转基因紫花苜蓿的耐盐性,分析了高盐(200 mmol·L-1NaCl)处理下转基因紫花苜蓿株系(L6和L7)及对照株系中MsDWF4的表达量和3种抗氧化酶(POD、CAT和SOD)的活性。结果显示,转MsDWF4和对照株系中MsDWF4的表达均被盐胁迫显著诱导,而且转基因株系的诱导水平显著高于对照植株。在正常条件下,转基因株系的 CAT、POD和SOD酶活性均显著高于野生型;受高盐胁迫,转基因株系和对照株系中3种酶活性均显著增强,但2个转基因株系的抗氧化酶活性显著高于对照,增加速度更快。在盐处理12 h后,CAT和POD活性在转基因材料和对照中均下降,CAT活性仍高于对照植株。而SOD的活性在处理12 h仍然呈上升趋势,并且显著高于对照植株。
3 讨论
DWF4是油菜素内酯合成的限速酶基因,已在多种植物中得到分离鉴定,但紫花苜蓿中DWF4的研究还未见报道。本研究利用同源克隆的方法分离得到紫花苜蓿油菜素内酯合成酶基因MsDWF4。对MsDWF4蛋白特性进行分析得知 MsDWF4为不稳定的跨膜亲水蛋白,其不稳定性可能为后续蛋白质的功能研究增加难度[30]。MsDWF4蛋白的三级结构的预测分析表明,DWF4蛋白的三级立体结构形成一个中空的活性囊。研究表明,DWF4蛋白的活性囊结构是其与配合物的结合位置,活性囊的形状和体积会随着配合物种类的变化而变化[30],DWF4的特异性抑制剂BRZ(brassinazole),与DWF4结合后,DWF4的空间构象发生改变,抑制BRs合成过程中的C-22位的羟基化反应,降低内源BRs水平[31-34]。因此,紫花苜蓿的MsDWF4蛋白可能也是通过这样的方式进行BR生物合成调控的。这些结构和理化性质的分析有利于加深对MsDWF4蛋白的了解,并且为之后MsDWF4的功能研究提供理论基础。
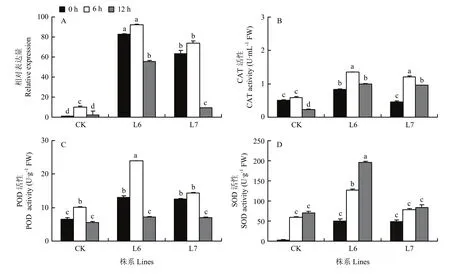
图11 200 mmol·L-1 NaCl处理条件下MsDWF4的表达及抗氧化酶的活性Fig. 11 Expression level of MsDWF4 and antioxidant enzyme activity analysis in CK and transgenic lines under 200 mmol·L-1 NaCl treatment
蛋白质磷酸化是一种重要的翻译后修饰[35],主要集中在肽链中的酪氨酸、丝氨酸、苏氨酸残基上,磷酸化后,这些氨基酸带上电荷,导致蛋白质的结构发生变化,进一步引起蛋白质的活性发生变化[36],磷酸化修饰与激素反应,信号转导,细胞周期及生长发育等诸多的生物学问题密切相关[36]。本研究预测了MsDWF4的磷酸化位点以及活跃的磷酸化位点,为后期开展MsDWF4功能的研究奠定了基础。
通过对MsDWF4表达模式的分析,发现MsDWF4主要在根尖、茎尖等生长旺盛的组织器官中表达,这与前人研究相似[16,37]。暗示MsDWF4可能与其他物种的DWF4一样,参与了紫花苜蓿的生长发育过程,对植株生长具有促进作用。具体功能还需要进一步的验证。
多项研究显示,DWF4参与了植物抗逆性的调控。SAHNI等[38]通过对植物的生长状态和应激反应的表型观测发现,与野生型相比,超表达拟南芥DWF4的转基因植物对脱水和热激的耐受性明显增加。低温环境下,转DWF4的植株相对电导率明显低于野生型,而脯氨酸积累量则明显高于对照野生型[21]。拟南芥AtDWF4过表达的幼苗相较于野生型幼苗低温耐受性明显提高[39],即超表达DWF4能够提高植株的抗寒性。本研究对MsDWF4在高温、低温和干旱胁迫下的表达进行了分析。结果显示,NaCl、15% PEG、35℃和4℃逆境处理下,MsDWF4的表达均可被不同程度的诱导,说明MsDWF4很可能也参与了这些逆境胁迫的响应。
自然环境中,当植物在生长发育过程中长时间受到非生物胁迫(如干旱、高盐、高温和低温等)时,植物细胞感知逆境信号并转换为胞内信号,进而通过调控相关基因表达和蛋白的合成,改变其细胞内部的生理代谢,启动各种防护机制以抵御和适应逆境胁迫[40]。其中抗氧化酶系统就是一个非常重要的防御机制。当植物遭受逆境胁迫时,细胞通过增加相关抗氧化防护酶(CAT、POD和SOD等)活性的和一些非酶类的小分子物质(还原性谷胱甘肽、抗坏血酸盐、生育酚等)的含量来清除逆境胁迫下细胞内积累的大量的活性氧(reactive oxygen species,ROS)以降低ROS对细胞器和各种生物大分子的破坏,从而维持细胞内环境的稳态及各种代谢活动的正常进行[41-43]。研究发现,盐胁迫下超表达DWF4的马铃薯植株中,渗透调节物质(如脯氨酸、可溶性蛋白和可溶性糖等)的含量和抗氧化酶(SOD、POD和APX等)的活性均高于对照组,渗透调节物质和抗氧化酶共同减轻植物盐胁迫伤害从而来提高马铃薯的抗盐性[13,20,24-27]。PeDWF4可促使盐胁迫下的植物细胞大量表达DWF4进而增加BR含量,从而提高转基因材料的抗盐性[44]。本研究中,盐胁迫下,MsDWF4的表达被显著诱导,且高盐胁迫下超表达MsDWF4的紫花苜蓿植株中MsDWF4的表达量和SOD、POD和CAT这些抗氧化酶的活性都较对照高,这些抗氧化酶可清除盐胁迫下植物体内增加的ROS,减轻紫花苜蓿因盐胁迫造成的伤害,从而使转基因植株具有更高的耐盐性。说明MsDWF4通过调节植物的抗氧化酶系统,正向调控了紫花苜蓿的耐盐性。
ABA被称为“逆境激素”[45],逆境胁迫条件下植株体内的脱落酸大量积累,并参与逆境胁迫应答。已有研究发现,ABA处理后玉米DWF4的相对表达量升高[46]。本研究中,MsDWF4受多种逆境胁迫的诱导表达上调,因此我们分析了ABA激素对MsDWF4表达的影响。结果显示,无论是在地上部还是根部,该基因表达都受ABA诱导上调。暗示MsDWF4对逆境胁迫的响应可能是依赖于或部分依赖于ABA途径的。
油菜素内酯(BRs)的动态平衡是高等植物正常生长发育的基础,植物内源油菜素内酯积累增加会导致油菜素内酯生物合成降低以及降解增加。DWF4是BR生物合成的第一限速酶基因,被认为是平衡BR浓度水平的目的调节基因[13]。外施油菜素内酯合成抑制剂Brz(brassinazole)可以增加DWF表达,而用表油菜素内酯(brassinolide,BL)处理植物,会使特异参与油菜素内酯生物合成途径的基因DWF4和BR6ox1等的表达降低,内源性BL含量增加时BR特异性生物合成基因,DWF4、CPD、BR6ox1和ROT3等基因的表达下调,而 BR缺陷体中这些基因的表达上调[47-49]。本研究中用1 μmol·L-1BR处理紫花苜蓿后,MsDWF4的表达被显著抑制。说明在紫花苜蓿中,外源BR对DWF4起到抑制作用,以维持植物体内油菜素内酯的动态平衡。
除了 ABA,BR与其他激素也存在互作。REN等[50]通过对与JA信号转导相关基因的相对表达量的检测发现,当外界条件变化触发JA信号时,JA通过下调DWF4的表达来破坏BRs信号,从而实现植物的最佳生长。本研究中,0.1 μmol·L-1JA处理下,根部和地上部MsDWF4的表达均被抑制,暗示 JA是对MsDWF4进行负调控从而实现对紫花苜蓿生长的调控。KIM等[51]、CHUNG等[52]和YOSHIMITSU等[53]通过对启动子的分析和内源性BRs的测定证明生长素对BRs生物合成有刺激作用且直接调控BR的生物合成。本研究中用低浓度的生长素(1 μmol·L-1)处理紫花苜蓿后,根部和地上部中MsDWF4的表达均被显著上调。说明在紫花苜蓿中,生长素对BR的生物合成同样起到积极的促进作用。
4 结论
获得紫花苜蓿油菜素内酯合成的关键酶基因MsDWF4,该基因编码489个氨基酸,为亲水性跨膜蛋白,属于P450超家族。MsDWF4主要在生长活跃的组织和器官中表达,可能参与紫花苜蓿某些生长发育方面的调控,并对多种非生物逆境发生响应。MsDWF4正向调控紫花苜蓿的耐盐性。

