雨生红球藻虾青素酰基转移酶的鉴定与功能研究
曹 黎 马海燕 魏自旺 赵 亮 伍小颖严海龙 胡 强 韩丹翔
(1. 中国科学院水生生物研究所藻类生物技术和生物能源中心, 武汉 430072; 2. 中国科学院大学, 北京 100049)
在自然界中, 虾青素由一部分的微藻、植物、真菌及细菌合成, 而在微藻中的分布尤为广泛。目前已知的能够合成虾青素的微藻包括新绿藻(Neochloris wimmeri)、栅藻(Scenedesmus vacuolatus)、小球藻(Chlorella zofingiensis)、原管藻(Protosiphon botryoides)和雨生红球藻(Haematococcus pluvialis)等[1]。虾青素在微藻细胞中的积累, 是单细胞光合生物抵抗环境胁迫的一种重要保护机制。以雨生红球藻为例, 其在氮和磷等营养缺乏以及高光、高盐、高温和干燥胁迫条件下可以诱导虾青素的积累, 最高可达干重的4%[2,3]。
近年来, 雨生红球藻中许多与类胡萝卜素和虾青素生物合成相关的编码基因已经被鉴定, 这也使其成为研究虾青素生物合成与调控的模式生物[4]。目前对雨生红球藻虾青素生物合成调控的研究大多数集中在基因表达调控上。研究发现, 雨生红球藻中大多数涉及类胡萝卜素生物合成的基因, 受到非生物胁迫条件(如高光、高盐等)在转录水平上的正向调控[5,6]。转录水平调控被认为受自由基的形成的控制[7]。另外, 通过一系列的光合电子传递的抑制剂研究表明, 质体醌的氧化还原状态也能调控类胡萝卜素合成基因的表达[8]。
最新研究表明虾青素和脂肪酸生物合成这两个途径是通过形成虾青素酯相互作用的, 表明虾青素的生物合成可能存在代谢水平的调控。一旦虾青素酯的合成受到抑制, 细胞内游离的虾青素过多积累, 从而对虾青素生物合成起到负反馈调节[9]。研究发现在虾青素合成的体外酶活测定体系中添加甘油二酯酰基转移酶(Diacylglycerol Acyltransferase, DGAT)特异性抑制剂黄腐酚(Xanthohumol)和A922500, 对虾青素酯和虾青素的净合成起到抑制作用[10—12]。该结果表明虾青素酯的形成即虾青素的酰基化可能是由DGAT所催化。
DGAT是甘油三酯(Triacylglycerol, TAG)合成过程中的限速酶, 能够催化甘油二酯的酰基化反应。目前有一些DGAT已经被鉴定, 包括Ⅰ型的DGAT1和Ⅱ型的DGAT2[13]。它们催化了相同的生物学反应, 但是在序列上并没有明显的相似性[14]。DGAT1作为膜结合Acyl-CoA-酰基转移酶(Membrane bound O-acyltransferase, MBOAT)家族的一员, 具有广泛的底物选择性, 是一种多功能酶[15]。DGAT2首次是在一种油性真菌拉曼被孢霉(Mortierella ramanniana)中被发现[16]。通过对目前已知基因组藻的比较分析表明在真核藻类中DGAT2比DGAT1更为普遍存在, 比如莱茵衣藻Chlamydomonas reinhardtii具有5个DGAT2, 其中的2个拷贝在缺氮条件下表达上调[17,18]。
本研究在前期研究的基础上, 首次克隆了雨生红球藻II型DGAT编码基因(DGTT2)cDNA全长序列, 并通过体内外的酶活分析体系初步确认了其功能, 为深入研究虾青素酯化过程奠定了基础。
1 材料与方法
1.1 实验材料
雨生红球藻H. pluvialis316由本实验室保藏。TAG合成缺陷型酵母Saccharomyces cerevisiaeH1246(MATαare1-Δ::HIS3are2-Δ::LEU2dga1-Δ::KanMX4 Iro1-Δ::TRP1 ADE2 ura3TAG-SE-)[19]和酵母表达载体pYES2/CT均购自美国Invitrogen公司。pYES2/CT-CrDGTT2-H1246过表达酵母转化子由北京大学刘进老师惠赠。
1.2 DGTT2基因引物设计与PCR扩增
将莱茵衣藻DGAT2家族中的CrDGTT1(Cre12.g557750), CrDGTT2(Cre02.g121200), CrDGTT3(Cre06.g299050)和CrDGTT4(Cre03.g205050)的氨基酸序列依次在雨生红球藻高光胁迫下的转录本中进行比对, 得到一个与CrDGTT2氨基酸序列高度匹配的转录本。该转录本含有第一个起始密码子ATG、终止密码子, 部分5′-UTR和3′-UTR。接着设计上下游引物(5′-cggaattcATGGGTGTCGCAACG AATGC-3′/5′-gctctagaCTGGATCTCCAGGGGCT TGTC-3′, 由上海生工生物技术有限公司合成), 并以雨生红球藻cDNA库为模版进行PCR扩增。PCR体系(25 μL)如下: Premix(Vazyme Biotech)12.5 μL,ddH2O 9.5 μL, 上游引物1 μL, 下游引物1 μL,cDNA模板1 μL。反应条件为98℃预变性2min,98℃变性30s, 59℃退火30s, 72℃延伸1min, 共35个循环; 72℃延伸10min, 4℃保存。PCR产物用1.2%的琼脂糖凝胶电泳检测, 切胶纯化回收目的片段, 然后将产物与pMD18-T载体连接, 并转化至DH5α中, 氨苄抗性平板筛选阳性克隆并进行菌液PCR鉴定, 最后送往上海生工生物技术有限公司测序。
1.3 DGTT2基因序列分析
利用NCBI(http://www.ncbi.nlm.nih.gov/BLAST)的BLASTP工具进行同源基因氨基酸序列的查找。利用ExPASy(http://web.expasy.org/protparam/)软件预测蛋白分子量及等电点。利用SMART(http://www.cbs.dtu.dk/services/TMHMM-2.0/)软件预测蛋白跨膜结构域。利用DNAMAN 6.0进行氨基酸序列比对以及MEGA 6.0软件中的邻接法(Neighbor-joining method)构建系统发育进化树。
1.4 酵母菌株的转化、培养和诱导
将测序正确的pMD18-T-HpDGTT2经双酶切后克隆到酵母表达载体pYES2/CT并转化至酵母S.cerevisiaeH1246, 实验操作根据试剂盒说明书(Invitrogen, USA)进行。将酵母株pYES2/CT-H1246、pYES2/CT-HpDGTT2-H1246以及pYES2/CTCrDGTT2-H1246接种于酵母Sc-Ura生长培养基中(北京泛基诺科技有限公司), 培养条件为30℃,250 r/min培养12h至16h, 然后转接至酵母诱导培养基(北京泛基诺科技有限公司)中并使其接种初始浓度A600为0.4。pYES2/CT-HpDGTT2-H1246、阳性对照pYES2/CT-CrDGTT2-H1246及空载pYES2/CT-H1246酵母转化子的诱导时间分别为12h、12h和24h。
1.5 外源脂肪酸喂养HpDGTT2和CrDGTT2酵母转化子
pYES2/CT-HpDGTT2-H1246和pYES2/CTCrDGTT2-H1246被转接至诱导培养基后, 将终浓度为90 μmol/L的外源脂肪酸C16﹕1(n7), C18﹕2和C18﹕3(n3)[脂肪酸均溶解于0.1 g/L牛血清白蛋白(Bovine serum albumin, BSA)]添加入酵母培养物中, 分别取培养0和24h的培养物经10 μmol/L的BODIPY 409/503(Invitrogen, USA)进行染色后拍照以观察脂滴的合成。
1.6 酵母微粒体的提取与蛋白免疫印迹(Westernblotting)验证
将诱导收获的酵母经4000×g, 2min离心后去除上清。用PBS磷酸缓冲液轻轻重悬酵母, 经4000×g, 2min离心后去除上清; 然后将菌体重悬于酵母裂解缓冲液[5%(w/v)甘油, 20 mmol/L Tris-HCl(pH=8.0)、0.3 mol/L (NH4)2SO4、10 mmol/L MgCl2+蛋白酶抑制剂, 购自Roche公司], 经低温超高压细胞破碎仪破碎(1000 bar预破碎一次, 1800 bar破碎3至4次), 收集细胞匀浆, 经3000×g, 10min,4℃离心, 将上清转移至干净的超离管; 经10000×g,30min, 4℃离心去除线粒体, 将上清转移至干净的超离管; 100000×g, 60min, 4℃离心去除上清, 收集沉淀得到酵母微粒体。用制备的酵母的微粒体做蛋白免疫印迹, 其中将转化空载的酵母的微粒体作为对照, 以确认HpDGTT2在酵母中的表达。蛋白免疫印记的操作过程为取20 μL的酵母微粒体, 加入60 μL的缓冲液A和40 μL的缓冲液B于震荡仪上震荡30min使其充分混合, 其中缓冲液A组分为0.1 mol/L Na2CO3和0.1 mol/L二硫苏糖醇(DL-Dithiothreitol, DTT); 缓冲液B组分为30%(m/v)蔗糖和5%(w/v)十二烷基硫酸钠(Sodium dodecyl sulfate,SDS); 然后加入20 μL 6×蛋白质上样缓冲液(Trans-Gen Biotech), 于65℃金属浴10min, 接着20000×g,4℃, 10min离心后取上清上样至聚丙烯酰胺凝胶中电泳。
1.7 雨生红球藻的培养和诱导
将雨生红球藻H. pluvialis316以初始接种浓度约5×104cells/mL接种于12 L的平板光生物反应器中, 培养基为BG-11(Blue-Green Medium)完全培养基[20], 培养温度为20℃, CO2通气量为2%(v/v), 光强控制在20 μmol photons/(m2·s)。经4-5d的生长细胞浓度约1.1×105cells/mL, 经3000×g, 3min离心去除上清收集藻细胞, 用PBS磷酸缓冲液洗1至2次后将细胞轻柔重悬于BG-11缺氮培养基中, 光强控制在200 μmol photons/(m2·s), 高光缺氮诱导13h后离心(3000×g, 3 min)收集雨生红球藻细胞, 再经磷酸缓冲液PBS清洗1至2次。3000×g, 3min离心后去掉上清收获藻细胞。
1.8 雨生红球藻内质网的制备
将经生长和诱导收获的雨生红球藻细胞重悬于藻裂解缓冲液(10 mmol/L Tris-HCl, pH=7.4、5 mmol/L Na2EDTA、0.1%(w/v)BSA+蛋白酶抑制剂, 购自Roche公司), 经低温超高压细胞破碎仪破碎(1000 bar预破碎1次, 1400 bar破碎3至4次)。收集细胞匀浆, 经3000×g, 10min, 4℃离心。将离心后的上清转移至干净的超离管中, 经10000×g, 14min,4℃离心去除线粒体; 然后将上清依次用18%和25%(w/v)的蔗糖溶液悬托, 经100000×g, 60min, 4℃超速离心后, 收集原蔗糖浓度18%以及18%和25%界面层位置所在处的溶液, 将其转移至干净的超离管中, 再次经100000×g, 60min, 4℃超速离心后去掉上清, 收集沉淀得到雨生红球藻的内质网。借助于内质网细胞器特异性蛋白Marker, 蛋白免疫印迹检测分离得到的内质网的质量。
1.9 雨生红球藻虾青素酰基化的体外酶学分析体系的建立
体外酶学分析体系的建立将分离出的雨生红球藻的内质网作为虾青素酰基转移酶反应测定的粗酶, 将虾青素单体(HPLC级, 纯度≥97%,Sigma-Aldrich)和酰基辅酶A(Acyl-CoA)(Sigma-Aldrich)作为虾青素酯合成的前体。体外酶学分析体系的建立如下: 将制备好的雨生红球藻内质网与虾青素分子(溶解在氯仿中)在正己烷和机械力的作用下融合。在一个总体积为600 μL的反应体系中,其中内质网蛋白总量约500 μg, 蛋白浓度用CB-X protein assay kit(GBiosciences, http://www.gbiosciences.com)来测量, 根据试剂盒说明书进行操作。虾青素单体和酰基辅酶A(18﹕1-CoA, n9)在反应体系中终浓度为250 μmol/L, 其中将以水代替酰基辅酶A的反应体系作为对照组。
利用体外酶学分析体系鉴定虾青素酰基转移酶将含有重组HpDGTT2的酵母微粒体(蛋白总量约为600 μg)分别添加至上述体系中进行虾青素酰基转移酶酶活检测。其中将空载表达载体pYES2/CT-H1246的酵母微粒体作为虾青素酰基转移酶活反应的对照组。以上实验反应条件为30℃,250 r/min, 反应时间90min。雨生红球藻虾青素酰基化的体外酶活反应完成后, 用1.8 mL甲醇终止反应, 再加入4.8 mL氯仿, 在震荡仪上水平震荡10min来提取反应体系中的色素。经1000×g, 3min离心后吸取有机层转移至干净的玻璃管中, 溶解于有机试剂中的色素经氮气吹干后, 复溶于300 μL甲醇﹕二氯甲烷=3﹕1(v/v)(HPLC级, Sigma-Aldrich, USA), 然后用高效液相色谱仪来对反应体系中的色素组分进行定性和定量的分析。
高效液相色谱检测条件根据不同类胡萝卜素保留时间和480 nm吸收光下光谱图的差异,可以鉴定出游离虾青素及虾青素酯所对应的色谱峰[21]。在本研究当类胡萝卜素的分离洗脱程序为: 0—8min流动相为100%A; 8—14min流动相由100%A切换为100%B; 14—38min流动相为100%B; 38—40min流动相由100%B切换为100%A; 40—45min流动相为100%A。A相为二氯甲烷﹕甲醇﹕乙腈﹕水=5﹕85﹕5.5﹕4.5(v/v); B相为二氯甲烷﹕甲醇﹕乙腈﹕水=25﹕28﹕42.5﹕4.5(v/v), 分离洗脱流速为1 mL/min。
1.10 酶活性的表征
利用雨生红球藻内质网膜建立体外反应体系雨生红球藻虾青素酰基化的体外酶活反应完成后, 用甲醇终止反应, 用氯仿来提取反应体系中的色素, 然后用高效液相色谱仪来对反应体系中的色素组分进行定性和定量的分析。根据不同色素保留时间和480 nm吸收光下光谱图的差异, 可以鉴定出虾青素酯所对应的色谱峰。每个色谱峰对应的峰面积数值大小可以表征色素的含量[22]。在以雨生红球藻内质网膜建立反应体系时, 将以水代替酰基辅酶A的反应体系作为对照组。分别统计实验组和对照组的虾青素酯的含量并进行比较分析。
利用体外分析体系鉴定虾青素酰基转移酶将实验组(HpDGTT2微粒体+内质网为酶源)所生成的虾青素酯的含量相对于对照组(空载微粒体+内质网为酶源)虾青素酯的含量的比值作为评价Hp-DGTT2酵母微粒体活性的依据。若其比值大于1,则表明HpDGTT2有效地参与了反应, 从而初步确定HpDGTT2为虾青素酰基转移酶。以上每组各设置4组技术重复并进行t-test, 如果P<0.05则认为差异显著。
2 结果
2.1 雨生红球藻DGTT2基因全长扩增和序列分析
以雨生红球藻cDNA为模板, 设计引物DGTT2-Y-F/R进行PCR扩增, 获得雨生红球藻DGTT2基因编码区全长为1017 bp, 共编码338个氨基酸, 其相对分子质量为37.82326 kD, 理论等电点(Isoelecric point)为9.75。通过TMHMM软件预测DGTT2编码了1个3次跨膜蛋白。通过DNAMAN6.0进行氨基酸多序列比对发现DGTT2包含一段高度保守的“YFP”结构域和一段与DGAT2/MGAT活性功能相关的“FPHG”结构域(图 1)[23]。
雨生红球藻DGTT2氨基酸序列经NCBI中Protein Blast比对, 发现其与莱茵衣藻的DGTT2(CrDGTT2)具有最高的同源性, 相似性高达97%。利用软件ClustalW与其他23种生物的DGAT2氨基酸序列进行多重比对, 并用MEGA6.0软件以邻位相接法(Neighbor-joining method)构建了DGAT2基因氨基酸的系统发育进化树。如图 2所示, HpDGTT2与莱茵衣藻中的同源基因CrDGTT2形成聚类, 该类群与由单细胞绿藻Monoraphidium neglectumdDGAT2和月牙藻Raphidocelis subcapitataDGAT2所组成的类群构成姐妹群。
2.2 HpDGTT2在TAG合成缺陷型酵母Saccharomyces cerevisiae H1246中的表达
用提取的pYES2/CT-HpDGTT2-H1246酵母的微粒体用做蛋白免疫印迹检测, 以确认HpDGTT2的表达。结果表明HpDGTT2在酵母中成功表达而且可在微粒体中检测到, HpDGTT2编码的融合蛋白分子大小分别约为38 kD(图 3A), 与预测的结果基本一致。为了检测HpDGTT2是否具有DGAT功能参与TAG的合成, 本研究对酵母细胞进行了荧光染色和显微观察。由于雨生红球藻的甘油三酯富含C16﹕1(n7)、C18﹕2和C18﹕3(n3), 而这些脂肪酸在酵母细胞中含量低[24,25], 因此在酵母培养体系中添加了以上三种外源的脂肪酸, 以避免由于脂肪酸缺乏导致无法检测到TAG合成的情况发生。本研究还将CrDGTT2过表达酵母(以及脂肪酸喂养组)作为TAG合成的正对照[26]。结果显示无论是否添加外源脂肪酸, 过表达HpDGTT2均未能回补S. cerevisiaeH1246的TAG合成缺陷的表型(图 3B), 而过表达阳性对照CrDGTT2酵母转化子出现了产油的表型(图 3C), 说明HpDGTT2不具备合成TAG的功能。
2.3 HpDGTT2具有虾青素酰基转移酶的功能
当用HPLC对雨生红球藻内质网的色素组成进行分析时, 发现在本研究中所使用的HPLC色素检测系统中, 虾青素在保留时间3min左右时出峰, 而虾青素酯的出峰时间在12—28min左右(图 4A)。将雨生红球藻分离的内质网作为粗酶建立虾青素酯的体外酶活测定方法时, 首先利用内质网细胞器特异性蛋白标记物BIP对分离的内质网进行免疫印迹, 结果显示内质网制备质量良好(图 4B)。体外酶活实验结果显示, 相比于对照组, 实验组的虾青素酯的绝对含量在反应的90min内呈现了明显的增加(图 4C)。
将空载pYES2/CT和pYES2/CT-HpDGTT2酵母微粒体添加到雨生红球藻分离的内质网为粗酶建立虾青素酯的体外酶活测定方法时, 发现添加Hp-DGTT2酵母微粒体使反应体系中保留时间为20.8min,21.1min, 24.3min对应的虾青素酯的含量分别提高了13.79%、9.56%和25.86%(P<0.05, 图 5)。这一结果说明HpDGTT2具有虾青素酰基转移酶的功能。
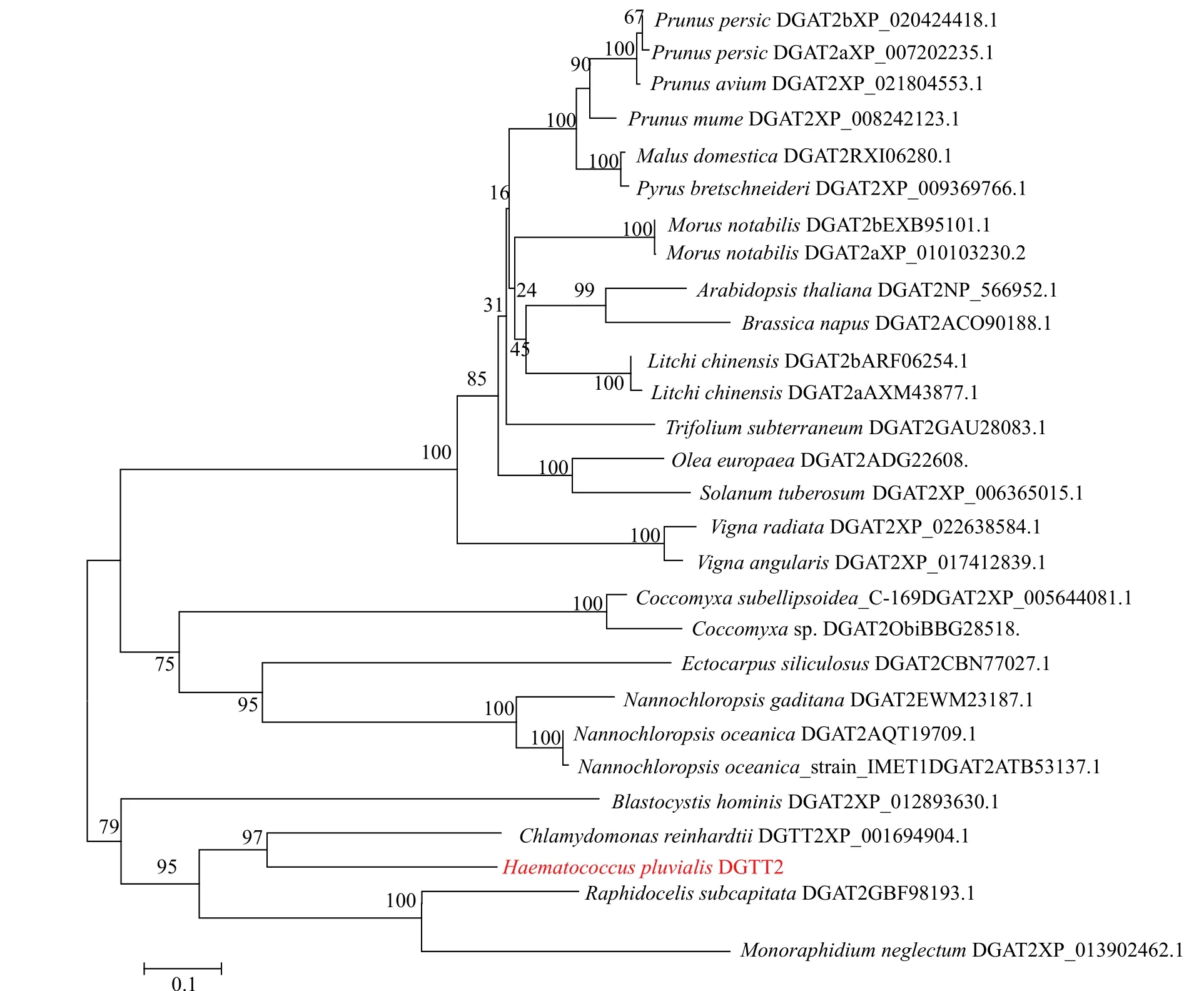
图2 邻接法构建HpDGTT2氨基酸系统发育进化树(Bootstrap=1000)Fig. 2 Phylogenetic tree constructed from the HpDGTT2 amino acid with the neighbor-joining method (Bootstrap=1000)
3 讨论
基于HpDGAT可能催化虾青素的酯化过程的科学假设, 本研究克隆了雨生红球藻II型DGAT编码基因HpDGTT2。生物信息学分析表明HpDGTT2属于溶血磷脂酰基转移酶(Lysophospholipid Acyltransferases, LPLAT)超家族, 系统发育进化分析显示HpDGTT2与CrDGTT2亲缘关系较近。氨基酸序列以及活性位点的高度相似性说明二者可能具有相似的功能。然而通过酵母的回补实验却发现HpDGTT2不具有典型的DGAT功能, 即以甘油二酯和酰基辅酶A为底物合成甘油三酯, 这与CrDGTT2形成了明显的对比。这一发现说明在进化的过程中, HpDGTT2基因可能发生了分化并获得了新的功能。
进一步通过体外酶活实验初步证实HpDGTT2可能具有虾青素酰基转移酶的功能, 即以虾青素和酰基辅酶A为底物催化虾青素酯的形成。尽管过去的研究成功建立了以β-carotene为前体合成虾青素的体外酶活测定体系[27,28],但是虾青素酰基化的酶活测定尚未见报道, 这也是鉴定虾青素酰基转移酶编码基因所面临的最大困难。已有的研究表明,虾青素的酰基化发生在内质网上[29—30], 因此本研究首先采用了分离的内质网作为正对照建立虾青素酰基化的酶活测定方法。在虾青素酰基化的体外酶学实验最初的探索阶段, 本研究参照过去虾青素生物合成的酶活的测定方法, 将外源虾青素和卵磷脂制成脂质体, 以增加底物的水溶性, 使其充分地参与到虾青素酰基化的反应体系当中。结果表明,实验组中虾青素酯的含量在反应时间内呈现持续的上升趋势, 说明内质网中的虾青素酰基转移酶催化了虾青素酯的合成(结果未显示)。然而, 这样的实验结果重复性差, 成功率低, 说明与β-carotene不同的是被脂质体包被的虾青素分子可能与内质网膜上的酰基转移酶接触并发生反应的几率并不高。因此, 本研究进一步尝试改进了促使虾青素分子进入反应体系中的方式, 即在正己烷的作用下用机械研磨的方式将虾青素分子与内质网膜融合, 以增加虾青素分子与内质网上的酰基转移酶接触并发生反应的几率。酶学分析发现以机械研磨的方式可以使雨生红球藻内质网酰基转移酶有效地参与到虾青素酰基化的反应体系中, 即采用内质网作为正对照的实验能稳定、可重复地检测出虾青素酰基转移酶活性。随后在此反应体系中加入表达有HpDGTT2的酵母的微粒体, 发现其使某些特定的保留时间下虾青素酯发生显著净增。通过成功建立虾青素酰基化的体外酶活分析体系, HpDGTT2被初步鉴定为虾青素酰基转移酶。
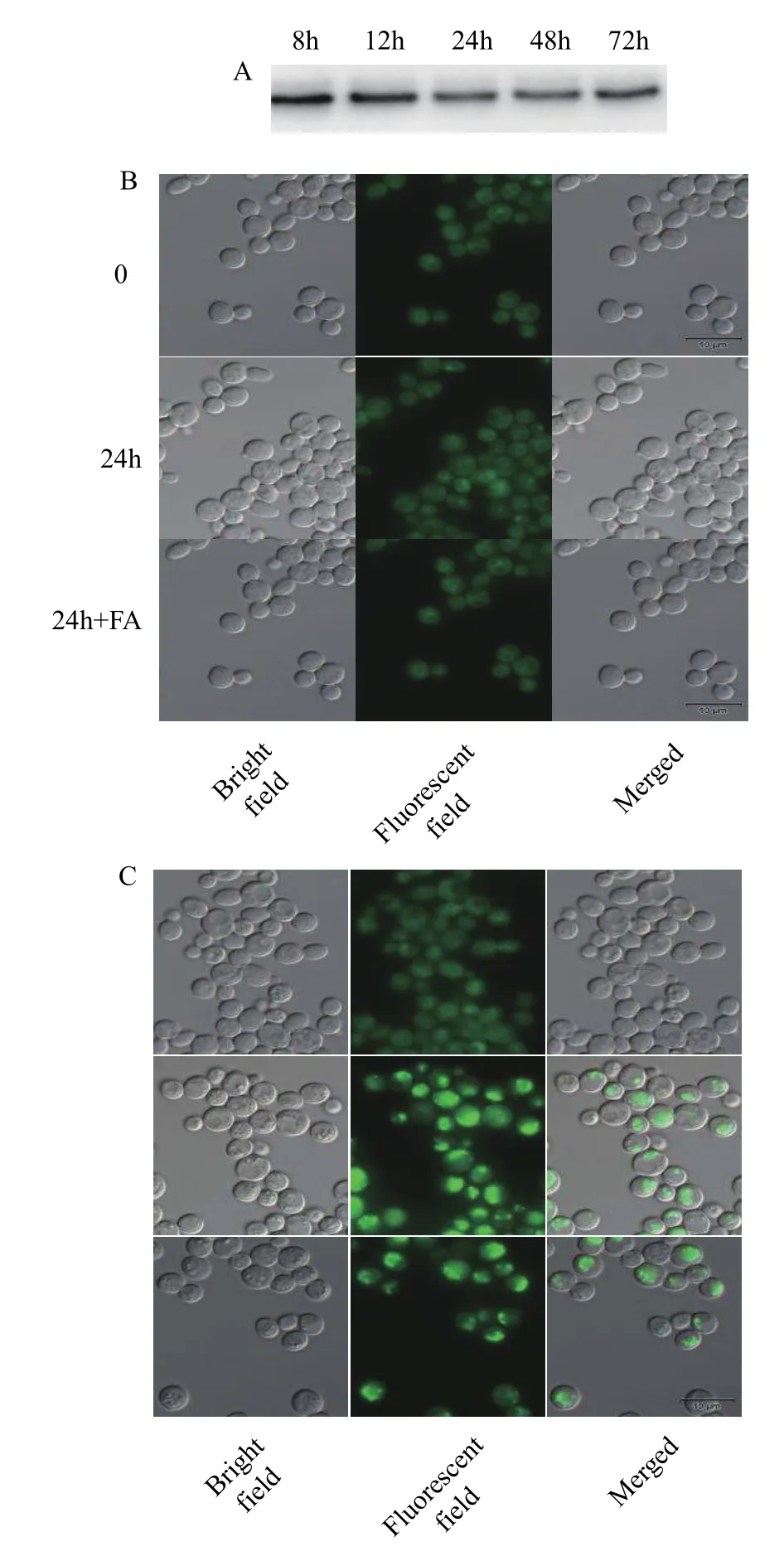
图3 HpDGTT2和CrDGTT2在S. cerevisiae H1246中的表达及功能回补分析Fig. 3 Expression of HpDGTT2 and CrDGTT2 in S. cerevisiae H1246 and functional complementation analysis
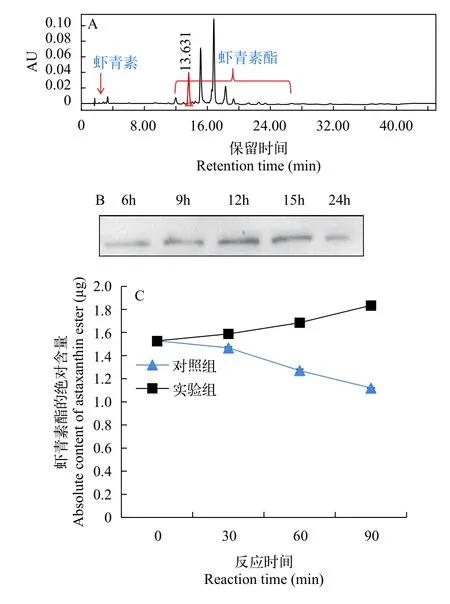
图4 虾青素酰基化体外酶活分析体系建立Fig. 4 Establishment of astaxanthin acylation in an in vitro enzymatic assay system
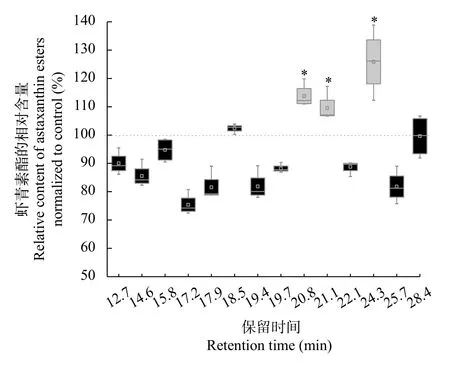
图5 添加含有HpDGTT2的酵母微粒体导致反应体系保留时间分别为20.8min、21.1min 和24.3min的虾青素酯含量的净增加(*, P<0.05)Fig. 5 Addition of the yeast microsomes harboring HpDGTT2 led to a net increase in the content of astaxanthin esters with retention times of 20.8min, 21.1min and 24.3min (*, P<0.05)
在大多数生物体内, DGAT2主要负责甘油三酯TAG的生物合成[31]。大多数已知的真核藻类含有多个DGAT2拷贝, 例如在伪矮海链藻(T. pseudonana), 三角褐指藻(Phaeodactylum triconutum),微拟球藻(Nanochloropsis oceanica)中分别有4和6和11个DGAT2编码基因[32,33], 而这些数目众多的DGAT基因在行使甘油三酯合成的功能之外是否还具有其他的功能是有待回答的科学问题。在过去一系列针对包括海洋微拟球藻、莱茵衣藻的研究中就发现部分DGAT基因在体外酶活的测试中并未显示出典型的催化甘油三酯合成的活性, 在体内诱导产油条件下, 部分DGAT基因在转录水平上也没有任何响应[34], 这表明这些DGAT基因可能在进化过程中获得了新的未知功能, 而具体的机制还有待进一步的研究。
目前对于类胡萝卜素(包括虾青素分子)酯的形成的相关研究非常有限。但是对比长链的碳氢化合物的酰基化过程的研究不难发现DGAT可能在这一类化合物酰基化的过程中扮演非常重要的作用。例如, 在哺乳动物中, 视黄醇(类胡萝卜素的降解产物)可以被酰基化为视黄醇酯[35], 而且这一过程是被DGAT1催化的, 其具有视黄醇酰基转移酶(Acyl-CoA: Retinol acyltransferase, ARAT)的活性[36]。鼠科的DGAT1也具有多种酰基转移酶活性, 包括甘油单酯酰基转移酶(Acyl-CoA: Monoacylglycerol acyltransferase, MGAT)活性合成甘油二酯DAG; 蜡酰基转移酶活性合成蜡酯。类似地, 在哺乳动物,植物和微生物中的DGAT2能够利用广泛的酰基受体[37], 例如破囊壶菌(Thraustochytrium aureum)的DGAT2能够利用脂肪醇和酰基辅酶A生成蜡酯类物质[38]。而对拟南芥的两个叶绿醇酰基转移酶(Phytyl ester synthase, PES)的酶学分析发现它们都具有典型的Ⅰ型和Ⅱ型的DGAT功能, 即利用酰基辅酶A为酰基供体, 甘油二酯DAG或者其他含有羟基的分子如甘油单酯(Monoacylglycerol, MAG)和醇类为酰基受体, 形成含有酯键的脂类分子[39]。这些信息也进一步反映了雨生红球藻中虾青素的酰基化反应极有可能是由DGAT催化的。
本研究克隆了雨生红球藻DGTT2编码区全长,其氨基酸序列和活性位点虽然与莱茵衣藻DGTT2高度相似, 但是在以酵母为表达宿主的异源体内实验并未检测到其TAG合成活性, 其不具有DGAT功能。而在以雨生红球藻分离的内质网作为粗酶成功建立虾青素酰基化的体外分析体系时,HpDGTT2却展示出了虾青素酰基转移酶的活性。这些结果表明HpDGTT2可能参与到虾青素酯的生物合成中, 但是其生物合成代谢调控有待进一步研究。值得一提地是HpDGTT2酵母微粒体作用的虾青素酯的保留时间相对靠后, 主要是一些虾青素双酯。这说明HpDGTT2可能主要以虾青素单酯为前体合成双酯。因此在未来的研究当中, 制备虾青素单酯用作体外反应研究HpDGTT2功能值得尝试。

