Cyclin D1、MMR、FIB与结肠癌预后的相关性分析
关高娃 马晓 司海王婧婷 张新红 路泽军 曹邦伟
结直肠癌(colorectal cancer,CRC)是常见的消化系统恶性肿瘤,发病率在世界范围内居第3位,在我国CRC发病率呈持续上升趋势[1]。近年来,尽管结肠癌的总体疗效有所改善,但死亡率仍较高[2]。缺乏早期诊断和有效的预后预测手段是患者死亡的重要原因。因此,鉴定新的诊断和预后标志物对改善患者生存至关重要。细胞周期蛋白D1(Cyclin D1)是一种细胞周期调节蛋白,与细胞周期蛋白激酶CDK4/6结合促使细胞周期由G1期向S期的过渡,促进细胞增殖[3]。目前研究显示Cyclin D1在肿瘤中的作用不明确[4-6]。在结肠癌中同样发现此现象,有研究报道Cyclin D1高表达是预后不良的因素[7],但亦有研究认为是预后保护因素[8],还有研究认为与预后无关[9]。错配修复(mis-match repair,MMR)是一种基因错配修复体系,错配修复基因完整(pMMR)可确保DNA复制过程的准确性,而当错配修复基因缺失(dMMR)时不能修复错配的碱基,致使DNA遗传不稳定而引发肿瘤[10]。其中10%~20%的CRC由MMR缺失造成,且在Ⅱ期CRC中dMMR为预后良好指标[11],然而也有研究认为无预后意义[12-13]。纤维蛋白原(fibrinogen,FIB)是肝细胞分泌的一种糖蛋白,可与细胞生长因子结合而促进肿瘤血管生成,导致肿瘤生长和转移[14-15]。但是目前三者与结肠癌预后的关系并不明确,本研究结合三项指标在肿瘤中的作用,检测其在210例结肠癌患者术后组织标本中的表达,并分析三者表达的相关性及其与预后的关系,以期为结肠癌的早期诊断及预后预测提供新的指标。
1 资料与方法
1.1 一般资料
选取2014年5月—2019年5月中国人民解放军第六医学中心行结肠癌根治术患者的病理组织蜡块标本。纳入标准:⑴经组织病理学诊断为结肠癌;⑵首次手术,且术前未行放化疗;⑶随访资料完整。排除标准:⑴年龄≤18岁或者>85岁患者;⑵合并其他原发恶性肿瘤;⑶合并严重心肺疾病。最终纳入210例,中位年龄为65岁(范围:29~84岁),≤65岁患者102例;男性122例;原发部位:左半结肠癌109例,右半结肠癌101例;腺癌133例,混合型(含黏液或印戒成分)77例;高中分化151例,低分化59例;淋巴结转移112例;根据2010 AJCC/UICC CRC pTNM分期,Ⅰ期6例,Ⅱ期89例,Ⅲ期91例,Ⅳ期24例。本研究经中国人民解放军第六医学中心伦理委员会通过。
1.2 免疫组化检测结肠癌组织中Cyclin D1的表达及MMR的缺失情况
所有标本经10%中性福尔马林固定,石蜡包埋,4 μm厚连续切片。免疫组化采用MaxVision-TM3法,石蜡切片脱蜡、水化并冲洗,用pH 9.0的EDTA修复液进行水煮加热抗原修复。一抗为兔抗人Cyclin D1、二抗为MaxVisionTM3/HRP试剂,4种MMR蛋白一抗依次为 MLH1、MSH2、MSH6、PMS2 抗体试剂,二抗为OptiView DAB kit试剂。DAB显色,复染并封固。Cyclin D1定位于细胞核为阳性。染色强度评分:无着色计0分、淡黄色计1分、棕黄色计2分、深褐色计3分。阳性细胞百分比评分:着色细胞数≤5%计0分、6%~25%计1分、26%~50%计2分、51%~75%计3分、≥76%计4分。两者得分相乘,0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)。将得分≤4分定义为Cyclin D1低表达,≥5 分为高表达。通过检测 MLH1、MSH2、MSH6、PMS2等4种蛋白判定MMR缺失情况,4者均定位于细胞核为阳性,阴性则定义为蛋白缺失,其中任何一个蛋白缺失即为dMMR,均无缺失为pMMR。
1.3 凝固法检测FIB的浓度
以血凝专用硅化真空管采集患者术前静脉血3 mL(枸橼酸钠与待测血液以1∶9比例混匀抗凝),离心10 min,2 h内以全自动凝血仪进行检验。FIB参考值为1.8~4.0 ng/mL,在此范围内数值定义为正常组,FIB>4 ng/mL定义为异常组,本研究中无FIB<1.8 ng/mL数据。
1.4 随访
采用门诊、住院及电话等方式随访。术后2年每隔3个月随访1次,之后每隔6个月随访1次。复查肠镜、胸腹部增强CT、消化道肿瘤标志物及便潜血等。中位随访34个月(范围:7~60个月),随访截止时间为2019年12月,随访率为100%。随访终点是患者死亡,随访期间死亡59例。总生存期(overall survival,OS)定义为术后至患者因任何原因死亡的时间。
1.5 统计学方法
采用SPSS 22.0软件进行数据分析。分类数据组间比较采用χ2检验,若差异有统计学意义,则进一步行phi检验分析两者相关方向及程度;采用Kaplan-Meier法计算累积生存率,采用Log-rank检验比较组间生存曲线的差异;采用Cox回归分析影响OS的因素。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 结肠癌组织中Cyclin D1、MMR的表达及FIB检测结果
免疫组化法检测结果显示,210例结肠癌患者术后石蜡标本Cyclin D1、MMR表达阳性均定位于细胞核。Cyclin D1低表达126例(60.0%),高表达84例(40.0%),见图1;dMMR 27例(12.9%),pMMR 183例(87.1%),见图2。静脉血检测FIB结果显示,正常组患者125例(59.5%),异常组患者85例(40.5%)。
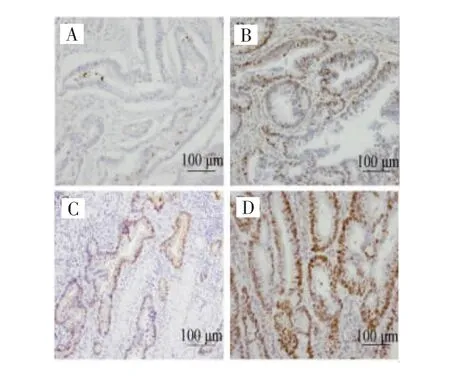
图1 Cyclin D1在结肠癌组织中的表达(×200)Fig.1 Expression of Cyclin D1 in colon cancer tissues(×200)
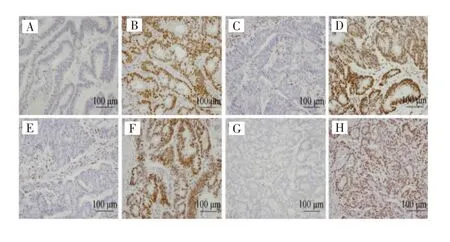
图2 MMR在结肠癌组织中的表达(×200)Fig.2 Expression of MMR in colon cancer tissues(×200)
2.2 Cyclin D1、MMR、FIB与结肠癌患者临床病理参数关系
CyclinD1与病理类型、pTNM分期有关(均P<0.05),MMR与原发灶部位、分化程度、有无淋巴结转移、pTNM分期有关(均P<0.05),FIB与分化程度、有无淋巴结转移、pTNM分期相关(均P<0.05),见表1。
2.3 结肠癌组织中Cyclin D1、MMR、FIB的相关性
Cyclin D1与 FIB 表达相关(χ2=8.235,P=0.004),phi检验示Cyclin D1与FIB呈正相关,相关强度一般(r=0.198,P=0.004);未发现 Cyclin D1和 FIB 与MMR有关(χ2=0.857,P=0.355;χ2=0.757,P=0.384)。
2.4 Cyclin D1、MMR、FIB与结肠癌患者预后的关系
Kaplan-Meier法结果显示,Cyclin D1低表达组患者1年、3年、5年生存率分别为92.1%、84.9%、80.2%,Cyclin D1高表达组分别为82.1%、67.9%、59.5%,两组生存曲线比较差异有统计学意义(Log-rankχ2=9.878,P=0.002),见图 3A;dMMR 组患者 1 年、3 年、5年生存率分别为96.3%、92.6%、92.6%,pMMR组分别为86.9%、76.0%、68.9%,两组生存曲线比较差异有统计学意义(Log-rank χ2=5.138,P=0.023),见图 3B;FIB正常组患者1年、3年、5年生存率分别为92.0%、85.6%、81.6%,FIB异常组分别为 82.4%、67.1%、57.6%,两组生存曲线比较差异有统计学意义(Logrank χ2=9.490,P=0.002),见图 3C。
单因素Cox回归分析结果示,分化程度、有无淋巴结转移、pTNM 分期、Cyclin D1、MMR、FIB 与结肠癌患者OS有关(均P<0.05),其中低分化、有淋巴结转移、Ⅲ+Ⅳ期、Cyclin D1高表达、pMMR及FIB异常的患者OS较差。考虑年龄及原发位置对结肠癌预后有影响,故将两者一并纳入多因素Cox回归进行分析,结果显示右半结肠癌、pTNM分期Ⅲ+Ⅳ期、Cyclin D1高表达及FIB异常的患者死亡风险均较高(P<0.05)。见表 2。
3 讨论
结肠癌易发生局部复发及远处转移,导致治疗难,死亡率高。近年研究发现Cyclin D1与肿瘤形成及转移密切相关。FUSTÉ等[16]报道Cyclin D1高表达可通过激活桩蛋白(Paxillin)磷酸化和7号染色体基因RAC1而增强细胞侵袭和迁移能力。Cyclin D1也可促使细胞周期从G1期进入S期,其高表达时大量细胞进入S期从而缩短细胞周期进程、加速增殖[17]。OGINO等[8]检测Cyclin D1在结直肠癌中的表达发现1/3以上的患者过表达。本研究检测结果发现结肠癌患者中亦表达Cyclin D1,其中高表达率为40.0%,且Cyclin D1高表达的患者病理多为混合型、且分期较晚。考虑可能与混合型含有黏液及印戒成分,而此类肿瘤浸润程度更深,脉管癌栓及淋巴结转移率更高有关。进一步行生存分析也发现Cyclin D1高表达为不良预后独立因素,高表达患者生存率明显下降,同样与既往研究结果一致[7,18]。然而,也有研究认为 Cyclin D1 高表达的患者预后较好[8],可能是由于Cyclin D1不同亚型(Cyclin D1a/b)的致癌能力不同从而导致研究结果不同,其中已有研究证实Cyclin D1b亚型的致癌能力高于Cyclin D1a[19],而既往研究以及本研究均未区分亚型,这可能是导致研究不同的原因。
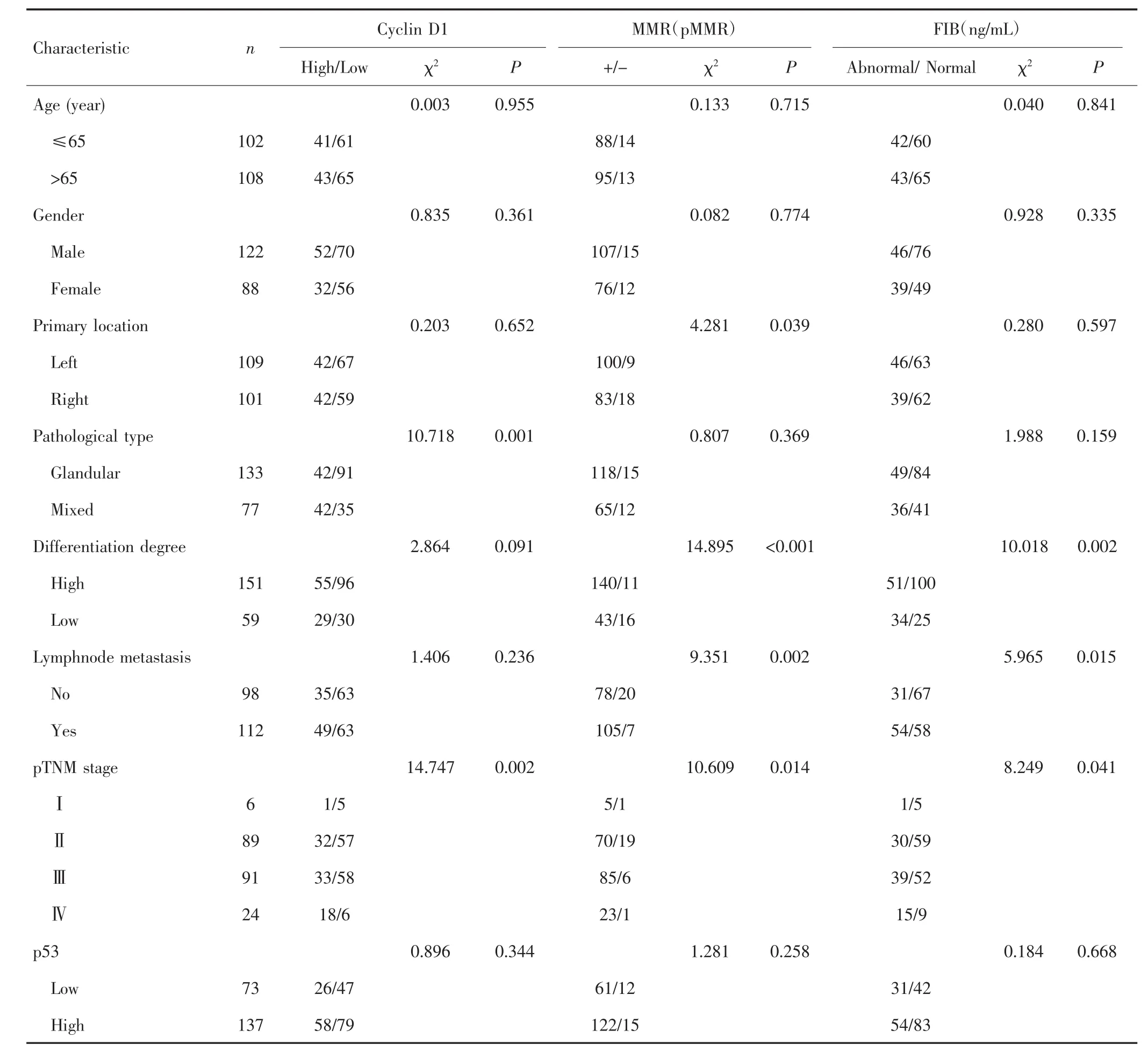
表1 Cyclin D1、MMR、FIB与结肠癌患者临床病理参数关系Tab.1 Relationship between Cyclin D1,MMR,FIB and clinicopathological parameters of colon cancer patients
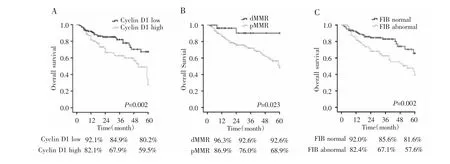
图3 Cyclin D1、MMR、FIB与结肠癌患者生存曲线图Fig.3 Survival curves of colon cancer patients with Cyclin D1,MMR and FIB
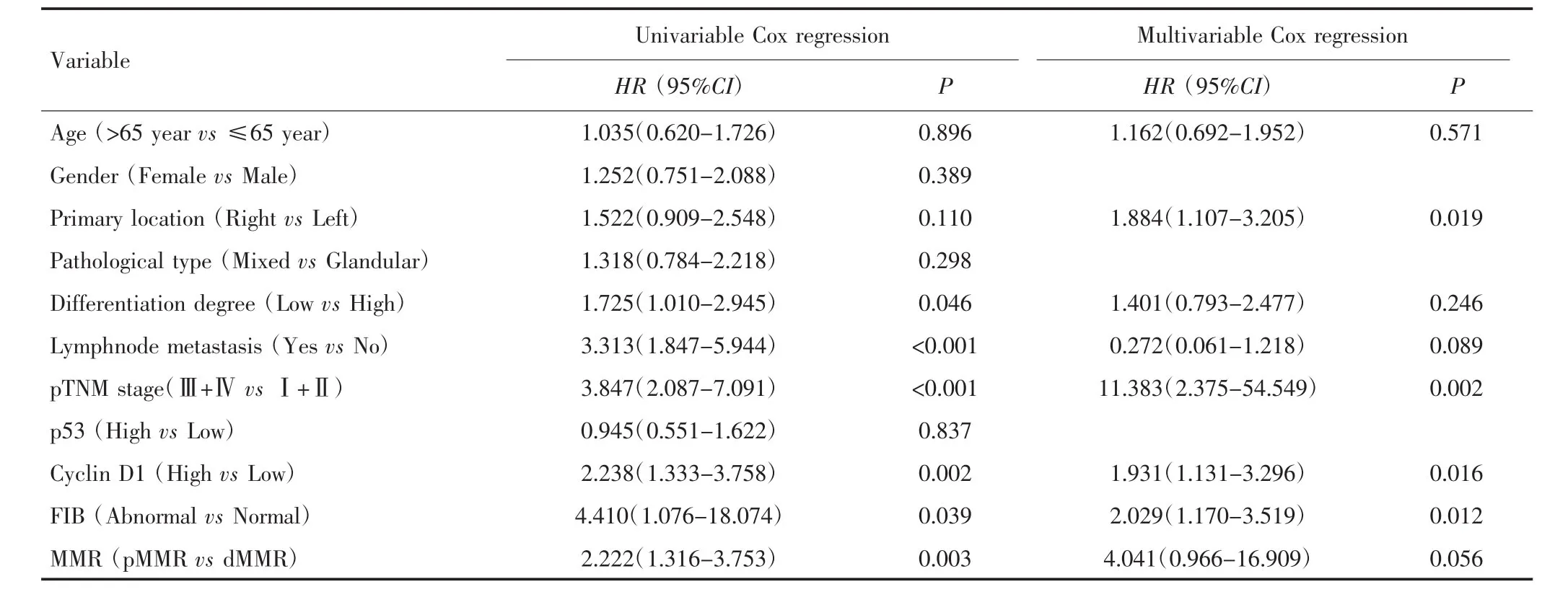
表2 影响结肠癌预后的单因素和多因素分析Tab.2 Univariable and multivariable analysis of the prognosis of colon cancer
高凝状态与恶性肿瘤密切相关,含FIB的血管内皮生长因子可促进血管生成,从而为肿瘤生长提供条件,FIB还能提供肿瘤细胞迁移的基质并通过与黏附分子和整联蛋白的相互作用促进细胞迁移[20],同时可以保护癌细胞逃避天然杀伤细胞的清除[21]。本研究检测结肠癌患者外周血FIB的浓度,异常比例为40.5%,且FIB异常患者与低分化、淋巴结有转移、分期较晚有关,1年、3年、5年生存率较FIB正常患者明显下降,单因素和多因素分析也显示FIB异常为预后不良的独立因素,与以往研究结果一致[21-22]。此外,FIB具有采样方便、价格低廉、可动态监测等优点,因此可能是判断结肠癌预后的理想标志。但同时也应考虑FIB易受炎症、血栓性疾病等多种因素影响,今后尚需开展研究进一步排除干扰因素的影响,证实其价值。
MMR可保证DNA复制精度及正确修复,其缺失导致基因复制过程中错误的累积而致癌。有研究报道10%~20%的CRC由MMR缺失造成[11]。本研究中结肠癌患者的dMMR发生率为12.9%,且dMMR的患者原发病灶多位于右半,表现为低分化、淋巴结无转移、分期较早,以往研究亦发现上述特点[11-12]。右半结肠癌主要源于中肠、多为CMS1型,基因突变率较高,可能为dMMR多发生在右半结肠的原因。在生存方面,目前的研究大多在Ⅱ期结肠癌中发现dMMR为预后良好的因素[23],在其他分期中的意义并不明确[11-13]。本研究在整体分期中也发现dMMR的患者生存率较pMMR患者高,但因样本量有限未行不同分期亚组分析,且在单因素和多因素分析结果发现dMMR不是结肠癌的独立预后因素。
本研究还分析三者表达的相关性,结果发现Cyclin D1表达与FIB相关,但与MMR表达并不相关。如前所述FIB可与生长因子结合促进肿瘤血管生成[20],而Cyclin D1受到生长因子信号后激活可引起一系列反应从而驱动细胞周期进程[19],结果可能共同促进了肿瘤增殖,上述Cyclin D1高表达及术前FIB异常患者预后较差也一定程度证实了这一推测。而关于Cyclin D1与MMR表达的相关性,理论上,MMR具有修复错配碱基、确保DNA复制精度的功能,而Cyclin D1高表达时可阻止细胞周期停滞,使受损DNA继续复制[19],因此两者可能存在一定相关性,但本研究并未发现两者的相关性,可能与dMMR病例较少有关。
综上所述,本研究发现Cyclin D1高表达、pMMR及术前FIB异常的结肠癌患者OS下降,Cyclin D1、FIB是影响预后的独立因素,可能是评估结肠癌患者预后的潜在指标,但因本研究为回顾性分析且样本量有限,后续可扩大样本并设计前瞻性研究进一步分析验证。

