动物胆汁及胆汁酸的合成、测定及药理作用的研究进展
王鑫 陈晓 时海波 杨恒 张新笑 徐为民 邹烨 王道营 苗颖


摘要:动物胆汁作为药物使用已有几千年的历史,伴随科学技术的进步,动物胆汁中活性成分胆汁酸的研究也逐步深入,本文介绍了不同动物胆汁的主要胆汁酸成分,尤其是鹅去氧胆酸和熊去氧胆酸及其药理作用。就胆汁酸的分离提纯方法、理化性质及测定方法展开讨论,并对鹅去氧胆酸和熊去氧胆酸的药理作用展开综述。
关键词:胆汁酸;鹅去氧胆酸;熊去氧胆酸;制备与提纯;药理作用
中图分类号: R284;R285文献标志码: A
文章编号:1002-1302(2020)18-0036-08
收稿日期:2019-09-06
基金项目:国家现代农业(肉鸡)产业技术体系建设专项(编号:CARS-41);国家自然科学基金(编号:31901612);江苏省农业科技自主创新资金[编号:CX(18)1006];江苏省自然科学基金(编号:BK20180300)。
作者简介:王 鑫(1994—),男,江苏南通人,硕士研究生,研究方向为动物源副产物综合利用及高值化開发。E-mail:937411786@qq.com。
通信作者:邹 烨,博士,副研究员,研究方向为动物源副产物综合利用及高值化开发。E-mail:zouye@jaas.ac.cn。
胆汁味苦黏稠,pH值约为7.4,具有明目、消肿、清热解毒等功效[1]。动物胆汁作为药物使用已有数千年,《中华本草》和《本草纲目》中都记录了几十种动物胆汁,包含畜类动物猪、牛、羊,禽类动物鸡,及其他动物如熊、蛇、兔等的胆汁。不同动物的胆汁化学成分不同,其主要成分是50%~70%的胆汁酸,除胆汁酸外还含有一些胆色素、脂类、黏蛋白、无机物、氨基酸、常量元素及微量元素。胆汁的主要生理功能来自于胆汁酸,为了更好地利用动物胆汁的药用价值,国内外研究者对其化学成分及药理作用做了大量的研究[2]。近年来胆汁酸被充分应用于医疗食品等行业,消费者对胆汁酸制品的需求也越来越大。因此,动物胆汁酸的分离提纯方法及药理作用的研究就显得格外重要,如何高效廉价地得到动物胆汁酸也是相关科研人员一直研究的问题。
1 动物胆汁研究
胆汁在传统中医药的应用有很长的历史,其主要应用于预防疾病。研究人员为了充分利用现有的动物胆汁资源,对不同动物胆汁中的胆汁酸和胆红素等物质进行化学分析,相关科研人员对于胆汁的药理活性研究也在逐步加深。
目前对于禽类动物胆汁研究最为广泛的是鸡胆汁。鸡胆汁呈墨绿色,有一定的黏性,能够溶于水。临床上鸡胆汁具有泻肺火利肺气、清热解毒明目、溶解胆结石、促进消化吸收的功能,也可用于治疗疟疾、百日咳。鸡胆汁的主要成分为胆汁酸(胆酸、去氧胆酸、鹅去氧胆酸等),另外鸡胆汁中还含有钾、钠、钙、镁等金属元素,以及一些氨基酸[3]。
畜类动物胆汁中对猪胆、羊胆、牛胆研究较多。猪胆是猪科动物的胆汁,猪胆汁性苦味寒,具有止咳平喘、清肝胆热、通便解毒的功能,通常用于导肠通便,清肝明目[4]。以猪胆汁作为原料经过干燥等加工过程而生产的猪胆粉的主要成分是猪去氧胆酸。羊胆汁是绵羊或者山羊的胆汁,具有清肝明目、清热解毒、润肺抗菌的作用。现代化学分析表明,羊胆汁中含有胆酸盐、水分、色素、无机盐、蛋白质等[5]。现代医学通常将羊胆汁临床应用于抗炎、抑菌、治疗肺结核,也用于治疗喉头红肿、肝热目赤、黄疸等疾病。牛胆汁是常见牛科动物水牛或者黄牛的胆汁。它具有解毒消肿、利胆通肠、清肝明目的作用,临床应用于治疗消化不良及便秘,促进脂肪消化,镇静或麻醉中枢神经系统、呼吸系统和循环系统。经过研究发现,水分、色素、无机盐、胆固醇、脂肪和胆酸盐是牛胆汁的主要成分[6]。
文献表明,科研人员对熊、蛇、兔等其他动物的胆汁也有相关的研究。熊胆汁是除了畜类、禽类胆汁外被科研人员研究最多的胆汁,是熊科动物黑熊或棕熊的胆汁。熊胆作为药源最早记录于唐朝的《新修本草》中,是我国四大珍稀动物药材之首。经过研究发现,熊胆汁中主要有效成分是熊去氧胆酸,此外熊胆汁中还含有胆酸、鹅去氧胆酸、胆固醇、胆红素和许多无机盐离子[7]。蛇胆汁的主要成分是胆汁酸、胆色素、胆固醇、氨基酸、无机盐和磷等。根据研究发现,蛇胆的多种药理效应和生理功能来源于胆汁酸,牛磺胆酸是大多数蛇胆的主要成分[8]。近年来,我国兔子养殖行业发展迅速,产生了大量的兔胆汁。这些兔胆资源通常作为废料被丢弃从而造成巨大的浪费,同时对环境造成了一定的污染,为了实现资源的有效利用,降低对环境的污染,许多研究人员将注意力转向兔胆汁的利用与开发。经研究表明,兔胆汁的主要成分为胆酸、去氧胆酸、鹅去氧胆酸、胆色素等[9]。
2 胆汁酸研究
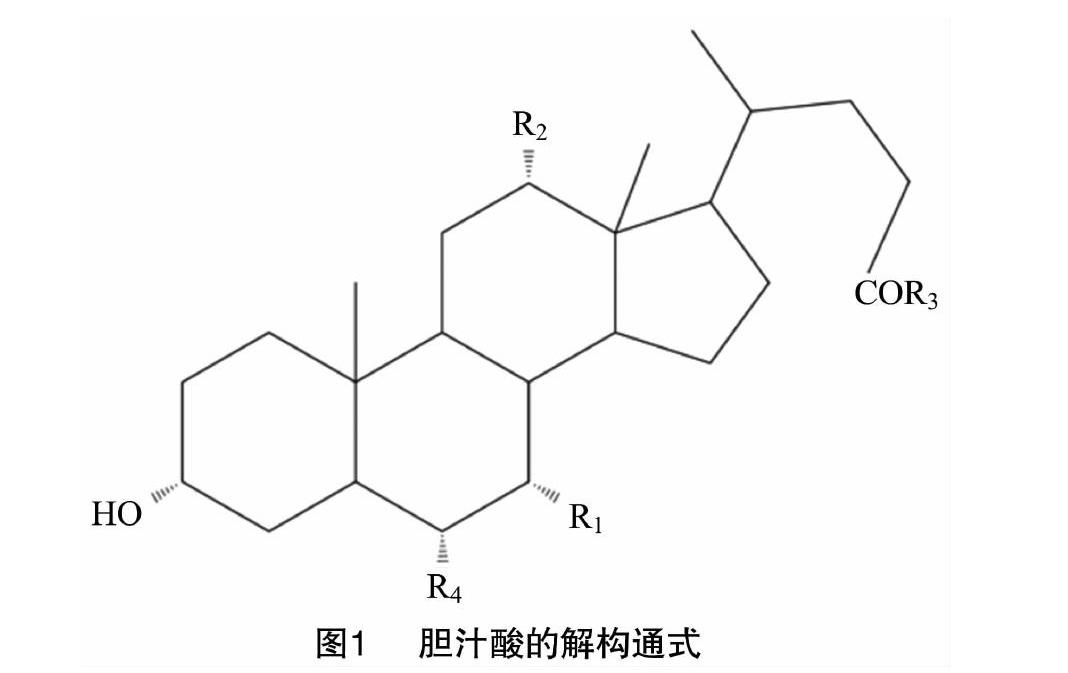
胆汁酸的结构是以胆烷酸为母核,根据胆烷酸取代基位置和数目的不同构成了不同结构的胆汁酸[10]。胆汁酸对动物的代谢有很大作用[11],在动物体内通常以钠盐或者钾盐的形式存在,按其结构可以分为两大类:游离型胆汁酸和结合型胆汁酸[12]。结合型胆汁酸的形成是由于氨基化合物与胆酸结合在一起,主要是甘氨酸(Gly)和牛磺酸(Tau)与游离型胆汁酸结合而形成的。而根据来源的不同胆汁酸又可以分为初级胆汁酸、次级胆汁酸和三级胆汁酸。初级胆汁酸(primary bile acid)由胆固醇直接合成,包含胆酸、鹅去氧胆酸以及相应的结合型胆汁酸;次级胆汁酸(secondary bile acids)是初级胆汁酸经过肠道菌酶的催化,脱去羟基转化而成,次级胆汁酸包括去氧胆酸和石胆酸;三级胆汁酸(tertiary bile acid)是次级胆汁酸经过肝脏和肠道的重吸收作用后所得的产物,熊去氧胆酸就是典型的三级胆汁酸。胆汁酸的结构通式见图1、表1。胆汁酸有很多种,其中较为重要的是胆酸、鹅去氧胆酸、熊去氧胆酸等。在动物胆汁中,鹅去氧胆酸通常不以游离态存在,而是与牛磺酸和甘氨酸形成结合物而存在。当人或动物的肝发生病变时,体内以结合态存在的鹅去氧胆酸会转化为游离态[13]。大多数动物胆汁内都不含有熊去氧胆酸,但其良好的生物活性及药理作用吸引了众多研究者的关注。下面着重介绍一下鹅去氧胆酸和熊去氧胆酸的研究进展。
2.1 鹅去氧胆酸
2.1.1 鹅去氧胆酸的理化性质
鹅去氧胆酸,化学名为3α,7α-二羟基-5-β-胆烷酸,分子式 C24H40O4,其结构见图2。鹅去氧胆酸的分子量为 392.56,味苦,无臭,呈白色针状结晶,属于酸性化合物。鹅去氧胆酸几乎不溶于水、石油醚和苯等,微溶于三氯甲烷,易溶于甲醇、乙醇、冰乙酸,熔点为 167~171 ℃,比旋光度为10°~13°,是大多数动物胆汁的主要胆汁酸。鹅去氧胆酸是一种甾体化合物,包含一个刚性的甾环和一个5碳的脂肪侧链,共24个碳原子,顺式稠合甾核的A环和B环而形成一个凹腔,位于3位和7位上的一个α羟基都指向凹面,与侧链上的羟基组合形成α面,从而表现出亲水性;而3个疏水的甲基则指向另一面,形成了憎水的β面,由此产生了水/脂双亲特性[14]。
2.1.2 鹅去氧胆酸的制备与提纯
目前市场上的鹅去氧胆酸来源有以下2种,一是从动物胆汁中提取,二是化学合成。可用于直接提取鵝去氧胆酸的动物胆汁有猪胆汁、鸡胆汁和鸭胆汁,但绝大部分从动物胆汁中提取的鹅去氧胆酸都是以鸡胆汁为原料[15]。提取方法主要是树脂法、超临界萃取法、有机溶剂提取法和沉淀法。化学合成法通常以胆酸、去氧胆酸和猪去氧胆酸为原料。
树脂法是一种利用大孔树脂来提取鹅去氧胆酸的方法。Wan等通过使用大孔树脂吸附层析法分离纯化出鹅去氧胆酸,首先将鸭胆汁用氢氧化钠皂化,再加入氯化钙使胆汁中的鹅去氧胆酸形成鹅去氧胆酸的钙盐,使用碳酸钠沉淀钙离子,得到了游离的鹅去氧胆酸[15]。通过大孔树脂HZ-802纯化,用50%和60%的乙醇梯度洗脱,最终得到了纯度为99%、熔点为160~170 ℃的鹅去氧胆酸。该方法因为具有经济环保等优点已经用于工业化生产。席晓志等使用价格便宜、能重复利用且对鹅去氧胆酸有强吸附力的大孔树脂D101优化了鹅去氧胆酸的提取和纯化工艺,使用活性炭将鹅去氧胆酸粗提物回流脱色2 h,45%乙醇溶解上样,用55%和75%的乙醇洗脱得到鹅去氧胆酸[16]。
超临界萃取是一种新技术,因它具有选择性好、清洁、高效等优点而被使用到鹅去氧胆酸的提取分离。该方法不但有效地保存了原料中的活性成分,且绿色环保无污染[17]。由于超临界萃取法提取鹅去氧胆酸全程不适用有机溶剂,因此得到的鹅去氧胆酸不会产生有机溶剂的残留,防止了提取过程中对人体有害物质的滞留和对环境的污染。Scalia等以牛胆汁为原料,利用超临界CO2萃取技术,增加了去氧胆酸的溶解性,去除了脂肪酸胆固醇等杂质,实现了胆汁酸的提取和分离[18]。
有机溶剂提取法获得鹅去氧胆酸的原理是使用活性炭脱色,再用有机溶剂加热提取,再经过滤得到鹅去氧胆酸。我国研究人员曾利用乙醇作为有机溶剂,后有研究者开始使用三氯甲烷。冯娜使用鸭胆膏为原料,使用乙酸乙酯作为提取溶剂,温度为78 ℃,浓缩固液比为3.5,时间为1 h,获得了提取率为80.2%的鹅去氧胆酸[19]。此方法工艺简单,制取时间短,但试验过程中会使用大量有机溶剂,成本较高且会造成一定的环境污染。若使用有机溶剂循环应用技术则能在一定程度上降低生产成本以满足工业化生产的需要。
沉淀法提取鹅去氧胆酸的原理是利用其与金属阳离子相结合会形成沉淀,通常是钙盐或钡盐。但钡盐含有毒性对人体有害,不利于工业化生产,因此使用氯化钙代替氯化钡。曹荣安等用氯化钙提取法从猪胆汁中提取了鹅去氧胆酸,为动物胆汁的提取纯化及加工生产开辟了一条切实可行的新途径[20]。Hu等用鸭胆膏来代替传统方法的鸡胆汁为原料,研究了钙盐法提取鹅去氧胆酸的新工艺,采用正交试验确定了每100 g鸭胆膏配以甲醇 1 000 mL,20%氯化钙500 mL,过氧化氢520 mL,60%冰乙酸600 mL的最佳提取条件,所得鹅去氧胆酸的收率为30%[21]。该工艺简单,适合工业化生产,能提高畜禽副产品的利用率。
化学合成鹅去氧胆酸通常是利用还原12位羰基或C11烯烃加氢的方法制备鹅去氧胆酸。以胆酸甲酯为原料,通过Fieser法氧化为羰基化合物,再与对甲苯磺酰肼反应后用NaBH4还原水解后得到鹅去氧胆酸。张飞等利用猪去氧胆酸为原料,经甲酯化、消去、Oppenauer氧化、6,7位脱氢、环氧化、催化氢化、3位选择性还原等反应得到鹅去氧胆酸,总产率26%,有较高的应用价值[22]。
树脂法、超临界萃取、有机溶剂萃取、沉淀法等直接从动物胆汁中提取鹅去氧胆酸的方法使得鹅去氧胆酸制备方法更加多样。有机溶剂提取法和沉淀法在生产过程中可能会产生毒性物质而对于环境产生污染,也会造成生产成本的提高,如需工业化生产,须要进一步研究。而超临界萃取和树脂法具有经济、高效、环保的优点,更适用于工业化生产。化学合成法的发明解决了动物的胆汁来源有限、难以满足医疗需求的问题,应用价值较高。
2.2 熊去氧胆酸
2.2.1 熊去氧胆酸的理化性质
熊去氧胆酸,化学名3α,7β-二羟基-5β-胆甾烷-24-酸,分子式C24H40O4,分子量392.57,是鹅去氧胆酸的同分异构体,其结构见图3。熊去氧胆酸呈白色粉末,味苦、无臭,不溶于水、三氯甲烷,易溶于冰乙酸、乙醇、氢氧化钠等。熔点为200~201 ℃,比旋光度为59~62°。熊去氧胆酸的主要特征在3位α羟基、5位β氢和7位β羟基,其中7位β羟基是区分熊去氧胆酸与鹅去氧胆酸的唯一特征。
2.2.2 熊去氧胆酸的制备与提纯
熊去氧胆酸的制备方法有3种:从熊胆汁中提取、化学合成和生物转化法[23]。最初,我国制备熊去氧胆酸的途径是从黑熊的胆汁中分离出熊去氧胆酸,主要是人工养殖的黑熊,利用活熊胆汁引流法,现已使用无管引流。但是此方法步骤繁杂,制备周期长且来源有限,无法满足工业生产的需要,而且熊是国家二级保护动物,不利于野生珍稀动物物种的延续。所以现研究人员已把目光转向化学合成和生物转化法。
化学合成法是现在工业生产鹅去氧胆酸的主要方式,通常以胆酸、猪胆酸、猪去氧胆酸、鹅去氧胆酸和一些非胆酸类甾体化合物为原料。Ferrari等将胆酸甲酯化乙酰化3位和7位羟基后得到3α,7α- 二乙酰-12α-羟基胆酸甲酯、氧化12位羟基还原酮基,水解3,7,24位酯基得到鹅去氧胆酸,再氧化7位羟基还原7位酮基得到了熊去氧胆酸[24]。He等以廉价易得的胆酸为原料合成熊去氧胆酸,同时研究了甲磺酸酯类化合物的关键消元反应条件,确定了最佳溶剂、碱和反应温度。猪去氧胆酸具有价格便宜、来源广泛等优点,具备很大的研发前景[25]。王钟麟等使用猪胆汁中的猪胆酸为原料,经过甲酯化反应、3,6,7位羟基三乙酰化反应、选择性水解、Jones氧化、碳酸氢钠水解得到 6α- 羟基-3,7-二酮基-5β胆酸烷甲酯,再经甲磺酰氯反应、碘化钠-锌粉还原、锂-液氨得到了熊去氧胆酸[26]。猪去氧胆酸与熊去氧胆酸的差异仅在6,7位羟基,且猪去氧胆酸廉价易得,因此窦倩等以猪去氧胆酸为原料,经过酯化反应、选择性氧化、环氧化和脱保护等过程,以夏皮罗(Shapiro)反应为关键步骤合成了熊去氧膽酸,产率为258%[27]。然后又对该方法进行优化,使用硅基保护、Rubuttom氧化、Clemmensen还原缩短了反应过程,最终产率288%。鹅去氧胆酸也是化学法合成熊去氧胆酸的重要原料,卢茂芳等利用鹅去氧胆酸,经过氧化和还原反应得到了熊去氧胆酸,并对其工艺进行改进,在氧化过程以N-溴琥珀酰亚胺(NBS)为氧化剂使用次氯酸钠代替Jounes试剂后减少了毒性,简化了后处理且提高了熊去氧胆酸的收率[28]。除了胆酸类物质,一些非胆酸类甾体化合物也能够合成熊去氧胆酸,韩兴春等以黄酮体为原料,经过乙酰化反应、NBS加溴并消除得到6,7位脱氢物,再以单过氧邻苯二甲酸氧化双键环、钯碳催化加氢、硼氢化钠还原、Wittig反应、二氧化铂催化加氢7步反应合成鹅去氧胆酸区,再经氧化和还原反应合成了熊去氧胆酸[29]。
近年来,利用生物转化法合成熊去氧胆酸的报道越来越多。酶法和微生物发酵等方法均可用于熊去氧胆酸的制备。随着固定化细胞技术的发展,研究人员开始将生物法制备熊去氧胆酸的研究方向从单酶系统转向多酶系统。伴随着带有辅酶的多酶系统细胞包埋技术的突破,使固定化细胞合成熊去氧胆酸的设想成为可能。来自梭状芽孢杆菌的7α羟基类固醇脱氢酶(7α-HSDHs)、7β羟基固醇脱氢酶(7β-HSDHs)、12α羟基类固醇脱氢酶(12α-HSDH)等脱氢酶能够参与到鹅去氧胆酸的酶法合成中,有报道首次利用Clostridium absonum固定化细胞得到了熊去氧胆酸,胆酸转化率不高[30-31]。到目前为止,微生物或酶法合成熊去氧胆酸的工艺还不成熟,生产成本高,还未能实现工业化生产。
这3种制备方法,从熊胆汁中提取熊去氧胆酸来源稀少,难以满足市场的需求且有违对动物的保护,逐渐被淘汰。化学合成法主要以动物胆酸为原料,但这些方法中存在着反应试剂昂贵、操作不便、分离困难、步骤多及收率较低等问题,今后应该着重研究使用廉价易得的动物胆酸为原料,步骤简单、收率高的合成路线。生物转化法的发展,使得许多研究人员把它和化学合成法相结合,目前有把酶法、微生物发酵法与化学合成法结合的趋势。
3 胆汁酸物性的测定方法
胆汁酸常用的测定方法有紫外可见分光光度法(UV-vis)、红外光谱法(IR)、薄层色谱法(TLC)、核磁共振氢谱(1HNMR)、高效液相色谱(HPLC)、质谱法(MS)等[32]。
3.1 紫外分光光度法
用UV-vis测定胆汁酸,该方法仪器使用简单、成本较低、操作简便,但样品处理时间较长。刘永贵等使用UV-vis法在605 nm处测定蛇胆中胆酸的含量,并且以此作为判断蛇胆品质的优劣指标,此方法简便有效[33]。赵启苗等用UV-vis法,以胆南星中的鹅去氧胆酸为指标,检测波长379 nm,建立了胆南星总胆酸含量的测定方法。此方法操作简便、重复性好、准确度高,适用于评价胆南星的质量[34]。
3.2 红外光谱法
红外光谱法是一种快速无损检测技术,但是定量分析有较大误差。李文龙等利用近红外漫反射光谱分析了熊胆粉的提取物,比较不同光谱的预处理对建模结果的影响,确定了模型所用的最佳潜变量个数[35]。用此方法建立了鹅去氧胆酸和熊去氧胆酸含量的定量校正模型,通过此模型可以对熊胆粉提取物进行快速准确的定性定量分析。Li等利用近红外光谱建立了一种熊胆粉水解过程的监测方法,在水解过程中使用近红外光谱仪对样品进行采集和测定,建立了TUDCA、TCDCA、UDCA、CDCA的定量校准模型,可快速测定新批次的样品[36]。此方法大大减少了样品分析的工作量,能快速分析出结果,有利于对熊胆粉水解过程的理解与控制。
3.3 薄层色谱法
TLC能检测胆汁酸的含量及鉴别杂质,佟爱东等使用TLC法建立熊去氧胆酸相关物质检查方法[37]。此方法能较好地分离鹅去氧胆酸和熊去氧胆酸,熊去氧胆酸可能含有的各种相关物质的斑点清晰可见,适用于熊去氧胆酸的质量控制。陈蓉等将甲醇作为提取溶剂,用硅胶高效薄层板(G)、显色剂10%硫酸乙醇溶液、展开剂异辛烷-乙酸乙酯-冰醋酸(体积比15 ∶7 ∶6),于460 nm处进行薄层定量扫描,建立了同时测定珠黄散中胆酸、去氧胆酸、猪去氧胆酸、鹅去氧胆酸含量的方法。此方法重复性好、专属性强、测定结果精确[38]。范艳美等运用TLC法对从猪胆粉中提取的猪去氧胆酸进行薄层分析,确定了提取物中含有猪去氧胆酸,此方法准确有效,重复性好[39]。
3.4 核磁共振氢谱
1HNMR可以识别出参与分子间相互作用的特定质子,此方法具有无损性,不会破坏样品的性质和结构,试验方法多样,适合研究样品中的复杂成分。Matsuok等利用核磁共振氢谱从分子间相互作用的角度对牛磺脱氧胆酸钠(NaTDC)、牛磺熊脱氧胆酸钠(NaTUDC)、牛磺鹅胆酸钠(NaTCDC)、牛磺胆酸钠(NaTC)4种胆汁酸盐形成的胶束进行了比较和测定,研究表明NaTC和其他3种胆汁酸盐不同,其胶束在溶液中仍然是小的初级结构[40]。刘双等用核磁共振氢谱图测定了由猪去氧胆酸合成的异熊去氧胆酸结构,确定了所合成化合物的结构与异熊去氧胆酸结构一致[41]。
3.5 质谱与高效液相色谱
MS被广泛应用于复杂组分的分离与鉴定,有很高的灵敏度,是生物样品研究的有效工具。HPLC具有强大的分离能力,因分离效率高时间短、柱效高、检测灵敏度短、流动相可控等优点而被广泛应用于物质含量的测定。Mostafa等用高效液相色谱法同时测定熊去氧胆酸和鹅去氧胆酸混合物及片剂中熊去氧胆酸的含量[42]。Wang等用高效液相色谱法对7种胆汁酸样品和胆汁酸进行化学成分分析及体外细胞毒性的测定,证明了牛胆汁可能是肝癌治疗中熊胆的潜在替代品[43]。高旭等采用HPLC-MS/MS法同时测定了牛黄提取物及不同来源所得牛黄提取物中的胆酸、甘氨胆酸、甘氨石胆酸、石胆酸、牛磺脱氧胆酸钠5种胆酸的含量,比较了不同提取方法对这5种胆汁酸含量的影响[44]。
除上述方法外,还有光学显微镜、扫描电镜、熔点测定等用于测定胆汁酸。
4 药理作用及临床应用
4.1 鹅去氧胆酸的药理作用及临床应用
鹅去氧胆酸在各种不同动物的胆汁中广泛存在,是鸡、鸭、鹅等家禽胆汁的主要成分。鹅去氧胆酸能抑制3-羟基-3-甲基戊二酸单酰辅酶A(HMG-COA)还原酶的活性,扩大胆汁酸池以便于胆固醇通过微胶粒状态溶解,减少胆固醇的合成,抑制胆固醇的排泄和降低小肠中胆固醇的重吸收作用而达到溶解胆固醇型结石的功效[45]。魏松以100位胆结石患者为研究对象,对观察组病患的常规治疗药物搭配鹅去氧胆酸治疗,观察对照组及观察组B超结果的变化及临床反应,结果发现搭配鹅去氧胆酸治疗的观察组的总治疗率为92.0%,显著高于仅用常规药物治疗的对照组[46]。
鹅去氧胆酸能够减少全身血液和组织中的NO含量,抑制炎症的加剧。NO会导致毛细血管的扩张,使渗透性增加,从而导致炎症。鹅去氧胆酸可增加小鼠皮肤毛细血管通透性、对小鼠耳壳炎症和甲醛性足肿胀等表现出了很好的抗炎作用,鹅去氧胆酸能够抑制绝大多数急慢性炎症。
鹅去氧胆酸也能够增加器官组织中环磷酸腺苷(cAMP)的含量,松弛气管平滑肌,扩张支气管,从而达到镇咳、平喘、祛痰的作用。赵红霞按 0.15 g/kg 和0.225 g/kg的剂量对小鼠进行灌胃,利用竞争性蛋白质结合分析法进行检测,灌胃给药鹅去氧胆酸后的小鼠器官组织中的cAMP含量显著提高,产生了极显著的镇咳、平喘、祛痰的作用[47]。
鹅去氧胆酸对革兰氏阳性菌有明显的抑菌作用,但对格兰氏阴性菌抑菌效果不明显。钱桂敏等构建了胆道内源胆汁酸缺乏的大鼠模型,给模型大鼠灌服鹅去氧胆酸,发现鹅去氧胆酸能显著降低肠道内芽孢杆菌属、丹毒菌属及红椿菌属的含量[48]。Shi等研究了鹅去氧胆酸对大肠杆菌的杀灭效果,培养3个月的处理组相比对照组有很好的抑制效果,表明鹅去氧胆酸能够很好地抑制大肠杆菌活性[49]。经研究,鹅去氧胆酸还可以显著增加热应激小鼠肝脏的抗氧化能力,缓解热应激小鼠的肝脏氧化损伤[50]。
目前鹅去氧胆酸的应用主要集中在溶解胆固醇型结石上,对其分子水平的研究及其他药效的应用较少[51]。目前为止,关于鹅去氧胆酸作用机理的研究还不多,须要相关科研人员进一步研究。
4.2 熊去氧胆酸的药理作用及临床应用
熊去氧胆酸能增加胆汁酸的分泌,促进肝肠循环[52],改变胆汁的成分,降低胆汁中胆固醇酯及胆固醇的含量,使结石中的胆固醇逐渐溶解,因此医学上用熊去氧胆酸来溶解胆结石中的胆固醇,预防肝硬化。刘彤等以2014—2017年的243例胆囊结石病患为样本,按数字随机表分为对照组和观察组,对观察组的病人除给予常规治疗外口服熊去氧胆酸胶囊。结果表明,观察组92.62%的总有效率明显高于对照组的81.82%[53]。因此,熊去氧胆酸能有效缓解胆固醇型结石的症状,缩小结石的直径。
熊去氧胆酸还能激活蛋白激酶C和钙离子形成的信号网络以及有分裂活性的蛋白激酶,以此来增强胆汁淤积于肝细胞时的分泌能力,降低血液和肝细胞中内源性疏水胆酸的浓度,防止胆汁在肝胆淤积。张莹等利用熊去氧胆酸对重度妊娠期肝内胆汁淤积患者进行治疗,显著改善了患者肝功能及胆汁淤积所致的临床症状[54]。
体外研究表明,熊去氧胆酸能够显著减弱乙醇对肝细胞的毒性,且能够改善非乙醇性肝病的患者的血清指标[55]。熊去氧胆酸是一种无毒的亲水性胆汁酸,能通过竞争性抑制的方式减少回肠内毒性内源性胆酸的吸收。熊去氧胆酸还能通过竞争方式取代细胞器和细胞膜上的毒性胆酸分子,防止胆管和肝细胞受到毒性胆酸的损害。
熊去氧胆酸因其药理作用被广泛应用于原发性胆汁肝硬化(PBC)、胆囊纤维化肝病(CF)、妊娠期肝内胆汁淤积症(ICP)、原发性硬化性胆囊炎(PSC)及非乙醇性脂肪肝(NAFLD)等疾病,有极高的临床使用价值。
5 结束语
胆汁酸因其良好的生理活性越来越受到人们的关注,鹅去氧胆酸和熊去氧胆酸因其溶解胆结石、保护肝脏、止咳平喘、消炎抗菌等功效被广泛应用于医疗食品等工业。然而还有一些问题尚未解决,目前的研究主要集中在胆汁酸制备提純技术的优化上,胆汁酸的微生物合成方法技术还不成熟,如需工业化生产需降低成本,如何以廉价易得的原料制得胆汁酸需要相关研究人员进一步研究。紫外分光光度法、薄层色谱法、红外光谱法、核磁共振氢谱、高效液相色谱和质谱等均可用于胆汁酸物性的测定,应根据样品的实际情况选择合适的测定方法。伴随着新技术的不断突破,相信会有更多的新技术应用于胆汁酸的定性定量测量,为胆汁酸的研究提供技术支撑。
参考文献:
[1]姜姣姣,杨 鹏,时新刚,等. 动物胆汁的成分及药理作用研究进展[J]. 食品与药品,2017,19(3):227-230.
[2]Hofmann A F,Hagey L R. Key discoveries in bile acid chemistry and biology and their clinical applications:history of the last eight decades[J]. Journal of Lipid Research,2014,55(8):1553-1595.
[3]张 青. 鸡胆汁的药理作用及应用[J]. 食品与药品,2005,7(2):18-19.
[4]石 岩,魏 锋,马双成. 猪胆药用研究进展及质量控制概况[J]. 中国中药杂志,2018,43(4):637-644.
[5]辛永涛,李卫民,高 英. 预处理方法对羊胆汁中胆酸含量的影响[J]. 中国实验方剂学杂志,2013,19(20):30-32.
[6]白万富,鞠爱华,杨 乾. 牛胆汁的化学成分及临床应用的研究进展[J]. 中华中医药杂志,2008,23(2):149-151.
[7]袁 斌,任颖龙,马 莉,等. 胆汁酸类成分替代中药熊胆的药性分析[J]. 中国中药杂志,2014,39(4):738-743.
[8]Zheng T J,Cheng X L,Wan L C,et al. Differentiation of various snake bile derived from different genus by high-performance thin-layer chromatography coupled with quadrupole time-of-flight mass spectrometry[J]. Journal of AOAC International,2019,102(3):708-713.
[9]谭文敏,任东波,何忠梅. 兔胆化学成分和药理作用的研究进展[J]. 黑龙江畜牧兽医,2016(1):39-40,45.
[10]Alrefai W A,Gill R K. Bile acid transporters:structure,function,regulation and pathophysiological implications[J]. Pharmaceutical Research,2007,24(10):1803-1823.
[11]Trauner M,Claudel T,Fickert P,et al. Bile acids as regulators of hepatic lipid and glucose metabolism[J]. Digestive Diseases,2010,28(1):220-224.
[12]李炎桂,王海军,贾 赟,等. 动物胆类中药化学成分研究概述[J]. 动物医学进展,2019,40(7):115-119.
[13]de Aguiar V T Q. Tarling E J,Edwards P A. Pleiotropic roles of bile acids in metabolism[J]. Cell Metabolism,2013,17(5):657-669.
[14]Posa M,Kuhajda K. Hydrophobicity and haemolytic potential of oxo derivatives of cholic,deoxycholic and chenodeoxycholic acids[J]. Steroids,2010,75(6):424-431.
[15]Wan J F,He J M,Cao X J. A novel process for preparing pure chenodeoxycholic acid from poultry bile[J]. Journal of Industrial and Engineering Chemistry,2012,18(1):65-71.
[16]席晓志,郭莎莎,曹 慧,等. 鹅去氧胆酸的大孔树脂纯化工艺优化及其降血脂活性[J]. 现代食品科技,2018,34(8):123-129.
[17]马雪梅,刘敦华. 超临界流体萃取技术在食品工业中的应用[J]. 现代食品,2018(17):161-163.
[18]Scalia S,Williams J R,Shim J H,et al. Supercritical fluid extraction of bile acids from bovine bile raw materials[J]. Chromatographia,1998,48(11/12):785-789.
[19]冯 娜. 鸭胆膏中鹅去氧胆酸提取及熊去氧胆酸合成[D]. 天津:天津科技大学,2018:43.
[20]曹荣安,李良玉,张丽萍. 猪胆汁中鹅去氧胆酸提取工艺的研究[J]. 食品研究与开发,2011,32(4):12-15.
[21]Hu X Z,Na F,Zhang J Q. Study on the factors influencing the extraction of chenodeoxycholic acid from duck bile paste by calcium salt method[J]. Journal of Applied Chemistry,2018(4):1-6.
[22]張 飞,赵静国,赵蒙浩. 鹅去氧胆酸与熊去氧胆酸的合成工艺研究[J]. 化学与生物工程,2014,31(1):47-50.
[23]Tonin F,Arends I W. Latest development in the synthesis of ursodeoxycholic acid (UDCA):a critical review[J]. Beilstein Journal of Organic Chemistry,2018,14(1):470-483.
[24]Ferrari M,Zinetti F. Process for preparing high purity ursodeoxycholic acid:US9206220[P]. 2015-12-08.
[25]He X L,Wang L T,Gu X Z,et al. A facile synthesis of ursodeoxycholic acid and obeticholic acid from cholic acid[J]. Steroids,2018,140:173-178.
[26]王钟麟,姜立中,周维善. 猪去氧胆酸化学-Ⅳ从猪去氧胆酸立体选择性合成熊去氧胆酸和鹅去氧胆酸的新法[J]. 中国科学,1991,21(7):660-665.
[27]窦 倩,闫 鹏,刘志玲,等. 熊去氧胆酸的合成[J]. 化学通报,2018,81(8):720-726.
[28]卢茂芳,尹伟成,王福东,等. 熊去氧胆酸的合成工艺改进[J]. 中国医药工业杂志,2015,46(10):1058-1059.
[29]韩兴春,卓 超,吴达俊. Wittig反应在天然产物合成中的应用[J]. 合成化学,2001,9(3):199-207.
[30]Eggert T,Bakonyi D,Hummel W. Enzymatic routes for the synthesis of ursodeoxycholic acid[J]. Journal of Biotechnology,2014,191:11-21.
[31]Xuan Z,Fan D D,Hua X F,et al. Large-scale production of ursodeoxycholic acid from chenodeoxycholic acid by engineering 7α- and 7β-hydroxysteroid dehydrogenase[J]. Bioprocess and Biosystems Engineering,2019,42(9):1537-1545.
[32]Sharma K R. Review:bile acid analysis[J]. PharmaInter Science Publishers,2012,3(2):28-34.
[33]刘永贵,袁 琪. 蛇胆的成分分析及临床应用[J]. 湖北中医杂志,2017,39(3):54-55.
[34]赵启苗,单国顺,陈江宁,等. 胆南星质量评价方法初探[J]. 中国实验方剂学杂志,2017,23(6):28-31.
[35]李文龙,刘绍勇,薛东升,等. 近红外漫反射光谱法快速测定熊胆粉提取物中熊去氧胆酸和鹅去氧胆酸的含量[J]. 中国药学杂志,2010,45(19):1500-1503.
[36]Li W L,Cheng Z W,Qu H B. Monitoring of the hydrolysis process of bear bile powder using near infrared spectroscopy and chemometrics[J]. Measurement,2016,88:18-26.
[37]佟爱东,劳瑞珍,李思源. 薄层色谱法检查熊去氧胆酸的有关物质[J]. 药物分析杂志,2012,32(9):1654-1657.
[38]陈 蓉,陈 伟,顾炳仁. TLCS同时测定珠黄散中4种胆汁酸含量[J]. 中国执业药师,2016,13(7):7-11.
[39]范艳美,贾梦杰,刘培培,等. 猪胆粉中猪去氧胆酸的提取、鉴定和含量测定[J]. 广州化工,2017,45(15):148-150.
[40]Matsuoka K,Atsushi Y. Study on micelle formation of bile salt using nuclear magnetic resonance spectroscopy[J]. Journal of Oleo Science,2017,66(10):1129-1137.
[41]刘 双,汪钢强,刘张坤,等. 由猪去氧胆酸合成异熊去氧胆酸的新方法[J]. 有机化学,2013,33(10):2216-2219.
[42]Mostafa A K,Mansour F R. Simultaneous determination of ursodeoxycholic acid and chenodeoxycholic acid in pharmaceutical dosage form by HPLC-UV detection[J]. Journal of AOAC International,2017,100(1):59-64.
[43]Wang N,Feng Y B,Tang N X,et al. Chemical and biological analysis of active free and conjugated bile acids in animal bile using HPLC-ELSD and MTT methods[J]. Experimental and Therapeutic Medicine,2011,2(1):125-130.
[44]高 旭,張 静. HPLC-MS/MS法测定不同产地牛黄中胆汁酸成分[J]. 食品工业,2019,40(3):181-184.
[45]Jones R D,Lopez A M,Ernest Y T,et al. Impact of physiological levels of chenodeoxycholic acid supplementation on intestinal and hepatic bile acid and cholesterol metabolism in Cyp7a1-deficient mice[J]. Steroids,2015,93:87-95.
[46]魏 松. 鹅去氧胆酸治疗胆石症的疗效分析[J]. 中国民族民间医药,2013,22(12):121.
[47]赵红霞. 鹅去氧胆酸的提纯及其免疫、镇咳、化痰、平喘作用研究[D]. 呼和浩特:内蒙古农业大学,2002:23.
[48]钱桂敏,齐莉莉,范哲于. 鹅去氧胆酸对大鼠肠道菌群结构及肠道功能的影响[J]. 核农学报,2018,32(11):2267-2273.
[49]Shi H J,Ying L,Bo W,et al. Protoscolicidal effects of chenodeoxycholic acid on protoscoleces of Echinococcus granulosus[J]. Experimental Parasitology,2016,167:76-82.
[50]王守开,孙克诚,张 乐,等. 鹅去氧胆酸调控Nrf2通路缓解热应激小鼠肝脏损伤的研究[J]. 黑龙江畜牧兽医,2019(4):117-120.
[51]Fiorucci S,Distrutti E. Chenodeoxycholic acid:an update on its therapeutic applications[J]. Handb Exp Pharmacol,2019,256:265-282.
[52]Zhang Y J,Jiang R Q,Zheng X J,et al. Ursodeoxycholic acid accelerates bile acid enterohepatic circulation[J]. British Journal of Pharmacology,2019,176(16):2848-2863.
[53]刘 彤,李 楠,李 栋,等. 消石利胆胶囊联合熊去氧胆酸治疗胆囊结石临床研究[J]. 中國药业,2019,28(8):30-32.
[54]张 莹,王 红. 熊去氧胆酸与地塞米松联合应用对重度妊娠期肝内胆汁淤积症患者的临床治疗效果、血清SIRT1/NF-κB p65信号通路及炎症因子的影响[J]. 中国妇幼保健,2019,34(14):3216-3220.
[55]何 涛,石晓东. 熊去氧胆酸治疗非酒精性脂肪肝的临床价值分析[J]. 中国继续医学教育,2018,33(10):130-132.

