根瘤菌和AM真菌对紫花苜蓿结瘤和产质量的影响*
刘 忆,袁 玲
根瘤菌和AM真菌对紫花苜蓿结瘤和产质量的影响*
刘 忆,袁 玲†
(西南大学资源环境学院,重庆 400716)
了解酸性土壤条件下紫花苜蓿()接种中华根瘤菌(,SM)和丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)的作用,有益于扩大西南地区牧草种植,促进牧业发展。选择当地典型、有代表性的酸性黄壤,设置不接种(CK)、接种SM(SM)、接种AMF(AMF)、混合接种(SM+AMF)四个处理,通过微区试验研究SM与AMF对紫花苜蓿生长、品质、根系结瘤和植株养分吸收等的影响。结果表明:在SM+AMF处理中,菌根真菌感染率和结瘤数分别较单接种提高,但根瘤单重显著减少,固氮效率和吸磷能力增加,其牧草产量、粗蛋白、粗脂肪、灰分、氮、磷、钾、钙、镁积累量均显著高于其他处理,表现出SM与AMF的协同效应。与CK相比,SM或AMF处理均促进苜蓿生长,提高牧草产量,改善品质,但SM和AMF处理之间无显著差异。在SM处理中,地上部氮含量和氮、磷、钾积累量高于CK,植株氮积累量高于AMF。在AMF处理中,其根系活力显著高于SM处理,有益于养分吸收,可解释植株磷、钾、钙、镁含量和积累量高于SM的原因。因此,SM和AMF均能不同程度地促进氮、磷、钾吸收,提高牧草产量品质。在西南酸性土壤上种植紫花苜蓿时,接种根瘤菌和菌根真菌尤其进行混合接种有益于提高牧草的产量和品质。
紫花苜蓿;根瘤菌;丛枝菌根真菌;养分
紫花苜蓿()是一种国内外广泛种植的多年生豆科牧草,产量高,草质佳,适口性好,适宜种植在中-微碱性钙质土壤[1]。在我国西南地区,光热资源丰富,适宜发展草食家畜,但当地土壤偏酸,磷钾有效性低,存在酸铝危害,不利于紫花苜蓿高产优质,影响牧草供应。
根瘤菌(Rhizobia)与豆科植物形成根瘤后,不仅通过共生固氮提供氮素营养,还能分泌植物生长激素,促进植物生长[2]。丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)适宜酸碱土壤,能与大多数高等植物形成菌根[3]。AMF与植物根系形成丛枝菌根后,外延菌丝伸入土壤,扩大养分吸收空间;菌丝可作为物理屏障,抵抗病害侵入;AMF还能通过一系列生理生化反应,增强植株适应酸碱和重金属污染土壤的能力;分泌氢离子和有机酸,活化土壤矿物中的磷、钾、钙、镁,提高生物有效性;诱导合成超氧化物歧化酶、过氧化物酶和过氧化氢酶等抗氧化保护酶,提高寄主植物抗逆性[4-6]。因此,在种植豆科牧草时,接种根瘤菌和AMF可能产生协同效应,改善植物营养尤其是磷素供应,更加有效地促进植物生长发育,提高产量,改善品质。但也有研究发现,尽管根瘤菌具有固氮作用,AMF能促进寄主植物吸收利用土壤中的难溶性磷,但根瘤菌和AMF均要消耗寄主植物的光合产物,影响根系生理生化过程,故同时接种根瘤菌和AMF可能消耗更多的光合产物,对改善植物营养带来的益处不足以弥补光合产物的消耗[7-8]。此外,根瘤菌对NH3高度敏感;在肥沃的土壤中,AMF利用难溶性养分的能力降低[9]。在贫瘠土壤中,根瘤菌和AMF能显著改善植物营养,促进植物生长发育和提高产量;但在现代农业中,AMF无促生和增产作用[10]。即不同的土壤环境(尤其是土壤肥力、pH等)可能影响根瘤菌、AMF对寄主植物的作用,且二者之间相互作用也存在不确定性。故增加研究实例有利于揭示根瘤菌和AMF在不同土壤环境中的作用。此外,我国南方的酸性土壤氮素缺乏,且有效磷低,增加豆科牧草作物结瘤固氮和吸磷能力,对减轻酸铝危害,提高牧草的产量品质有重要作用。本研究以重庆市典型、具有代表性的酸性黄壤为供试土壤,研究接种根瘤菌和AMF对紫花苜蓿结瘤、生长和品质的影响,为西南地区提高紫花苜蓿产量、品质提供科学依据。
1 材料与方法
1.1 供试材料
供试土壤为重庆市缙云山酸性黄壤,母质为三叠纪须家河组长石石英砂岩,质地中壤,pH5.42,有机质、全氮、全磷、全钾含量分别为15.21、1.65、1.27和13.35 g·kg–1,速效氮、有效磷、速效钾含量依次为52.71、8.27和87.24 mg·kg–1。
苜蓿品种为适合我国南方种植的赛迪紫花苜蓿(Sadie),由重庆市畜牧科学研究院提供。选取饱满度一致的苜蓿种子,1% H2O2消毒3 min,无菌水洗净,25℃发芽至露白。
根瘤菌为中华苜蓿根瘤菌(CQ,SM),从重庆市缙云山酸性黄壤(pH5.51)中自主分离获得,经回接和16S rDNA测序证实,并能在pH5.0以上土壤中感染紫花苜蓿形成根瘤。配制YMA固体培养基(20 g琼脂、10 g甘露醇、5 g酵母粉、0.5 g K2HPO4、0.2 g MgSO4×7H2O、0.1 g NaCl、1000 mL H2O,pH6.8~ 7.0),将保藏菌株接至YMA斜面,25±1℃暗培养3~4 d,再转接于盛有YMA液体培养基的三角瓶中,暗培养96~120 h(25℃,150 r·min–1),制备出菌含量约1.7´109cell·mL–1的根瘤菌液。
AMF:根内球囊霉(Smith & Schenck,BEG Number 193,简称BEG-193),购置于北京市农林科学院。用三叶草¾玉米扩繁成含根段、孢子和菌丝的土壤作为AMF菌剂,孢子含量31 cfu·g–1土。
1.2 试验设计
采用微区试验种植紫花苜蓿,共设置4个处理:(1)对照(不接种,CK),(2)接种根瘤菌(SM),(3)接种丛枝菌根真菌(AMF),(4)同时接种SM和AMF(SM+AMF)。供试土壤晾干、去除杂物后4.5 Mrad60Co-g射线灭菌,置于2.0 m´1.0 m´0.4 m的水泥池内,每池装灭菌土壤约1 000 kg。按窝距´行距=10 cm´10 cm挖窝,参考当地施肥习惯,基施尿素(N46%)、过磷酸钙(P2O513%)和硫酸钾(K2O 60%)各6、15、5 kg·667m–2。
接种AMF时,将菌剂均匀施于穴内(15 g·穴–1),然后播种。接种SM时,播种后浇灌SM菌液(75 mL·穴–1,相当于5´1010cfu·穴–1),盖土。浇灌的根瘤菌液能浸润种子周围约3~5 cm的土壤,在根系穿过周围土壤的过程中,可充分接触根瘤菌而形成根瘤。SM+AMF处理,依次施用AMF,播种,浇SM菌液,用量同AMF和SM处理;在CK处理中,施用等量高温灭菌的AMF和SM液体。每窝播种10粒种子,实施处理后盖土。每处理占用1个水泥池重复3次,常规管理,持续75 d。
1.3 测定项目与方法
试验结束后,收获植株和根瘤,分别称取植株地上部和地下部生物量,计算根冠比;统计单株根瘤数量并称取根瘤生物量。取第一片完全展开叶,用丙酮提取¾分光光度法测定叶绿素含量[11],a¾奈胺比色法测定硝酸还原酶活性[11]。从根尖取约1 cm的根段,用TTC法测定根系活力[11],酸性品红染色法测定AMF浸染率[12]。80±1°C烘干植株地上部,H2SO4-H2O2消化,分别用凱氏法、钼蓝比色法和火焰光度法测定氮、磷、钾含量[13]。按照国标GB/T 6432-2011、GB/T 6433-2011、GB/T 6434-2011和GB/T 6438-2011[14]测定地上部粗蛋白、粗脂肪、粗纤维和灰分含量。
1.4 统计分析
用Excel 2007对试验数据进行基本计算,SPSS18.0进行统计分析,LSD比较处理间的差异显著性,显著水平为<0.05。
2 结 果
2.1 紫花苜蓿产量及品质
表1可见,苜蓿地上部生物量SM+AMF处理最高(2.67 kg·m–2),SM(2.34 kg·m–2)和AMF(2.25 kg·m–2)次之,CK最低(2.04 kg·m–2);地下部分生物量以SM+AMF最高,AMF次之,CK高于SM。在各处理之间,苜蓿根冠比无显著差异,变化于0.58~0.69。
粗蛋白含量的变化规律同地上部生物量,仍表现为SM+AMF最高(19.81%),SM(19.06%)和AMF居中(18.56%),CK最低(17.56%)。粗脂肪含量在接菌的3个处理之间无显著差异(2.83%~2.95%),但显著高于CK(2.62%)。粗纤维含量各处理之间无显著差异(27.36%~28.45%)。灰分含量SM+AMF最高(8.66%),CK最低(7.42%),SM和AMF介于二者之间,显著高于CK(表1)。
2.2 SM结瘤和AMF感染
表2可见,在CK和AMF处理中,未见苜蓿根系结瘤。SM+AMF的结瘤数较SM增加,但根瘤单重和每株植物的根瘤总重降低。在CK和SM处理中,未见AMF感染根系,SM+AMF的菌根感染率为37.51%,显著高于AMF(30.15%)。
2.3 叶绿素、硝酸还原酶活性和根系活力
在SM、AMF和SM+AMF处理中,叶绿素含量依次较CK增加13.11%、8.85%和15.41%,硝酸还原酶活性接菌的3个处理之间无显著差异,但显著高于CK;根系活力则表现为SM+AMF和AMF(二者无显著差异)显著高于SM和CK(见表3)。
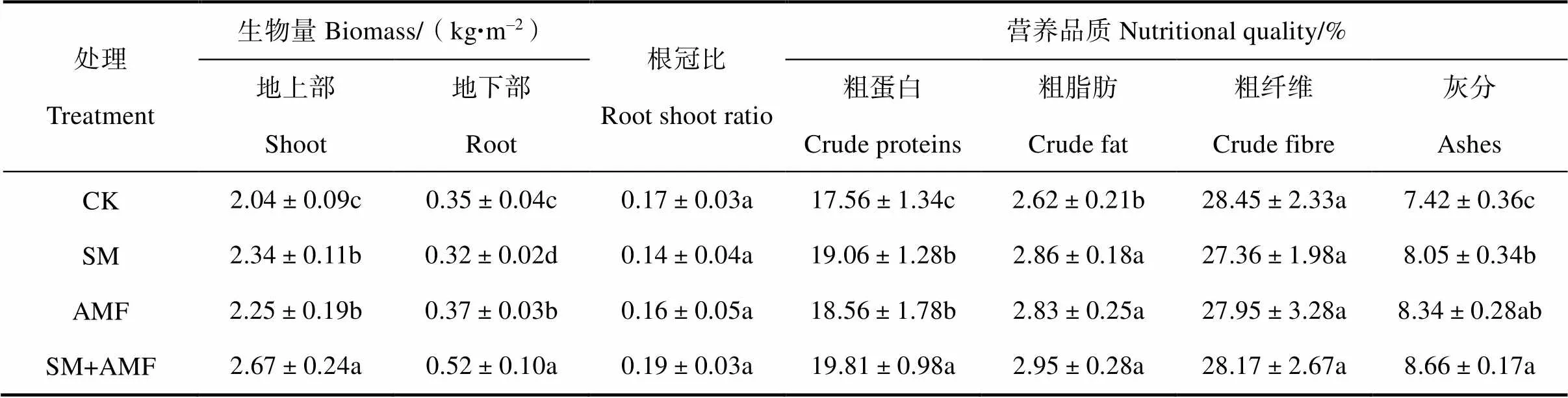
表1 紫花苜蓿生物量及营养品质
注:同一列中小写字母不同表示处理间差异显著(<0.05),下同。Note:Different letters in each column mean significant difference between treatments at0.05 level. The same below.

表2 SM和AMF对紫花苜蓿根系的感染
* 未检测到。Not detected.
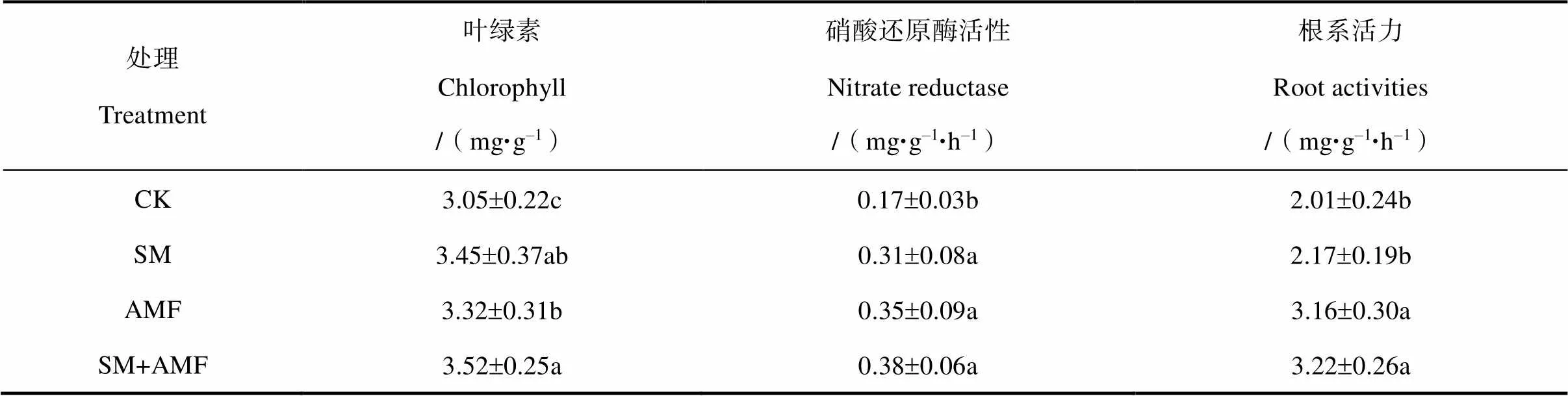
表3 接种SM和AMF对紫花苜蓿部分生理指标的影响
2.4 地上部养分含量与积累量
表4可见,紫花苜蓿地上部含氮量以SM+AMF 处理最高,SM 和AMF次之(但两者无差异),CK最低;磷、钾、钙、镁含量SM+AM 和AMF之间无显著差异,但显著高于SM和CK。由于养分积累量受到生物量影响,地上部的氮、磷、钾、钙、镁的积累量以SM+AMF处理最高,AMF次之(氮除外,显著低于SM),SM第三(钙、镁积累量与CK相比,增幅未达显著水平),CK最低。
3 讨 论
紫花苜蓿接种SM和AMF之后,分别形成根瘤和菌根,地上部生物量、粗蛋白、粗脂肪和灰分比对照显著增加,且以SM+AMF处理最高,说明SM和AMF感染紫花苜蓿之后,SM和AMF消耗的光合产物低于增加的光合产物,使紫花苜蓿生物量增加,牧草产量提高,营养品质改善,二者混合接种具有协同效应,更有益于牧草高产优质。
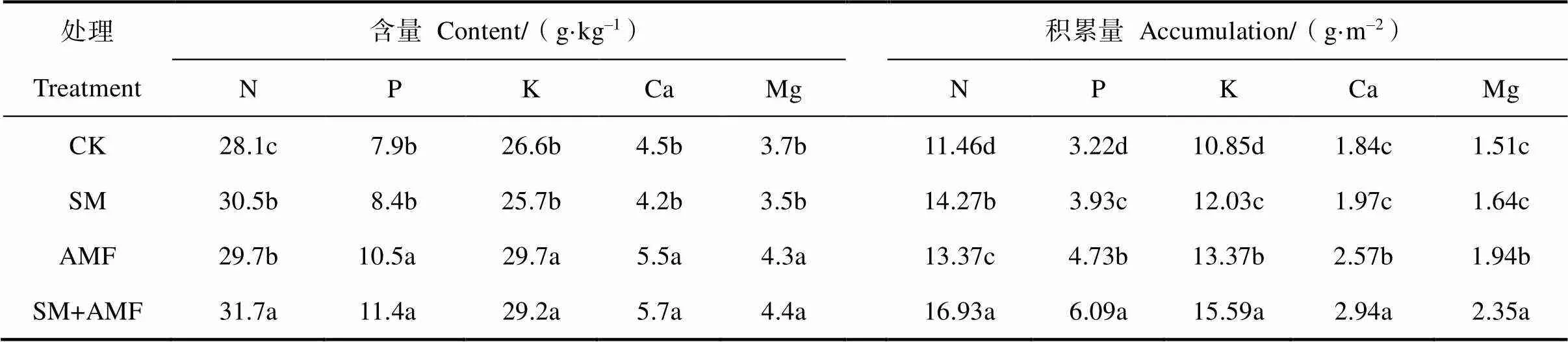
表4 紫花苜蓿地上部养分含量与吸收量
供试土壤pH5.42,接种SM形成根瘤,不仅促进紫花苜蓿生长,而且提高牧草产量和粗蛋白含量,意味着在酸性土壤中,接种SM能结瘤固氮,可用于人工栽培紫花苜蓿。在SM+AMF处理中,结瘤数较SM增加,AMF感染率显著高于AMF。在形成根瘤的过程中,根瘤菌分泌IAA和纤维素酶,软化和分解根毛细胞壁[15-16];AMF除分泌纤维素酶外,还能分泌几丁质酶、蛋白酶和磷酸酶,分解根系细胞壁和原生质膜[17-18]。因此,在酸性土壤上种植紫花苜蓿时,SM+AMF可能增加SM和AMF感染根系的点位,促进结瘤和形成菌根,发挥根瘤和菌根效应。与SM相比,SM+AMF的根瘤多,体积小,意味着根瘤比表面积大,可能更有益于气体交换。此外,SM+AMF还使牧草氮积累量增大,说明根瘤固氮效率有所提高。
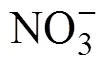
根系活力是根系物质能量代谢的综合体现,与养分吸收量一般呈正相关[21]。AMF和SM+AMF的根系活力显著高于CK和SM,苜蓿地上部磷、钾、钙、镁的含量和积累量也显著增加,类似前人研究[9,22]。菌根外延菌丝广泛伸入土壤,能扩大养分吸收空间;所分泌氢离子和有机酸(如草酸、柠檬酸、苹果酸、琥珀酸等)可溶解土壤矿物,提高磷、钾、钙、镁的生物有效性;并释放纤维素酶、蛋白酶和磷酸酶,促进有机质矿化[23-24],这也可能是菌根植物磷、钾、钙、镁等养分含量和吸收量增加的原因之一[22,25]。众所周知,植物灰分主要由磷、钾、钙、镁等元素组成。因此,随着紫花苜蓿地上部磷、钾、钙、镁含量增加,灰分含量显著提高。此外,在SM处理中,地上部含氮量和氮、磷、钾积累量较CK显著增加,说明在紫花苜蓿在结瘤固氮的同时,氮、磷、钾吸收量增加。
4 结 论
紫花苜蓿单独接种SM或AMF之后,可分别形成根瘤和菌根,提高植株叶绿素及硝酸还原酶含量,并增强根系活力,增加植株氮、磷、钾、钙、镁等养分吸收,最终促进生长,改善苜蓿品质。此外,紫花苜宿双接种(SM+AMF)显示根瘤菌与AMF具有正的协同效应,苜蓿的产量及营养指标均明显高于单接种的处理。因此,在酸性贫瘠的土壤上根瘤菌和菌根真菌双接种更有益于紫花苜蓿的高产优质。
[ 1 ] Wu L F,Wei X M,Zhang Y G,et al. Callus induction of alfalfa and evaluation of callus tolerance to acid and aluminum[J]. Agricultural Science & Technology,2014,15(7):1079—1081.
[ 2 ] Zhang L,Wang X F,Luo Z,et al. Effect of calcium and phosphorous on migration,propagation and quorum sensing of rhizobia in acid soil under aluminum stress[J]. Acta Pedologica Sinica,2014,51(5):1120—1131. [张磊,王晓锋,罗珍,等. 钙磷对酸铝土壤中苜蓿根瘤菌迁移定殖和群体感应的影响[J]. 土壤学报,2014,51(5):1120—1131.]
[ 3 ] Zhou X,Cui M,Qin Y S,et al. The effects of the propagation condition on the three kinds of arbuscular mycorrhizal fungi[J]. Chinese Agricultural Science Bulletin,2012,28(12):83—87. [周霞,崔明,秦永胜,等. 扩繁条件对3种丛枝菌根真菌(AMF)的影响[J]. 中国农学通报,2012,28(12):83—87.]
[ 4 ] Li H,Li X L,Zhang J L,et al. Interaction between earthworms and am fungi and their effects on plant performance[J]. Acta Pedologica Sinica,2011,48(4):847—855. [李欢,李晓林,张俊伶,等. 蚯蚓与丛枝菌根真菌的相互作用及其对植物的影响[J]. 土壤学报,2011,48(4):847—855.]
[ 5 ] Jiang L,Yang Y,Xu W H,et al. Effects of ryegrass and arbuscular mycorrhiza on activities of antioxidant enzymes,accumulation and chemical forms of cadmium in different varieties of tomato[J]. Environmental Science,2014,35(6):2349—2357. [江玲,杨芸,徐卫红,等. 黑麦草-丛枝菌根对不同番茄品种抗氧化酶活性、镉积累及化学形态的影响[J]. 环境科学,2014,35(6):2349—2357.]
[ 6 ] Guo Y E,Li F,Li Y D,et al. Progress in the elucidation of the mechanisms of arbuscular mycorrhizal fungi in promotion of phosphorus uptake and utilization by plants[J]. Pratacultural Science,2016,33(12):2379—2390. [郭艳娥,李芳,李应德,等. AM真菌促进植物吸收利用磷元素的机制[J]. 草业科学,2016,33(12):2379—2390.]
[ 7 ] Goicoechea N,Baslam M,Erice G,et al. Increased photosynthetic acclimation in alfalfa associated with arbuscular mycorrhizal fungi(AMF)and cultivated in greenhouse under elevated CO2[J]. Journal of Plant Physiology,2014,171(18):1774—1781.
[ 8 ] Wu Q S,Yuan F Y,Fei Y J,et al. Effects of arbuscular mycorrhizal fungi on root system architecture and sugar contents of white clover[J]. Acta Prataculturae Sinica,2014,23(1):199—204. [吴强盛,袁芳英,费永俊,等. 丛枝菌根真菌对白三叶根系构型和糖含量的影响[J]. 草业学报,2014,23(1):199—204.]
[ 9 ] Meng C,Lu N,Chai Q. Effects of inoculation with arbuscular mycorrhizal fungi and rhizobia on growth ofin acidic soil[J]. Pratacultural Science,2017,34(2):352—360. [蒙程,陆妮,柴琦. 不同pH下接种AM真菌和根瘤菌对紫花苜蓿生长的影响[J]. 草业科学,2017,34(2):352—360.]
[ 10 ] Ryan M H,Graham J H. Is there a role for arbuscular mycorrhizal fungi in production agriculture?[J]. Plant and soil,2002,244:263—271.
[ 11 ] Cao J K,Jiang W B,Zhao Y M. Experiment guidance of postharvest physiology and biochemistry of fruits and vegetables[M]. Beijing:China Light Industry Press,2011:34—78. [曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2011:34—78.]
[ 12 ] Giovannetti M,Mosse B. An evaluation of techniques for measuring vesicular-arbuscular mycorrbizal infection of roots[J]. New Phytologist,1980,84(3):489—500.
[ 13 ] Yang J H,Wang C L,Dai H L. Soil agro-chemistry analysis and environmental monitoring[M]. Beijing:China Land Press,2008:55—66.[杨剑虹,王成林,代亨林. 土壤农化分析与环境监测[M]. 北京:中国大地出版社,2008:55—56.]
[ 14 ] Bao S D. Soil and agricultural chemistry analysis[M]. Beijing:China Agriculture Press,2000. [鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,2000.]
[ 15 ] Zhang L,Huang J G. Effect ofon mobilization and release of inorganic phosphorus in soil[J]. Acta Pedologica Sinica,2012,49(5):996—1002. [张亮,黄建国. 菜豆根瘤菌对土壤无机磷的活化释放作用[J]. 土壤学报,2012,49(5):996—1002.]
[ 16 ] Chen P J,Wei T C,Chang Y T,et alPurification and characterization of carboxymethyl cellulase from[J]. Botanical Bulletin of Academia Sinica,2004,45(2):111—118.
[ 17 ] Schimel J P,Weintraub M N. The implications of exoenzyme activity on microbial carbon and nitrogen limitation in soil:A theoretical model[J]. Soil Biology and Biochemistry,2003,35(4):549—563.
[ 18 ] Xu X H,Li T T,Li H. Effects of arbuscular mycorrhizal fungi on photosynthetic characteristics and metabolic enzyme activities of carbon and phosphorus of sweetpotato[J]. Journal of Soil and Water Conservation,2016,30(2):255—259. [徐西红,李腾腾,李欢. 接种AM真菌对甘薯光合作用及碳磷代谢酶活性的影响[J]. 水土保持学报,2016,30(2):255—259.]
[ 19 ] Zhang M S,Xie B,Tan F,et al. Relationship among soluble protein,chlorophyll and ATP in sweet potato under water stress with drought resistance[J]. Scientia Agricultura Sinica,2003,36(1):13—16. [张明生,谢波,谈锋,等. 甘薯可溶性蛋白、叶绿素及ATP含量变化与品种抗旱性关系的研究[J]. 中国农业科学,2003,36(1):13—16.]
[ 20 ] Wu W,Zhao J. Progress of research on plant nitrogen absorption and utilization[J]. Chinese Agricultural Science Bulletin,2010,26(13):75—78. [吴巍,赵军. 植物对氮素吸收利用的研究进展[J]. 中国农学通报,2010,26(13):75—78.]
[ 21 ] Kerley S J. The effect of soil liming on shoot development,root growth,and cluster root activity of white lupin[J]. Biology and Fertility of Soils,2000,32(2):94—101.
[ 22 ] Zhang Y,Li J,Yao Q,et al. Effects of arbuscular mycorrhizal fungi on growth and nutrient uptake ofplants under different water regimes[J]. Acta Horticulturae Sinica,2012,39(4):757—762. [张燕,李娟,姚青,等. 丛枝菌根真菌对水分胁迫下枇杷实生苗生长和养分吸收的影响[J]. 园艺学报,2012,39(4):757—762.]
[ 23 ] Yang H J,Li Y,Huang J G. Effect of phosphorus supply and signal inhibitors on oxalate efflux in ectomycorrhizal fungi[J]. Acta Microbiologica Sinica,2015,55(6):788—795. [杨红军,李勇,黄建国. 磷与信号抑制剂对外生菌根真菌分泌草酸的调控作用[J]. 微生物学报,2015,55(6):788—795.]
[ 24 ] Li H,Wang C,Wang S Y. Interaction of earthworms and amfungi on maize growth,and nitrogen and phosphorus uptake[J]. Journal of Plant Nutrition and Fertilizer,2015,21(4):920—926. [李欢,王冲,汪顺义. 蚯蚓与菌根提高玉米生长和氮磷吸收的互补效应[J]. 植物营养与肥料学报,2015,21(4):920—926.]
[ 25 ] Zhang Y F,Feng G,Li X L. The effect of arbuscular mycorrhizal fungi on the components and concentrations of organic acids in the exudates of mycorrhizal red clover[J]. Acta Ecologica Sinica,2003,23(1):30—37. [张玉凤,冯固,李晓林. 丛枝菌根真菌对三叶草根系分泌的有机酸组分和含量的影响[J]. 生态学报,2003,23(1):30—37.]
Effects of Rhizobia and Arbuscular Mycorrhizal Fungi on Nodulation, Yield and Quality of
LIU Yi, YUAN Ling†
(College of Resources and Environment, Southwest University, Chongqing 400716, China)
; Rhizobia; Arbuscular mycorrhizal fungi; Nutrients
S541+.2;S182
A
10.11766/trxb201907030439
刘忆,袁玲. 根瘤菌和AM真菌对紫花苜蓿结瘤和产质量的影响 [J]. 土壤学报,2020,57(5):1292–1298.
LIU Yi,YUAN Ling. Effects of Rhizobia and Arbuscular Mycorrhizal Fungi on Nodulation,Yield and Quality of[J]. Acta Pedologica Sinica,2020,57(5):1292–1298.
* 国家重点研发计划项目(2016YFD0200304)资助 Supported by the National Key Research and Development Program of China(No. 2016YFD0200304)
,Email:lingyuanh@aliyun.com
刘 忆(1995—),女,山东滨州人,硕士,主要从事植物营养研究。E-mail:997981844@qq.com
2019–07–03;
2019–12–09;
优先数字出版日期(www.cnki.net):2020–03–16
(责任编辑:卢 萍)

