尼罗罗非鱼Galectin-related protein B基因的原核表达与条件优化
黄永雄 牛金中 杨世平 简纪常
摘 要:Galectin-related protein B是一种缺乏半乳糖苷结合活性的半乳糖凝集素相关蛋白B。基于NCBI公布的尼罗罗非鱼(Oreochromis niloticus) Galectin-related protein B 基因序列设计带酶切位点引物,构建原核表达载体pET-28a-GRPB,将重组质粒导入大肠杆菌,诱导重组质粒的蛋白表达,并对蛋白表达条件进行优化。结果表明:在28℃条件下,IPTG浓度为0.20mmol/L,诱导6h时,诱导重组蛋白的效果最佳;经Western-blot免疫印迹显示,纯化后的重组蛋白能与带HIS标签的单抗特异结合,条带单一,进一步证明该重组蛋白为Galectin-related protein B蛋白。
关键词:尼罗罗非鱼;凝集素相关蛋白B;原核表达;条件优化
中图分类号 S917.4 文献标识码 A文章编号 1007-7731(2020)18-0012-04
Prokaryotic Expression and Condition Optimization of Galectin-related Protein B Gene in Nile Tilapia
HUANG Yongxiong et al.
(Fisheries College of Guangdong Ocean University,Zhanjiang 524088,China;Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemilogy for Aquatic Economic Animals,Zhanjiang 524088,China;Key Laboratory of Control for Diseases of Aquatic Economic Animals of Guangdong Higher Education Institutes,Zhanjiang 524088,China)
Abstract:Galectin-related protein B is a galactose lectin-related protein B which lacks galactoside binding activity. In this study,primers with restriction site were designed based on the Galectin-related protein B gene sequence of Nile tilapia(Oreochromis niloticus)published by NCBI,and the prokaryotic expression vector pET-28a-GRPB,was constructed. The recombinant plasmid was introduced into E. coli to induce the expression of the recombinant plasmid protein. The factors affecting the expression of the protein were optimized. The results showed that the concentration of the recombinant protein reached a maximum under the induced time of 6h,the induced temperature of 28℃ and concentration of IPTG of 0.20mmol/L. Western-blot blotting showed that the purified recombinant protein could specifically bind to the monoclonal antibody with HIS tag and had a single band,which further proved that the recombinant protein was Galectin-related protein B protein.
Key words:Oreochromis niloticus;Lectin-associated protein B;Prokaryotic expression;Condition optimization
凝集素是一类碳水化合物结合蛋白,广泛存在于各种生物体内,能在诸如先天免疫、抵御病原体中发挥作用:识别,内吞,补体激活,抗原加工,B和T细胞克隆选择、成熟、激活和凋亡[1]。半乳凝素(Galectins)识别β-半乳糖的能力及对凝集素的保守序列2大特征,于20世纪70年代首次被描述为半乳糖苷结合凝集素[2],也被称为galaptins和S型凝集素[3]。所有半乳糖凝集素共有130个氨基酸组成的保守碳水化合物识别域(crd),负责碳水化合物的结合。Galectins参与了多种生物过程,如细胞粘附[4]、先天免疫[5-6]、细胞分化与发育[7]、信号转导[8],细胞增殖和细胞死亡的调控[9]以及前mRNA剪接[10]。
近年来,人们发现了许多与galectin家族序列相似的蛋白质。然而,由于缺乏半乳糖苷结合活性,它们被称为Galectin相关蛋白(GRPs)[11]。目前,已从鱼类物种中鉴定出若干种GRP,包括红鳍东方鲀(Takifugu rubripes)、綠河鲀(Tetraodon nigroviridis)、尼罗罗非鱼(Oreochromis niloticus)、牙鲆(Paralichthys olivaceus)、虹鳟鱼(Oncorhynchus mykiss)等,但硬骨鱼类中,仅报道了条石鲷(Oplegnathus fasciatus)GRP的分子特征和生物学功能[12]。研究显示,条石鲷GRP是一种进化保守的合成凝集素,与原型半乳糖凝集素密切相关。Galectin相关蛋白在条石鲷的鳃和脾脏中的上调,表明它可能在细菌和病毒感染过程中发挥重要作用。
尼罗罗非鱼是我国重要的水产经济养殖品种[13],但近年来由于受到无乳链球菌感染,罗非鱼养殖受到沉重打击,经济损失巨大。目前对于罗非鱼免疫系统的研究尚处于起步阶段,尤其是凝集素相关蛋白。因此,本研究基于Galectin-related protein B基因在NCBI上的序列设计引物克隆其完整ORF区并构建原核表达载体,进行重组蛋白的表达及条件优化,为后续罗非鱼凝集素相关蛋白的研究提供参考。
1 材料与方法
1.1 材料 试验所用尼罗罗非鱼购于湛江市东海岛养殖场;Ex Tap酶、DL2000 DNA Marker、PMD-18载体购于TaKara 生物公司;RNA提取试剂盒、RNA反转录试剂盒、切胶回收试剂盒及E.coil DH5α、BL21感受态细胞购自TRANS公司;质粒提取试剂盒由Thermo scientific公司提供;原核表达载体pET-28a(+)载体质粒由广东省水产经济动物病原生物学及流行病学重点实验室保存。
1.2 方法
1.2.1 尼罗罗非鱼GRPB基因片段的扩增及测序 在超净工作台上剪取罗非鱼肝脏组织块,用组织匀浆器研磨组织块,按照RNA提取试剂盒说明纯化提取RNA。将提取所得RNA用琼脂凝胶电泳检测RNA质量,条带单一且具有2条带以上即可用RNA反转录试剂盒合成cDNA。根据NBCI官网所收录的罗非鱼GRPB基因序列(登录号:XM_031733405.1)设计克隆引物:GRPB-H-F:CCGGAATTCATGGAAGAAAAGGACAATAAAGAAAATG,GRPB-hisR:CCG CTCGAG A GGCCACCTTGGTAAGCTGTAGA。PCR扩增以合成的cDNA为模板,扩增体系为:Ex Tap:10μL、4-GRPB-H-F/4-GRPB-hisR:1μL、cDNA:1μL、ddH2O:7μL,共20μL。PCR扩增反应程序为:95℃、5min;95℃、30s;56℃、30s;72℃、25s;30个循环;结束后72℃、5min;扩增产物经过凝胶电泳后根据切胶回收试剂盒说明回收产物。将纯化所得DNA片段与PMD-18载体链接,16℃连接12h后将连接产物导入E.coil DH5α感受态细胞,涂布于含氨苄抗性的固体培养基中培养,挑选单个菌落进行菌落PCR鉴定,选取阳性菌液送往广州生工进行测序。
1.2.2 原核表达载体构建 将测序比对结果正确的阳性菌液进行扩增培养提取重组质粒PMD-18-GRPB以及pET-28a(+)空载质粒,分别用EcoR1和XhoI限制内切酶酶切重组质粒和空载质粒,酶切条件为37℃、10min。将酶切产物凝胶电泳,同样也使用胶回收试剂盒纯化回收产物。用T4连接酶将2种回收产物在4℃条件下连接12h后导入BL21感受态细胞,随后将感受态细胞涂布于含卡那霉素抗性的固体培养基培养,挑选单菌落进行PCR检测,选取单菌落阳性菌送往生物公司测序。
1.2.3 重组蛋白表达的诱导 将测序比对结果正确的含重组质粒pET-28a-GRPB的单菌落按照1∶100的比例接种于含卡那霉素的液体培养基,在37℃恒温摇床进行扩大培养,当菌液OD值在0.4~0.6时,加入1mmol/L异丙基硫代半乳糖苷IPTG进行诱导5h,将诱导后菌液离心收集细菌,水煮法提取诱导蛋白,利用聚丙烯酰氨SDS-PAGE凝胶电泳检测分析蛋白。
1.2.4 重组蛋白表达诱导条件优化(1)IPTG浓度优化。分别使用浓度0.2、0.4、0.6、0.8、1.0mmol/L的IPTG诱导重组蛋白,条件是37℃、5h。收集不同诱导浓度菌液中的细菌,用PBS缓冲液洗去培养液后加蛋白上样缓冲液染色,水煮10min,4℃离心收集上清进行SDS-PAGE蛋白电泳,分析电泳图。
(2)诱导温度优化。温度设置3个梯度:18、28、37℃,使用1mmol/L IPTG诱导5h,同上述方法步骤处理收集诱导后的蛋白进行SDS-PAGE蛋白电泳,分析图谱。
(3)诱导时间优化。选取最适IPIG浓度以及诱导温度,设置诱导时间梯度为1、2、3、4、5、6、7h。分别处理不同诱导时间菌液,进行SDS-PAGE蛋白电泳。
(4)重组蛋白表达形式分析。在最佳诱导条件下诱导重组蛋白,离心收集菌液中细菌,一部分进行超声波粉碎后,离心取上清和沉淀;另一部分提取全菌蛋白;将上清、沉淀以及全菌蛋白进行SDS-PAGE蛋白电泳,确定重组蛋白主要表达形式。
1.2.5 Western blot分析 将纯化所得GRPB蛋白进行SDS-PAGE电泳,完毕后将蛋白转印到PVDF膜上,转印电流为450mA,35min。用含5%脱脂奶粉的TBS-Tween-20封闭转印好的PDVF膜(4℃、2h)。封闭完成后使用TBST缓冲液洗脱PDVF膜,每次洗脱5min,洗脱3次;一抗(含GST标签鼠抗)常温孵育GRPB蛋白2h,同样用TBST 洗脱3次;二抗羊抗鼠IgG常温孵育蛋白1h,TBST缓冲液洗脱3次,用DAB显色试剂盒显色。
2 结果与分析
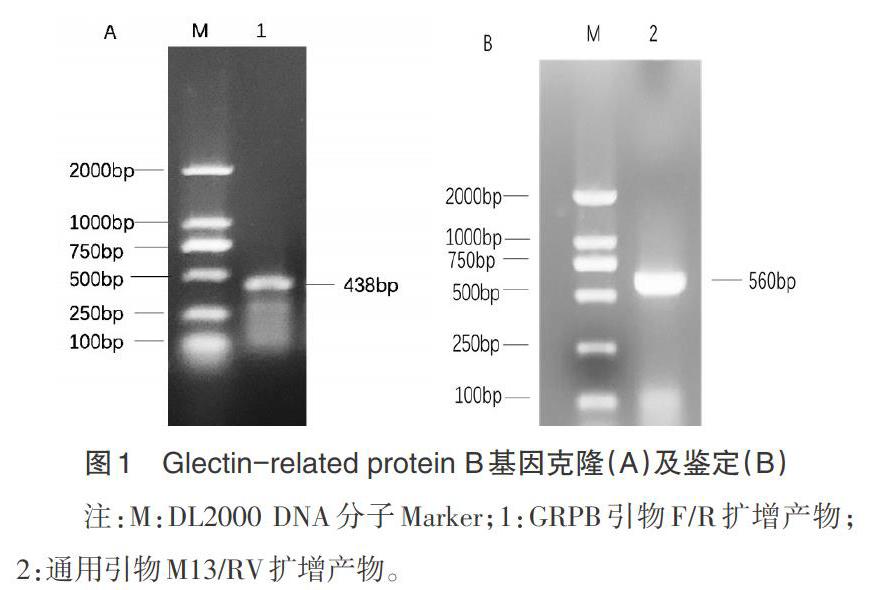
2.1 GRPB基因的扩增及表达载体的构建 用罗非鱼cDNA模板与特异性引物扩增得到一条438bp的条带(见图1)。目的片段与PMD-18T载体连接,用PMD-18T载体通用引物M13/RV进行扩增,产物片段大小约560bp(图1),与预期目标一致,说明所挑选的单菌落为阳性克隆菌,GRPB基因克隆及载体构建成功。
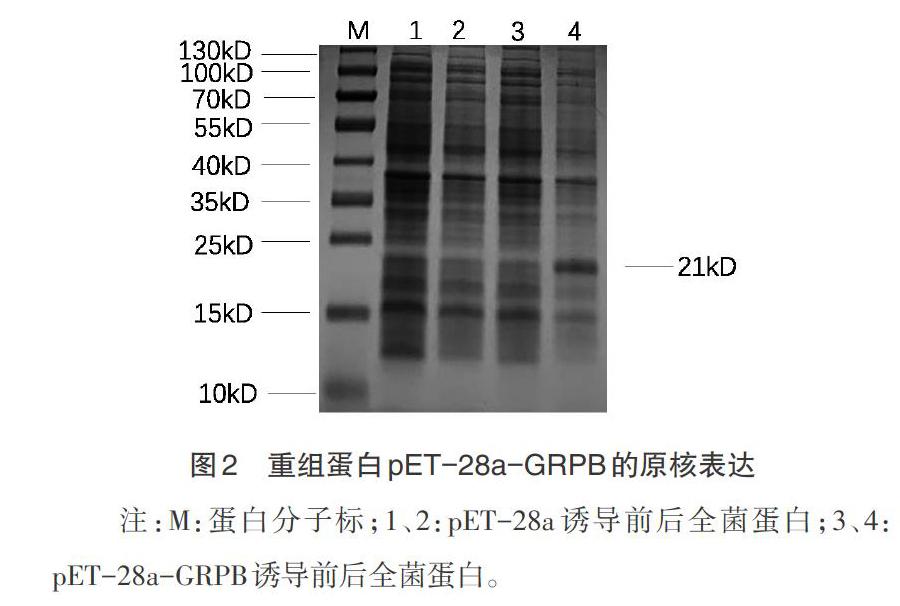
2.2 重组蛋白表达的诱导 重组蛋白pET-28a-GRPB在经IPTG诱导后出现大小约为21kD条带(图2),与GRPB蛋白预测大小一致,未經过诱导的重组蛋白则没有该条带,而空载pET-28a菌株在诱导前后无差别,说明重组蛋白pET-28a-GRPB表达成功。
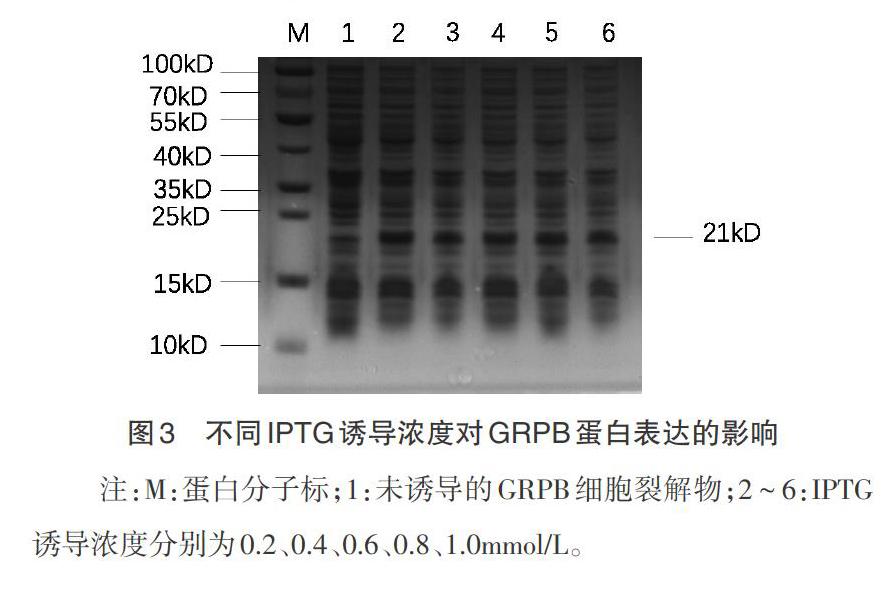
2.3 重组蛋白表达诱导条件优化 GRPB蛋白表达量影响后续的蛋白纯化和收集,因此,有必要进行IPTG诱导浓度、诱导温度和诱导时间的优化试验。由不同浓度IPTG诱导的SDS-PAGE电泳图可知,在IPTG浓度为0.2mmol/L,重组蛋白的表达量最大(图3);诱导时间和诱导浓度不变时,诱导温度在28℃时蛋白表达量最多(图4);蛋白表达量随诱导时间增加而增多,诱导6h表达量达到最大(图5)
2.4 GRPB重组蛋白的可溶性分析 分别在18、28、37℃条件下加入0.2mmol/L IPTG诱导GRPB蛋白6h后用超声波破碎,取上清、沉淀以及全菌跑SDS-PAGE电泳,结果显示在最优诱导温度28℃时,GRPB蛋白以可溶性蛋白为主要表达形式(见图6)。
2.5 GRPB重组蛋白的纯化及鉴定 通过最优诱导条件(IPTG浓度为0.2mmol/L、28℃以及诱导6h),经破碎及纯化柱纯化后跑SDS-PAGE电泳,显示该蛋白为可溶性蛋白表达且纯化后的条带单一(图7)。Western-blot结果显示,GRPB重组蛋白能与鼠抗His-Tag单克隆抗体特异性结合,说明重组蛋白为尼罗罗非鱼的Galectin-related protein B蛋白(图8)。
3 结论与讨论
本研究将罗非鱼GRPB基因进行克隆及成功构建pET-28a-GRPB原核表达载体,并表达带HIS标签蛋白。试验所用菌株为大肠杆菌,该菌株具有快速、简易、高效诱导表达等特点[14],是最为常用的重组蛋白表达体系。蛋白大量纯化时,蛋白表达量与温度、诱导时间及IPTG浓度有关[15]。试验结果表明,在IPTG浓度为0.2mmol/L,蛋白表达量最大,诱导浓度大于0.2mmol/L时,蛋白表达量反而下降,说明过高浓度的IPTG对大肠杆菌的生长具有抑制作用[16];诱导温度为28℃时,蛋白表达量最高,诱导温度过低或过高均对蛋白产量产生影响,推测温度影响合成蛋白相关酶的活性[17];诱导时间以6h最佳。经Western blot检测纯化后蛋白,蛋白能与带HIS标签单克隆抗体特异结合且条带单一,证明该重组蛋白就是Galectin-related protein B。
本试验探究了尼罗罗非鱼GRPB基因的最优条件诱导原核表达,实现GRPB蛋白的大量纯化回收,为后续该基因的抗体制备和蛋白的功能研究奠定了基础。
参考文献
[1]Gerardo R Vasta,Hafiz Ahmed,Eric W Odom. Structural and functional diversity of lectin repertoires in invertebrates,protochordates and ectothermic vertebrates[J]. Current opinion in structural biology,2004,14(5):617-630.
[2]A de Waard,S Hickman,S Kornfeld. Isolation and properties of beta-galactoside binding lectins of calf heart and lung[J]. The Journal of biological chemistry,1976,251(23):7581-7587.
[3]Samuel H. Barondes,Vincent Castronovo,Douglas N.W. Cooper,et al. Galectins:a family of animal beta-galactoside-binding lectins[J].Cell,1994,76(4):597-598.
[4]Jiale He,Linda G Baum. Galectin interactions with extracellular matrix and effects on cellular function[J].Methods in Enzymology,2006,417:247-256.
[5]Kohatsu L.,Hsu D K,Jegalian A G,et al. Galectin-3 induces death of Candida species expressing specific β-1,2-linked mannans[J].The Journal of Immunology,2006,177(7):4718-4726.
[6]Sato S,Nieminen J. Seeing strangers or announcing “danger”:galectin-3 in two models of innate immunity[J]. Glycoconjugate journal,2002,19(7-9):583-591.
[7]Karen E Pace,Linda G Baum. Insect galectins:roles in immunity and development[J]. Glycoconjugate Journal,2002,19(7-9):607-614.
[8]Nakahara,Susumu. On the role of galectins in signal transduction[J].Methods in Enzymology,2006,417:273-289.
[9]Hernandez Joseph D,Baum Linda G. Ah,sweet mystery of death! Galectins and control of cell fate[J].Glycobiology,2002,12(10):127R-136R.
[10]Liu Futong,Patterson,Ronald J,et al. Intracellular functions of galectins[J].General Subjects,2002,1572(2-3):263-273.
[11]COOPER,D. N. W. Galectinomics:finding themes in complexity[J].Biochim Biophys Acta,2002,1572(2-3):209-231.
[12]William S T,Ilson Whang,Navaneethaiyer U,et al. A galectin related protein from Oplegnathus fasciatus:Genomic,molecular,transcriptional features and biological responses against microbial pathogens[J].Developmental and Comparative Immunology,2016,56:13-24.
[13]El-Sayed A F M. Total replacement of fish meal with animal protein sources in Nile tilapia,Oreochromis niloticus(L.),feeds[J]. Aquaculture Research,1998,29(4):275-280.
[14]朱峰.家蚕微孢子虫孢壁蛋白 SWP26 及其宿主互作蛋白的研究[D].镇江:江苏科技大学,2013.
[15]P.R.Patnaik. Investigation of induction effect on the steady state performance of a continuous fermentation for recombinant β-ga1actosidase[J].Process Biochemistry,2001,36(11):1069-1074.
[16]陸海,吴薇,曾庆银.大肠杆菌BL21(DE3)中表达重组蛋白的研究[J].北京林业大学学报,2001,23(6):1-4.
[17]罗国玲,牛金中,黄瑜,等.尼罗罗非鱼Galectin-3基因的原核表达与条件优化[J].广东海洋大学学报,2019(4):35-41.
(责编:徐世红)

