水稻抗白叶枯病基因xa5的原核表达及蛋白纯化
范玉龙等
摘 要 水稻是重要的粮食作物,其产量高低与病虫害等因素密切相关,由黄单胞杆菌引起的水稻白叶枯病是导致水稻产量减少的主要病害之一。控制白叶枯病最安全、经济有效的方法是培育抗病品种,隐性抗病基因xa5是重要的水稻白叶枯病抗性基因。通过构建显性及隐性xa5基因的原核表达载体(PGEX-4T-1-Xa5和PGEX-4T-1-xa5),转化大肠杆菌BL21,经0.2 mmol/L IPTG 28℃ 诱导4 h,表达显性Xa5和隐性xa5蛋白;结合western-blotting分析,结果表明表达的蛋白是带有GST标签的融合蛋白,最后利用谷胱甘肽亲和层析柱将蛋白纯化,为后期研究xa5基因的功能提供基础。
关键词 水稻 ;白叶枯病 ;xa5 ;原核表达 ;蛋白纯化 ;western-blotting
分类号 S511
Abstract Rice is an economically important crop, the output of rice is closely related to the factors such as plant diseases and insect pests. Bacterial blight (BB) caused by Xanthomonas oryzae pv. Oryzae (Xoo) is one of three most destructive diseases in rice which cased output reduce. The cultivation of varieties with high resistance is considered as the most effective and economical option to control this disease. xa5 recessive resistance gene is an important rice bacterial leaf blight resistance genes. In this study, we construct prokaryotic expression vector(PGEX-4T-1-Xa5 and PGEX-4T-1-xa5), and translate it into BL21, then 0.2 mmol/L IPTG, 28℃, 4 h induced dominant Xa5 and recessive xa5 protein expression. Then in combination with western-blotting analysis, show that the expression of protein is a GST fusion protein and purification of the protein, These results laid a foundation for elucidating characteristic and function of xa5.
Keywords rice ; bacterial blight ; xa5 ; prokaryotic expression ; protein purification ; western-blotting
水稻是重要的粮食作物,全世界约1/2的人口以它为主要粮食[1]。水稻的产量高低与病虫害等因素密切相关,水稻白叶枯病就是导致水稻产量减少的主要病害之一,白叶枯病发病时一般可造成水稻减产20%~30%,严重时会达到50%,甚至绝收[2]。控制白叶枯病最安全、经济有效的方法就是培育抗病品种,抗性基因的发掘与克隆是培育抗病品种的基础,因此对水稻白叶枯病抗性基因的研究一直是水稻白叶枯病研究的重点。截至2013年3月,经国际注册确认和期刊报道的水稻白叶枯病抗性基因共38个[3]。已被定位的抗性基因有26个,并且Xa1、xa5、xa13、Xa21、Xa23、Xa26、Xa27 共7个基因已成功克隆[4]。
在已经发现的38个白叶枯病抗性基因中,有12个是隐性抗病基因,可见隐性抗病基因在白叶枯病抗性资源中起着重要作用。据报道,白叶枯病抗性基因xa5是具有重要研究价值和育种价值的一类新型的隐性抗病基因[5],目前的研究结果表明,xa5基因定位在第5 号染色体上[6];该基因的cDNA全长为906 bp,包含3个外显子,编码1个由106 个氨基酸组成的蛋白产物,且该蛋白产物是一个转录因子ⅡA的γ亚基(TFⅡAγ)[7-8]。xa5基因与已知抗病基因具有不同的结构,前期的研究结果已经明确了显性Xa5和隐性xa5开放阅读框(Open reading frame,ORF)区有2个碱基的差异是导致抗、感差异的功能突变位点[8-9],xa5在抗病品种IRBB5和感病品种日本晴中有2个碱基的差异,导致IRBB5中的第39位的缬氨酸在日本晴及IR24中变成谷氨酸,该氨基酸位点位于蛋白质三维结构的表面,可能与蛋白质之间的相互作用有关。后期Gu等[10]的研究结果发现,基因可影响显性抗病基因Xa27的抗病性xa5,但目前对xa5基因的抗病机制知之甚少,在蛋白水平对xa5基因的研究报道也很少。鉴于此,本研究试图表达xa5基因的原核表达蛋白,进而在蛋白水平对xa5基因的抗病机制进行阐释,此研究将为其他隐性抗病基因机制的研究提供参考与模板,同时有助于生产上更好利用xa5基因培育抗病品种。
大肠杆菌表达系统是目前广泛应用的一种基因表达系统,它具有遗传背景清楚、基因操作方便、表达水平高及试验成本低等优点[11]。因此,利用原核表达对基因进行分析已经成为实验室中不可或缺的一种方法[12]。本研究成功构建了显性Xa5基因的原核表达载体PGEX-4T-1-Xa5和隐性xa5基因的原核表达载体PGEX-4T-1-xa5,通过转化大肠杆菌BL21,0.2 mmol/L的IPTG诱导表达特异蛋白,并利用western-blotting分析确定,最后利用GST标签纯化原核表达蛋白,为后期进一步研究xa5基因的功能奠定基础。
1 材料与方法
1.1 材料
原核表达载体PGEX-4T-1及大肠杆菌BL21由本实验室保存;大肠杆菌DH5α购自TaKaRa公司;异丙基-β-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)购自中科瑞泰公司;Pyrobest DNA聚合酶和DNA Marker购自TaKaRa公司;限制性内切酶、T4 DNA 连接酶、蛋白markers、GST亲和层析柱及谷胱甘肽还原酶购自Fermentas 公司;抗GST标签鼠单克隆抗体和GST-羊抗鼠IgG购自武汉博士德生物公司。引物合成和测序委托上海生物工程技术服务有限公司完成。
1.2 方法
1.2.1 显性基因Xa5和隐性基因xa5的PCR扩增及测序
以携有显性Xa5的日本晴植株的cDNA和携有隐性xa5的IRBB5水稻植株的cDNA为模板,以pex-xa5-F-EcoRI(5′GAATTCATGGCCACCTTCGAGCTCTAC′3)和pex-xa5-R-XhoI(5′CTCGAGTTATTGGCTGAGTAGTTTGG′3)为引物,PCR扩增pex-Xa5的基因片段(命名为pex-Xa5)和pex-xa5的基因片段(命名为pex-xa5)。PCR反应程序为:94℃预变性4 min;94℃变性30 s,56℃退火30 s,72℃延伸30 s,30个循环;72℃延伸10 min,扩增产物回收连接到PMD-18T载体上,转化大肠杆菌DH5α,挑取阳性克隆送测序公司测序。
1.2.2 PGEX-4T-1-Xa5和PGEX-4T-1-xa5原核表达载体的构建
将上述测序正确的阳性克隆的质粒用EcoRI和XhoI双酶切,回收目的基因片段,与同样经过EcoRI和XhoI双酶切的原核表达载体PGEX-4T-1用T4连接酶连接,转化大肠杆菌DH5α,在含100 μg/mL的氨苄青霉素(Amp)的LB培养基上生长,筛选阳性克隆,提取质粒,双酶切鉴定,最后送公司测序。
1.2.3 PGEX-4T-1-Xa5 和PGEX-4T-1-xa5诱导表达及可溶性分析
将上述测序正确的重组质粒转化大肠杆菌BL21感受态细胞,挑取单克隆菌斑,于含有100 μg/mL的氨苄青霉素(Amp)的LB液体培养基中37℃培养过夜,按照1∶100的比例取菌液至新鲜的LB液体培养基中,37℃培养至OD600为0.4左右时,加入终浓度为0.2 mmol/L的IPTG,28℃诱导表达4 h,收集菌体。用10 mmol/L Tris-HCl(pH 8.0)洗涤沉淀2次后重悬菌体,冰上用30%超声强度破碎5 s,间隔5 s处理样品10 min。4℃,12 000 r/min 离心10 min, 分离上清和沉淀。取超声波处理后的上清和沉淀样品各10 μL,对其进行SDS-PAGE电泳分析。
1.2.4 融合蛋白PGEX-4T-1-Xa5 和PGEX-4T-1-xa5的western-blotting分析
将融合蛋白上清及空载体表达上清进行SDS-PAGE电泳,利用电压转膜法,将蛋白转移到醋酸纤维薄膜(PVDF膜)上,转膜结束后,取出PVDF膜在TBS中漂洗5 min。接着将PVDF膜移至5%脱脂奶粉封闭液中封闭2 h,室温慢摇。弃封闭液,TBST洗膜3次。分别用一抗(GST-tag)、二抗(羊抗鼠IgG)室温轻摇,封闭孵育1 h,按武汉博士德试剂公司要求配制显色剂,均匀滴加到PVDF膜上,曝光拍照[13]。
1.2.5 融合蛋白PGEX-4T-1-Xa5和PGEX-4T-1-xa5的纯化
根据GE公司GST Fusion Protein Spin Purification Kit说明书标准进行改进。取融合蛋白上清10 mL,同时加入100 μL谷胱甘肽层析柱,在混合器上4℃混合2 h。500 r/min,4℃,离心2 min,弃上清,加2 mL PBS洗3次,最后加1 mL PBS混匀,转移到1.5 mL离心管中,500 r/min,离心1 min,弃上清。加500 μL谷胱甘肽还原酶(浓度为50 mmol/L),混合器上,4℃混合0.5 h,4℃ 500 r/min离心2 min,取上清到1.5 mL离心管中,上清即为纯化后的蛋白。取10 μL上样缓冲液+10 μL上清,对其进行SDS-PAGE跑胶检测。
2 结果与分析
2.1 显性基因Xa5和隐性基因xa5的扩增
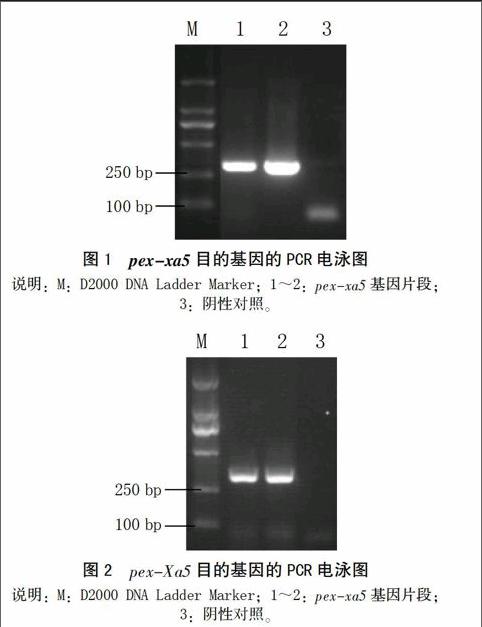
以携有显性基因Xa5的日本晴植株的cDNA和携有隐性基因xa5的IRBB5水稻植株的cDNA为模板,以pex-xa5-F-EcoRI和pex-xa5-R-XhoI为引物,PCR扩增pex-xa5的基因片段(命名为pex-xa5)和pex-Xa5的基因片段(命名为pex-Xa5),结果得到330 bp的目的片段(图1、2)。
2.2 原核表达载体PGEX-4T-1-Xa5和PGEX-4T-1-xa5的构建
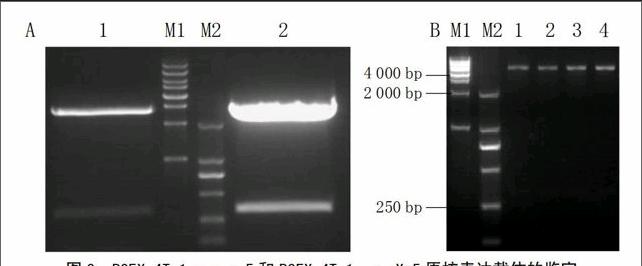
将上述PCR扩增得到的基因片段进行胶回收,并连接PMD-18T载体,转化大肠杆菌DH5α,挑取阳性克隆,最后送公司测序,将测序正确的菌株摇菌并提取质粒。用EcoRI和XhoI双酶切的结果见图3-A,回收目的片段;接着与经过同样2种酶酶切回收之后的原核表达载体PGEX-4T-1连接,转化大肠杆菌DH5α,挑取阳性克隆摇菌并提取质粒;然后双酶切鉴定(图3-B),结果获得330 bp的目的片段,说明目的基因已经插入到了PGEX-4T-1表达载体中;最后将阳性克隆的菌株送公司测序,测序结果表明插入基因未发生突变或移码,说明原核表达载体PGEX-4T-1-Xa5和PGEX-4T-1-xa5构建成功。
2.3 目的蛋白的诱导表达
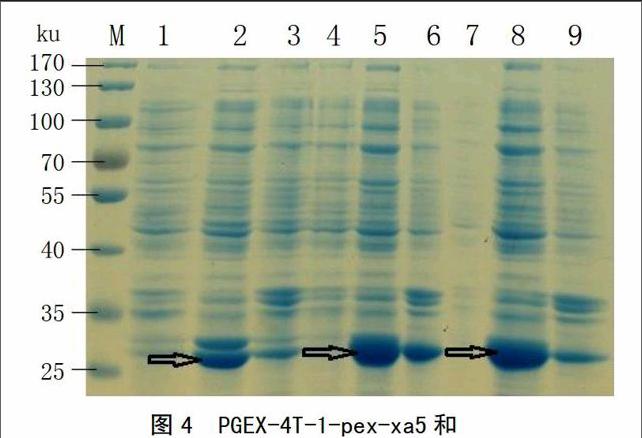
将构建成功的重组质粒PGEX-4T-1-pex-xa5、PGEX-4T-1-pex-Xa5及PGEX-4T-1空载体转化大肠杆菌表达菌株BL21中,挑取单克隆菌落用0.2 mmol/L的IPTG进行诱导表达,对表达产物进行SDS-PAGE电泳分析(图4)。结果发现,相对于对照而言,被诱导的PGEX-4T-1-pex-xa5和PGEX-4T-1-pex-Xa5中表达了30 ku左右的特异的融合目的蛋白,PGEX-4T-1空载体表达了其特有的26 ku左右的GST标签蛋白,且都在上清中大量存在,说明表达的原核蛋白是可溶的。
2.4 western-blotting分析
将上述诱导表达的PGEX-4T-1-pex-xa5、PGEX-4T-1-pex-Xa5及PGEX-4T-1空载体蛋白进行western-blotting分析,结果出现了单一的条带(图5),进一步说明上述诱导表达的蛋白确实是带有GST标签的目的蛋白。
2.5 目的蛋白的纯化
为了进一步研究上述表达的融合目的蛋白,利用谷胱甘肽层析柱过柱纯化融合蛋白(图6),纯化的目的蛋白单一,无杂带,可满足后期的实验要求。
3 讨论与结论
本研究采用了最常用的PGEX-4T-1原核表达载体的原核表达系统,该系统表达的融合蛋白带有GST标签,可通过亲和层析与固定在基质上的谷胱甘肽结合。GST与谷胱甘肽之间的高特异性结合确保了单个步骤就能获得高纯度的目的蛋白[14],因此,本研究利用已知的xa5的序列,设计引物,扩增得到显性Xa5和隐性xa5基因序列,并成功构建了PGEX-4T-1-pex-xa5和PGEX-4T-1-pex-Xa5原核表达载体,为后期的融合蛋白的纯化奠定基础。
目前能够影响外源基因在大肠杆菌中稳定表达的因素有很多,如大肠杆菌菌株、诱导剂浓度、温度和诱导时间等[12]。前人通过原核表达获得目的融合蛋白的研究已有很多,如邓治等[15]通过构建pET28a-HbADF、转化大肠杆菌BL21、1 mmol/L IPTG诱导表达了橡胶树肌动蛋白解聚因子HbADF融合蛋白。Fan等[16]用0.8 mmol/L的IPTG,18℃诱导20 h后,获得了可溶性表达的CAD蛋白。基于前人的研究基础,本研究采用了适度低温(28℃)及较低含量的IPTG(0.2 mmol/L),诱导4 h,成功诱导表达了30 ku左右的目标蛋白;经SDS-PAGE跑胶分析,该蛋白在上清中大量表达,说明表达的融合蛋白为可溶性蛋白,并未形成包涵体。充分说明试验中所使用的诱导条件可很好的诱导xa5和Xa5基因的表达,并且蛋白表达量较高,可满足后期的实验要求。对表达的特异融合蛋白利用GST标签抗体进行western-blotting分析,结果有特异性反应,说明构建的载体是带有GST标签的融合蛋白。为了后期能够更好地研究和利用表达的融合蛋白,利用GST亲和层析柱纯化了目的蛋白,纯化后的目的蛋白条带特异且无杂带,说明纯化后的蛋白纯度较好,可为后期在蛋白水平研究xa5基因的功能奠定基础。
参考文献
[1] Khush G S. What it will take to feed 5.0 billion rice consumers in 2030[J]. Plant Mol Biol, 2005,59(1):1-6.
[2] Mew T W. Current status and future prospects of research on bacterial blight of rice[J]. Annual Review of Phytopathology, 1987, 125(3):539-582.
[3] Wang C L, Fan Y L, Zheng C K, et al. High-resolution genetic mapping of rice bacterial blight resistance gene Xa23[J]. Molecular Genetics and Genomics, 2014, 289(5): 745-753.
[4] 陈小林,颜 群,高利军,等. 水稻白叶枯病抗性基因Xa21的分子生物学研究进展[J]. 生物技术通报,2014,30(1):8-14.
[5] 钟义明,江光怀,陈学伟,等. 水稻含隐性抗白叶枯病基因xa5的24kb片段的鉴定与基因预测[J]. 科学通报,2003,48(19):2 057-2 061.
[6] Blair M W, McCouch S R. Microsatellite and sequence-tagged site markers diagnostic for the rice bacterial leaf blight resistance gene xa-5[J]. Theoretical and Applied Genetics 1997, 95(1-2): 174-184.
[7] Jiang G H, Xia Z H, Zhou Y L, et al. Testifying the rice bacterial blight resistance gene xa5 by genetic complementation and further analyzing xa5 (Xa5) in comparison with its homolog TFIIAγ1[J]. Mol Genet Genomics, 2006, 275(4): 354-366.
[8] Iyer A S, McCouch S R. The rice bacterial blight resistance gene xa5 encodes a novel form of disease resistance[J]. Mol Plant-Microbe Interact, 2004, 17(7): 1 348-1 354.
[9] Iyer-Pascuzzi A S, Jiang H, Huang L, et al. Genetic and functional characterization of the rice bacterial blight disease resistance gene xa5[J]. Phytopathology, 2008, 98(3):289-295.
[10] Gu K Y, Tian D, Qiu C, et al. Transcription activator-like type III effector AvrXa27 depends on OsTFIIAγ5 for the activation of Xa27 transcription in rice that triggers disease resistance to Xanthomonas oryzae pv. oryzae[J]. Molecular Plant Pathology, 2009, 10(6):829-835.
[11] Xia L H, Bing X G, An X T, et al. Serum cystatin C assay for the detection of early renal impairment in diabetic patients[J]. Journal of Clinical Laboratory Analysis, 2004, 18(1):31-35.
[12] 李 波,倪志勇,李晓东,等. 棉花GhCOMT1基因原核表达载体构建及蛋白纯化和western[J]. 西北植物学报,2012,32(10):1 971-1 976.
[13] 杨安钢,刘新平,药立波. 生物化学与分子生物学实验技术[M]. 北京:高等教育出版社,2008:6.
[14] Gnidehou S, Gerbaud P, Ducarme G, et al. Expression in Escherichia coli and purification of human recombinant connexin-43, a fourpass transmembrane protein[J]. Protein Expr Purif, 2011, 78(2):174-180.
[15] 邓 治,杜 磊,李德军. 橡胶树肌动蛋白解聚因子原核表达及纯化[J]. 热带作物学报,2014,35(2):277-281.
[16] Fan L, Shi W J, Hu W R. Molecular and biochemical evidence for phenylpropanoid synthesis and presence of wall-link phenolics in cotton fibers[J]. Journal of Integrative Plant Biology, 2009, 51(7): 626-637.

