敲除OIP5-AS1基因通过miR-7-5p/PARP1轴增强非小细胞肺癌细胞的化学敏感性
靳彩玲,赵树鹏,姬颖华,王荦楠,杨 军,张清琴,牛红蕊
肺癌包括小细胞肺癌和非小细胞肺癌(non-small cell lung cancer, NSCLC),其中NSCLC是肺癌最常见的类型,占所有肺癌的80%~85%[1]。NSCLC治疗主要通过手术、化疗和放疗,约75%的NSCLC患者发现时已处于中晚期,5年生存率很低。OIP5-AS1属于肿瘤相关长链非编码RNA(long-chain non-coding RNA, lncRNA),在恶性肿瘤的演变中参与复杂的细胞机制[2]。OIP5-AS1已被证实是多种恶性肿瘤发生的重要调控因子[3]。然而,OIP5-AS1与miR-7-5p在肺癌中的相互作用尚未被提及和研究。因此,本实验探讨OIP5-AS1与miR-7-5p相互作用对NSCLC细胞化学敏感性的作用及分子机制,旨在为NSCLC的发病机制和治疗策略提供新的理论依据。
1 材料与方法
1.1 材料正常肺细胞系BEAS-2B、肺癌细胞系A549和顺铂耐药肺癌细胞A549/DDP购自美国ATCC公司;Lipofectamine 2000转染试剂购自赛默飞世儿科技公司;Dual-Luciferase Reporter Assay System购自美国普洛麦格公司;牛血清白蛋白、20×TBS、RT-qPCR/TaqMan One Step RT-qPCR Kit、PARP1抗体均购自北京索莱宝公司;RIPA裂解液购自上海源叶生物公司;Ki-67抗体购自武汉菲恩公司;PCNA鼠单抗、MDR1兔单抗、BCL-2鼠单抗、Bax兔单抗均购自美国CST公司;生物安全柜购自济南鑫贝西生物公司;生物显微镜购自日本奥林巴斯株式会社;恒温培养箱购自韩国DAIHAN公司;倒置荧光显微镜购自日本尼康株式会社;流式细胞仪购自常州必达科生物公司;凝胶成像系统购自美国Axygen公司。
1.2 方法
1.2.1细胞培养和转染 A549和A549/DDP细胞培养在(含10%FBS、1%青霉素链霉素和1 mmol/L丙酮酸钠)RPMI 1640培养基中。BEAS-2B细胞培养在(含10%FBS、1%青霉素链霉素和1 mmol/L丙酮酸钠)DMEM(高糖)培养基中。此外,将A549/DDP细胞培养在含2 mg/L顺铂的培养基中,以保留耐药表型[4]。将BEAS-2B、A549和A549/DDP细胞置入37 ℃、5%CO2的恒温培养箱中培养。100 mm培养皿中细胞密度为1 107个细胞时最佳。48~72 h后换液,进行细胞的传代,取对数期生长旺盛的细胞进行后续的试验。转染时,A549/DDP细胞密度融合70%~80%时效果最佳。根据Lipofectamine 2000转染试剂说明书进行A549/DDP细胞的转染。
1.2.2CCK-8 检测正常肺细胞系BEAS-2B、肺癌细胞系A549和顺铂耐药肺癌细胞A549/DDP的IC50值将BEAS-2B、A549和A549/DDP细胞分别接种于96孔板(1×105/孔),每组至少设置6个复孔。37 ℃恒温培养箱孵育,每孔加入10 μL CCK-8(0.5 mg/mL),培养4 h。培养结束后,在酶标仪上测定波长在450 nm处各孔细胞的光密度值。
1.2.3RT-qPCR检测OIP5-AS1、miR-7-5p和PARP1的表达水平 转染后24 h内收集细胞,加入Trizol试剂提取正常肺细胞系BEAS-2B,肺癌细胞系A549和顺铂耐药肺癌细胞A549/DDP中的总RNA。按照TaqMan One Step RT-qPCR Kit说明书将总RNA逆转录为cDNA,再进行qPCR。检测OIP5-AS1和miR-7-5p、PARP1表达水平的RNA。根据每个基因序列利用Primer Premier 6.0设计引物。根据荧光定量,计算所有样品和标准品的循环阈值(cycle threshold, Ct)。基于该标准的Ct值,绘制标准曲线,然后使用2-ΔΔCt方法进行定量计算。
1.2.4双荧光素酶报告分析 使用生物信息学软件StarBase和TargetScan对OIP5-AS1、miR-7-5p和PARP1的靶向关系进行预测。用Dual-Luciferase Reporter Assay System进一步验证靶向关系。用PCR扩增含有miR-7-5p结合位点的OIP5-AS1基因的3′UTR序列。将OIP5-AS1的3′UTR克隆到pMIR-REPORT荧光素酶载体pMIR-OIP5-AS1-wild type中。通过PCR扩增OIP5-AS1 3′UTR结合位点的突变,克隆到pMIR-OIP5-AS1-mutant质粒中。根据Lipofectamine 2000转染试剂说明书将miR模拟物(miR-7 mimic)和荧光素酶质粒pMIR-OIP5-AS1(野生型/突变型,WT/MUT)转染到A549/DDP细胞中。转染48 h后,弃去旧培养基,用PBS清洗细胞2次。随后,在每孔细胞中加入100 μL裂解缓冲液(passive lysis buffer, PLB),室温下轻轻震荡15 min,收集细胞裂解液。取20 μL PLB加入发光板中,用GloMax生物发光检测仪读取背景值2 s,每个样品加入100 μL LAR Ⅱ 工作液,快速混匀,读值2 s。读值完毕后,每个样品再加入100 μL Stop&Gl Reagent,快速混匀后,放入发光板中检测,读值2 s。荧光显微镜开启或关闭30 min以内不可关闭或开启。
1.2.5克隆形成检测 A549/DDP细胞的生长转染pLenti-CMV-PARP1于A549/DDP细胞,用克隆形成分别检测敲除OIP5-AS1和PARP1过表达后A549/DDP细胞的生长情况。以200个细胞/皿的速度接种于60 mm培养皿中。敲除OIP5-AS1后将A549/DDP细胞分为4组:对照组(Control组)、sh-OIP5-AS1组、miR-7-5p inhibitor组、sh-OIP5-AS+inhibitor组。PARP1过表达后将A549/DDP细胞分为4组:对照组(A549/DDP)、sh-OIP5-AS1组、pLenti-CMV-PARP1组、sh-OIP5-AS1+PARP1组。处理24 h后,用新鲜培养基代替旧培养基。细胞经Giemsa染色后培养14天,计数含>50个细胞的菌落。确定细胞生长情况。
1.2.6Western blot法 采用Western blot法检测A549/DDP细胞中Ki-67、PCNA、MDR1、BCL-2、Bax和PARP1的表达水平。用预冷的PBS洗涤A549/DDP细胞2次,在RIPA裂解液中裂解。细胞裂解液以12 000g离心15 min。通过Bradford法测定蛋白质含量。用由1%聚丙烯酰胺溶解凝胶和8%堆积凝胶组成的不连续系统电泳分级分离蛋白质样品(100 g),然后转移至硝酸纤维素膜(KALANG)。以100 V和250 mA(电流常数)通电70 min。洗膜,用5%BSA在TBS中封膜1 h。加入一抗Ki-67(1 ∶2 000)、PCNA(1 ∶2 000)、MDR1(1 ∶3 000)、BCL-2(1 ∶1 000)、Bax(1 ∶1 000)和PARP1(1 ∶1 000)4 ℃孵育过夜。加入二抗室温下孵育2 h。用化学发光剂观察条带。通过酶联免疫斑点图像分析仪分析在硝酸纤维素膜上捕获的信号来确定各蛋白的表达水平。试验中的蛋白表达水平相对于GAPDH表示。
1.2.7流式细胞术检测细胞凋亡情况 收集对照组(A549/DDP)、sh-OIP5-AS1、pLenti-CMV-PARP1和sh-OIP5-AS1+PARP1组中A549/DDP细胞,在500 μL结合缓冲液中重悬复苏。每个样品中分别加入200 μL的Annexin V-FITC和PI(10 μg/mL),在室温中避光孵育15 min。通过流式细胞仪检测A549/DDP细胞凋亡情况。
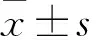
2 结果
2.1 A549/DDP细胞中OIP5-AS1、miR-7-5p、PARP1的表达CCK-8实验结果显示,与BEAS-2B细胞相比,A549细胞IC50值明显增加(P<0.05,图1),A549/DDP细胞IC50值显著增加(P<0.01)。RT-qPCR检测显示,与BEAS-2B细胞相比,A549细胞OIP5-AS1、PARP1表达显著升高(P<0.05,图2),miR-7-5p表达显著降低(P<0.05);A549/DDP细胞OIP5-AS1、PARP1表达极显著升高(P<0.01),miR-7-5p表达极显著降低(P<0.01)。本实验选择A549/DDP细胞进行后续试验。
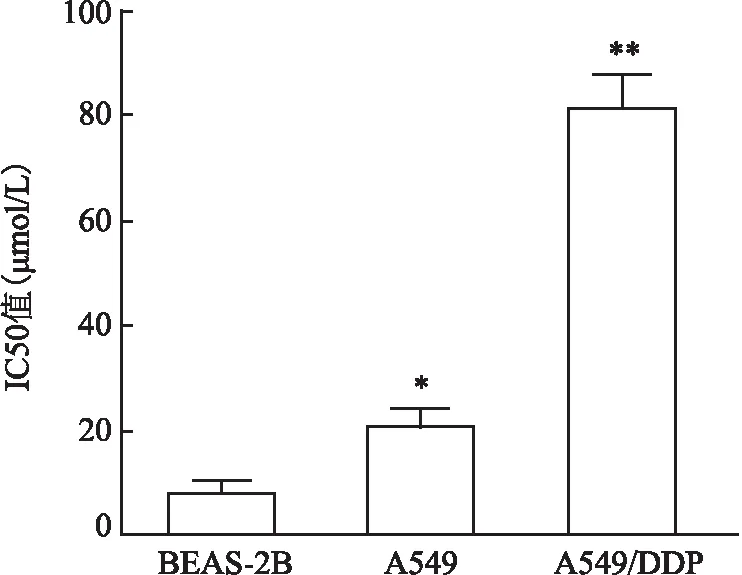
图1 BEAS-2B、A549和A549/DDP细胞中IC50值:与BEAS-2B细胞相比,*P<0.05,**P<0.01

图2 RT-qPCR检测BEAS-2B、A549和A549/DDP细胞中OIP5-AS1、miR-7-5p、PARP1的表达:与BEAS-2B细胞相比,*P<0.05,**P<0.01
2.2 OIP5-AS1和miR-7-5p的靶向关系通过生物信息学软件StarBase对OIP5-AS1和miR-7-5p的靶向关系进行预测。结果发现,在has-miR-7-5p区域存在lncRNA OIP5-AS1的潜在结合位点(图3),说明miR-7-5p是OIP5-AS1的靶向调节基因之一。RT-qPCR检测敲除OIP5-AS1后A549/DDP细胞中miR-7-5p的表达水平:与对照组相比,sh-OIP5-AS1组miR-7-5p表达显著增加(P<0.01,图4),miR-7-5p inhibitor组miR-7-5p表达显著降低(P<0.05);与miR-7-5p inhibitor组相比,sh-OIP5-AS1+inhibitor组miR-7-5p表达明显增加(P<0.05)。用RT-qPCR检测过表达OIP5-AS1后A549/DDP细胞中miR-7-5p的表达水平:与对照组相比,Ad-OIP5-AS1组miR-7-5p表达明显降低(P<0.05,图5),miR-7-5p mimic组miR-7-5p表达显著增加(P<0.01);与miR-7-5p mimic组相比,Ad-OIP5-AS1+mimic组miR-7-5p表达显著降低(P<0.05)。双荧光素酶报告验证OIP5-AS1和miR-7-5p的靶向关系,过表达miR-7-5p后OIP5-AS1-WT组的荧光素酶活性明显低于OIP5-AS1-MUT组(图6),证明OIP5-AS1和miR-7-5p之间确实存在着靶向关系,且miR-7-5p受OIP5-AS1的负调控作用。

图3 OIP5-AS1与miR-7-5p结合区域及突变区域

图4 RT-qPCR检测敲除OIP5-AS1后A549/DDP细胞中miR-7-5p的表达水平:与Control组相比,*P<0.05,**P<0.01;与miR-7-5p inhibitor组相比,#P<0.05
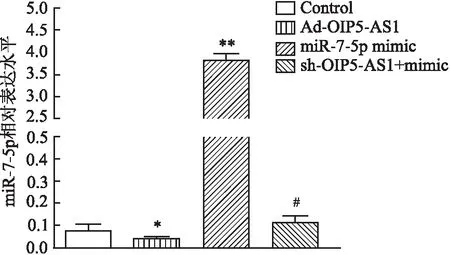
图5 RT-qPCR检测过表达OIP5-AS1后A549/DDP细胞中miR-7-5p的表达水平:与Control组相比,*P<0.05,**P<0.01;与miR-7-5p mimic组相比,#P<0.05
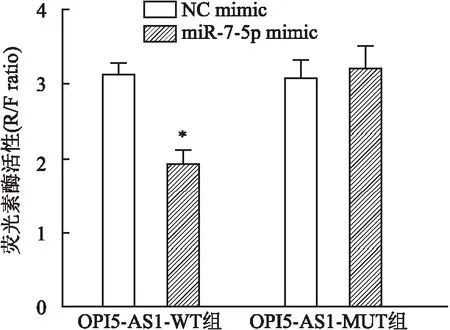
图6 双荧光素酶报告验证OIP5-AS1和miR-7-5p的靶向关系
2.3 敲除OIP5-AS1对A549/DDP细胞IC50值的影响CCK-8实验结果显示,与Control组相比,sh-OIP5-AS1组A549/DDP细胞IC50值明显降低(P<0.05,图7),miR-7-5p inhibitor组A549/DDP细胞IC50值明显增加(P<0.05)。与miR-7-5p inhibitor组相比,sh-OIP5-AS1+inhibitor组A549/DDP细胞IC50值显著降低(P<0.05)。
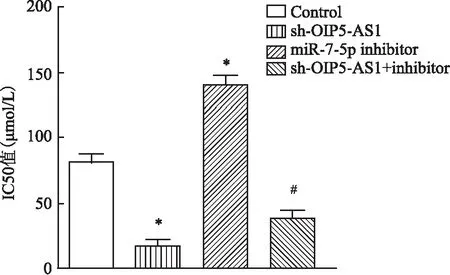
图7 CCK-8法检测敲除OIP5-AS1后A549/DDP细胞IC50值:与Control组相比,*P<0.05,**P<0.01;与miR-7-5p inhibitor组相比,#P<0.05
2.4 敲除OIP5-AS1对A549/DDP细胞生长的影响克隆形成分析实验发现,与Control组相比,sh-OIP5-AS1组A549/DDP细胞生长明显减少(P<0.05,图8),miR-7-5p inhibitor组A549/DDP细胞生长明显增加(P<0.05)。与miR-7-5p inhibitor组相比,sh-OIP5-AS1+inhibitor组A549/DDP细胞生长明显减少(P<0.05)。
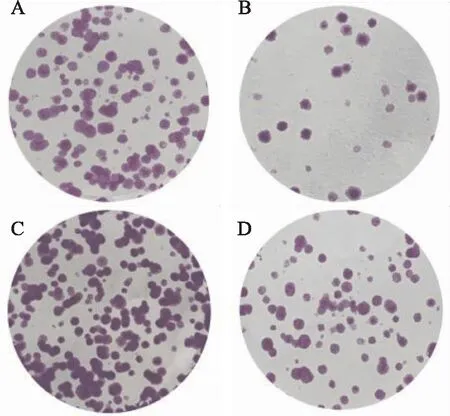
图8 克隆形成检测敲除OIP5-AS1后A549/DDP细胞生长:A.Control组;B.sh-OIP5-AS1组;C.miR-7-5p inhibitor组;D.sh-OIP5-AS1+inhibitor组
2.5 敲除OIP5-AS1后Ki-67、PCNA、MDR1蛋白表达Western blot分析显示,与Control组相比,sh-OIP5-AS1组Ki-67、PCNA、MDR1表达明显降低(P<0.05,图9),miR-7-5p inhibitor组Ki-67、PCNA、MDR1表达明显增加(P<0.05)。与miR-7-5p inhibitor组相比,sh-OIP5-AS1+inhibitor组Ki-67、PCNA、MDR1表达明显降低(P<0.05)。

图9 Western blot法检测敲除OIP5-AS1后A549/DDP细胞Ki-67、PCNA、MDR1蛋白表达
2.6 敲除OIP5-AS1对A549/DDP细胞凋亡的影响利用流式细胞术分析显示,与Control组相比,sh-OIP5-AS1组细胞凋亡率明显升高(P<0.05,图10),miR-7-5p inhibitor组细胞凋亡率明显降低(P<0.05)。与miR-7-5p inhibitor组相比,sh-OIP5-AS1+inhibitor组细胞凋亡率明显升高(P<0.05)。
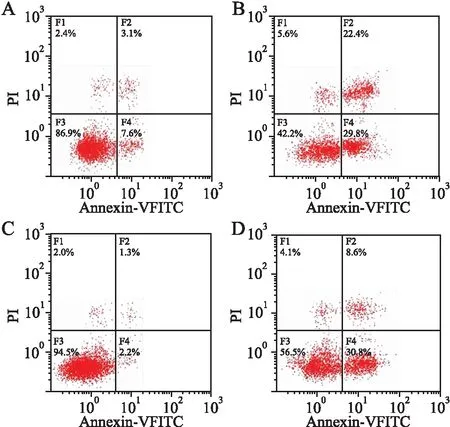
图10 敲除OIP5-AS1促进A549/DDP细胞凋亡:A.Control组;B.sh-OIP5-AS1组;C.miR-7-5p inhibitor组;D.sh-OIP5-AS1+inhibitor组
2.7 敲除OIP5-AS1后Bax、BCL-2蛋白表达Western blot分析显示,与Control组相比,sh-OIP5-AS1组BCL-2表达明显降低(P<0.05,图11),Bax表达明显增加(P<0.05),miR-7-5p inhibitor组A549/DDP细胞中BCL-2表达明显增加(P<0.05),Bax表达明显降低(P<0.05)。与miR-7-5p inhibitor组相比,sh-OIP5-AS1+inhibitor组BCL-2表达明显降低(P<0.05),Bax表达明显增加(P<0.05)。

图11 Western blot法检测敲除OIP5-AS1后A549/DDP细胞Bax、BCL-2蛋白表达
2.8 敲除OIP5-AS1调节miR-7-5p/PARP1轴增强A549/DDP细胞的化学敏感性通过生物信息学软件TargetScan分析预测结果显示,PARP1 3′UTR的685~692 bp区域存在has-miR-7-5p的潜在结合位点,故PARP1是miR-7-5p的靶向调节基因之一(图12);转染pLenti-CMV-PARP1于A549/DDP细胞,利用Western blot检测Control组、sh-OIP5-AS1组、pLenti-CMV-PARP1组和sh-OIP5-AS1+PARP1组中PARP1、Ki-67、MDR1和BCL-2的表达水平。与Control组相比,sh-OIP5-AS1组中PARP1、Ki-67、MDR1、BCL-2表达明显降低(P<0.05,图13),pLenti-CMV-PARP1组PARP1、Ki-67、MDR1、BCL-2表达明显增加(P<0.05);与pLenti-CMV-PARP1组相比,sh-OIP5-AS1+PARP1组PARP1、Ki-67、MDR1、BCL-2表达明显降低(P<0.05)。用克隆形成分析检测A549/DDP细胞的生长,流式细胞术检测细胞的凋亡。与Control组相比,sh-OIP5-AS1组中细胞凋亡率明显升高(P<0.05,图14),细胞生长明显减少(P<0.05,图15);pLenti-CMV-PARP1组细胞凋亡率明显降低(P<0.05),细胞生长明显增加(P<0.05)。与pLenti-CMV-PARP1组相比,sh-OIP5-AS1+PARP1组细胞凋亡率明显升高(P<0.05),细胞生长明显减少(P<0.05)。
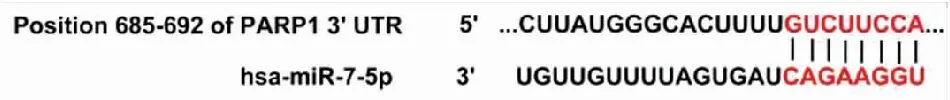
图12 PARP1与miR-7-5p结合区域及突变区域
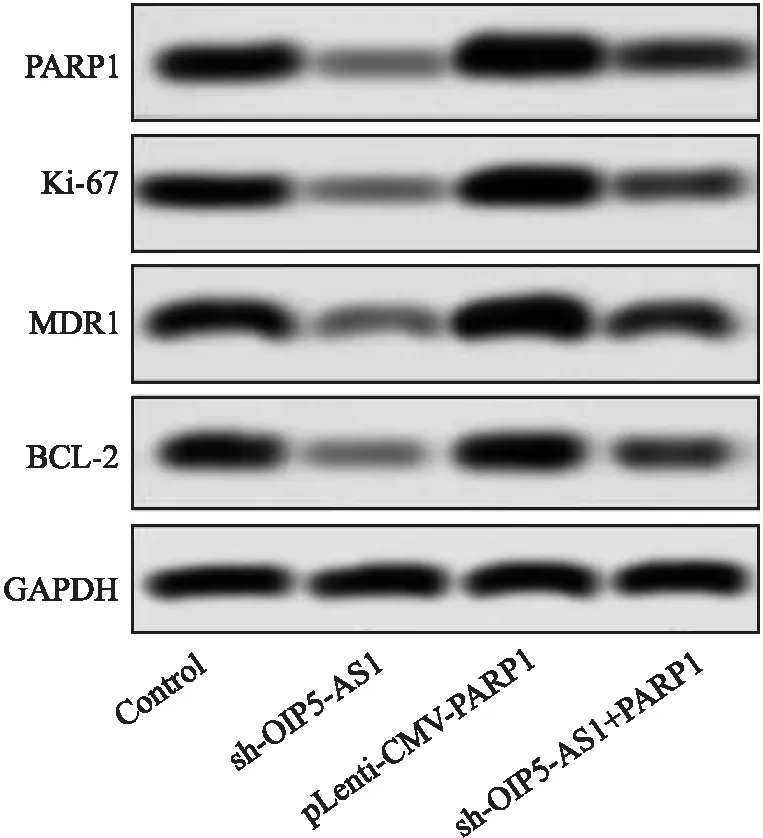
图13 Western blot法检测PARP1、Ki-67、MDR1、BCL-2蛋白表达
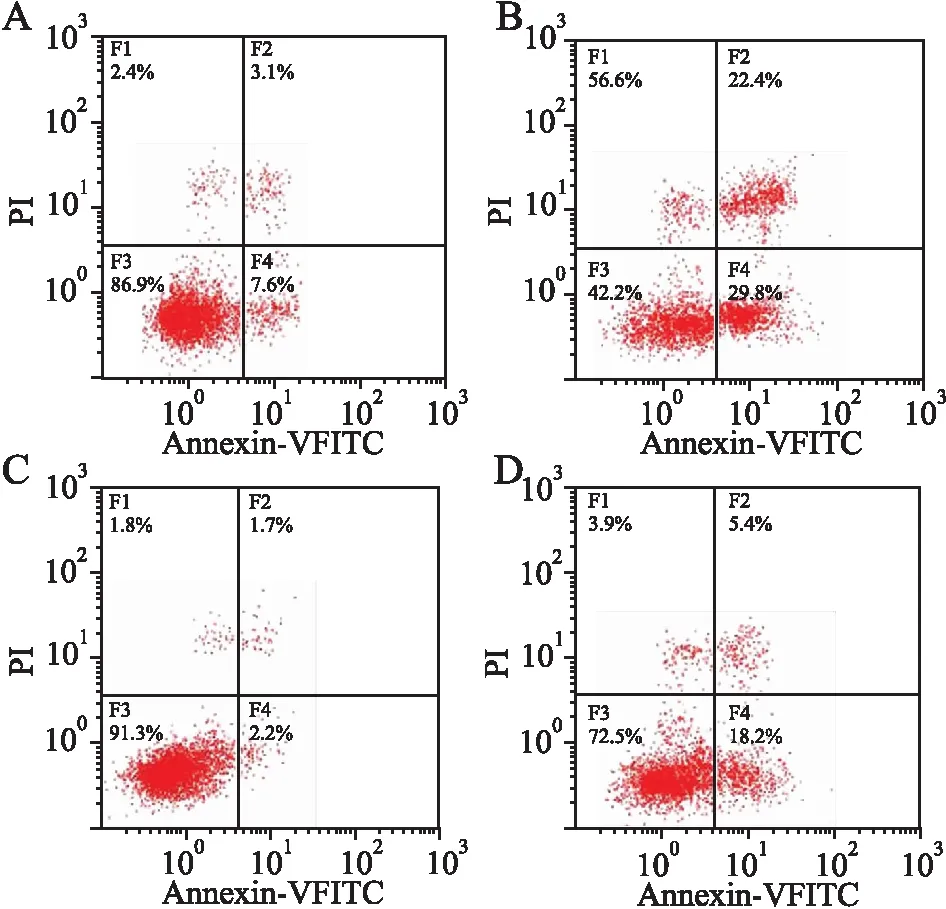
图14 流式细胞术检测细胞凋亡:A.Control组;B.sh-OIP5-AS1组;C.pLenti-CMV-PARP1组;D.sh-OIP5-AS1+PARP1组

图15 克隆形成检测细胞生长:A.Control组;B.sh-OIP5-AS1组;C.pLenti-CMV-PARP1组;D.sh-OIP5-AS1+PARP1组
3 讨论
肺癌是男性预后较差的癌症之一[4],以腺癌和鳞癌为主要亚型,NSCLC为主要的组织病理学亚型。研究发现,FOXD2-AS1/miR185-5p通过增强顺铂耐药癌细胞的化学敏感性,抑制NSCLC[5]。lncRNA TUG1通过削弱miR-221依赖的PTEN,增强NSCLC的化学敏感性[6]。本实验通过增强化学敏感性来探究lncRNA和miRNA相互作用对NSCLC的作用和分子机制。本实验检测了顺铂对正常肺细胞系BEAS-2B、肺癌细胞系A549和顺铂耐药肺癌细胞A549/DDP的IC50值。结果发现,顺铂对A549/DDP细胞的毒性作用远远小于BEAS-2B和A549。因此,本实验利用A549/DDP细胞进行后续试验。此外,A549/DDP细胞中OIP5-AS1高表达,miR-7-5p低表达。表明OIP5-AS1和miR-7-5p可能参与A549/DDP细胞对顺铂的耐药性。
lcnRNA调控基因表达程序,影响特定的细胞过程。lcnRNA形成一组核酸,参与多种不同的细胞机制,包括增殖、分化、凋亡和衰老[2]。lcnRNA OIP5-AS1抑制GAK表达控制有丝分裂。lcnRNA OIP5-AS1为NSCLC的生物标志物。OIP5-AS1可靶向多种miRNA来调节肺癌的发生。Wang等[7]发现,OIP5-AS1通过靶向miR-378a-3p促进肺癌细胞增殖,导致预后不良。本实验利用RT-qPCR检测BEAS-2B、A549和A549/DDP细胞中OIP5-AS1的表达水平,结果显示,A549/DDP细胞中OIP5-AS1高表达;且敲除OIP5-AS1后,A549/DDP细胞生长被抑制,化学敏感性增强,A549/DDP细胞凋亡增加。
microRNAs(miRNAs)是单链非编码、长度在20~25个核苷酸之间的RNA,在真核生物中广泛表达。不同的miRNA根据其特定的表达模式、靶基因表达或细胞环境,能够同时作为癌基因和抑癌基因发挥作用[8]。miRNA是肿瘤进展的关键调控因子,研究发现,miR-7-5p通过靶向PAK2,诱导NSCLC细胞生长抑制、细胞周期阻滞和凋亡[9]。miR-7-5p可以有效治疗NSCLC产生的细胞学效应[10]。本实验利用RT-qPCR检测BEAS-2B、A549和A549/DDP细胞中miR-7-5p的表达水平,并通过生物信息学软件预测了miR-7-5p的潜在靶标。结果显示,A549/DDP细胞中miR-7-5p低表达。miR-7-5p是OIP5-AS1的靶向调节基因之一,且两者之间为负相关调控。
PARP1在癌症的临床治疗中,被认为是通过抑制PARP1聚合酶和捕获PARP1-DNA来发挥其细胞毒性[11]。PARP1在软组织肉瘤中被认为是潜在的治疗靶点[12]。研究发现,通过抑制PARP1表达可以缓解顺铂抗癌治疗的副作用[13]。花生黄酮作为一种强效高选择性PARP1抑制剂,能够增强NSCLC的抗癌作用[14]。PARP1在NSCLC组织中被微囊藻毒素上调,抑制癌细胞增殖[15]。miR-7-5p介导的PARP1下调影响小细胞肺癌DNA同源重组的修复和对阿霉素的耐药性[16]。同样地,本实验通过生物信息学软件TargetScan对miR-7-5p和PARP1的靶向关系进行预测,结果显示,PARP1是miR-7-5p的靶向调节基因之一,且两者之间为负向调控关系。下调PARP1可以增强A549/DDP细胞的化学敏感性,抑制NSCLC。
本实验结果表明,lncRNA OIP5-AS1通过上调miR-7-5p或下调PARP1,增强A549/DDP细胞的化学敏感性,抑制NSCLC。

