中国部分地区鸡传染性贫血流行病学调查及病原分离鉴定
李 岳,闫娜娜,刘爱晶,兰兴鸽,杨 搏,刘长军,高玉龙,高宏雷,祁小乐,崔红玉,高 立,李 凯,潘 青,王永强,张艳萍,王笑梅
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/禽传染病研究室,黑龙江 哈尔滨 150069)
鸡传染性贫血病毒(Chicken infectious anemia virus,CAV)是圆环病毒科环状病毒属的成员之一,引起2~4 周龄鸡群发生传染性贫血综合征(CIA)[1]。CAV 无囊膜,病毒颗粒呈20 面体对称,平均直径为25 nm~26.5 nm。CAV 的基因组为单股负链环状DNA,大小为2 298 bp 或2 319 bp,编码3 种病毒蛋白(VP1、VP2 和VP3),其中VP1 为病毒主要结构蛋白,是病毒编码的3 个蛋白中变异率最大的蛋白,其高变区位于aa139~aa151;VP2 为非结构蛋白,是CAV 最保守的蛋白,具有双重特异性蛋白磷酸酶活性;VP3 又称为凋亡素,诱导肿瘤细胞凋亡。
自1979 年Yuasa 等在日本首次分离到CAV(Gifu-1 株)[2],随后英国、美国、澳大利亚等均有该病的报道,目前,该病呈全球性流行,给养禽业带来了严重的经济损失。我国于1992 年首次分离并报道了该病毒[3],随后,广西、江苏、山东、广东等地也陆续报道了该病的流行[4-7]。目前,CAV 只有一个血清型,但是不同地区CAV 分离株之间序列存在差异,毒力也有所不同[8-9]。为了解近年来CAV 在我国规模化养鸡场的流行情况,2016 年1 月~2019 年9月,对黑龙江、北京、山东等13 个省市疑似CAV阳性鸡场进行PCR 检测,并于MDCC-MSB 1 细胞中分离得到1 株CAV,并对分离株VP1 基因进行了序列分析。
1 材料与方法
1.1 病料样品来源和细胞2016 年1 月~2019 年9月,从山东(30 个)、内蒙古(18 个)、湖南(8 个)、北京(22 个)、江苏(16 个)、黑龙江(121 个)、辽宁(49 个)、甘肃(4 个)、宁夏(3 个)、吉林(71 个)、广西(15 个)、河南(16 个)和安徽(8 个)等13 个省市疑似发病的381 个鸡群中采集肝脏病料样品共1 677 份,病料样品于-20 ℃保存备用。鸡马立克氏病脾淋巴瘤继代细胞系(MDCC-MSB 1 细胞)由本实验室保存。
1.2 主要试剂1640 细胞培养基、FITC 标记的兔抗鼠IgG 购自Sigma 公司;胎牛血清购自Gibco 公司;Primer Star 高保真DNA 聚合酶、Ex TaqDNA 聚合酶、pMD18-T 载体、DL2000 Marker 均购自宝生物工程(大连)有限公司;DNA 提取试剂盒购自AxyGen公司;质粒pCAGGs-VP1 及CAV VP3 单克隆抗体(BC11)由本实验制备与保存。
1.3 引物设计与合成根据CAV 参考株Cux-1 基因组序列(M55918.1),设计合成引物CAV VP1R/F,用于扩增CAV VP1 基因。参照文献分别合成CAV[10]、鸡马立克氏病病毒(MDV)[10]、网状内皮组织增生症病毒(REV)[10]、禽白血病病毒(ALV)[10]及禽腺病毒(FADV)[11](表1)。上述引物均由吉林库美生物科技股份有限公司合成。

表1 实验用引物序列Table 1 Sequences of the primers used in the present study
1.4 病料样品中CAV 的检测无菌取发病鸡肝脏,加入1 mL PBS,利用高通量组织研磨仪研磨破碎,震荡研磨两次,获得组织匀浆液后6000 r/min离心5 min,取200 μL 上清,利用DNA 提取试剂盒提取病毒DNA,利用引物CAVR/F 进行PCR 检测。统计2016 年1 月~2019 年9 月来自疑似发病的381 个鸡群1 677 份肝脏样品中的CAV 阳性样品数量及阳性鸡群数量。
1.5 病料样品中其它免疫抑制病的检测取经检测为CAV 阳性的病料样品DNA,采用MDV、REV、ALV 及FADV 特异性引物(MDVR/F、REVR/F、ALVR/F 及FADV R/F)分别进行PCR 检测。统计分析CIA 与其它免疫抑制病混合感染情况。
1.6 病毒分离与鉴定
1.6.1 病毒分离 取来自山东临沂某CAV 阳性鸡场采集的肝脏样品研磨上清,70 ℃金属浴加热5 min去除外源囊膜病毒,6000 r/min 离心5 min,取上清经0.22 μm 滤器过滤除菌,接种MDCC-MSB 1 细胞,37 ℃、5% CO2条件下培养3 d。收获接毒细胞,反复冻融3 次,2000 r/min 离心3 min,收集上清,按25%比例接种MDCC-MSB 1 细胞,连续传代6 次,反复冻融后收集上清储存于-80 ℃冰箱备用。1.6.2 PCR 鉴定 取1.6.1 分离获得的病毒液200 μL,提取病毒DNA后,利用引物CAV R/F进行PCR检测。
1.6.3 间接免疫荧光(IFA)鉴定 取第6 代病毒液接种MDCC-MSB 1 细胞,于37 ℃、5%CO2条件下培养3 d 后,采用预冷的95%酒精固定于48 孔板,以CAV VP3 MAb BC11(1∶400)为一抗,FITC 标记的兔抗鼠IgG(1∶200)为二抗进行IFA 鉴定。
1.6.4 分离病毒的VP1 基因克隆、测序及序列分析取1.6.2 病毒DNA 为模板,利用引物CAV VP1R/F 扩增CAV VP1 基因,回收PCR 产物并克隆至pMD18-T载体,转化DH5α 感受态细胞,选取3 个菌液PCR鉴定为阳性的单克隆,由吉林库美生物科技股份有限公司测序。采用DNAStar 软件对分离病毒株VP1基因及GenBank 中19 株参考株VP1 基因进行序列比对及分析,采用MEGA 6.0.软件绘制遗传进化树。
2 结 果
2.1 病料样品中CAV 的检测结果对采集的1 677份疑似CIA 阳性肝脏病料样品进行PCR 检测。结果显示,CAV 阳性肝脏病料样品242 份,平均阳性率为14.43%(242/1677),鸡群阳性率达到22.31%(85/381);各年样品CAV 阳性率5.36%~16.54%,鸡群阳性率12.50%~25.69%(表2)。
对13 个省市中疑似发病的381 个鸡群进行调查,结果发现,CAV 感染普遍存在于调查的13 个省市中,鸡群阳性率12.50%~50%。其中,黑龙江省为调查鸡群数目最多的省份,共有121 个疑似CAV 发病鸡群,阳性率为24.79%(表3)。
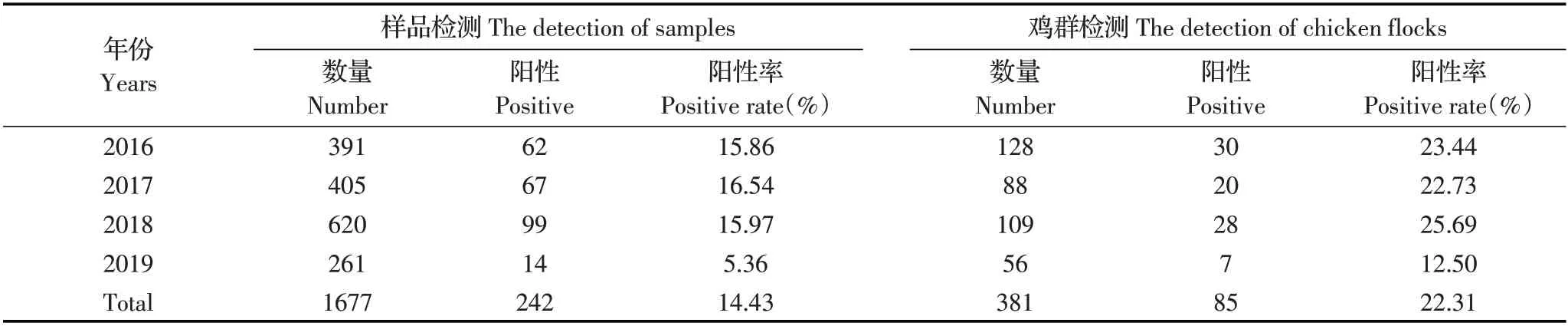
表2 2016 年1 月~2019 年9 月我国部分 地区CAV 的检测结果Table 2 CAV detection in some areas of China during January 2016-September 2019

表3 2016 年1 月~2019 年9 月我国部分地区CAV 阳性鸡群的分布Table 3 The distribution of CAV-positive flocks in some areas of China during January 2016-September 2019
2.2 病料样品中其它免疫抑制病病毒检测结果取经检测为CAV 阳性的病料样品DNA,进行CAV 与其它免疫抑制病病毒混合感染情况检测,结果显示,2016 年1 月~2019 年9 月,单独感染CAV 鸡群比率为47.06%(40/85),与其它免疫抑制病病毒混合感染率为52.94%(45/85)。混感类型包括CAV 与MDV、CAV 与ALV、CAV 与REV 双重感染,CAV、MDV 与ALV 三重感染,CAV、MDV、REV 与ALV四重感染等,其中,CAV 与MDV 双重感染占混合感染的比例为61%(图1)。表明CAV 与其他免疫抑制病病毒混合感染在调查鸡场中普遍存在,并且CAV 与MDV 双重感染为最主要的混合感染类型。

图1 调查鸡群中CAV 及其他免疫抑制病病毒混合感染的检测结果Fig.1 Detection of CAV and other immunosuppressive diseases in chicken flocks
2.3 病毒分离株的鉴定结果
2.3.1 PCR鉴定 将PCR检测为阳性的来自山东临沂某CAV 阳性鸡场的1份肝脏处理液接种MDCC-MSB 1细胞,连续传代6 次后,提取其细胞培养物上清DNA,采用引物CAV F/R 进行PCR 扩增。结果显示在约600 bp 获得与阳性对照(pCAGGs-VP1)一致的条带(图2),初步表明从山东临沂某CAV 阳性鸡场的肝脏病料样品中分离到1 株CAV。
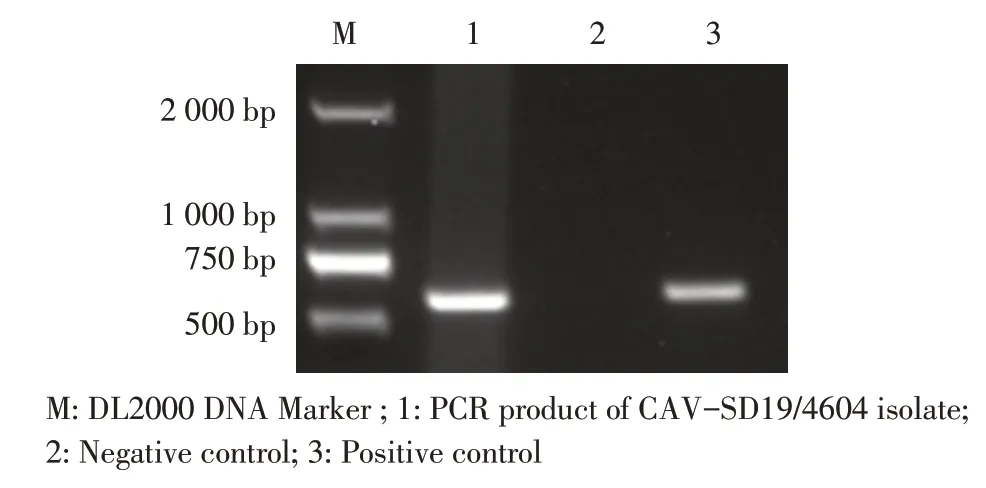
图2 CAV-SD19/4604 分离株PCR 检测Fig.2 PCR detection of CAV-SD19/4604 isolate
2.3.2 分离株IFA 鉴定结果 将收获的P6 代病毒液接种MDCC-MSB 1,利用IFA 对分离病毒株作进一步鉴定,同时以空白细胞为对照。结果显示,接种P6 代病毒液的细胞出现明显的绿色荧光(图3A),而空白细胞未见荧光(图3B),进一步证明分离到1株CAV,命名为CAV-SD19/4604。

图3 IFA 鉴定分离株CAV-SD19/4604Fig.3 IFA identification of CAV-SD19/4604 isolate
2.4 分离株VP1 同源性及遗传进化分析利用引物CAV VP1R/F PCR 扩增分离病毒株CAV-SD19/4604的VP1 基因,获得1 400 bp 左右目的片段,将目的片段克隆至pMD18-T 中测序。序列分析表明,分离病毒株CAV-SD19/4604 VP1 基因全长为1 350 bp,无基因缺失及插入,并将其上传至GenBank。与Gen-Bank 中登录的19 株CAV 参考株的VP1 基因序列作同源性分析,结果显示分离病毒株VP1 基因与19株参考株VP1 基因的同源性为95.00%~98.80%。对分离株及参考株的VP1 基因绘制遗传进化树,结果显示,CAV-SD19/4604 及参考株VP1 基因可分为Ⅰ、Ⅱ两群,分离株CAV-SD19/46049(MN746999)位于Ⅰ群,并且与C369(AB046590)、HN9(DQ141672)、GD101(KU050680)、GD104(KU050679)、CIA89-69(JF507715)等亚洲病毒株位于同一分支(图4),表明分离病毒株与亚洲流行病毒株亲缘关系较近。
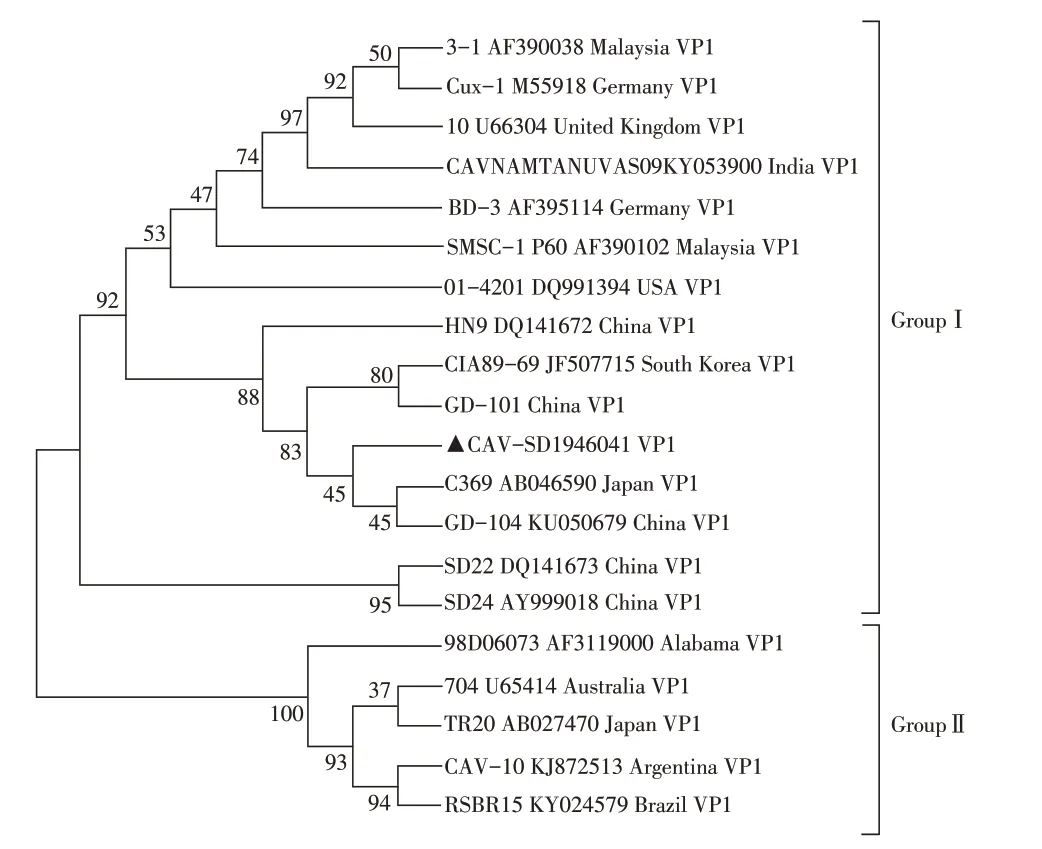
图4 CAV-SD19/4604 分离株VP1 基因的进化树Fig.4 Phylogenetic tree based on VP1 gene of the isolate CAV-SD19/4604
3 讨 论
CAV 主要攻击鸡的T 细胞以及骨髓中的成血细胞,是引起鸡群发生免疫抑制病的主要病原之一[12]。我国于1992 年由崔现兰等首次分离报道该病毒后,广西、安徽、山东等地也相继发现了该病的流行。2016 年1 月~2019 年9 月,本研究对13 个 省市的疑似发病鸡群开展调查,发现了较高的CAV 阳性鸡群(22.31%),调查结果显示CAV 感染普遍存在于我国13 个省市的规模化养殖场,鸡群中有不同程度的CAV 感染;2016 年1 月~2019 年9 月鸡群CAV阳性率在12.50%~25.69%,表明近年来CAV 感染在我国呈现稳定趋势,但并未暴发CIA 疫情。对越南北部10 个省份的64 个鸡群进行检测,CAV 普遍存在于检测省份中并且阳性鸡群检出率达到73.4%[13]。伊朗全国范围内普遍存在CAV,鸡群阳性率58.4%[14]。CAV 与MDV、REV 或ALV 等免疫抑制病病毒的混合感染,可使CAV 的致病性增强,鸡群病症加剧,死亡增加;这可能是引发目前我国部分地区鸡群多种疾病暴发,使养鸡业的疫病更加复杂和严重的主要原因之一[15]。对2016 年1 月~2019 年9 月鸡群中CAV及其他免疫抑制病病毒检测结果显示,CAV 混合感染其他免疫抑制病病毒为主要感染类型,占据CAV感染总量的52.94%;值得注意的是,调查的85 个CAV 阳性鸡群中,共检测出26 个鸡群(57.78%)为MDV 阳性,但是CAV 与其他免疫抑制病病毒混合感染比例不高,表明在本次调查中,CAV 与MDV 混合感染为最常见的混感类型,鸡群中MD 的免疫失败可能与CAV 早期感染有关[16]。
CAV 可以在T 细胞系MDCC-MSB 1 细 胞、1 日龄鸡或鸡胚中增殖。本研究用来自山东临沂某CAV 阳性鸡场的肝脏病料样品接种MDCC-MSB 1 细胞,传代6 次收集病毒液,经PCR 及IFA 鉴定获得1 株CAV 细胞适应毒,命名为CAV-SD19/4604。对其VP1 基因与GenBank 中19 株参考株VP1 基因进行同源性分析发现,分离病毒株与中国分离株GD104 亲缘关系最近,同源性为98.80%。同时,采用MEGA对分离株及其他病毒株绘制遗传进化树,结果显示,CAV-SD19/4604 与大多数亚洲分离株位于同一分支,具备亚洲流行株的特征。据报道,VP1 蛋白的394 位氨基酸是主要的毒力决定位点,若394 位为谷氨酰胺(Q),则具备高致病性病毒株特征,相对应的,若病毒株394 位氨基酸为组氨酸(H),则为低致病性病毒株[17]。在本研究中,分离株CAVSD19/4604 VP1 蛋白394 氨基酸为谷氨酰胺(Q),具备高致病性病毒株特征。Renshaw 等人研究发现,VP1 蛋白139 及144 位氨基酸影响着病毒增殖及传播能力[18],分离株VP1 蛋白的139 位氨基酸为赖氨酸(K),144 位氨基酸为谷氨酸(E),CAV-SD19/4604可以在易感细胞MDCC-MSB 1 中正常增殖传播。
本研究调查了我国部分地区CAV 感染情况,CAV 普遍存在于调查鸡群中并且与多种免疫抑制病病病毒混合感染,使鸡群处于免疫抑制状态,增加了鸡群对其他病原体的易感性及免疫失败的风险。因此,加强CAV 流行情况的监测,剔除CAV 阳性鸡群对我国养鸡业健康发展具有重大意义。

