采用“一测多评”法测定含绿原酸中药及制剂中绿原酸类成分的含量
张秋燕 张妮 张春礼 郭文全 崔翰明
[摘要] 目的 建立含綠原酸成分的中药及其制剂中所含的6种绿原酸“一测多评”(QAMS)的分析方法。 方法 以乙腈-0.4%磷酸为流动相梯度洗脱、柱温为25℃、流速为1.0 mL/min、检测波长为327 nm的高效液相色谱-二极管阵列检测器(HPLC-DAD)法,测定并计算以绿原酸为内参物的其他5种绿原酸类成分的相对校正因子;并考察相对校正因子的耐用性,确立以绿原酸为内参的QAMS法;分别采用已建立的QAMS分析方法和外标法计算含绿原酸中药(金银花、野菊花)及其滴眼剂中绿原酸类成分的含量,利用t检验和相对误差分析不同算法的含量差异,评价QAMS法的准确性;并采用相对保留时间方法对6种成分色谱峰进行准确定位。 结果 建立的以绿原酸为内参物的相对校正因子耐用性良好,采用2种方法计算10批次滴眼剂和3批次金银花及野菊花中绿原酸类成分的含量,两者相对误差范围为-3.32%~4.99%,差异无统计学意义(P > 0.05)。 结论 建立的QAMS法可同时用于金银花、野菊花中药材及其滴眼剂中6种绿原酸类成分的质量评价,具有快速、准确、方便等特点。
[关键词] 一测多评法;相对校正因子;滴眼剂;金银花;野菊花
[中图分类号] R284.2 [文献标识码] A [文章编号] 1673-7210(2020)09(a)-0010-05
[Abstract] Objective To establish the quantitative analysis of multi-components by single marker (QAMS) method for the analysis of six chlorogenic acids in traditional Chinese medicine and their preparations. Methods A high performance liquid chromatography-photodiode array detector (HPLC-DAD) method was developed with acetonitrile-0.4% phosphoric acid as mobile phase ingradient elution. The column temperature was 25℃. The flow rare was 1.0 mL/min and the detection wavelength was 327 nm. Then the relative correction factors among the other five chlorogenic acids were calculated, when the chlorogenic acid was used as internal referring substances. The ruggedness of relative correction factors was evaluated to establish the QAMS method, when the chlorogenic acid was used as internal referring substances. The content of chlorogenic acid in traditional Chinese medicine (Lonicerae Japonicae Flos and Chrysanthemi Indici Flos) and their eye drops were calculated by the established QAMS method and external standard method respectively, and the content difference of different algorithms was analyzed by t-test and relative error analysis to evaluate the accuracy of the QAMS method. The relative retention time method was used to accurately locate the chromatographic peaks of the six constituents. Results The established relative correction factor with chlorogenic acid as internal referring substances had good ruggedness. Two methods were used to calculate the content of chlorogenic acid in 10 batches of eye drops and three batches of Lonicerae Japonicae Flos and Chrysanthemi Indici Flos. The relative error range was -3.32% to 4.99%, and there was no statistically significant difference (P > 0.05). Conclusion A rapid, accurate and convenient QAMS method for simultaneous measurement of six chlorogenic acids has been established, and this method can be used for quality analysis of six chlorogenic acids in Lonicerae Japonicae Flos, Chrysanthemi Indici Flos and their eye drops.
[Key words] Quantitative analysis of multi-components by single marker; Relative correction factor; Eye drop; Lonicerae Japonicae Flos; Chrysanthemi Indici Flos
绿原酸是金银花等多种中药的主要有效成分之一,具有抗氧化、抗菌、保肝、利胆、保护心血管、降糖、降压和抗肿瘤等多种药理活性[1-5]。绿原酸是咖啡酸和奎尼酸的缩合物,结构中存在酯键、不饱和双键和多元酚,随温度、酸碱(pH)值和光照等条件的影响发生水解和分子内酯基迁移而发生异构化[6-11]。而从植物中发现的绿原酸异构体包括绿原酸、新绿原酸、隐绿原酸、异绿原酸A、异绿原酸B和异绿原酸C等[12-14]。因此单独以绿原酸作为指标,并不能充分地表征绿原酸类成分。
睛阅滴眼液是含金银花、野菊花等的中药滴眼剂,具有缓解眼睛疲劳、退赤消肿等作用,主要以绿原酸作为质控指标。但有研究发现,绿原酸在生产及储存时不稳定,绿原酸类成分在溶液状态下易发生转化[15]。采用单一成分不能反映其产品整体质量,需对绿原酸类成分进行多成分的含量分析,便于控制药材-制剂质量。本文采用“一测多评”(quantitative analysis of multi-components by single-marker,QAMS)法对药材和滴眼剂制剂中的6种绿原酸类成分进行测定和分析,以绿原酸为参照成分,建立对另外5种成分的QAMS法,根据相对校正因子实现多指标质量分析,并与外标法测定结果进行比较,评价该技术的可行性与适用性。
1 仪器与试药
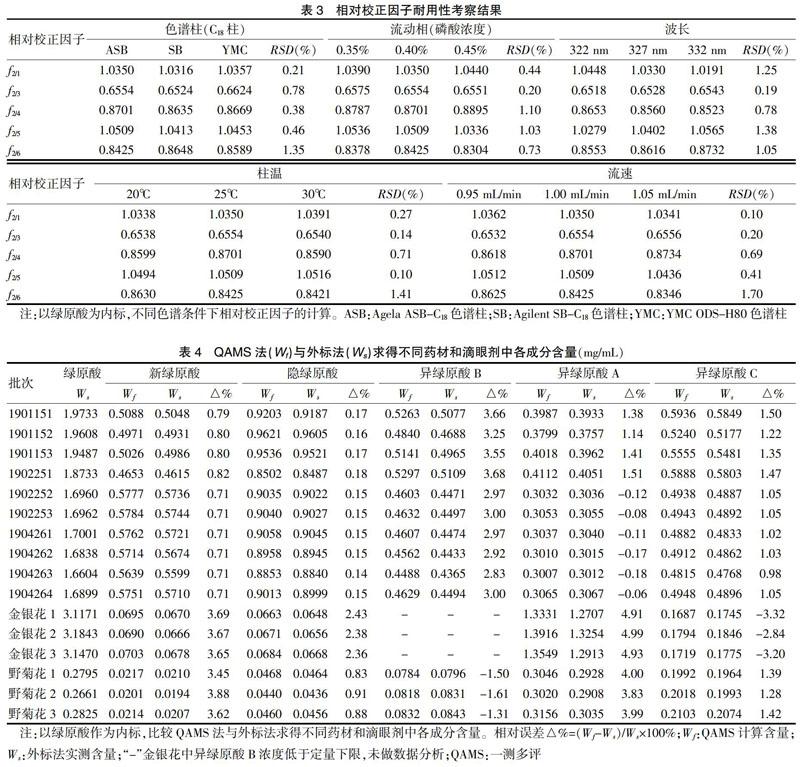
高效液相色谱(HPLC)仪(G1311A四元泵、G1329A自动进样器、G1315D二极管阵列检测器);Agilent chemstation工作站(Agilent 1200型,美国安捷伦公司);Agela ASB-C18(4.6 mm×250 mm,5 μm)色谱柱和Agilent TC-C18保护柱;Agilent SB-C18(4.6 mm×250 mm,5 μm)色谱柱;YMC ODS-H80(4.6 mm×250 mm,5 μm)色谱柱;数控超声波清洗器(KQ-500DE,昆山市超声仪器设备有限公司);十万分之一天平(ME 215P型,Sartorius);超纯水机(Milli-Q,Millipore)。
绿原酸(批号:110753-201817,纯度为96.8%),购自中国食品药品检定研究院;新绿原酸、隐绿原酸、异绿原酸A、异绿原酸B和异绿原酸C(批号分别为DST190124-015、DST190118-035、DST190113-036、DST190226-037、DST190110-038,纯度分别≥99%、98%、98%、98%、99%),购自成都德思特生物技术有限公司;乙腈(HPLC级,美国Fisher);甲醇(色谱淋洗级)、磷酸(A.R.级)购自国药集团化学试剂有限公司;水为超纯水。
试验用药:金银花(产地:河南)、野菊花(产地:安徽)购自北京丰泰金源药业有限公司,由中国中医科学院广安门医院崔翰明研究员鉴定为忍冬科植物忍冬Lonicera japonica Thunb.的干燥花蕾和菊科植物野菊Ghrysanthemum indicum L.的干燥头状花序;睛阅滴眼液为中国中医科学院广安门医院中药研发中心自制(批号分别为1901151、1901152、1901153、1902251、1902252、1902253、1904261、1904262、1904263、1904264)。
2 方法与结果
2.1 实验方法
2.1.1 色谱条件 Agela ASB-C18(4.6 mm×250 mm,5 μm)色谱柱和Agilent TC-C18保护柱,流动相为乙腈(A)-0.4%磷酸水溶液(B),梯度洗脱0~15 min,5%~20% A;15~30 min,20%~30% A;30~40 min,30%A;柱温为25℃,流速为1.0 mL/min,检测波长327 nm,进样量10 μL。结果显示,6个待测组分色谱峰分离效果良好。见图1。
2.1.2 混合对照品溶液的配制 取新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A和异绿原酸C对照品适量,精密称定,置于量瓶中,用甲醇溶解并稀释至10 mL,配制成浓度分别为261、311、217、209、203、216 μg/mL的混合对照品溶液,再用甲醇稀释成系列混合对照品溶液。
2.1.3 供试液的制备 金银花药材供试液:精密称量过60目筛的金银花粉末约0.5 g,置于具塞三角瓶中,精密加入50%甲醇溶液50 mL并称重,超声提取30 min,晾凉并补重,摇匀,过滤,即可。野菊花药材供试液:精密称量过60目筛的野菊花粉末约1.5g ,置于具塞三角瓶中,精密加入50%甲醇溶液50 mL,并称重,超声提取30 min,晾凉并补重,摇匀,过滤,即可。滴眼剂供试液:精密移取滴眼剂1 mL,置于10 mL量瓶中,用50%甲醇溶液稀释至刻度,摇匀,即可。
2.1.4 相对校正因子的原理和计算 在一定范围内(线性范围内)成分的量(质量或浓度)与检测器响应成正比,即:W = fA(W表示成分的量,A表示响应值,f表示相对校正因子)[16-17]。选取某一典型成分作为内参物,建立该成分与其他成分之间的相对校正因子fk/i,fk/i = (Ai×Wk)/(Ak×Wi),其中A、W分别为色谱峰的峰面积、成分的质量浓度(单位:μg/mL),下标k、i分别代表内参物及待测成分。根据公式求算以绿原酸为参照成分时,其他5種绿原酸类成分的相对校正因子(fk/i)。
2.2 方法学验证
2.2.1 线性关系考察 按“2.1.1”项下色谱条件测定系列混合对照品溶液,并以对照品浓度(X)为横坐标,峰面积(Y)为纵坐标,进行回归处理,结果显示,6种绿原酸成分在相应的线性范围内线性关系良好。见表1。
2.2.2 精密度试验 精密吸取混合对照品溶液10 μL,连续进样5次,记录峰面积,计算新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A和异绿原酸C的日内精密度,其RSD分别为0.22%、0.34%、0.61%、0.82%、0.78%、1.59%。精密吸取中浓度的混合对照品溶液,连续进样6 d,计算6个绿原酸类成分的日间精密度,RSD分别是0.86%、0.78%、0.60%、0.93%、0.96%、 1.79%。结果提示,仪器的精密度良好,绿原酸类成分在甲醇溶液中6 d内的稳定性良好。
2.2.3 重复性试验 分别取金银花、野菊花粉末和滴眼剂各6份,精密称定或量取,按“2.1.3”项下制备样品供试液,按“2.1.1”项下色谱条件测定,根据标准曲线计算6个绿原酸类成分的含量,金银花中新绿原酸、绿原酸、隐绿原酸、异绿原酸A和异绿原酸C含量的RSD分别为0.95%、1.07%、1.54%、2.13%、2.90%,野菊花中绿原酸成分含量的RSD依次为4.83%、3.17%、3.35%、2.87%、2.23%、2.76%;滴眼剂中绿原酸成分含量的RSD依次为0.95%、0.86%、0.85%、1.12%、0.71%、1.02%,结果提示,重复性良好。
2.2.4 稳定性试验 取“2.2.3”项下滴眼剂供试液1份,连续6 d进样,记录新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A和异绿原酸C峰面积,计算其RSD依次为1.05%、0.71%、0.52%、1.28%、1.35%、1.64%,结果显示,滴眼剂供试液在6 d内的稳定性良好。
2.2.5 加样回收率试验 取已知含量的睛阅滴眼液(1901152)6份,每份2 mL,分別精密加入浓度为60.0、172.6、90.3、45.0、39.0、49.0 μg/mL的新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A和异绿原酸C混合对照品溶液2 mL,混匀,按“2.1.1”项下色谱条件测定,计算各成分的量,6个成分的回收率为96.18%~104.24%,RSD为0.37%~4.03%。
2.3 相对校正因子及耐用性
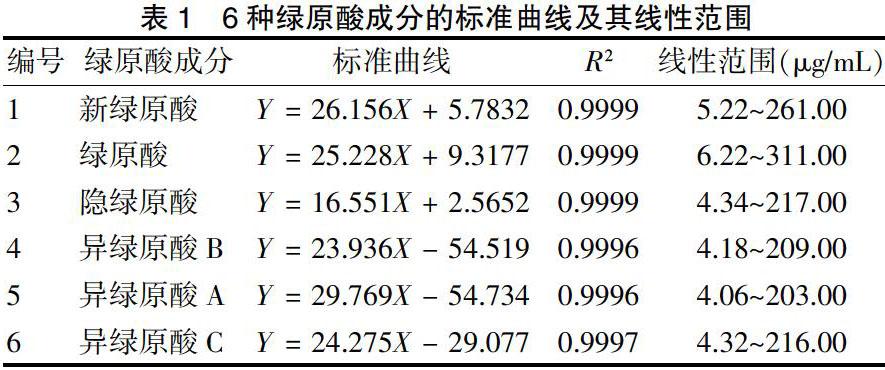
2.3.1 相对校正因子的计算 根据相对校正因子计算公式,以绿原酸为内参物,对“2.2.1”项下系列浓度对照品溶液及其所对应的峰面积进行数据处理,计算其余5种绿原酸类成分的相对校正因子。结果显示,不同浓度间的相对校正因子RSD均<5%。见表2。
2.3.2 相对校正因子的耐用性 采用Agilent 1200色谱仪,考察Agela ASB-C18、Agilent SB-C18、YMC ODS-H80 3种色谱柱;并采用Agilent 1200色谱仪和Agela ASB-C18色谱柱,不同流动相磷酸比例(0.35%、0.40%、0.45%)、不同波长(322、327、332 nm)、不同柱温(20、25、30℃)、分别考察不同流速(0.95、1.00、1.05 mL/min)对相对校正因子的影响。结果显示,各成分不同色谱条件下的相对校正因子RSD均<5%,耐用性良好。见表3。
2.4 待测组分色谱峰的定位
实验中采用Agela ASB-C18、Agilent SB-C18、YMC ODS-H80色谱柱,并采用Agilent 1200色谱仪和Agela ASB-C18色谱柱,对不同流速(0.95、1.00、1.05 mL/min)、不同柱温(20、25、30℃)条件下绿原酸成分出峰时间的相对保留值(以绿原酸为内参物)进行计算。结果显示,以绿原酸为内标,在不同色谱条件下其相对保留时间RSD均<3%。
2.5 QAMS法与外标法计算结果的比较
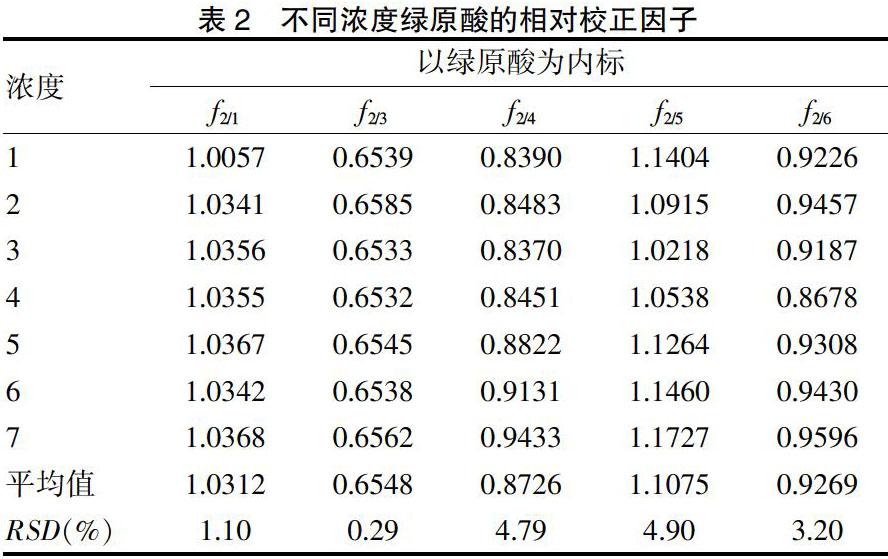
按照“2.1.3”项下供试液的制备方法分别制备样品溶液,并采用“2.1.1”项下色谱条件测定,以绿原酸作为内参物,分别计算药材及滴眼剂中6种成分的含量,并与外标法的计算结果进行比较,计算相对误差,利用相对误差评价QAMS法的准确度。结果显示,建立的QAMS法所计算含量的准确度与外标法相当,采用t检验对两种方法所计算的结果进行分析,两者计算含量,差异无统计学意义(P > 0.05)。见表4。
3 讨论
本研究建立以绿原酸为内参的QAMS分析方法,并对3批次金银花、野菊花药材及10批次睛阅滴眼液进行测定和分析,金银花药材中均可检出6种绿原酸类成分,但由于金银花中异绿原酸B的浓度低于线性范围的下限,因此并未对金银花药材中的异绿原酸B成分进行计算和含量比较。比较外标法和QAMS法的计算结果,二者所得含量的相对误差范围在-3.32~4.99%之间,t检验结果显示两者含量的差异无统计学意义(P > 0.05),提示所建立的以绿原酸为内标的相对校正因子定量分析方法具有较高的准确度,且适用于金银花、野菊花药材及其滴眼剂制剂。
本研究在对滴眼剂的制备及存储过程中发现,绿原酸在溶液中不稳定,易受温度、光照和pH的影响,随着储存时间延长,滴眼剂中绿原酸和异绿原酸A含量降低,新绿原酸和隐绿原酸含量增加,但绿原酸、新绿原酸和隐绿原酸总含量降低不明显,这与文献报道的在中性和碱性条件下绿原酸会异构化为4-咖啡酰奎尼酸和5-咖啡酰奎尼酸,与异绿原酸A会异构化为异绿原酸B和异绿原酸C是一致的[10,18-20]。因此,采用单一的绿原酸并不能很好地反映药材和制剂的质量,建立多成分的含量分析方法,不仅能更好地体现药材及制剂的质量标准,同时也能较好地监测药材-中间体-制剂质量和优化生产工艺参数。
[参考文献]
[1] 那龚雪,张文涛,谈远锋,等.绿原酸及其异构体药理作用及不良反应研究进展[J].辽宁中医药大学学报,2018, 20(3):140-143.
[2] Miao M,Xiang L. Pharmacological action and potential targets of chlorogenic acid [J]. Adv Pharmacol,2020,87:71-88.
[3] 杨玉彬,柯斌,秦鉴.绿原酸对3T3-L1前脂肪细胞分化的抑制作用[J].中成药,2018,40(11):2380-2385.
[4] 严永旺,肖兰,周旭,等.绿原酸的药理作用及药用研发对策[J].中国药房,2017,28(19):2729-2732.
[5] Bagdas D,Gul Z,Meade JA,et al. Pharmacologic overview of chlorogenic acid and its metabolites in chronic pain and inflammation [J]. Curr Neuropharmacol,2020,18(3):216-228.
[6] 蒋杰,李雪营,魏学军.杜仲不同“发汗”加工方法制品中绿原酸含量的比较[J].中国民族民间医药,2019,28(1):28-30.
[7] 潘明飞,杨晶莹,李睿,等.药食同源食品金银花中绿原酸标准物質的研制与评价[J].中国食品学报,2020 20(4):224-232.
[8] 郭满满,肖卓炳,于华忠,等.热重法研究绿原酸的热稳定性、分解动力学及贮存期[J].药物评价研究,2011,34(5):348-352.
[9] 罗奇志,王有志,罗佳波.绿原酸水解产物的高效液相色谱-电喷雾串联质谱分析[J].药物分析杂志,2011,31(7):1345-1349.
[10] 顾丽红,朱品业.日光和温度对绿原酸供试液稳定性的影响[J].中成药,1999,21(11):568-569.
[11] 刘意,曾桂先,宋凤兰,等.绿原酸稳定性研究[J].化工中间体,2009,5(2):25-28.
[12] Farah A,Monteiro M,Donangelo CM,et al. Chlorogenic acids from green coffee extract are highly bioavailable in humans [J]. J Nutr,2008,138(12):2309-2315.
[13] 荣传兰,孟勇,刘丹.HPLC法同时测定多花蒿中绿原酸类成分的含量[J].中医药导报,2018,24(8):68-70.
[14] 张荣林,林雀跃.超高效液相色谱法测定清咽糖中6种绿原酸类化合物的含量[J].食品安全质量检测学报,2019(16):279-285.
[15] 伍涛,李茂婷,邓余,等.银黄-聚乙烯醇注射液稳定性研究[J].福建农业科技,2019(11):59-53.
[16] 王智民,高慧敏,付雪涛,等.“一测多评”法中药质量评价模式方法学研究[J].中国中药杂志,2006,31(23):1925-1928.
[17] 王智民,钱忠直,张启伟,等.一测多评法建立的技术指南[J].中国中药杂志,2011,36(6):656-658.
[18] 邱喜龙,任晓亮,张慧杰,等.热毒宁注射液中绿原酸的降解动力学研究[J].药物分析杂志,2012,32(12):2240-2245.
[19] 李建晨,廖明丽,贾玉捷,等.双黄连口服液中绿原酸含量的影响因素研究[J].河北科技大学学报,2015,36(5):499-503.
[20] Ma YC,Wang XQ,Hou FF,et al. Rapid resolution liquid chromatography(RRLC)analysis and studies on the stability of Shuang-Huang-Lian preparations [J]. J Pharmaceut Biomed,2011,54(2):265-272.
(收稿日期:2020-01-07)

