高脂饮食性肥胖对猪螺杆菌感染后小鼠胃淋巴趋化因子表达与MALT形成的影响
杨鑫 田字彬 张翠萍 张茜 赵文君 杨林
[摘要] 目的 研究高脂飲食性肥胖对猪螺杆菌感染后小鼠胃相关淋巴趋化因子表达与黏膜相关淋巴组织(MALT)形成影响及其机制。方法 将40只雌性C57BL/6小鼠随机分为正常对照组(NC组)、猪螺杆菌感染组(HS组)、高脂饮食组(HFD组)、猪螺杆菌感染+高脂饮食组(HS+HFD组),每组10只。用普通饮食喂养NC组与HS组小鼠,而其余两组小鼠普通饮食喂养3周后给予高脂饮食。按上述饮食喂养24周后,取小鼠胃组织,行苏木精-伊红染色分别检测各组小鼠胃黏膜淋巴滤泡的数量与大小;行实时定量PCR,分别检测各组小鼠胃黏膜相关淋巴趋化因子CXCL13、CCL19、CCL21和核转录因子-κB(NF-κB)信号通路的上游因子肿瘤坏死因子α(TNF-α)、淋巴毒素α(LTα)、淋巴毒素β(LTβ)的mRNA表达水平。结果 猪螺杆菌感染可诱导小鼠胃黏膜滤泡的形成,且HS+HFD组小鼠胃黏膜淋巴滤泡的数量与大小较HS组明显增加(t=3.05、4.01,P<0.05)。HS+HFD组小鼠胃黏膜中TNF-α、LTα与LTβ的mRNA表达水平与HS组相比较明显增加(F=117.261~306.855,P<0.05)。HS+HFD组小鼠胃黏膜相关淋巴趋化因子CXCL13、CCL19、CCL21的mRNA表达水平明显高于HS组,差异具有统计学意义(F=68.461~252.398,P<0.05)。结论 高脂饮食诱导的肥胖可能通过激活NF-κB信号通路以及诱导上调胃内淋巴趋化因子表达,进一步促进猪螺杆菌感染后胃MALT的形成。
[关键词] 小鼠,肥胖;膳食,高脂;海尔曼螺杆菌属;黏膜相关淋巴组织;趋化因子类;NF-κB
[中图分类号] R573.6 [文献标志码] A [文章编号] 2096-5532(2020)06-0631-05
doi:10.11712/jms.2096-5532.2020.56.148 [开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20200714.1202.001.html;
2020-07-16 09:01
[ABSTRACT] Objective To investigate the effect of high-fat diet-induced obesity on the expression of gastric lymphocyte chemokines and the formation of mucosa-associated lymphoid tissue (MALT) after Helicobacter suis (H. suis) infection and its possible mechanism. Methods A total of 40 female C57BL/6 mice were randomly divided into normal control group (NC group), H. suis infection group (HS group), high-fat diet group (HFD group), and H. suis infection+high-fat diet group (HS+HFD group), with 10 mice in each group. The mice in the NC group and the HS group were given a normal diet, and those in the other two groups were given high-fat diet after 3 weeks of normal diet. After the mice were given the above diet for 24 weeks, gastric tissue was collected and HE staining was used to measure the number and size of gastric mucosal lymphoid follicles; quantitative real-time PCR was used to measure the mRNA expression levels of gastric mucosa-associated lymphocyte chemokines (CXCL13, CCL19, and CCL21) and upstream factors of the nuclear factor-kappa B (NF-κB) signaling pathway (tumor necrosis factor-α (TNF-α), lymphotoxin α (LTα), and lymphotoxin β (LTβ)). Results H. suis infection induced the formation of gastric mucosal follicles in mice, and the HS+HFD group had significantly greater number and size of gastric mucosal lymphoid follicles than the HS group (t=3.05,4.01;P<0.05). Compared with the HS group, the HS+HFD group had significant increases in the mRNA expression levels of TNF-α, LTα, and LTβ in the gastric mucosa (F=117.261-306.855,P<0.05), as well as significantly higher mRNA expression levels of the gastric mucosa-associated lymphocyte chemokines CXCL13, CCL19, and CCL21 (F=68.461-252.398,P<0.05). Conclusion High-fat diet-induced obesity may further promote the formation of gastric MALT after H. suis infection by activating the NF-κB signaling pathway and inducing upregulation of the expression of gastric lymphocyte chemokines.
[KEY WORDS] mice,obese; diet,high-fat; Helicobacter heilmannii; mucosa associated lymphoid tissue; chemotactic factors; NF-κB
猪螺杆菌(Helicobacter suis,H. suis)是除幽门螺杆菌(Hp)外最常见的定植于人类胃黏膜的螺旋杆菌,其感染与萎缩性胃炎、胃溃疡、胃黏膜相关淋巴样组织(MALT)淋巴瘤甚至胃癌等发生存在相关性[1-5],值得临床重视。近年来,关于猪螺杆菌相关性胃MALT淋巴瘤的报道逐渐增多[6]。有研究结果表明,猪螺杆菌可定植于C57BL/6小鼠胃内,其机制主要是通过激活B细胞与辅助性T细胞(CD4+ T细胞),引起获得性免疫反应,进而诱导胃MALT形成,且CCL19、CXCL13等是猪螺杆菌感染后胃MALT形成的关键趋化因子[7-11]。肥胖是由不同炎症因子诱导产生的一种全身慢性低度炎症状态,能增加许多恶性肿瘤(包括胃MALT淋巴瘤)发生的风险[12],另外還有MALT淋巴瘤病人减体质量术后淋巴瘤完全消退的报道[13],说明肥胖可影响MALT淋巴瘤的发生发展。另有研究结果显示,高脂饮食诱导的肥胖可增加小鼠淋巴结中CCL19、CCL21和脂肪组织中CXCL13的表达水平[14-15]。因此,我们推测肥胖可能会通过某种信号通路影响猪螺杆菌感染后MALT淋巴瘤的形成。本研究旨在初步探讨高脂饮食诱导的肥胖对猪螺杆菌感染后小鼠胃MALT形成的影响及其可能的机制。
1 材料和方法
1.1 实验动物
SPF级8周龄雌性C57BL/6野生型小鼠(体质量18~20 g)40只购自济南朋悦实验动物繁育有限公司,饲养于青岛大学附属医院动物实验室(SPF级)。小鼠饲料、饮用水经高温高压灭菌。动物实验得到了青岛大学实验动物管理和使用委员会的批准。
1.2 动物分组及处理
将40只小鼠随机分为正常对照组(NC组,A组)、猪螺杆菌感染组(HS组,B组)、高脂饮食组(HFD组,C组)以及猪螺杆菌感染+高脂饮食组(HS+HFD组,D组),每组10只。取本实验室已感染猪螺杆菌的供体小鼠(已证实其胃内只有猪螺杆菌,没有其他螺杆菌的定植[5])的胃黏膜匀浆,按每只0.2 mL给B组和D组小鼠灌胃,致其感染;A组和C组则给予同等量的非感染野生型小鼠胃黏膜匀浆灌胃。A组和B组小鼠给予普通饮食,C组和D组小鼠普通饮食喂养3周后给予高脂饮食(高脂饲料购自Research Diets,Inc;其中脂肪占总热量的45%)。各组小鼠每周测定体质量1次。
1.3 标本采集
喂养24周后,将各组小鼠麻醉后行颈椎脱臼处死,取全胃,沿胃大弯剪开,用无菌PBS溶液冲洗干净。部分胃组织用于石蜡包埋,部分提取RNA。
1.4 组织学检测
取1/2的小鼠胃组织,经石蜡包埋后10 μm连续切片,行苏木精-伊红(HE)染色,检测并比较不同组小鼠胃黏膜是否有淋巴滤泡生成及生成淋巴滤泡的数量和大小。
1.5 淋巴趋化因子和核转录因子-κB(NF-κB)信号通路上游因子mRNA表达的检测
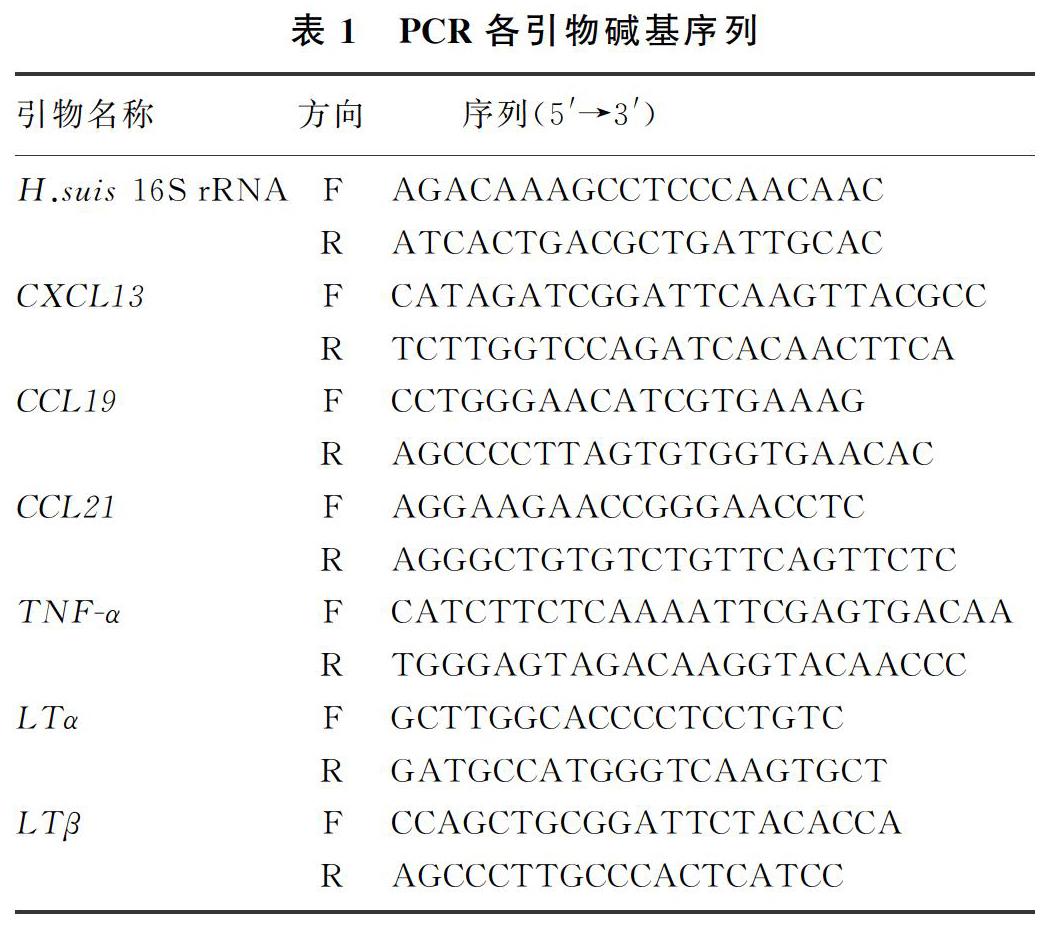
用实时定量PCR法。以Trizol试剂(TaKaRa)匀浆,从胃组织中提取总RNA,测定其纯度和浓度后取1 μg的RNA进行逆转录反应得到cDNA,使用SYBR Green试剂盒(TaKaRa)进行实时荧光定量PCR(real-time PCR)。利用比较CT(△△CT)的方法确定各样本中H. suis 16S rRNA、CCL19、CCL21、CXCL13、肿瘤坏死因子α(TNF-α)、淋巴毒素α(LTα)、淋巴毒素β(LTβ)等mRNA的相对表达水平。各基因引物序列见表1。
1.6 统计学分析
应用SPSS 24.0软件进行统计学处理。经检验各组计量数据均服从正态分布,组间方差齐,故数据以±s表示,采用二因素析因设计方差分析检验高脂饮食与猪螺杆菌的主效应和交互作用。
2 结 果
2.1 各组小鼠体质量的变化比较
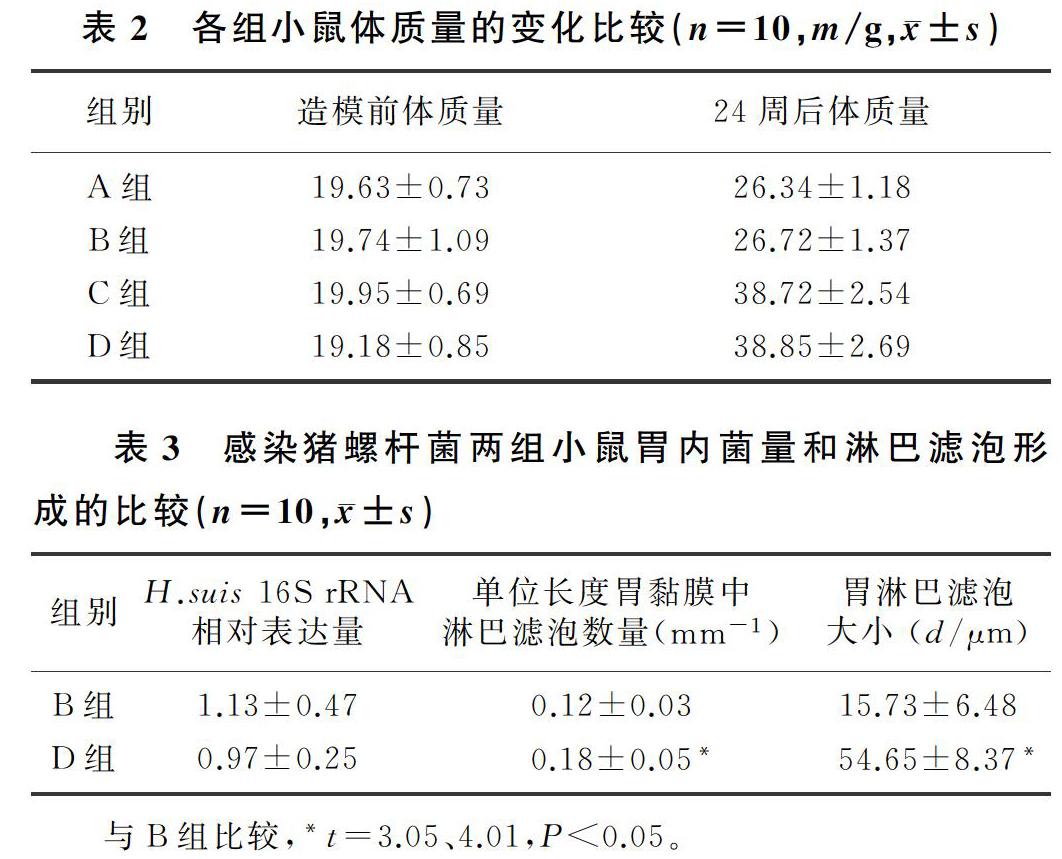
高脂饮食主效应具有统计学意义(F=353.365, P<0.01),猪螺杆菌感染主效应无统计学意义(F=0.158,P>0.05),高脂饮食与猪螺杆菌感染不存在交互作用(F=0.037,P>0.05)。说明高脂饮食是影响小鼠体质量的主要因素,而猪螺杆菌感染并不会显著影响小鼠的体质量,且两者之间无交互作用。在造模前,各组小鼠体质量差异无统计学意义(F=1.425,P>0.05);喂养24周后,高脂饮食小鼠(C、D组)体质量与非高脂饮食小鼠(A、B组)相比,差异有统计学意义(F=117.902,P<0.01)。见表2。
2.2 肥胖对猪螺杆菌感染后胃淋巴滤泡形成和细菌负荷的影响
喂养24周后,猪螺杆菌感染小鼠(B、D组)胃黏膜中均观察到淋巴滤泡的形成,而非感染小鼠(A、C组)未见胃淋巴滤泡形成(图1)。B组和D组小鼠胃组织中均检测到H.suis 16S rRNA的表达,两组之间比较差异无显著性(t=1.35,P>0.05);而与B组比较,D组小鼠单位长度胃黏膜淋巴滤泡的数量明显增加,且淋巴滤泡明显增大,差异具有统计学意义(t=3.05、4.01,P<0.05)。见表3。
2.3 肥胖对猪螺杆菌感染后小鼠胃组织NF-κB信号通路上游因子表达的影响
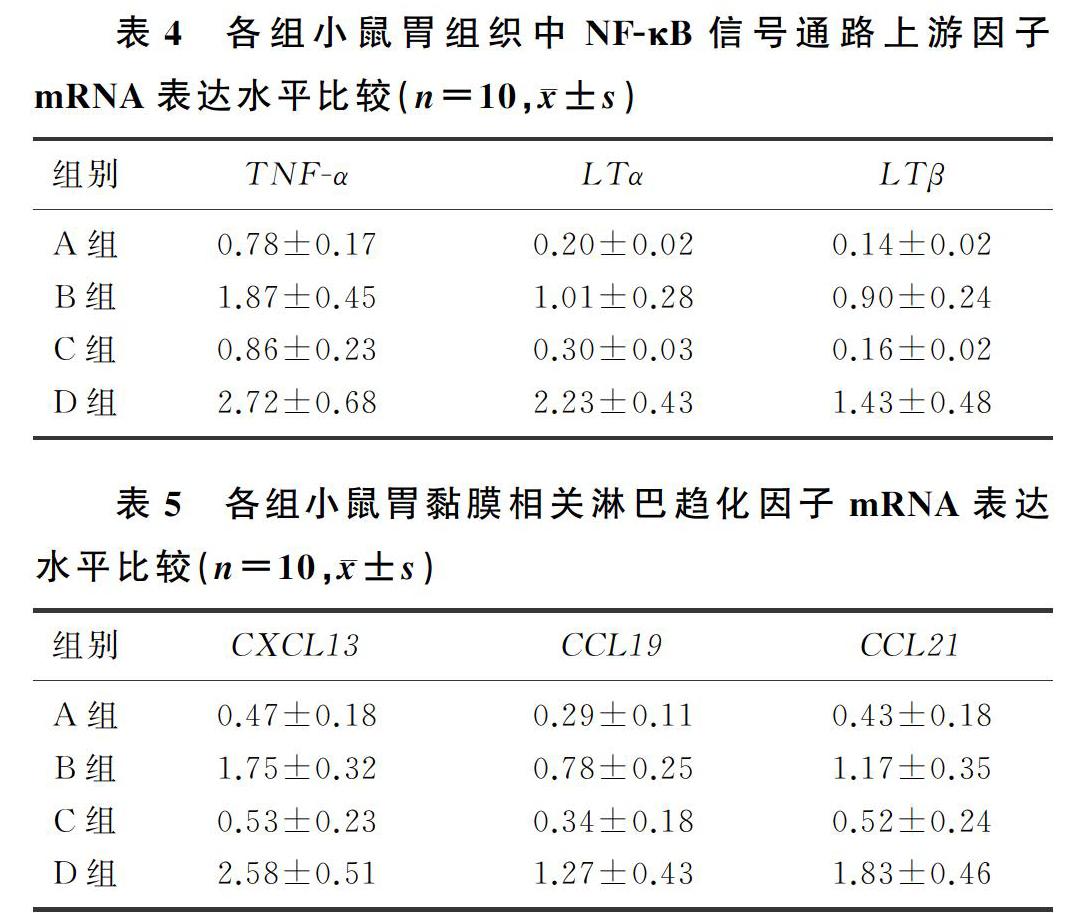
喂养24周后,小鼠胃组织内NF-κB信号通路的上游因子TNF-α、LTα、LTβ的mRNA表达水平,均在D组最高,B、C组次之,A组最低。析因设计的方差分析显示,高脂饮食主效应有统计学意义(F=8.001~55.725,P<0.01),猪螺杆菌感染主效应亦有统计学意义(F=10.607~56.735,P<0.01),且二者存在交互作用(F=117.261~306.855,P<0.01)。提示高脂饮食和猪螺杆菌感染均对各因子表达有影响,二者存在交互作用,且由每组的最大合计数可知,该交互作用为正向协同作用。说明在猪螺杆菌感染的小鼠胃组织中,NF-κB信号通路被激活,高脂饮食诱导的肥胖进一步增强了NF-κB信号通路的活化。见表4。
2.4 肥胖对猪螺杆菌感染后小鼠胃黏膜相关淋巴趋化因子表达水平的影响
喂养24周后,小鼠胃黏膜相关淋巴趋化因子的表达水平,均在D组最高,B、C组次之,A组最低。析因设计方差分析结果显示,高脂饮食主效应有统计学意义(F=6.620~13.737,P<0.01),猪螺杆菌感染主效应亦有显著性(F=9.915~18.200,P<0.01),且二者存在交互作用(F=68.461~252.398,P<0.01)。提示高脂饮食和猪螺杆菌感染均对各因子表达有影响,二者存在交互作用,且由每组的最大合计数可知,该交互作用为正向协同作用。说明高脂饮食诱导的肥胖明显促进了猪螺杆菌感染所致胃黏膜相关淋巴趋化因子的表达上调。见表5。
3 讨 论
研究表明,C57BL/6J小鼠长期感染猪螺杆菌后几乎100%可以引起胃MALT淋巴瘤样病变[6],且该菌与其他螺杆菌相比,与胃MALT淋巴瘤的发生关系更密切。因此,猪螺杆菌感染的小鼠是研究胃MALT形成机制以及胃MALT淋巴瘤发病机制的理想模型[9]。正常情况下胃黏膜不含有MALT,胃MALT作为异位淋巴组织,其形成是胃MALT淋巴瘤发生的组织学背景。螺杆菌感染的直接抗原刺激导致淋巴细胞的增殖与淋巴滤泡的形成,最终诱导MALT淋巴瘤的形成[16]。CXCL13及其受体CXCR5在Hp感染小鼠胃黏膜炎症以及MALT形成中的作用已被证实,且这些因子表达上调主要是由非经典的NF-κB通路诱导活化的[17-18]。相关文献报道,通过LTα1β2-LTβR-NIK-IKKα信号途径激活NF-κB是MALT形成的关键步骤[19]。另一方面,肿瘤坏死因子受体(TNFR)传递信号诱导磷酸化和NF-κB抑制剂(IκB)下调,并触发RelA-P50复合物从细胞质移位到细胞核(经典途径),引起广泛的炎症基因的表达。且淋巴毒素β受体(LTβR)触发磷酸化并处理p100(NF-κB2基因产物)依次生成p52,并最终激活RelB-p52复合体(非经典途径)[20],调节CXCL13、CCL19、CCL21和CXCL12等基因表达[21-22]。近年来,某些关键因子如肿瘤坏死因子和淋巴毒素α1β2(LTα1β2)在异位淋巴组织生成过程中的作用已被证实[23]。LTα1β2和TNF-α分别与各自的受体LTβR和TNFR1相结合,可激活NF-κB信号通路,诱导一系列趋化因子(CCL19、CCL21、CXCL12与CXCL13)表达增加,进而调节淋巴细胞归巢,参与异位淋巴组织的形成[24-25]。本文研究结果表明,猪螺杆菌感染小鼠NF-κB信号通路上游因子和相关淋巴趋化因子mRNA表达水平明显高于NC组。说明猪螺杆菌感染可能通过激活NF-κB信号通路以及上调胃内淋巴趋化因子表达影响胃MALT的发生发展。
目前肥胖致瘤机制的相关研究主要集中在脂肪因子的直接作用上,而肥胖对组织中趋化因子表达以及慢性感染引起的获得性MALT形成的影响仍知之甚少。肥胖作为一种慢性低度炎症状态,主要表现为异常的细胞因子产生、免疫激活以及炎症信号通路蛋白表达的增加[26]。在肥胖相关的慢性炎症状态下,脂肪细胞可表达多种主要由NF-κB调节的趋化因子如CCL19、CXCL12等[15,27]。此外,肥胖可以影响某些器官中免疫细胞对趋化因子的反应。例如,肥胖可以增加肝脏中淋巴細胞对趋化因子的反应,增加CD4+T细胞和B细胞对趋化因子CXCL12和CXCL13的趋化性[28-29]。本研究结果表明,猪螺杆菌感染可诱导胃黏膜淋巴滤泡形成,激活胃组织中NF-κB经典/非经典信号通路,并上调相关淋巴趋化因子的表达,而这种影响在不影响胃内猪螺杆菌菌量的前提下可被高脂饮食诱导的肥胖进一步加强,说明肥胖可能通过促进猪螺杆菌感染后NF-κB信号通路的激活,并上调淋巴趋化因子,进一步促进了胃MALT的发生发展。本文结果初步揭示了肥胖对胃MALT淋巴瘤发生的影响及其可能的机制。
综上所述,高脂饮食诱导的肥胖状态,促进了猪螺杆菌感染后胃MALT的发生发展,这可能与NF-κB信号通路的激活以及胃内淋巴趋化因子的表达上调有关。肥胖与肿瘤之间的关系涉及诸如炎症变化、脂肪细胞因子谱改变、胰岛素抵抗和脂肪组织低氧等多种机制,因此,肥胖相关性胃疾病确切的发病机制还需进一步研究探讨。
[参考文献]
[1] PADRA M, ADAMCZYK B, BENKTANDER J, et al. Helicobacter suis binding to carbohydrates on human and porcine gastric mucins and glycolipids occurs via two modes[J]. Virulence, 2018,9(1):898-918.
[2] OKIYAMA Y, MATSUZAWA K, HIDAKA E, et al. Helicobacter heilmannii infection: clinical, endoscopic and histopathological features in Japanese patients[J]. Pathol Int, 2005,55(7):398-404.
[3] GOJI S, TAMURA Y, SASAKI M, et al. Helicobacter suis-infected nodular gastritis and a review of diagnostic sensitivity for Helicobacter heilmannii-like organisms[J]. Case Reports in Gastroenterology, 2015,9(2):179-187.
[4] DE WITTE C, DEVRIENDT B, FLAHOU B, et al. Helicobacter suis induces changes in gastric inflammation and acid secretion markers in pigs of different ages[J]. Vet Res, 2017,48(1):34.
[5] YANG L, YAMAMOTO K, NISHIUMI S, et al. Interferon-γ-producing B cells induce the formation of gastric lymphoidfollicles after Helicobacter suis infection[J]. Mucosal Immu- nol, 2015,8(2):279-295.
[6] NAKAMURA M, MURAYAMA S Y, SERIZAWA H, et al. “Candidatus Helicobacter heilmannii” from a cynomolgus monkey induces gastric mucosa-associated lymphoid tissue lymphomas in C57BL/6 mice[J]. Infect Immun, 2007,75(3):1214-1222.
[7] YAMAMOTO K, TANAKA H, NISHITANI Y, et al. Helicobacter suis KB1 derived from pig gastric lymphoid follicles induces the formation of gastric lymphoid follicles in mice through the activation of B cells and CD4 positive cells[J]. Microbes Infect, 2011,13(7):697-708.
[8] NISHIKAWA K, NAKAMURA M, TAKAHASHI S, et al. Increased apoptosis and angiogenesis in gastric low-grade mucosa-associated lymphoid tissue-type lymphoma by Helicobac-ter heilmannii infection in C57/BL6 mice[J]. FEMS Immunol Med Microbiol, 2007,50(2):268-272.
[9] 杨若明,杨林,田字彬,等. Helicobacter suis感染小鼠模型的建立及其意义[J]. 中国人兽共患病学报, 2016,32(7):604-607,617.
[10] WINTER S, LODDENKEMPER C, AEBISCHER A, et al. The chemokine receptor CXCR5 is pivotal for ectopic mucosa-associated lymphoid tissue neogenesis in chronic Helicobacter pylori-induced inflammation[J]. Journal of Molecular Medicine, 2010,88(11):1169-1180.
[10] WINTER S, LODDENKEMPER C, AEBISCHER A, et al. The chemokine receptor CXCR5 is pivotal for ectopic mucosa-associated lymphoid tissue neogenesis in chronic Helicobacter pylori-induced inflammation[J]. Journal of Molecular Medicine, 2010,88(11):1169-1180.
[11] YAMAMOTO K, NISHIUMI S, YANG L, et al. Anti-CXCL13 antibody can inhibit the formation of gastric lymphoid follicles induced by Helicobacter infection[J]. Mucosal Immunology, 2014,7(5):1244-1254.
[12] 許松欣,邓彬,陈姚生,等. 减重手术是否降低肥胖相关肿瘤发病风险的Meta分析[J]. 中华胃肠外科杂志, 2015,18(11):1144-1148.
[13] HELMAN R, TEIXEIRA P P, MENDES C J, et al. Gastric MALT lymphoma and grade Ⅱ obesity: gastric bypass surge-ry as a therapeutic option[J]. Obes Surg, 2011,21(3):407-409.
[14] JUNG J I, CHO H J, JUNG Y J, et al. High-fat diet-induced obesity increases lymphangiogenesis and lymph node metastasis in the B16F10 melanoma allograft model: roles of adipocytes and M2-macrophages[J]. Int J Cancer, 2015,136(2):258-270.
[15] KIM D, KIM J, YOON J H, et al. CXCL12 secreted from adipose tissue recruits macrophages and induces insulin resis-tance in mice[J]. Diabetologia, 2014,57(7):1456-1465.
[16] ZHAO W J, TIAN Z B, YAO S S, et al. High-fat-diet-induced obesity upregulates the expression of lymphoid chemokines and promotes the formation of gastric lymphoid follicles after Helicobacter suis infection[J]. Pathog Dis, 2017,75(8):1-8.
[17] SHOMER N H, FOX J G, JUEDES A E, et al. Helicobacter-induced chronic active lymphoid aggregates have characteristics of tertiary lymphoid tissue[J]. Infect Immun, 2003,71(6):3572-3577.
[18] HILL D G, YU L, GAO H, et al. Hyperactive gp130/STAT3-driven gastric tumourigenesis promotes submucosal tertiary lymphoid structure development[J]. Int J Cancer, 2018,143(1):167-178.
[19] KUCHARZEWKA P, MARACLE C X, HAMBURG J V, et al. NF-κB-inducing kinase regulates LTβR-DRIVEN NF-κB signaling and inflammatory activation of endothelium[J]. Annual European Congress of Rheumatology, 2017,19(5):14-17.
[20] DALLER B, MSCH W, RHRL J, et al. Lymphotoxin-β receptor activation by lymphotoxin-α(1)β(2) and LIGHT promotes tumor growth in an NFκB-dependent manner[J]. Int J Cancer, 2011,128(6):1363-1370.
[21] JANG S W, LIM S G, SUK K, et al. Activation of lymphotoxin-beta receptor enhances the LPS-induced expression of IL-8 through NF-κB and IRF-1[J]. Immunol Lett, 2015,165(2):63-69.
[22] DEJARDIN E, DROIN N M, DELHASE M, et al. The lymphotoxin-beta receptor induces different patterns of gene expression via two NF-kappaB pathways[J]. Immunity, 2002,17(4):525-535.
[23] DEMETER J, PORZSOLT F, RMISCH S, et al. Polymorphism of the tumour necrosis factor-alpha and lymphotoxin-alpha genes in hairy cell leukaemia[J]. Br J Haematol, 1997,97(1):132-134.
[24] ALOISI F, PUJOL-BORRELL R. Lymphoid neogenesis in chronic inflammatory diseases[J]. Nature Reviews Immunology, 2006,6(3):205-217.
[25] WHARRY C E, HAINES K M, CARROLL R G, et al. Constitutive non-canonical NFkappaB signaling in pancreatic can-cer cells[J]. Cancer Biol Ther, 2009,8(16):1567-1576.
[26] ALEMN J O, EUSEBI L H, RICCIARDIELLO L, et al. Mechanisms of obesity-induced gastrointestinal neoplasia[J]. Gastroenterology, 2014,146(2):357-373.
[27] TOURNIAIRE F, ROMIER-CROUZET B, LEE J H, et al. Chemokine expression in inflamed adipose tissue is mainly mediated by NF-κB[J]. PLoS One, 2013,8(6):e66515.
[28] BIGORGNE A E, BOUCHET-DELBOS L, NAVEAU S, et al. Obesity-induced lymphocyte hyperresponsiveness to chemokines: a new mechanism of fatty liver inflammation in obese mice[J]. Gastroenterology, 2008,134(5):1459-1469.
[29] FERRERE G, LEROUX A, WRZOSEK L, et al. Activation of Kupffer cells is associated with a specific dysbiosis induced by fructose or high fat diet in mice[J]. PLoS One, 2016,11(1):e0146177.
(本文編辑 马伟平)

