限制性酶解对大米蛋白结构、功能特性及体外抗氧化活性的影响
马晓雨 陈先鑫 胡振瀛 朱雪梅,2* 熊 华 赵 强
(1 南昌大学 食品科学与技术国家重点实验室 南昌330047 2 大连工业大学食品学院 辽宁大连116034 3 山东科技大学泰山科技学院 山东泰安271038 4 江西卫生职业学院 南昌330052)
我国是世界上稻米产量最丰富的国家,每年的产量可高达1 850 亿kg[1]。稻米中含有80%的淀粉及约8%的蛋白质[2],除了作为居民膳食中最重要的组成部分满足人们日常的饮食需求外,还被用作动物饲料或用于生产淀粉糖浆、米线、味精等低附加值的产品[3]。随着生活水平的不断提高,人们对营养有了更好的认知和更高的需求,大米蛋白的优势也逐渐被人们认可。由于高生物效价[4]、低致敏性[5]和高消化率[6]以及符合世界卫生组织认定的氨基酸配比[7]等优势,使得大米蛋白成为公认的优质、营养的植物蛋白资源,其深度加工和利用及相关营养保健产品的开发也被食品领域广泛关注。然而,大米蛋白分子间通过氢键和二硫键的相互作用使得疏水性基团相互交联形成难溶性的聚集体[8],疏水性氨基酸含量远高于其它蛋白[9],导致大米蛋白水溶性较差,进而影响其功能性质,如起泡性、乳化性等,在食品领域的应用极为受限,相关产品至今仍未形成规模。应用合理的改性技术改善大米蛋白的功能性质,拓宽其应用范围,提高其应用价值,近年来备受关注。现阶段,常见的蛋白改性方法有物理改性、化学改性、酶法改性、基因工程法和复合法[10],而蛋白质的酶法修饰作为其中一种蛋白改性技术,由于其温和的反应条件使得反应易于控制,加上副产物较少、特异性和安全性高,可以有效改善蛋白质的功能性质,因此被国内外学者广泛报道[11-13]。然而,过度水解会造成蛋白三级结构破坏,理化性质稳定性下降。目前,国内外对大米蛋白在内的蛋白质的研究主要集中于蛋白质的提取工艺以及不同蛋白酶的水解效果方面,而低、中、高水解度对于蛋白结构、功能以及抗氧化功能的影响鲜有报道。胰蛋白酶作为一种特异性蛋白酶,可以对精氨酸和赖氨酸的羧基末端进行高效水解[14]。本文通过对大米蛋白进行限制性酶解处理,对酶解产物建立水解度与结构、功能和体外抗氧化活性的相关性,分析其影响机制,为拓宽大米蛋白在食品领域的应用,开发高值附加产品提供理论依据。
1 材料与方法
1.1 材料与试剂
大米蛋白(80%,干基,300 目),陕西锦泰生物工程有限公司;5-5’-二硫代-2-硝基苯甲酸(DTNB),Sigma 公司;2,6-二叔丁基-4-甲基苯酚(BHT),Aladdin 公司;乙二胺四乙酸,索莱宝化学试剂公司;1,1-二苯基-2-苦肼基,Aladdin 公司;1-苯胺基-8-萘磺酸盐 (ANS),Sigma 公司;1N Folin-酚,索莱宝化学试剂公司;甘氨酸、胰蛋白酶、尿素、苯酚、氢氧化钠、碳酸钠、硫酸铜、酒石酸钾钠、盐酸、磷酸氢二钠、磷酸二氢钠等试剂,均为分析纯级。
1.2 仪器与设备
新世纪T6 紫外可见分光光度计,北京普析通用仪器有限公司;JSM 6701F 场发射扫描电镜带能谱仪,日本电子;F-4500 荧光分光光度计,日本日立公司;L-8900 氨基酸分析仪,日本HITACH;PHS-3C 精密pH 计,上海雷磁新径仪器有限公司;Nicolet-5700 智能型傅里叶变换红外光谱仪,美国Thermo Nicolet 公司;FD-1 真空冷冻干燥机,北京神泰伟业仪器设备有限公司;LXJ-IIB 台式离心机,上海安亭科学仪器厂;磁力搅拌水浴锅,常州金坛良友仪器有限公司;DSC 8000 差式扫描量热仪,美国PE 公司。
1.3 方法
1.3.1 大米蛋白水解物的制备 不同水解度大米蛋白水解物的制备参照Phoon 等[14]的方法并稍作改动。具体步骤:准确称取100 g 大米蛋白粉,按照蛋白与蒸馏水1∶15 的质量比分散,于室温下搅拌3 h 确保蛋白充分水化。调节蛋白水溶液pH=8,于50 ℃水浴锅中保持15 min 后,加入一定量的胰蛋白酶(酶与底物的质量比为1∶100)水解。在酶解过程中,不断加入1 mol/L NaOH 溶液以维持pH 值,酶解结束后迅速移入95 ℃水浴锅中加热15 min 使酶失活。冷却至室温后,复调pH=7,离心去不溶性蛋白,上清液经冷冻干燥后备用。
1.3.2 水解度的测定 根据赵新淮等[15]的方法调整后,采用甲醛滴定法测定大米蛋白的水解度。取离心后的大米蛋白酶解液5 mL 于烧杯中,加入60 mL 的去CO2超纯水,开动磁力搅拌器,不断滴加0.1 mol/L NaOH 溶液,并用精密pH 计调节至pH=8.2,加入已中和的甲醛溶液(pH=8.2)10 mL。随后,改用0.01 mol/L NaOH 溶液将体系pH 值滴定至9.2,记录消耗的体积。

式中,c——标定的NaOH 的浓度 (0.01 mol/L);V1——样品消耗NaOH 的体积(mL);V2——空白液消耗NaOH 的体积(mL);cVD——蛋白质的质量浓度(mg/L);V——用于滴定水解液的体积,5 mL;htot——每克蛋白质中肽键的毫摩尔数,通常是一个经验值,大米蛋白的htot=7.40 meq/g[16]。
1.3.3 表面微观形态观察 样品的表面微观形貌采用JSM 6701F 场发射扫描电镜带能谱仪(Scanning Electron Microscope,以下简称SEM)观察。将样品均匀平铺至载有导电胶的铜块置物台上,经表面真空喷金处理后,于20 kV 工作电压下对样品进行观察[17]。
1.3.4 傅里叶变换红外光谱(FT-IR)分析 取冷冻干燥的样品5 mg 与200 mg 溴化钾进行充分研磨后压制成片,用于FT-IR 的测定。仪器参数设置为:扫描范围4 000~400 cm-1,扫描次数32 次,分辨率4 cm-1。谱图采用Omnic 8.0 和Peakfit 4.12分析。去卷积后做二阶导数求导,同时采用Gaussian 法进行曲线拟合,对FSD 图谱进行峰归属后,分析样品的二级结构。
1.3.5 差式扫描量热(DSC)分析 将约10 mg 样品置铝盘中并密封,使用差式扫描量热仪评估其热性质。仪器扫描温度为20~150 ℃,升温速度为5 ℃/min,以空铝盘作为参考。对每个样品的起始温度(T0)、峰值温度(Tp)、终止温度(Te)和焓变(△H)进行记录、分析。
1.3.6 内源荧光 根据Xu 等[18]的方法,将蛋白样品溶解在10 mmol/L 磷酸盐缓冲液(pH7.0)中,配制成0.1 mg/mL 的蛋白溶液,采用日立F-4500 荧光光谱仪分析。仪器参数设置为:激发波长290 nm,发射波长300~500 nm,狭缝宽度5.0 nm。以相应的缓冲溶液作为空白对照。
1.3.7 表面疏水性的测定 使用荧光探针1-苯胺基-8-萘磺酸盐(ANS)对样品进行表面疏水性的测定。将蛋白样品溶于pH 7.2 的10 mmol/L 磷酸盐缓冲液中,分别得到0.0025%,0.0050%,0.01%,0.015%和0.02%的样品稀释液。将20 μL浓度为8 mmol/L 的ANS (10 mmol/L 磷酸盐缓冲液,pH 7.2)溶液加到4 mL 样品稀释液中,旋涡5 s 后避光静置10 min,用荧光分光光度计测定荧光强度。仪器参数设置为:激发波长390 nm,发射波长470 nm,狭缝宽度5.0 nm。根据系列稀释样品的荧光强度-蛋白质浓度图的初始斜率,计算溶液的表面疏水性指数(H0)。
1.3.8 巯基(SH)含量的测定 采用Elman 法测定蛋白样品的暴露巯基和总巯基含量。参照Zhao等[19]的方法稍作修改,具体步骤是:将1 mL 质量分数为1%的样品稀释液加到5 mL Tris-Gly 缓冲液 (0.086 mol/L Tris,0.09 mol/L 甘氨酸,0.004 mol/L EDTA,pH8.0)中,测定样品中暴露巯基的含量。将1 mL 样品稀释液加到5 mL 含有8 mol/L尿素的Tris-Gly 缓冲液中,测定样品中总巯基的含量。然后,向缓冲液中加入40 μL Ellman’s 试剂(DTNB 溶于Tris-Gly 缓冲液,4 mg/mL)。将处理好的样品在室温下反应15 min,于412 nm 处测定其吸光度值。巯基含量计算公式:

式中,73.53=106/(1.36×104),其中1.36×104为Ellman’s 试剂的摩尔消光系数;A412——样品在412 nm 处的吸光度值;C——样品溶液的质量浓度(mg/mL)。
1.3.9 溶解度的测定 样品的溶解性采用Lowry法[20]测定。将1%样品分散于去离子水中,室温下搅拌40 min,随后用1 mol/L NaOH 或HCl 调节溶液pH 值,继续搅拌30 min 后4 500 r/min 离心15 min,取上清液测定蛋白含量。以BSA 为标准蛋白,计算样品的溶解度。
1.3.10 乳化性和乳化稳定性 参考比浊法[21]测定样品的乳化性和乳化稳定性。将样品分散于pH7.0 的10 mmol/L 磷酸盐缓冲液中,得到1%样品溶液。取20 mL 样品溶液加入5 mL 大豆油,以分散机转速10 000 r/min 分散60 s。迅速在距离容器底部约0.5 cm 处取50 μL 乳状液,加至5 mL 0.1% SDS 中,充分混合后于波长500 nm 处测定吸光度值,以SDS 溶液做空白对照。10 min 后重复操作1 次。以乳化性指数(EAI)和乳化稳定性指数(ESI)来表示样品的乳化性。

式中,C——乳化前样品溶液的质量浓度(g/mL);φ——乳状液中油的体积分数;A0和A10——分别为0 min 和10 min 时样品的吸光度值。
1.3.11 DPPH 自由基清除能力的测定 将不同质量浓度的样品溶液(1,2,4,8 mg/mL,2 mL)与2 mL DPPH(0.1 mmol/L,95%乙醇)混合,室温避光反应30 min,立即在波长517 nm 处测定样品的吸光度值A1。以去离子水替代样品作为对照组,95%乙醇替代DPPH 溶液作为空白组,并以等体积的去离子水和95%乙醇的混合液作为空白调零[22]。样品的DPPH 自由基清除能力按照以下公式计算:
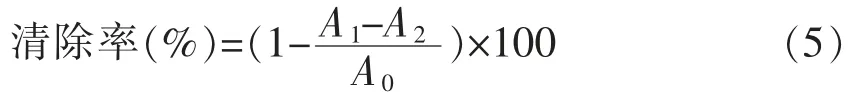
式中,A1——样品组吸光度值;A2——空白组吸光度值;A0——对照组吸光度值。
1.3.12 还原力的测定 将样品溶于去离子水中,分别得到1,2,4,8 mg/mL 的溶液。取2 mL 样品溶液依次添加2 mL pH 6.6 的0.2 mol/L 磷酸盐缓冲液和1%铁氰化钾【K3Fe(CN)6】溶液,充分混匀后于50 ℃水浴保温20 min,加入2 mL 10%三氯乙酸 (TCA) 溶液,涡旋5 s 后4 000 r/min 离心10 min。取离心后的上清液2 mL,加入相同体积的去离子水和0.4 mL 1% FeCl3溶液,于50 ℃水浴保温10 min,待溶液的颜色由黄变蓝后,于700 nm处测定吸光度。以去离子水代替样品作为空白对照[23]。
1.3.13 ABTS 自由基清除能力的测定 参考Bkhairia 等[24]的方法并稍作修改。取2 mL 7.4 mmol/L ABTS 溶液,与2 mL 2.6 mmol/L 过硫酸钾混合,在室温条件下避光反应12 h 后用95%乙醇稀释40~50 倍,使其在734 nm 处的吸光度值为0.7±0.02,得ABTS+工作液。取该工作液0.8 mL,加入0.2 mL 样品,6 min 内测定其在734 nm 处的吸光度值AS。以95%乙醇替代样品作为对照组。样品的ABTS 自由基清除能力计算公式:

式中,A0——空白样品的吸光度。
1.4 数据分析
采用Origin 8.5 和SPSS 17.0 方差分析法(ANOVA)对试验数据作图和显著性差异分析,每组试验重复3 次,结果表示为平均值±标准偏差。
2 结果与分析
2.1 傅里叶红外光谱分析
如图1所示,大米蛋白经酶解后,红外光谱中无特征性吸收峰,振动强度略有差异,这表明酶解导致分子间的化学键和作用力发生变化,从而改变了蛋白的空间结构。原大米蛋白(DH0)在红外1 400~1 054 cm-1附近有明显的振动吸收峰,这可能与原料中极少量的糖分子的-OH 振动有关。酶解过程中可溶性游离糖经洗脱,酶解后的水解物在此区间内的吸收峰强度减弱甚至消失。
红外光谱中1 600~1 700 cm-1是蛋白质的酰胺I 区,通常可通过去卷积峰形拟合得到蛋白的二级结构信息,结果见表1。相比于天然大米蛋白(DH0),酶解物中的α-螺旋和β-折叠的含量均有所降低,而β-转角的含量显著增加。随着酶解程度的增大这一变化更加明显,说明在酶解过程中蛋白质结构展开,有序的β-折叠结构被破坏,转变为更加灵活舒展的β-转角结构。同时伴随着分子内更强的氢键作用,这种结构有助于蛋白分子紧密吸附于油水界面上,具备更好的乳化性能[25]。Yong 等[26]利用谷氨酰胺酶处理麦谷蛋白后麦谷蛋白的二级结构更加灵活,同时也伴随着β-折叠含量降低,β-转角含量增加的现象。
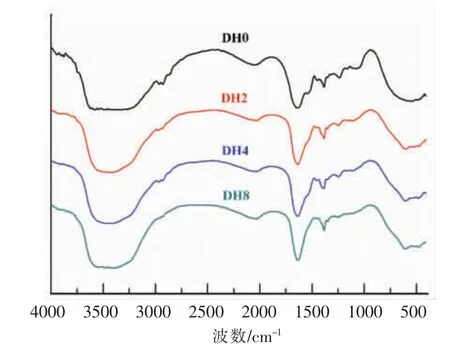
图1 不同水解度大米蛋白的红外光谱图Fig.1 Infrared spectra of rice protein hydrolysates with different degrees of hydrolysis
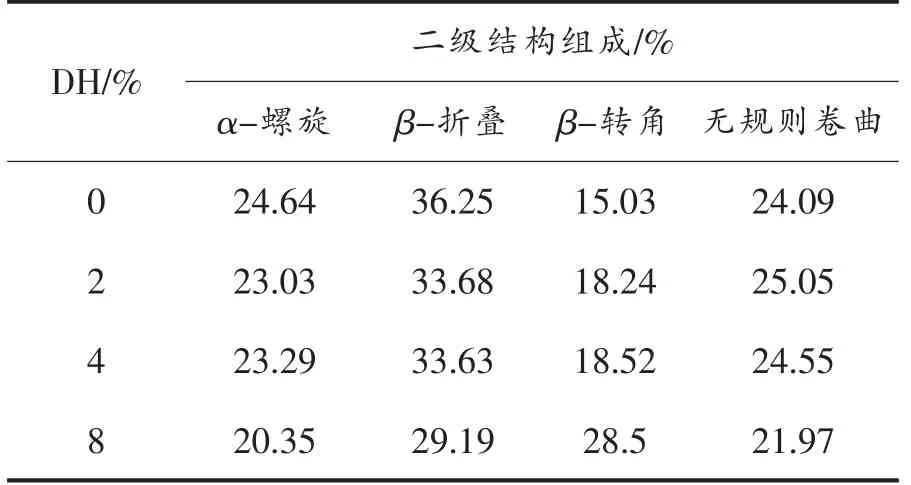
表1 不同水解度大米蛋白的二级结构Table 1 Secondary structure content of rice protein hydrolysates with different degrees of hydrolysis
2.2 表面微观结构(SEM)
图2为大米蛋白及其酶解产物在扫描电镜下的微观结构。天然大米蛋白结构紧密,表面较为平整光滑,呈现块状。而酶解处理后结构变得疏松无序,分子被水解成更小的片段,且在水解度高的情况下出现明显的聚集现象,表面有细小空洞,呈颗粒状。这表明大米蛋白经酶解处理后结构发生明显变化,具有更小的分子结构,且疏松多孔的质地结构更有利于在水中的溶解和分散。


图2 不同水解度的大米蛋白表面微观结构Fig.2 Surface microstructure of rice protein hydrolysates with different degrees of hydrolysis
2.3 热特性分析
不同水解度的大米蛋白的热力学特性如表2所示。样品在升温的过程中,由于涉及蛋白质间新的分子键的生成和分子内的折叠与解折叠,因此出现变性温度和焓的变化。当水解度为2%和4%时,蛋白的变性温度相比于天然大米蛋白有所提高,说明适度的水解可以提高蛋白的热稳定性,扩大蛋白的应用范围;而当水解度为8%时,蛋白的变性温度降至80.30 ℃,此时的DSC 图谱没有明显的吸热峰(数据未显示),表明过度水解会破坏蛋白内和蛋白间维持结构稳定的氢键,加剧蛋白分子间的聚集,进而导致蛋白质的耐热性降低。

表2 不同水解度的大米蛋白的热力学行为Table 2 Thermodynamic behavior of rice protein hydrolysates with different degrees of hydrolysis
2.4 内源荧光
内源荧光强度在一定程度上反映色氨酸和酪氨酸残基暴露于水中的程度,表明它们之间特殊的相互作用和蛋白质构型的变化,从而体现蛋白质三级结构的变化[27]。当更多的发色团暴露于溶剂中时,荧光光谱的最大值发生红移;反之,当更多的发色团嵌入蛋白质分子内部时,则表现为蓝移[28]。从图3可以看出,经过酶水解的大米蛋白荧光强度显著增加,这一过程伴随着红移效应。大米蛋白的λmax为333.2 nm,酶解后λmax随之增大,当DH 为8%时达到最大值349.2 nm。这表明,酶解过程使得更多的发色集团暴露于溶剂中。其中当DH从0 增至2%时变化最为显著,说明胰蛋白酶的参与使得生色基团很快暴露,随着水解程度的增大,这一进程逐渐减缓。
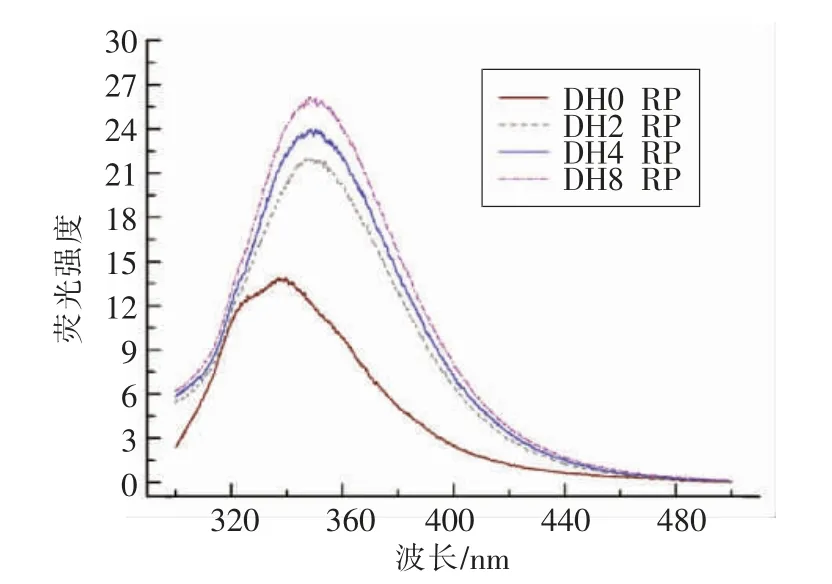
图3 不同水解度的大米蛋白内源荧光变化Fig.3 Intrinsic fluorescence of rice protein with different DH
2.5 表面疏水性及巯基含量分析
蛋白质的表面疏水性受蛋白质种类和酶的特异性的影响,并随着水解度的增大表面疏水性增加或降低。不同水解度的大米蛋白表面疏水性如图4a 所示。与天然大米蛋白相比,经酶解处理的样品表面疏水性显著降低(P<0.05),其中水解度2%的大米蛋白酶解产物的表面疏水性最低。这可能是因为轻度的水解使得蛋白分子舒展,部分被水解成更小的片段,同时这些小的片段在疏水作用和二硫键的作用下重新聚集,使得表面疏水性基团的数量减少,导致表面疏水性降低[29]。随着酶解程度的增大,这些小的片段解折叠,抑制了二硫键的生成及小分子肽的聚集,使得更多的疏水基团暴露,这也是随着水解度的增大表面疏水性升高的原因[30]。
蛋白质中巯基和二硫键的含量决定了其刚性结构,并对其功能性质影响显著。图4b 显示大米蛋白在酶解前、后巯基(总巯基和暴露巯基)含量的变化。与天然大米蛋白相比,酶解过程使得巯基含量降低,这可能是由于在胰蛋白酶的作用下,蛋白质分子内的巯基被破坏,巯基基团之间的空间阻碍被解除,游离巯基之间形成二硫键,进而导致巯基含量降低。也可能是在酶解过程中蛋白质分子内的巯基被氧化成二硫键,造成巯基含量降低。而蛋白结构随着酶解程度的增大发生解折叠,促使二硫键断裂并形成新的巯基,使巯基含量升高。

图4 不同水解度的大米蛋白表面疏水性(a)和巯基含量(b)Fig.4 Surface hydrophobicity(a) and sulfhydryl(b) of rice protein with different DH
2.6 溶解性
溶解性是决定蛋白功能性质的先决条件,因此良好的溶解性对于蛋白质的起泡性和乳化性至关重要。在不同pH 条件下大米蛋白在酶解前、后的溶解性如图4所示。大米蛋白在不同的pH 条件下显示出不同的溶解度,其中在等电点附近溶解性最差,远离等电点后溶解性逐渐增大。这是由于在等电点附近蛋白分子间的静电斥力减小,蛋白出现聚集而导致溶解度降低[31]。与天然大米蛋白相比,经酶解处理的样品溶解性有了明显的提升,这是因为天然大米蛋白具有致密的分子结构,其亚基通过分子内或分子间的二硫键和疏水相互作用进行交联[32],而酶解过程促使大米蛋白分子的巯基断裂,分子质量降低,肽链舒展,暴露出更多的亲水性基团,不溶性的聚集体含量降低,从而使得溶解性增加[33]。另外,酶解过程使蛋白质的等电点发生偏移,这可能是由于蛋白质水解物的带电基团的种类和数量发生了变化,从而引起等电点的变化,这与Xu 等[18]的研究结果是一致的。
2.7 乳化性和乳化稳定性分析
蛋白质的两亲性常被应用于食品乳液制备中。乳化特性是植物蛋白重要的物化特性之一,包括乳化性和乳化稳定性。通常情况下,乳化性越强,形成乳状液越稳定,越不容易形成沉淀。图6显示大米蛋白在酶解前、后乳化性及乳化稳定性的变化。经胰蛋白酶处理的大米蛋白的乳化性和乳化稳定性均有明显的提高,可能与大米蛋白酶解产物的溶解性和肽链灵活性增加有关,水解度在一定范围内对乳化性的影响没有显著性差异(P<0.05)。酶解后的大米蛋白断裂成许多肽段,有更多的亲水基团暴露于水相中,大量肽分子附着于油水界面,降低了界面张力,亲水基团紧密包裹在油层表面,增加了其亲水、亲油平衡值,进而提高了乳化性。而乳化稳定性呈先升高后降低的趋势,这表明乳化稳定性和乳化性不一定呈正相关。这可能是由于过度的水解导致蛋白质被分解成更小的肽段,使其在油水界面的相互作用受到抑制,肽段之间的电荷斥力造成乳状液的稳定性降低。

图5 不同水解度大米蛋白的溶解性差异Fig.5 Solubility of rice protein with different DH

图6 不同水解度大米蛋白乳化性和乳化稳定性差异Fig.6 Emulsifying activity index(EAI) and emulsifying stability index(ESI) of native and hydrolyzed rice protein
2.8 体外抗氧化活性
由于抗氧化机制的不同,因此使用多种测定方法(DPPH 自由基抑制能力、还原力和ABTS 自由基清除能力) 对大米蛋白及其酶解物的抗氧化性质进行评估。选取5 个质量浓度(0,1,2,4,8 mg/mL),测定这些样品的水解度,以常见抗氧化剂BHT(2,6-二叔丁基-4-甲基苯酚)作为阳性对照。
2.8.1 DPPH 自由基清除能力 DPPH 自由基是一种常见的自由基,能够在有机试剂中稳定存在,在波长517 nm 处有明显吸收,在清除剂存在的情况下自由基的孤对电子迅速配对,使吸光度发生变化。图7a 比较了不同水解度的大米蛋白在不同浓度下对DPPH 自由基的抑制率,结果显示,随着样品浓度的升高,其自由基抑制能力提高,即样品的浓度与其DPPH 自由基抑制能力呈现正相关。在相同浓度下大米蛋白酶解物的DPPH 自由基抑制能力明显高于天然大米蛋白,说明酶解物具有更强的供氢能力,通过终止自由基的链式反应将自由基转化为更加稳定的产物,从而清除自由基[34]。当样品质量浓度低于2 mg/mL 时,DPPH 抑制率随浓度的增大呈现较快的增长;当样品的质量浓度高于2 mg/mL 时,抑制率的增长速度逐渐减缓。在不同的样品中DPPH 自由基的抑制率存在较为明显的差异,其中水解度为2%的大米蛋白酶解物表现出最强的DPPH 自由基抑制能力,当样品质量浓度为8 mg/mL 时抑制率达80.32%,与同浓度下BHT 的抑制率(81.05%)基本持平。还有研究表明蛋白水解物的DPPH 抑制能力与疏水性氨基酸和表面疏水性有关,通常情况下表面疏水性越低抑制能力越强[35],这与作者先前的研究结果一致(图4)。
2.8.2 还原力 还原力是评价天然产物提供氢和电子能力大小的一个重要指标。大米蛋白及酶解物可作为电子供体将K3Fe(CN)6中Fe3+还原为Fe2+并产生普鲁士蓝色,样品在700 nm 处的吸光度值即可表示还原力的大小。通常情况下,溶液的颜色越深,吸光度值越大,还原力越强。图7b 显示不同水解度的大米蛋白还原力的差异。大米蛋白及酶解物的还原力均与样品浓度呈现良好的线性相关,酶解后的大米蛋白相较天然大米蛋白具有更强的还原力。这可能是由于酶解反应提高了蛋白的溶解性,随着酶解过程的进行,一些具有还原性的肽段不断被水解出来,导致还原力提高。在较低的样品浓度下,水解度越高还原力越强,而当样品质量浓度为8 mg/mL 时,不同水解度的大米蛋白的还原力无显著性差异。
2.8.3 ABTS 自由基清除能力 图7c 为不同水解度的大米蛋白对ABTS 自由基清除能力的影响。ABTS 在一些氧化剂的作用下被氧化成深绿色的ABTS·+工作液,在抗氧化化合物存在的情况下会抑制ABTS·+的生成,表现为在波长734 nm 处吸光度值降低。研究发现,酶解后的大米蛋白ABTS自由基清除率明显高于天然大米蛋白,当样品质量浓度低于2 mg/mL 时,水解度为2%的大米蛋白显示出略低的清除率;当样品质量浓度大于2 mg/mL 时,大米蛋白酶解物均表现出良好的ABTS 自由基清除能力且清除率高达95%以上,与BHT 相当。

图7 不同水解度大米蛋白的DPPH 自由基抑制能力(a)、还原力(b)和ABTS 自由基清除能力(c)变化Fig.7 DPPH radical scavenging activities(a),reducing power(b) and ABTS radical scavenging activities(c) of rice protein with different DH
3 结论
以大米蛋白为研究对象,制备不同水解度的大米蛋白酶解物,探究水解度对其结构、功能以及体外抗氧化活性的影响,结果显示:酶解过程可以改善大米蛋白的结构功能特性,且体外抗氧化活性也显著提高。以天然大米蛋白为对照,经过酶解处理的大米蛋白具有更加灵活舒展的二级结构,使其更有利于吸附在油水界面,提高乳化性能。酶解物的结构疏松多孔,大大提高其溶解性。适度的水解可以提高大米蛋白的热稳定性,而水解度为8%时酶解物结构被破坏,导致耐热性降低。同时,酶解过程也会引起蛋白质发色团、表面疏水性基团以及巯基含量的变化。另外,对比天然大米蛋白,酶解后的产物在抗氧化活性方面显著提升。大米蛋白作为一种低敏、安全且高品质、低价格的蛋白质,可以通过酶法改性扩大其应用范围,充分挖掘其潜在的商业价值,以满足消费需求。

