酶辅助提取南极磷虾磷脂及脂质组学研究
俞喜娜 陈 康 张燕平 崔益玮 汪 艺 戴志远 王萍亚 赵巧灵 沈 清*
(1 浙江省水产品加工技术联合重点实验室 浙江工商大学海洋食品研究院 杭州310012 2 舟山市食品药品检测检验研究院 浙江舟山316000)
南极磷虾是一种主要生活在南极洲水域的甲壳类动物,生物资源丰富[1]。虽然其体积较小,但是含有丰富的蛋白质及磷脂,磷脂中含大量Ω-3 系列多不饱和脂肪酸链,尤其是 EPA(二十碳五烯酸)和DHA(二十二碳六烯酸)。EPA 可降低胆固醇的含量和血液的黏稠度,促进血液的循环[2]。DHA 可预防心血管疾病和癌症[3],健脑明目[4]。相对于传统鱼油中脂质来说,南极磷虾中的脂质吸收性较高,且无毒副作用,因此具有较高的营养价值。目前国内外生产磷脂的原料主要为蛋黄和大豆,开发南极磷虾资源有利于缓解资源紧缺的问题,研究南极磷虾磷脂的提取和应用不仅具有经济价值,还具有一定的社会价值[5]。
现阶段研究多集中于油脂类(鱼油、虾油)研究,而从海洋生物中提取磷脂的报道较少。传统磷脂提取方法主要有超临界萃取法[6]、超声波[7]和微波酶辅助提取法[8]、有机溶剂萃取法[9]、酶水解结合溶剂法[10]等。如边晶晶等[11]用正己烷和异丙醇溶剂提取南美白对虾虾头中的磷脂;崔益玮等[12]用氯仿和甲醇提取南极磷虾粗脂,并用丙酮纯化。虽然溶剂提取法分离的效率较高,便于连续操作,但磷脂提取率较低[13],操作步骤繁琐,而且磷脂中残留的有机溶剂的含量易超标,有些有机溶剂具有较高毒性,这些原因都使此方法的使用受到限制。超临界萃取法和超声波酶辅助提取法等具有操作温度低,提取成分不易被破坏的优点,然而这些方法的设备昂贵,生产成本较高。陈文娟等[14]采用蛋白酶水解结合溶剂法提取大黄鱼的卵磷脂,并对酶解的工艺条件进行优化,结果表明酶水解法的提取率比溶剂法和超声波法高。
脂质组学是在大范围的分子水平上对细胞脂质组进行研究,其内容主要包括脂质的提取、分离及分析鉴定,进而了解脂质相关的结构信息。目前脂质组学的研究方法有很多,如核磁共振法、软电离质谱技术、气相色谱-质谱联用法等,随着这些技术的快速发展,提高了微量脂质分析检测的准确性和快速性,其在基础医学及药学等领域应用较为广泛,而在食品科学领域的研究相对较少[15]。对于南极磷虾脂质组学的研究有助于开发和利用南极磷虾磷脂,提高相关产品的应用价值。
本试验中采用酶辅助提取法提取南极磷虾中的磷脂,确定最佳的工艺条件,并对磷脂的脂质组学进行研究。
1 材料与方法
1.1 原料与试剂
原料:南极磷虾肉糜冻品,辽宁省大连海洋渔业集团公司。将南极磷虾肉糜冻结后于-18 ℃运至实验室,-30 ℃冻藏备用。
胃蛋白酶(来自猪胃黏膜,800~2 500 U/mg 蛋白质,鳕鱼蛋白P700)和胰蛋白酶(来自猪胰腺,活性相当于4 IU,cod P1750),美国Sigama-Aldrich 公司;色谱级乙腈、甲醇和二氯甲烷,美国Fisher Scientific 公司;PC 28:0 (14:0/14:0)、PE 30:0(15:0/15:0)和PI 32:0(16:0/16:0) 3 种磷脂标准品,美国Avanti Polar Lipids 公司;盐酸、氢氧化钠、1,2-二氯乙烷、甲醇钠、三氟化硼-甲醇配合物、正己烷、均为分析纯级试剂,国药试剂公司。
1.2 主要仪器与设备
4000 QTRAP 串联四极杆质谱配ESI 离子源,美国AB Sciex 公司;Agilent 1100 高效液相色谱仪,美国Agilent 公司;7890A 气相色谱仪,美国Agilent 公司;METTLER-AL204 电子天平,美国Mettler 公司;超纯水系统,法国Milli-Q 公司。其余为实验室常用的仪器与设备。
1.3 试验方法
1.3.1 磷脂提取 将南极磷虾脂质的提取率作为考察提取效果的指标,以提取温度、pH 值、提取时间作为影响提取效果的因素,对胃蛋白酶和胰蛋白酶两种辅助提取磷脂的方法进行比较。磷脂的提取方法如下:
1)胃蛋白酶法 定量称取5 g 磷虾虾糜,放入250 mL 烧杯中,加入50 mL 胃蛋白酶溶液(0.2%胃蛋白酶溶于0.075 mol/L 盐酸中),用0.1 mol/L 盐酸溶液调整pH 值为2.6~2.8。在42 ℃的恒温室中用磁力搅拌器搅拌过夜。室温下冷却后,用1 mol/L 氢氧化钠溶液调节提取液的pH 值至7.4±0.2,磷脂的提取采用1,2-二氯乙烷替换氯仿后的Bligh & Dyer 法[16]。
2)胰酶法 定量称取5 g 磷虾虾糜,与50 mL 胰酶溶液(1%胰酶溶于0.2 mol/L 磷酸缓冲液)于250 mL 烧杯中混合。将混合物置37 ℃恒温室搅拌过夜,冷却至室温,用1 mol/L 盐酸溶液调节提取物的pH 值至7.4±0.2。磷脂的提取采用1,2-二氯乙烷替换氯仿后的Bligh & Dyer 法[16]。
1.3.2 南极磷虾脂质的脂肪酸组成分析
1.3.2.1 脂肪酸甲酯化 将2 mL 甲醇钠溶液(2 g 氢氧化钠加到100 mL 甲醇溶液中)与0.1 g 磷虾油混合、振荡均匀,在65 ℃水浴条件下酯交换30 min,加入2 mL 三氟化硼-甲醇配合物混匀后继续在65 ℃水浴中加热3 min。冷却后加入2 mL 正己烷和2 mL 饱和氯化钠溶液。在上清液中加入适量的无水硫酸钠后,用0.22 μmol/L 有机膜过滤。
1.3.2.2 气相色谱分析[17]色谱柱:HP-88 毛细管柱 (100%氰丙基聚硅氧烷,30 m×0.25 mm,0.25 μm 膜,美国Agilent 公司);载气:氮气;流速:0.65 mL/min;火焰离子化检测(FID)温度:250 ℃;升温程序:设定初始温度70 ℃并保持5 min,然后以15℃/min 速率升至120 ℃并保持1 min,接着以5 ℃/min 速率升至175 ℃并保持5 min,最后5 min 内升至220 ℃。
1.3.3 HILIC-QTOF/MS 法分析 用二氯甲烷和甲醇(2:1,V/V)混合溶液溶解提取的磷脂,过0.22 μmol/L 有机膜后用液相色谱-质谱联用设备分析。色谱和质谱条件如下:
1)色谱条件 用Agilent 1100 高效液相色谱仪进行色谱分离。色谱柱:YMC Triart diol HILIC 柱(4.6 mm×250 mm,3 μm);柱温:40 ℃;流速:0.2 mL/min;进样量:2 μL;流动相组成:流动相A(乙腈中添加53 mmol/L 甲酸,pH 4.0~4.5)和流动相B(添加60 mmol/L 甲酸胺和53 mmol/L 甲酸的超纯水溶液,pH 3.6);梯度洗脱条件:0~3 min,A维持在95%;3~13 min,A 从95%降至70%;13~18 min,A 持续下降至50%。
2)质谱条件 用4000 QTRAP 串联四极杆质谱配ESI 离子源设备进行质谱分析。正/负离子模式:负离子模式;离子喷雾电压:4 500 V;温度:500 ℃;干燥气压力:344.76 kPa;雾化气压力:413.80 kPa;气帘气压力:172.38 kPa;质谱测量范围:m/z 450~950;仪器控制和数据采集软件:Analyst 1.5.1。
1.3.4 数据处理分析 用Origin 软件进行统计分析,计算数据的平均值、标准差及显著性水平。P<0.05,具有显著性差异。
2 结果与分析
2.1 蛋白酶的选择
蛋白酶对磷脂含量的影响见图1。可以看出,添加任意两种酶都可提高磷虾糜中磷脂的提取率。随着胰蛋白酶浓度的增加,磷脂提取率显著增加,在胰蛋白酶添加量为0.02%时达到最高值;继续添加胰蛋白酶,磷脂提取率快速下降,并在酶添加量0.03%时开始缓慢减少,由于胰蛋白酶自身为蛋白质,过量的酶会引起蛋白酶水解,因此导致磷脂的提取率降低[18]。随着胃蛋白酶的添加量的增加,磷脂提取率缓慢增加,在胃蛋白酶添加量为0.025%时达到最高值1.7%,并保持稳定。这是因为由酶和底物结合而成的中间产物饱和,当底物浓度不再改变的时候,磷脂提取量保持在平衡范围。不同的蛋白酶对南极磷虾磷脂提取率的影响差异比较显著,这是因为不同种类的蛋白酶与蛋白质的结合位点不同[19]。当酶添加量相同时,用胰蛋白酶提取磷脂的含量较高。当磷脂提取率达到最大值3.5%时,所需酶添加量为0.02%。而胃蛋白酶最适酶添加量为0.025%,此时磷脂提取率为1.74%,远低于胰蛋白酶最高的磷脂提取量,因此选取胰蛋白酶作为最优提取酶[20]。
2.2 优化的提取条件
2.2.1 温度对南极磷虾磷脂提取率的影响 温度对磷脂提取率的影响见图2。可以看出,在一定温度范围,随着温度的升高,磷脂提取率先逐渐增加,40 ℃时达到最大值,提取率为(2.51±0.05)%;温度超过40 ℃后,磷脂提取率逐渐降低。这是因为每种酶都有其最适的温度范围,在这一范围内,温度升高酶活性增强,温度过高则会导致酶失活[21]。温度升高也易导致磷脂自身氧化,胰蛋白酶的最适温度约为40 ℃[22]。

图1 酶含量对磷脂提取率的影响Fig.1 The effect of enzyme concentration on the extraction rate of phosphatide

图2 温度对磷脂提取率的影响Fig.2 The effect of temperature on the extraction rate of phosphatide
2.2.2 pH 值对南极磷虾磷脂提取率的影响 pH值对磷脂提取率的影响见图3。可以看出,当pH9时,磷脂提取率最高,为(3.35±0.07)%。随着pH值的增加,提取率呈显著下降趋势。这是由于酶活性中心的分子构型随pH 值的变化而变化,使底物和酶的结合受到一定的影响,从而影响酶的活性[23]。本试验中选取的胰蛋白酶在碱性条件下活性较强,据文献报道胰蛋白酶的最适pH 值为8左右[24-25],而图中胰蛋白酶活性最强时的pH 值为9 左右,这可能是因为不同部位提取的胰蛋白酶的最适pH 不同[26]。
2.2.3 时间对南极磷虾磷脂提取率的影响 时间对磷脂提取率的影响见图4。可以看出随着时间的增加,磷脂提取率显著增加,在3 h 附近磷脂的提取率达到最大值(3.01±0.08)%。之后,随着时间的增加,磷脂提取率下降。这是由于长时间的酶解导致南极磷虾中富含的多不饱和脂肪酸发生氧化分解,因此南极磷虾磷脂的提取率降低[27]。

图3 pH 值对磷脂提取率的影响Fig.3 The effect of pH on the extraction rate of phosphatide

图4 时间对磷脂提取率的影响Fig.4 The effect of hydrolysis time on the extraction rate of phosphatide
2.3 响应面优化设计与数据分析
由单因素试验得知,温度、pH 值和时间对南极磷虾磷脂的提取都有影响。采用响应面法对工艺参数进一步优化,确定反应的最佳工艺条件。由单因素试验可知,在温度40 ℃,pH10,时间3 h 时得到最佳的磷脂提取率。根据Box-Benhnken 中心组合试验设计原理,选取温度、pH 值和时间作为自变量,每个因素选取3 个水平,以磷脂提取率为响应值。试验因素与水平编码表见表1。表2为17 个试验点的结果。采用Design-Expert 8.0.6 Trial 软件对试验数据进行响应面分析。

表1 响应面因素水平表Table 1 Levels and factors of response surface methodology(RSM)

表2 响应面方案设计和试验结果Table 2 The program of RSM and experiment result
以南极磷虾磷脂的提取率为响应值进行二次多元回归拟合,得到南极磷虾磷脂提取率对温度、pH 值、时间3 个因素的回归方程为:
Y=3.73+0.058A+0.026B+0.051C-0.43AB-0.27AC+0.015BC-0.23A2-0.76B2-0.41C2
对该二次多元回归拟合模型进行方差分析和显著性检验,结果见表3。
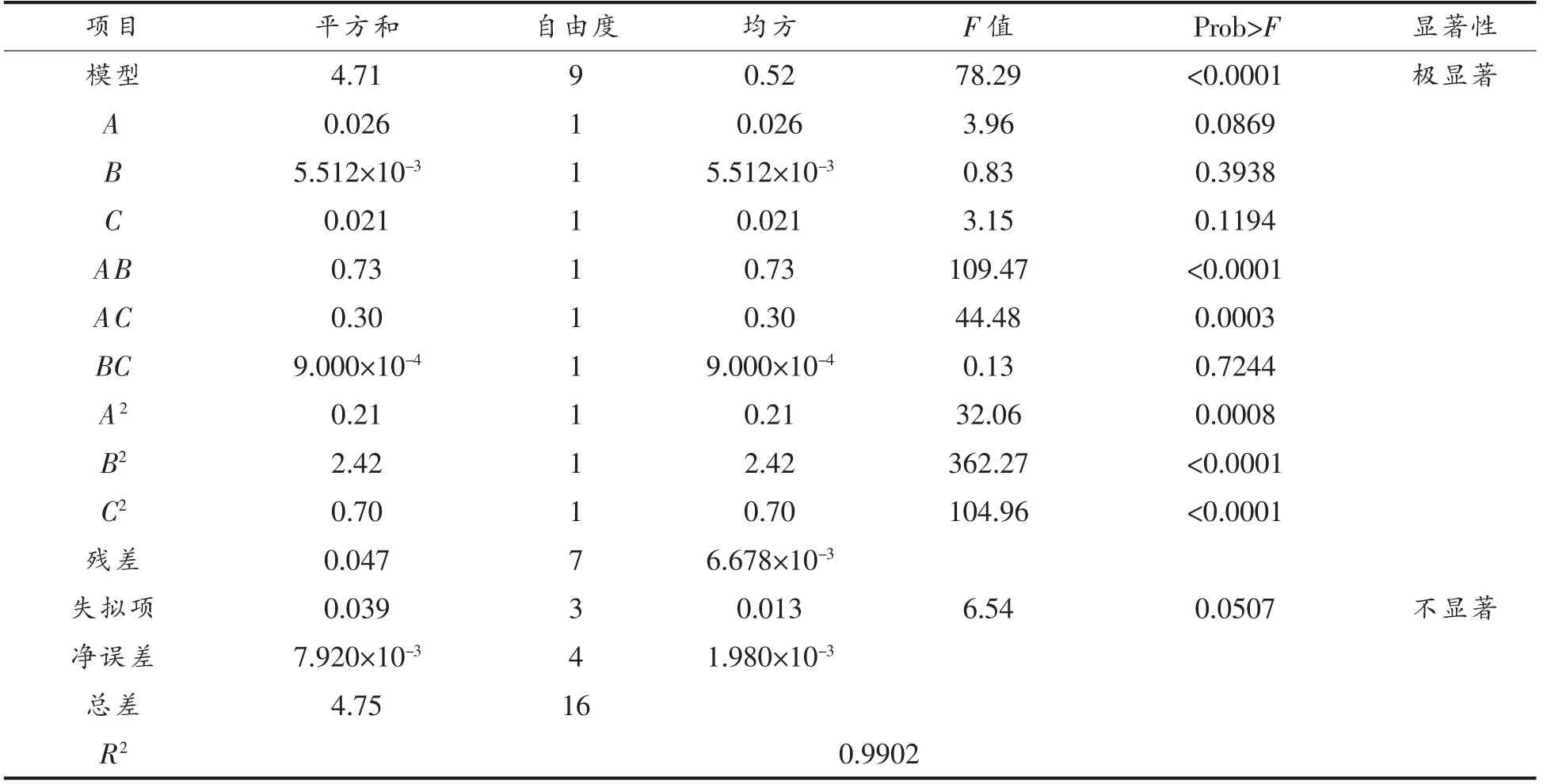
表3 回归方程参数方差分析表Table 3 Analysis of variance table of regression equation parameters
由方差分析表3可以看出,模型P<0.0001,表明模型极其显著,失拟项P=0.0507>0.05 不显著,表明模型拟合较好。影响磷脂提取率的因素排序为:温度>pH 值>时间,即温度对南极磷虾磷脂提取率的影响最大,pH 值次之,时间的影响最小。温度、pH 值、时间的二次项对磷脂的提取率的影响极其显著(P<0.05),交互项中AB 和AC 相互影响极其显著,BC 影响不显著。据文献[20]可知,酶最适温度受pH 值、底物种类等因素影响,而时间对pH 值影响不大。3 个因素间相互作用的响应面与等高线图见图5。
为确定最佳工艺条件,在因素水平内以磷脂提取率为指标,对响应面进行分析,得到最佳工艺组合为:温度40.7 ℃,pH 8.98,时间3.02 h,提取率的预测值为3.73%。为了便于实际操作,将工艺条件调整为温度41 ℃,pH 9,时间3 h。在最佳优化工艺条件下做5 次重复试验,提取率为(3.66 ±0.03)%。

2.4 南极磷虾样品中磷脂脂肪酸化学成分
对提取到的南极磷虾磷脂进行甲酯化衍生处理,用气相色谱法[28]分析。对比37 种脂肪酸甲酯混标的标准气相色谱图与试验所得气相色谱图,按照面积归一化进行定量处理,结果见表4。从南极磷虾磷脂样品中共鉴定出16 种脂肪酸,其中多不饱和脂肪酸含量占比最高。饱和脂肪酸(Saturated fatty acid,SFA)的含量占33.91%,以棕榈酸酯为主,含量达31.58%,肉豆蔻酸甲酯次之,含量为2.33%。不饱和脂肪酸 (Unsaturated fatty acid,UFA)占68.42%,以多不饱和脂肪酸(Polyunsaturated fatty acid,PUFA)含量为主,占59.52%,单不饱和脂肪酸 (Monounsaturated fatty acid,MUFA)含量占8.90%。不饱和脂肪酸中,以EPA和DHA 为主,其含量分别达31.94%和20.64%,说明南极磷虾磷脂中含丰富的Ω-3 多不饱和脂肪酸,EPA 和DHA 总和达52.58%。

表4 南极磷虾脂肪酸化学组分及含量Table 4 The chemical constituent and content of fatty acids in Antarctic krill
2.5 南极磷虾样品中磷脂的HILIC-QTOF/MS脂质组学鉴定
利用HILIC-QTOF/MS 对南极磷虾磷脂进行脂质组学鉴定,南极磷虾样品的PC,PE 和PI 的HILIC-MS/MS 色谱图如图6所示。在此实验样品未检出磷脂酰丝氨酸(PS),这是因为其在南极磷虾虾肉中属于丰度较低的磷脂。根据磷脂标准品PC 28:0(14:0/14:0),PE 30:0(15:0/15:0)和32:0(16:0/16:0) 的洗脱顺序得到PC、PE 和PI 的保留时间分别为10.42,11.3 min 和17.09 min。由于在流动相中添加了甲酸,PC 分子易被电离为[M+HCOO]-,共检测到39 种PC 分子,大多集中在m/z 750~950 区域,其中m/z 824.9 离子丰度最大,根据其MS 信息及先前发表的文献[2],可初步鉴定其结构可能为[PC 16:0/20:5+HCOO]-。另外m/z 850.9 和m/z 906.9 的丰度也较大,结构分别被鉴定为[PC 16:0/22:6 + HCOO]-和[PC 20:0/22:6+HCOO]-。PE 分子被脱质为[M-H]-,共检测到16 种PE 分子,响应值最大的为m/z 836.8,其结构为[PE 22:5/22:6-H]-,其次为m/z 854。PI 的光谱与前两者相比较为简单,出峰较少,因此其分子种类较少。共检测到4 种,其中m/z 881.9 的丰度最大,其结构可能为[PI 16:0/22:6-H]-。
由于不同的共价化合物的离子化效率主要依赖于其偶极电位,磷脂的偶极矩集中在极性头上,而疏水尾的偶极矩则可忽略不计,因此根据提取离子色谱图得到各磷脂分子物种的峰面积,并对其相对含量进行归一化处理,结果见表5。磷脂的C 原子总数为30~44,双键数为1~12。从表5中可以看出南极磷虾磷脂种类较多,EPA 和DHA 链的磷脂含量相对较高。例如在PC、PE 和PI 中都存在含C16:0/C22:6脂肪酸链的磷脂分子,其丰度分别为7.71%,11.32%和41.78%;在PC 和PI 中都存在含C16:0/C20:5脂肪酸链的磷脂分子,其丰度分别为8.21%和31.93%;从PC 和PE 中检测出含C20:0/C22:6脂肪酸链的磷脂分子,丰度分别为6.79%和2.10%。从表5中还可以发现PC、PE 和PI 的脂肪酸链中不饱和度高的脂肪酸链含量很高。例如PC中存在含有o-16:1/18:4、16:1/18:4、o-14:0/22:5、14:0/22:5、o-16:0/22:6、o-16:0/22:5、16:0/22:6、16:0/22:5、o-18:0/22:6、18:0/22:6、20:0/22:6、20:0/22:5、22:6/22:6、20:3/24:4、20:2/24:4、20:1/24:4 等脂肪酸链的磷脂分子;PE 中存在含有16:0/20:5、o-16:0/22:6、o-16:0/22:5、16:0/22:6、16:0/22:5、20:5/22:6、20:0/22:6、22:6/22:5、22:6/22:4 等脂肪酸链的磷脂分子;PI 中存在含有16:0/20:5、16:0/22:6、16:0/22:5 等脂肪酸链的磷脂分子。
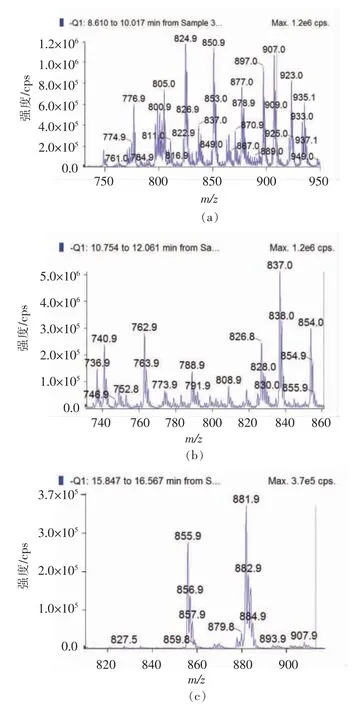
图6 南极磷虾样品的(a)PC,(b)PE 和(c)PI 的HILIC-MS/MS 色谱图Fig.6 HILIC-MS/MS chromatograms of(a) PC,(b) PE and (c) PI from Antarctic krill sample
3 结论
本研究发现胰蛋白酶水解后用1,2-二氯乙烷改进的Bligh & Dyer 法提取,可显著提高南极磷虾中磷脂的提取率,其受酶解温度、pH 值、时间的影响。为获得最佳提取条件,采用响应面优化提取工艺,获得最佳工艺条件为温度41 ℃,pH 9,时间3 h。在最佳工艺条件下磷脂提取率为(3.66±0.03)%。采用优化的南极磷虾磷脂的酶辅助Bligh & Dyer 法提取的南极磷虾磷脂中共检出8种脂肪酸,不饱和脂肪酸含量为8.90%,其中多不饱和脂肪酸占总脂肪酸含量的59.52%,富含EPA和DHA;饱和脂肪酸为31.58%,其中棕榈酸甲酯和肉豆蔻酸甲酯含量较高。采用HILIC-QTOF/MS方法对磷脂进行定量分析、鉴定,共测定出磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰肌醇3 类59 种磷脂分子,其中很多磷脂分子中含有EPA 和DHA 链。与其它方法相比,酶辅助提取南极磷虾中的磷脂得到的脂肪酸种类多,不饱和脂肪酸含量高,磷脂营养品质较好。

表5 南极磷虾中磷脂分子的种类和数量Table 5 The identity and quantity of phospholipid molecular species in Antarctic krill
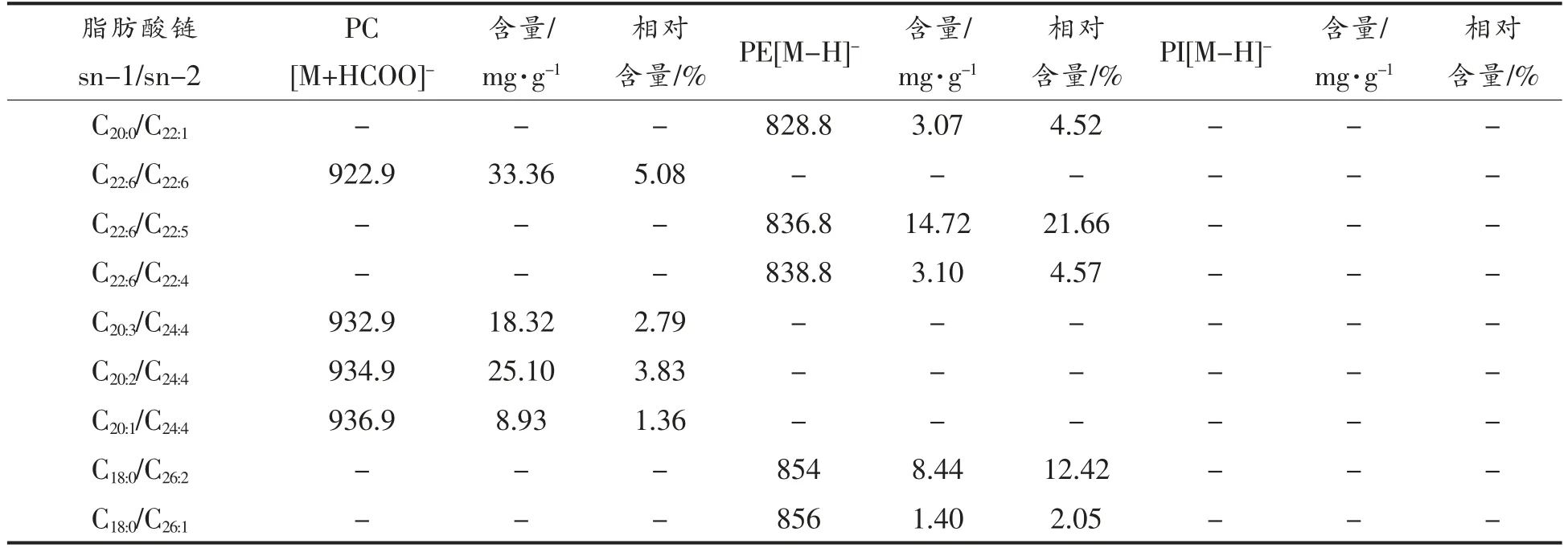
(续表5)

