褐飞虱安全高效RNAi靶基因的筛选及Snf7同源基因的控害效果*
黎丹,毛婕,李灿,张文庆
(1. 有害生物控制与资源利用国家重点实验室/中山大学生命科学学院,广东广州510275;2. 贵州省山地珍稀动物与经济昆虫重点实验室/贵阳学院生物与环境工程学院,贵州贵阳550005)
水稻作为主要的粮食作物,在亚洲的种植面积约占全世界的90%。我国的水稻生产受到众多的病虫害影响,其中褐飞虱(Nilaparvata lugens,BPH)是危害极为严重的害虫之一。褐飞虱属半翅目飞虱科(Homoptera: Delphacidae)昆虫,为专食性害虫,只在水稻上取食和繁殖后代,是一种远距离迁飞的害虫,在夏季多雨时易暴发成灾[1-2]。目前,褐飞虱的防治方式主要有农业防治、生物防治、物理防治、化学防治等。
基于RNAi(RNA 干扰)技术的基因农药被称为重大颠覆性产品[3]。2017 年,孟山都公司研发的第一个以RNA 干扰技术为基础的杀虫剂正式被美国环保署批准(http://www.biotech.org.cn/information/147718)。目前,RNAi 技术用于害虫防治时,RNAi靶基因的筛选至关重要。筛选的RNAi靶基因应同时具备安全性和高效性两大特点。安全性,即害虫摄入的靶基因dsRNA 对非目标生物和环境友好。高效性,即害虫摄入低剂量的靶基因dsRNA 后,不能正常生长发育直到死亡或出现繁殖力减弱、交配能力低下等现象。近年来,已报道的具有应用潜力的RNAi 靶基因有Hsp90、转运必需内吞体分选复合物Ⅲ亚基Snf7、几丁质合成酶基因A(CHSA)、蜕皮激素受体EcR等[4-7]。
为更有效获得安全高效的RNAi 靶标基因,本文通过大规模筛选和文献阅读建立了一套安全高效RNAi 靶基因的筛选流程,得到了32 个致死候选基因,并检测了其中12个基因的RNAi效率。进一步对其中的转运必需内吞体分选复合物Ⅲ亚基Snf7同源基因(简称为NlSnf7)的控害效果进行了研究。
1 材料与方法
1.1 实验材料
褐飞虱(N. lugens)种群由广东省农科院植物保护研究所提供,白背飞虱(Sogatella furcifera)采集于广东省农科院植物保护研究所的钟落潭水稻种植基地,两者均在昆虫饲养温室中用分蘖期的黄华占品种水稻饲养。饲养温室的相对湿度为(80±10)%,温度为(27±2)℃,光照周期为L∶D=16∶8 h。亚洲玉米螟(Ostrinia furnacalis)由本实验室用人工饲料饲养。
1.2 安全高效RNAi靶基因的获得
首先,将Flybase(http://flybase. org/)和iBeetle-base(http://ibeetle-base.uni-goettingen.de/)中进行过RNAi 相关基因的ID、表型、突变类型、序列名称等进行整理,并将相对应的基因序列提取出来整理成FASTA 文件。然后,将整理得到的基因序列与本实验室的褐飞虱转录本序列进行同源比对,再将比对得到的序列于Blast2GO 进行GO注释及分析。同时,将比对得到的序列与脊椎动物进行同源比对,选取Unmapped 的序列,作为安全候选基因,最后再结合Flybase 和ibeetle-base 两大数据库分析其致死表型,获得候选靶基因。此外,通过文献阅读,选取高致死率(>90%)的序列作为高效候选基因,最后通过设计特异性dsRNA片段,获得安全高效RNAi候选靶基因。
1.3 dsRNA的合成及注射
将筛选到的候选靶基因根据dsRNA 引物设计原则,利用Editseq 软件分析序列的ORF 区,利用primer5.0 软件设计包含ORF 区的特异性引物(表1)。再将设计得到的序列通过本地blast 检测脱靶效应,分别构建含有dsRNA 片段的重组质粒,阳性克隆经测序验证后利用质粒提取试剂盒提取重组质粒,分别命名为ds-基因名,按照Promega T7 RiboMAX™Express RNAi System 试剂盒的方法合成dsRNA。最后将获得的dsRNA 用w=1%的琼脂糖凝胶和NanoDrop ND-2000 超微量紫外分光光度计分别进行质量检测和浓度测定,最终将其稀释至5 μg/μL,保存于-20 ℃。

表1 12个特异性dsRNA片段的合成引物Table 1 Synthetic primers for 12 specific dsRNA fragments
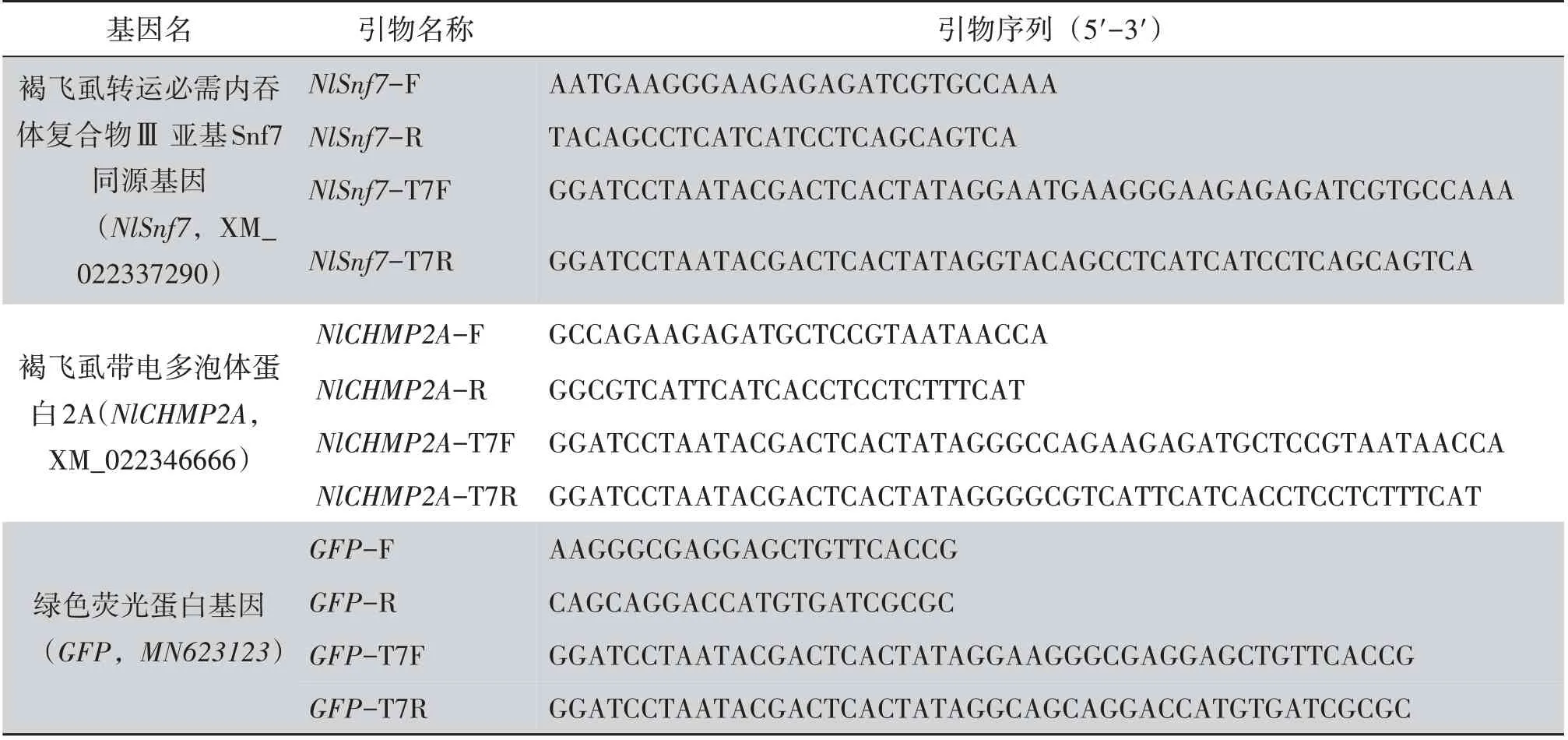
续表
1.4 褐飞虱NlSnf7基因的时空表达
褐飞虱龄期和组织模板的收集、褐飞虱和亚洲玉米螟总RNA 的提取及cDNA 的合成均见文献[8]。利用primer5.0 软件设计q-PCR 的特异性引物,内参基因选取β-Actin(表2)。以反转录得到的褐飞虱各个时期和各个组织cDNA 为模板,利用KAPA SYBR®FAST qPCR Master Mix 试剂盒进行荧光定量PCR。其反应体系为:KAPA SYBR FAST qPCR Master Mix(2×)16.5 μL,cDNA 模板1 μL,q-PCR 上下游引物各0.7 μL,ddH2O 14.1 μL,总体系为33 μL。将上述反应液分装到3 个孔中,每孔10 μL。q-PCR 反应程序:95 ℃预变性3 min,然后95 ℃变性3 s,60 ℃退火20 s,40 个循环。反应结束后确认q-PCR 的扩增曲线和融解曲线。定量数据由LightCycler480仪器自带的软件分析导出,导出数据为Ct 值。Ct 值表示每个反应管内的荧光信号达到设定的阈值时所经历的循环数。
1.5 褐飞虱NlSnf7基因的致死效应和安全性检测
1.5.1 干扰效率检测
注射法:取短翅型成虫1 d 的雌性褐飞虱或白背飞虱,用CO2将其吹晕后置于注射盘,并使其腹部朝上,最后注射其腹面口器末端右侧,注射后将褐飞虱和白背飞虱放回温室分蘖期的水稻上继续饲养,其中褐飞虱的注射总剂量每头分别为50、10、1 和0.1 ng,白背飞虱每头为200 ng。取5 龄2 d 的亚洲玉米螟,先用酒精棉球对幼虫体表进行消毒,然后用吸取好注射液毛细管在幼虫倒数第二对腹足处进行快速注射,再将幼虫放入饲料中培养,亚洲玉米螟的注射总剂量每头为20 μg。最后随机选取注射后24、48 和72 h 的褐飞虱和白背飞虱各3 头;随机选取注射后48、60 和72 h 的亚洲玉米螟各3头,按照1头/组进行分组,提取总RNA并反转录后利用q-PCR 技术检测其体内各基因的变化。
饲喂法:将合成的dsRNA 与褐飞虱人工饲料分别配制成50、10、1 和0.1 ng/μL 的混合饲料。取大小一致的4龄褐飞虱若虫进行饲喂,饲喂后的褐飞虱若虫放入人工气候培养箱中进行培养,每24 h 更换一次饲料。最后随机选取饲喂后第1、3、5 和7 天的褐飞虱各9 头,按照3 头/组进行分组,提取总RNA 并反转录后利用q-PCR 技术检测其体内各个基因的变化。
1.5.2 RNAi后致死率的统计
注射法:取短翅型成虫1 d 的雌性褐飞虱,用CO2将其吹晕后置于注射盘,并使其腹部朝上,最后注射其腹面口器末端两侧,注射后将褐飞虱放回温室分蘖期的水稻上继续饲养,然后统计注射后13 d内的褐飞虱死亡数量。
饲喂法:取大小一致的4龄褐飞虱若虫饲喂混有50、10、1 和0.1 ng/μL 4 个低剂量dsRNA 的人工饲料,饲喂后的褐飞虱若虫放入人工气候培养箱中进行培养,每24 h 更换一次饲料,并统计饲喂9 d内的褐飞虱死亡数量。
1.5.3 RNAi后蛋白变化的检测 随机收集每头注射10 ng dsRNA 片段后第1 天和第5 天的褐飞虱各9头,每3 头一组,共3 个生物学重复,进行总蛋白的提取,于4 ℃保存。然后配制SDS-PAGE 胶进行Western blot 检测。所用的SDS-PAGE 分离胶为w=10%,蛋白上样量为20 μg。电泳时程序的是80 V,30 min,100 V,50 min。转膜时的程序是100 V,50 min。孵育一抗时,NlSnf7 的效价为1∶3 000,β-Actin 的效价为1∶5 000;孵育二抗时,两者的效价均为1∶5 000。

表2 定量PCR引物Table 2 Quantitative primers
1.6 数据处理与分析
基因的相对定量数据的差异计算按照△△Ct法,并使用β-Actin 的mRNA 表达量进行校正[9]。数据以平均值±标准误表示。使用t 检验分析处理组和对照组之间基因表达量的差异,P <0.05表示差异显著,以符号“*”标记;P <0.01 表示差异极显著,以符号“**”标记。褐飞虱的死亡情况用校正死亡率进行表示,其公式为:

2 结果与分析
2.1 安全高效RNAi靶基因的获得
为获得安全高效RNAi 靶基因,本文建立了安全高效RNAi 靶基因的筛选流程(图1)。首先将本实验室的褐飞虱转录本序列与Flybase 和ibeetlebase 两大数据库中RNAi 过的序列进行同源比对,获得2 996 条基因序列,其中2 481 条有GO 注释。再将2 996 条基因与脊椎动物进行同源比对,保真值为10-5,获得unmapped 序列141 条。分析该141个基因的GO 注释数目,发现大部分基因的GO 号注释数目在1~5个之间,说明筛选出来的基因功能都较简单,安全性较高;其中有致死表型且序列ORF 区大于350 bp 的序列有15 条。将这15 个基因进行特异性dsRNA 片段设计,再将dsRNA 片段于NCBI 中进行Blastx,发现其中12 个基因的dsRNA片段只与褐飞虱同源,其分别是中心体(centrosomin, Cnn)、 周 期 蛋 白 (cycle protein, Cyc)、LOC111054118(基因名简称为Nl026080)、神经肽G蛋白偶联受体A10(neuropeptide G proteincoupled receptor A10,NGR-A10)、β-1,3-葡聚糖结合蛋白样(Beta-1,3-glucan-binding protein-like,GRP3)、羽化激素(eclosion hormone, Eh)、锌指蛋白Chinmo(zinc finger protein chinmo,Chinmo)、保幼激素酸甲基转移酶(juvenile hormone acid O-methyltransferase,Jhamt)、酚氧化酶1(prophenoloxidase 1,PPO1)、超级双胸(ultrabithorax, Ubx)、超氧化物歧化酶1 (superoxide dismutase[Cu-Zn]-like,Sod1)、眼缺陷同源物4(Eyes absent homolog 4-like,Eya4)。
通过文献阅读,将Baum 等获得的15个高效致死基因于Flybase 和Wormbase(https://wormbase.org/)下载相对应的蛋白序列,再与实验室褐飞虱转录本进行tblastn,获得92 条比对序列;然后于NCBI 中进行Blastx 和E 值分析,发现有15 个同源基因;最后将其进行特异性dsRNA 片段的设计,并将设计的dsRNA 片段于NCBI 中进行Blastx[10]。结果发现外壳蛋白复合物1 亚基β(putative coatomer subunit beta,CopI-β)、跨膜ATP 酶亚基D(putative v-ATPase subunit D,v-ATPase-D)、核糖体蛋白S4(putative 40S ribosomal protein S4,RPS4)、核糖体蛋白L9(putative 60S ribosomal protein L9,RpL9)、核糖体 蛋 白S14A(putative ribosomal protein S14A,RPS14A)、外壳蛋白复合物1 亚基β′(putative coatomer subunit β‘-like,CopI-β′)、核糖体蛋白L19(putative 60S ribosomal protein L19,RpL19)、带电多泡体蛋白2A(putative charged multivesicular body protein 2a-like,CHPM2A)和转运必需内吞体复合物Ⅲ亚基Snf7(putative ESCRT Ⅲ_Snf7 ortholog,Snf7)的dsRNA 片段安全性较高。此外,将Ulrich 等在赤拟谷盗RNAi 后致死率达100%的11 个基因于ibeetlebase下载相对应的蛋白序列,再与实验室褐飞虱转录本进行tblastn,获得161 条比对序列,最后经NCBI Blastx 和E 值分析和设计特异性dsRNA 片段后,发现有8个安全性较高的dsRNA片段,分别是NF-kappa-B inhibitor cactus-like isoform X1Cact)、信号识别粒子54 000 蛋白(signal recognition particle 54 000 protein,Srp54k)、Protien ROP(ROP)、α可溶性NSF 附着蛋白(alpha-soluble NSF attachment protein, αSnap)、热休克蛋白70-2(heat shock protein 70-2,Hsp70-2)、26S 蛋白酶体non-ATPase 调节亚基6(26S proteasome non-ATPase regulatory subunit 6,PSMD6)、Protein Gawky (Gw) 和ATP 酶家族3A结构域含蛋白2 样亚型X1(ATPase family AAA domain-containing protein 2-like isoform X1,Atad2)[11]。
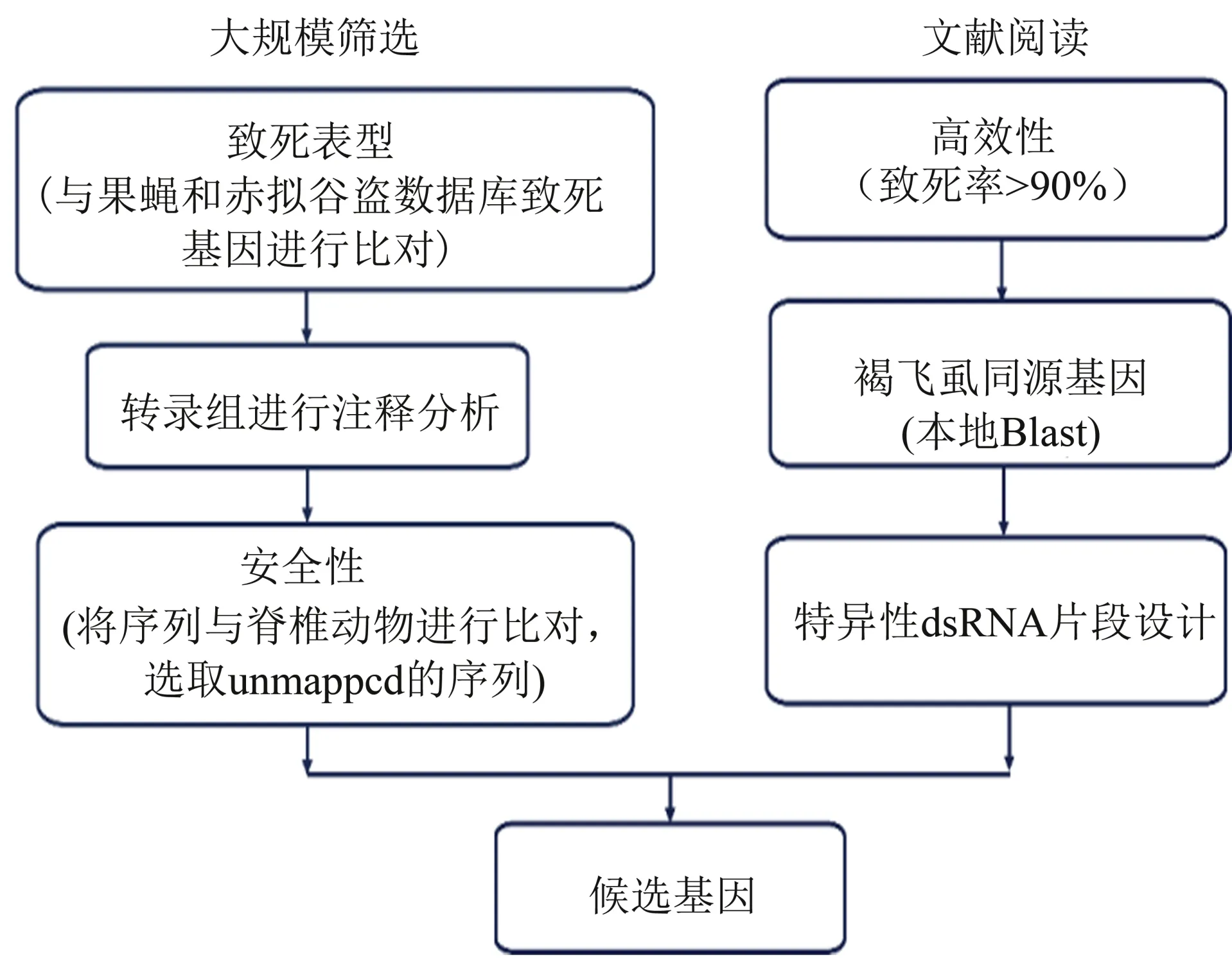
图1 褐飞虱安全高效RNAi靶基因的筛选流程Fig.1 The screening process of safe and efficient RNAi target genes of BPH
为确保dsRNA 片段的可操作性、安全性和高效性,进一步制定了筛选的原则:一是ORF 区的长度大于500 bp,便于设计dsRNA 和引物;二是设计的dsRNA 片段只与褐飞虱同源或与两种稻飞虱同源;三是选择已知RNAi 后有极高死亡率的基因或昆虫特异性基因。基于上述筛选原则,选择了中心体(NlCnn)、LOC111054118(Nl026080)、保幼激素酸甲基转移酶(NlJhamt)、外壳蛋白复合物1 亚基β(NlCopI-β)、核糖体蛋白L9(NlRpL9)、眼缺陷(NlEya4)、 NF-kappa-B inhibitor cactus-like isoform X1(NlCact)、26S 蛋白酶体non-ATPase 调节亚基6(NlPSMD6)、Protein Gawky(NlGw)、几丁质合成酶A(NlCHSA)、 转 运 必 需 内 吞 体 复 合 物Ⅲ亚基Snf7同源基因(NlSnf7)和带电多泡体蛋白2A(NlCHMP2A)共 12 个 基 因 进 行 后 续 的 研究(表3)。

表3 特异性dsRNA片段Table 3 Specific dsRNA fragments
2.2 安全高效RNAi靶基因的初筛
采用注射法RNAi技术分析上述12个靶基因的RNAi 效率。首先合成了12 个基因的dsRNA 片段,然后以低剂量(每头10 ng)注射成虫一天雌性褐飞虱,检测注射后24、48和72 h的RNAi效率。结果 显 示NlCnn、Nl026080、NlJhamt、NlCopI-β、NlRpL9、 NlPSMD6、NlCHSA 和NlSnf7 8 个基因在注射后3个时间点的mRNA 表达水平均极显著下降(图2);其中NlSnf7 是基于已有研究筛选出来的管家基因,在玉米根萤叶甲(Diabrotica virgifera virgifera) 的研究中, DvSnf7 表现出高效致死性[10,12],表明NlSnf7有较高的研究价值。
2.3 NlSnf7基因的时空表达
褐飞虱不同龄期的定量PCR 结果显示,NlSnf7在褐飞虱各个发育历期均有表达,在成虫期的表达量明显高于若虫期,并在成虫第11天达到顶峰;不同组织的定量PCR结果显示,NlSnf7在头部的表达量最高,其次分别是卵巢、表皮、足、脂肪体和中肠组织(图3)。
2.4 NlSnf7基因的致死效应和安全性检测
2.4.1 注射法致死效应 利用注射法RNAi 技术,检测了每头注射剂量为50、10、1 和0.1 ng 4 个低剂量的RNAi 干扰效率,发现dsNlSnf7 在4 个低剂量干扰48 h 后,基因表达水平均极显著下降(图4)。为进一步研究dsNlSnf7片段的致死效率,分别统计了注射4 个低剂量dsNlSnf7 后13 d 内雌性褐飞虱的校正死亡率。结果发现注射不同剂量dsNlSnf7后的褐飞虱校正死亡率持续上升,其中在第13 天的校正死亡率分别为75.05%、63.93%、49.44%和23.04%(图4)。
2.4.2 饲喂法致死效率 为了模拟田间环境,利用饲喂法RNAi 技术对褐飞虱进行致死效率检测。通过饲喂褐飞虱4 龄若虫50、10、1 和0.1 ng/μL 4个低剂量dsNlSnf7 的人工饲料,发现NlSnf7 的RNAi 干扰效率处于相对动态的过程。NlSnf7 的基因表达水平在饲喂50 ng/μL 剂量后的4 个时间点均显著下降;在饲喂10 ng/μL 剂量的第3 天后显著下降;在饲喂1 ng/μL 剂量第5 天后显著下降;在饲喂0.1 ng/μL 剂量后,与对照组相比有下降趋势,但不显著(图5)。之后统计了对褐飞虱分别饲喂4个不同剂量dsNlSnf7 后9 d 内的校正死亡率,结果发现第9 天的校正死亡率分别为50.24%、32.69%、23.33%和11.04%,表明饲喂低剂量的dsNlSnf7也具有一定的致死效应(图5)。
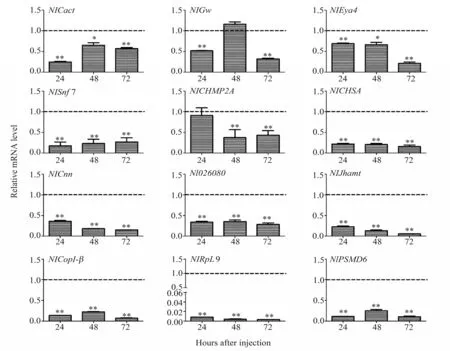
图2 12个基因的RNAi效率Fig.2 The RNAi efficiency of 12 genes
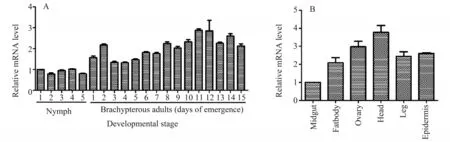
图3 NlSnf7的龄期和组织表达模式Fig.3 The expression patterns of NlSnf7 at different ages and tissues

图4 注射dsNlSnf7后的干扰效率和校正死亡率Fig.4 The interference efficiency and the corrected mortality rate after injection dsNlSnf7
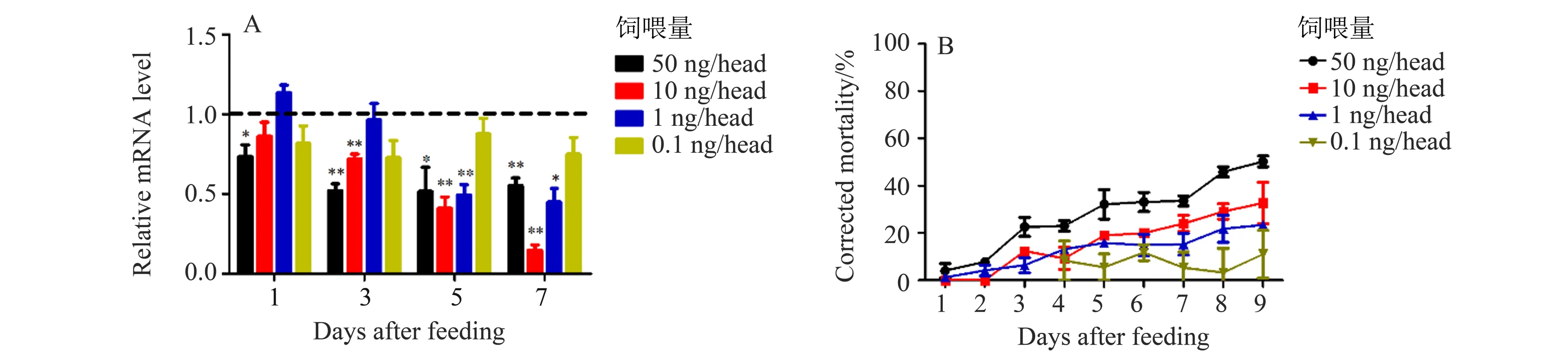
图5 饲喂dsNlSnf7后的干扰效率和校正死亡率Fig.5 The interference efficiency and the corrected mortality rate after feeding dsNlSnf7
2.4.3 蛋白变化和安全性检测 为了验证注射dsNlSnf7后褐飞虱相对应基因的蛋白水平是否也发生变化,分别收集每头注射剂量10 ng dsRNA 片段后第1 天和第5 天的褐飞虱进行蛋白水平检测。结果发现注射dsNlSnf7后的NlSnf7蛋白表达量均显著降低(图6)。同时,为了验证dsNlSnf7 片段对其他物种的安全性问题,选择无连续21 bp 相同序列的亚洲玉米螟(O. furnacalis) 和白背飞虱(S.furcifera)进行dsNlSnf7 注射。结果发现与对照组(注射dsGFP)相比,实验组均无显著变化,说明dsNlSnf7片段的安全性较高。
3 结论与讨论
害虫防治既要保证效果,又要保证安全性。本文建立的安全高效RNAi 靶基因的筛选流程包括两条途径:实验室转录组分析和文献阅读(图1)。该筛选流程将现有的两大RNAi 靶基因筛选策略进行了整合,分别是大规模或高通量RNAi 靶点筛选策略和基于已知功能基因寻找同源基因的筛选策略,这与现有研究的单一筛选流程相比,综合性更强[13-15]。
Snf7 是一类保守的空泡分选蛋白,是ESCRT-Ⅲ的一个核心亚基,存在除古细菌外的所有生物中[16];Snf7在果蝇中的同系物为Shrb(Shrub),在人类的同系物为CHMP4[17]。本文研究的NlSnf7 在褐飞虱的整个发育历期均有表达,说明NlSnf7 是褐飞虱的管家基因(图3)。目前,Snf7 在鞘翅目玉米根萤叶甲中的研究最多[5,10,18-19],但还未在褐飞虱中开展相关研究。通过研究发现饲喂褐飞虱四龄若虫低剂量的dsNlSnf7的校正死亡率会稍低于饲喂玉米根萤叶甲二龄幼虫低剂量的dsDvSnf7 的校正死亡率[12],推测这一结果可能与昆虫口器类型及昆虫龄期有关。褐飞虱属于刺吸式口器昆虫,与玉米根萤叶甲的咀嚼式口器相比,其通过饲喂法获取的dsRNA 量较少。此外有研究表明,昆虫龄期越小,死亡率越高[20-21]。同时RNAi 靶基因的效果可能与昆虫物种也密切相关,如饲喂同为刺吸式口器的烟草蓟马(Thrips tabaci)500 ng/μL 高剂量的dsSnf7 后,其死亡率为72%[22];饲喂茄二十八星瓢虫(Henosepilachna vigintioctopunctata)5 ng/μL 的dsSnf7,可导致54%的死亡率[23];饲喂非洲甘薯象鼻虫(Cylas brunneus)1 μg/mL 的dsSnf7,其死亡率可达69.1%[24]。此外,递送dsRNA 的方式也对致死效果存在一定的影响,如通过壳聚糖形式向埃及伊蚊(Aedes aegypti)递送dsSnf7,其死亡率为46.67%,而通过碳量子点纳米技术向埃及伊蚊递送dsSnf7的死亡率可达53.33%[25]。
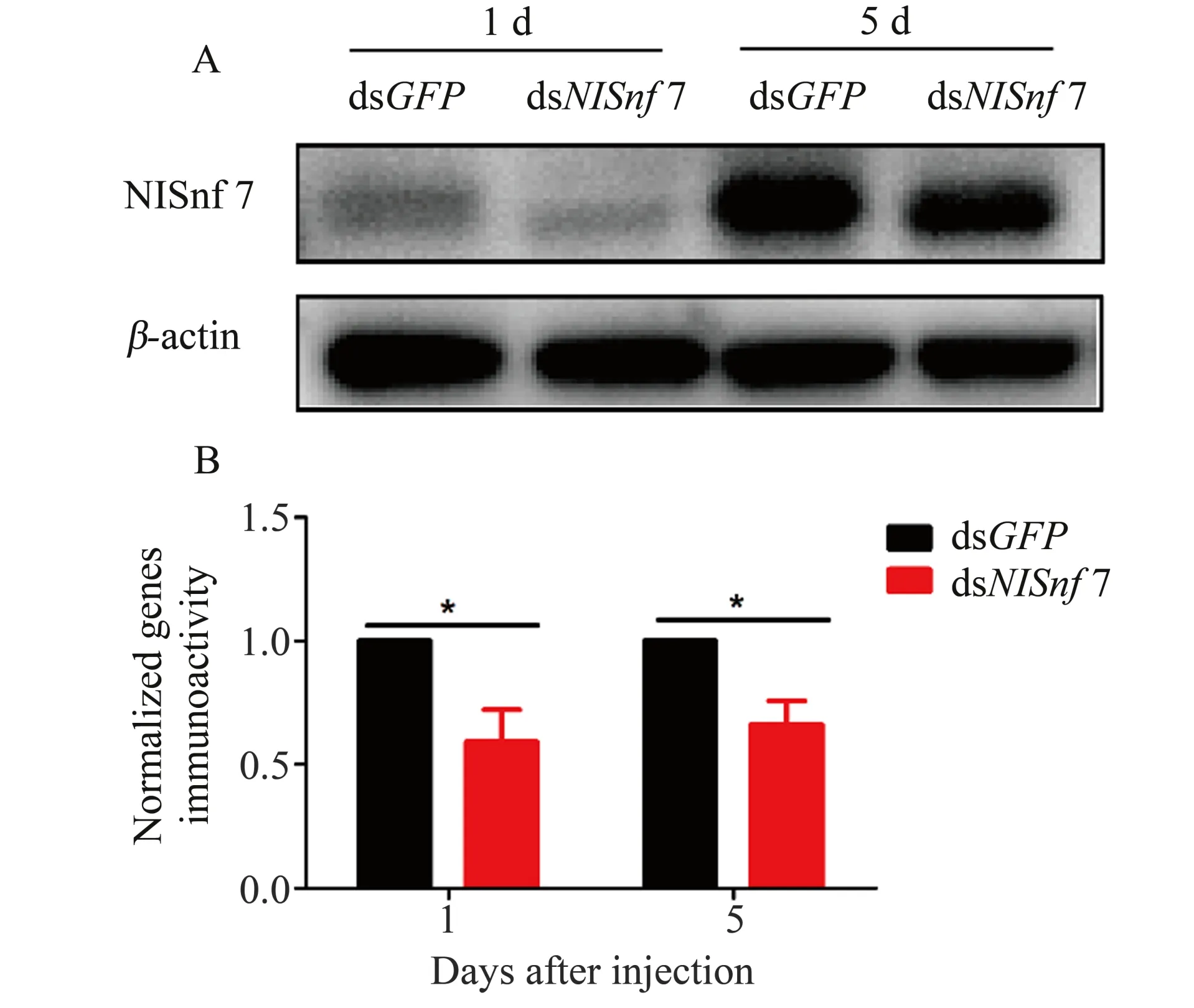
图6 注射dsNlSnf7后的蛋白表达情况Fig.6 The protein expression level after injection dsNlSnf7
本文利用的RNAi 技术实施方式主要是注射法和饲喂法,其中注射法虽会对虫体造成一定的机械伤害,但有定量导入dsRNA 和实验周期短的优点,可用于高通量初筛。饲喂法虽实验周期长,但基本不会造成机械损伤,可以模拟田间褐飞虱的取食模式,更好地统计死亡率。通过注射法和饲喂法确定dsNlSnf7 片段为高效致死的RNAi 靶标分子后,本文进一步在非目标生物中对其进行了安全性实验验证。研究结果显示在非目标生物中注射dsRNA 后无RNAi 现象,这与已有研究结果一致[18,26],说明dsNlSnf7 片段的安全性很高。综上所述,dsNlSnf7片段是个安全高效的褐飞虱防治分子靶标,具有较高的应用价值。

