钛金属表面骨诱导型可降解壳聚糖涂层的构建及生物活性调控
李海霞, 何宏燕, 董秀琳, 常铃雪, 刘昌胜
(华东理工大学材料科学与工程学院,教育部医用生物材料工程研究中心,上海 200237)
钛金属材料具有质轻、无毒、易加工、生物相容性好、弹性模量与人骨相近等一系列优点,已被广泛用于固定材料和矫形/牙科植入物[1,2],但钛植入材料在植入初期稳定性不佳、成骨活性不足,进而导致初期长入缓慢,甚至引起关节松动或脱落[3,4]。仅仅依靠金属材料的表/界面结构,缩短种植周期、促进早期骨整合的作用有限,最为有效的方法是引入生长因子[5],该方法可加强种植材料与周围细胞相互交流的生物学信号,进而促进骨组织与植入体之间的骨性键合。
骨形态发生蛋白(BMP)是目前公认的有效促进细胞生长、诱导成骨分化的的局部生长因子,其高效的成骨活性已被充分认可[6-8]。蛋白质的固载方式分为:非共价固载[9-11]和共价固载[12]。非共价固载蛋白质的量有限、停留时间短、易发生突释;共价固载蛋白质条件苛刻、操作复杂、反应条件较剧烈。要实现蛋白质的高效固载,需要瞬间固定,且需要一定的时间与周围细胞发生作用使诱导活性得到充分发挥。采用静电喷涂(ES)法制备材料的周期短、条件温和、涂层厚度可控,该方法可以把BMP 快速、稳定固载于金属表面[13],但需要均一、稳定的导电溶液。壳聚糖(CS)是一种天然高分子多糖,具有优异的生物相容性和可降解性,是固载蛋白质良好的载体[14],其氨基质子化(NH2与H+结合)形成NH3+结构,使得CS 溶液带正电。
在钛金属表面构建微米/亚微米级的结构有利于细胞早期黏附,促进成骨[15]。喷砂酸蚀(SLA)可构建微米级别的形貌,改善表面粗糙度,增加比表面积。植入活性亲水的钛金属材料更有利于细胞黏附、增殖,加速骨结合[16]。阿仑膦酸钠(ALN)分子结构中有大量的亲水性基团,物理吸附可以明显改善材料表面的亲水性,抑制破骨细胞,促进成骨,已被美国食品药品监督管理局(FDA)批准用于临床试验[17]。本文首先将工业纯钛片(Ti)通过SLA 处理制得SLA-Ti,然后SLA-Ti 物理吸附ALN 进行亲水性处理制得ALN-SLA-Ti,最后采用静电喷涂法将CS 与蛋白质的混合溶液快速、稳定地喷涂于ALN-SLA-Ti 表面制得CS 涂层。通过扫描电子显微镜表征各钛片的表面形貌,选用小鼠成肌细胞(C2C12)和大鼠骨髓间充质干细胞(rBMSCs)与钛片共培养,评价钛片改性后的表面对细胞黏附、增殖与成骨分化能力的影响。
1 实验部分
1.1 原料和试剂
Ti:TA2 型,威高集团;CS:η>400 mPa·s 上海阿拉丁生化科技有限公司;ALN:分析纯,上海泰坦科技有限公司;冰乙酸:分析纯,上海凌峰化学试剂有限公司;重组人骨形态发生蛋白-2(rhBMP-2):生化级,上海瑞邦有限公司;四唑盐(MTT)、异硫氰酸荧光素(FITC)标记的鬼笔环肽、4',6-二脒基-2-苯基吲哚(DAPI)、二甲基亚砜(DMSO):生化级,美国Sigma-Aldrich 公司;C2C12 细胞:美国模式培养物集存库;rBMSCs:本实验室自行提取,上海斯莱克公司;牛血清白蛋白(BSA)、碱性磷酸酶(ALP)活性检测试剂盒:上海碧云天生物技术研究所。
1.2 仪器
美国KDS 公司100 型恒流注射泵;日本日立公司S-4800 型扫描电子显微镜;上海中晨数字设备JC2000D2型水接触角测量仪;美国Molecular Devices 公司SPECTRAmax 384 型酶标仪;日本Nikon 公司A1R 型共聚焦激光扫描显微镜。
1.3 SLA-Ti 的表面处理
用超纯水配制质量浓度为0.02 μg/mL 的ALN 溶液,然后用0.22 μm 过滤膜无菌过滤该溶液,SLA-Ti 在过滤后的ALN 溶液中4 ℃浸泡2 h,浸泡后的SLA-Ti 在无菌超净台通风干燥约15 min,干燥后的钛片标记为ALN-SLA-Ti。
1.4 涂层制备
用超纯水配制w=0.5%的醋酸溶液,称取60 mg CS 溶解于4 mL 的醋酸溶液中,制备w=1.5%的CS 溶液,根据实验需求再加入BSA 或rhBMP-2 制备成CS 和蛋白质的混合溶液。将微流注射器置于钛片正上方,在静电场作用下喷涂一定时间制得涂层。喷涂工艺参数:喷涂速率为0.3 mL/h,正电压为10~11 kV,不锈钢针头与钛片表面的距离为20~30 mm。当喷涂时间分别为3、5、10 min 时,喷涂后的SLA-Ti 分别标记为SLATi-3、SLA-Ti-5、SLA-Ti-10,喷涂后的ALN-SLA-Ti 分别标记为ALN-SLA-Ti-3、ALN-SLA-Ti-5、ALN-SLA-Ti-10,其制备示意图如图1 所示。
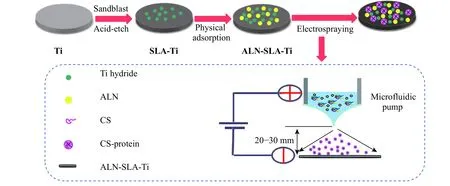
图 1 钛片表面可降解生物涂层的构建示意图Fig. 1 Schematic diagram of constructing degradable bio-coating on titanium surface
1.5 蛋白质的体外释放研究
1.5.1 固载方式对BSA 体外释放的影响 分别配制BSA 溶液、BSA-CS 混合溶液,其中BSA 的质量浓度为30 mg/mL,通过物理吸附BSA 溶液(方式A)、蛋白滴加BSA 溶液(方式B)、蛋白滴加BSA-CS 混合溶液(方式C)、静电喷涂BSA-CS 混合溶液(方式D)、静电喷涂后冻干BSA-CS 混合溶液(方式E)固载BSA 于ALNSLA-Ti 表面,处理时间为5 min,研究BSA 的体外释放情况。用酶标仪在波长562 nm 处测定每孔的光学密度(OD),根据BSA 标准曲线计算蛋白质释放量。
1.5.2 喷涂时间对BSA 体外释放的影响 配制BSA-CS 混合溶液,其中BSA 的质量浓度为30 mg/mL,在ALN-SLA-Ti 表面采用静电喷涂的方式分别喷涂3、5、10 min 固载BSA,研究BSA 的体外释放情况。用酶标仪在波长562 nm 处测定每孔的OD 值,根据BSA 标准曲线计算蛋白质释放量。
1.6 生物学行为评价
1.6.1 细胞黏附与增殖 将Ti、SLA-Ti、ALN-SLA-Ti、ALN-SLA-Ti-5(固载约2 μg rhBMP-2)分别与1 mL 悬浮液(约含20 000 个C2C12 细胞)在24 孔板中培养12 h 后,对孔板中的细胞进行固定、染色、表面黏附形态观察。将Ti、SLA-Ti、ALN-SLA-Ti、SLA-Ti-5、ALN-SLA-Ti-5(固载约2 μg rhBMP-2)分别与1 mL 细胞悬浮液(约含20 000 个C2C12 细胞)在24 孔板中共培养 1、3 d,加入100 μL MTT 溶液,在37 ℃下孵育4 h;吸去多余溶液,加入500 μL DMSO,在37 ℃恒温震荡15 min;蓝紫结晶物溶解后,从24 孔板中取200 μL 溶液加入96 孔板中,用酶标仪在波长492 nm 下测定每孔的OD 值。
1.6.2 ALP 活性检测 采用ALP 活性法对各钛片表面细胞的成骨分化能力进行测试。将Ti、SLA-Ti、ALNSLA-Ti、SLA-Ti-5、ALN-SLA-Ti-5(固载约2 μg rhBMP-2)与1 mL 悬浮液(含30 000 个rBMSCs 细胞)在24 孔板中共培养4、7、14 d,每隔3 d 换1 次培养液。共培养结束后,吸去多余溶液,PBS 清洗2 次,每孔加500 μL裂解液,37 ℃恒温震荡90 min;每孔取10 μL 溶液,孵育30 min 后,在波长562 nm 下测定每孔的OD 值;从24 孔板中取50 μL 溶液至96 孔板后,再加100 μL 的ALP 工作液孵育2 h,在波长405 nm 处测定每孔的OD值,进而计算钛片表面的ALP 的活性值。
2 结果与讨论
2.1 钛片的表面形貌
图2(a1~a3)展示了SLA-Ti 喷涂不同时间的表面形貌。SLA-Ti-3 表面只保留少许孔洞结构,0.2~4 μm的孔洞微结构基本被覆盖;随着喷涂时间增加,SLA-Ti 表面结构被涂层完全覆盖,基本为平面形貌。图2(a4~a6)展示了ALN-SLA-Ti 喷涂不同时间的表面形貌,ALN-SLA-Ti-3 表面留有较多孔洞结构;ALNSLA-Ti-5 表面形成直径约5 μm 的微球涂层,且该表面仍有孔洞结构,增加了钛片表面粗糙度和比表面积,为后期细胞的黏附和增殖提供了有利的条件;ALN-SLA-Ti-10 表面覆盖了微球和孔洞结构,钛片表面不均匀。

图 2 SLA-Ti(上)与ALN-SLA-Ti(下)喷涂不同时间的表面形貌Fig. 2 Surface morphology of SLA-Ti (up) and ALN-SLA-Ti (down) after spraying differen time
2.2 钛片表面的亲疏水性
表1 比较了不同钛片表面的接触角。SLATi 表面接触角约为101°,其表面疏水;ALN-SLATi 表面接触角约为16°,亲水性显著增加。在SLATi 表 面 喷 涂3、5、10 min 时,接 触角 分 别 约 为107°、100°、97°,CS 涂层的厚度并不能明显改善SLA-Ti 表面的亲疏水性。在ALN-SLA-Ti 表面喷涂3、5、10 min 时,接触角分别约为 37°、59°、87°,接触角随着涂层厚度增加而逐渐增大。已有研究表明材料表面的亲疏水性对细胞的黏附有很大影响,当接触角在 30°~70°时更有利于细胞黏附[18]。因此,ALN-SLA-Ti-5 的亲水性表面为后期细胞的黏附提供了有利的条件。
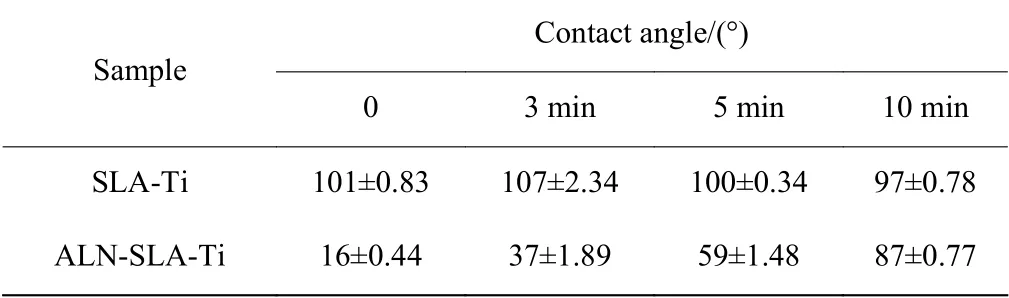
表 1 不同钛片表面的接触角Table 1 Contact angles of different titanium surfaces
2.3 蛋白质的控释行为
图3(a)比较了不同固载方式对蛋白质释放行为的影响。通过方式A 固载BSA 时,BSA 的突释量约69%,突释现象最为严重,12 h 内几乎完全释放。通过方式B 固载BSA 时,BSA 的突释量约为56%,1 d 内几乎完全释放。通过方式C 固载BSA 时,BSA 的突释量约为43%,5 d 内几乎完全释放。通过方式D 固载BSA 时,BSA 突释量约为25%,7 d 后BSA 的释放量约为81%;通过方式E 固载BSA 时,冻干前后BSA 释放量相似。因此,CS 载体对蛋白质的释放起到一定的缓释作用,冻干对蛋白质的释放行为没有显著影响。
图3(b)比较了喷涂时间对蛋白质释放行为的影响。喷涂3 min 后,BSA 的突释量约37%,钛片表面涂层偏薄,释放迅速,7 d 后BSA 的释放量约为95%;喷涂5 min 后,BSA 的突释量约26%;喷涂10 min 后,BSA 的突释量约为16%。喷涂5、10 min 后的钛片表面涂层较厚,减缓了BSA 的释放速率,7 d 后其释放量约为80%。因此,通过调节喷涂时间可控制蛋白质的释放量。
2.4 涂层的降解行为
图4 显示了ALN-SLA-Ti-5 表面的降解情况。随着降解时间的增加,钛片表面构建的CS 涂层逐渐降解。3 d 后,钛片表面在一定程度上维持着微球形貌;7 d 后,钛片表面剩余的涂层量较少,微球形貌基本消失;10 d 后,钛片表面有少量的CS 涂层,仍具有一定的可降解性。因此,蛋白质随着CS 涂层的降解持续释放,为后期细胞的黏附、增殖和早期成骨分化不断提供生长因子。
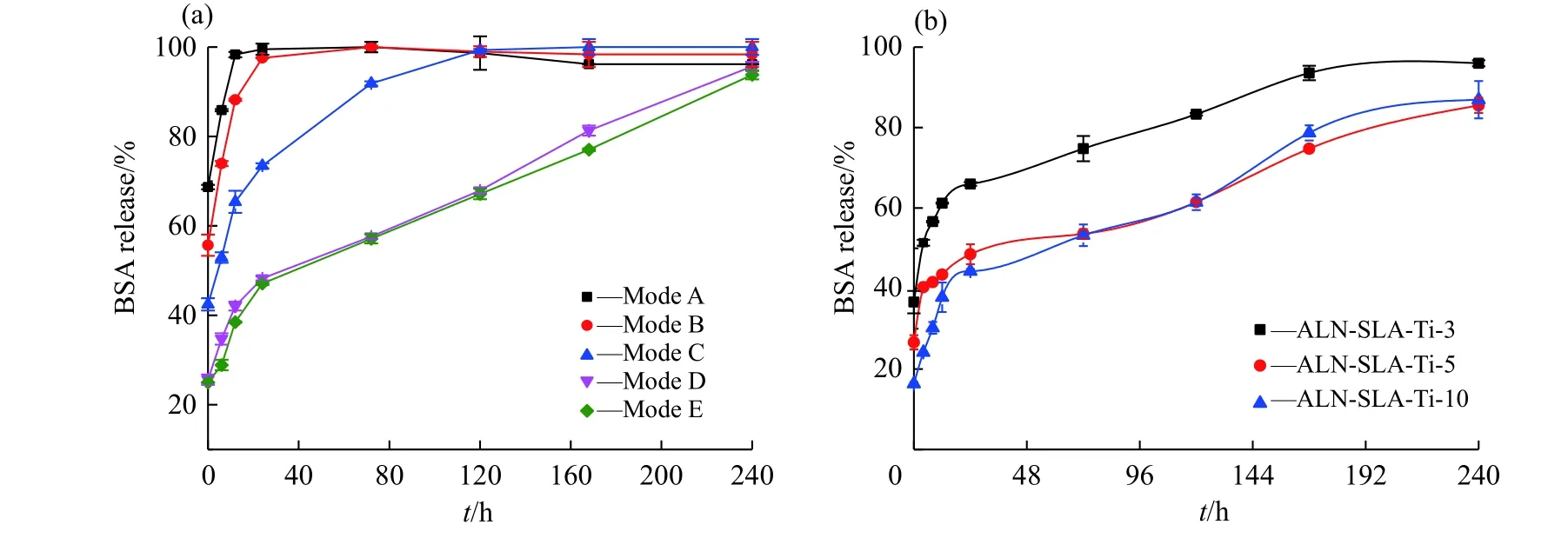
图 3 固载方式(a)和喷涂时间(b)对钛片表面蛋白质释放行为的影响Fig. 3 Effects of loading methods (a) and spraying time (b) on the released behavior of titanium surface

图 4 CS 涂层在PBS 缓冲液中的降解行为Fig. 4 Degradation behavior of CS coatings in PBS buffer
2.5 细胞的黏附与增殖

图 5 C2C12 细胞在钛片表面共培养12 h 后的黏附形态Fig. 5 Adhesion morphology of C2C12 cells after co-culture on the surface of titanium for 12 h
图5 比较了C2C12 细胞在钛片表面共培养12 h后的黏附形态。SLA-Ti 表面黏附的细胞数量明显多于Ti 表面黏附的细胞数量;ALN-SLA-Ti 表面黏附的细胞数量略多于SLA-Ti 表面黏附的细胞数量;ALN-SLATi-5 表面黏附的细胞数量最多。图6(a)比较了C2C12 细胞在钛片表面共培养1、3 d 后的增殖情况。共培养1 d 后,SLA-Ti、ALN-SLA-Ti、SLA-Ti-5、ALN-SLA-Ti-5 表面细胞的活性略高于Ti 表面细胞的活性。共培养3 d后,前述样品表面细胞的活性明显高于Ti 表面细胞的活性,其中ALN-SLA-Ti-5 表面细胞的增殖效果最明显。
2.6 钛片表面的成骨分化能力
图6(b)比较了rBMSCs 细胞在钛片表面共培养1、7、14 d 后的成骨分化情况。共培养1 d 后,5 组钛片表面细胞的ALP 活性没有显著差异,因为细胞与钛片共培养时间短,细胞还处于黏附增殖期,rhBMP-2 对细胞的促成骨分化能力较弱。共培养7 d 后,SLA-Ti、SLA-Ti-5、ALN-SLA-Ti 表面细胞的ALP 活性略高于Ti 表面细胞的ALP 活性,ALN-SLA-Ti-5 表面细胞的ALP 活性最高,成骨分化能力明显。共培养14 d 后,Ti、SLA-Ti、SLA-Ti-5 表面细胞的ALP 活性变化较小,而ALN-SLA-Ti 表面细胞的ALP 活性略有增加,ALNSLA-Ti-5 表面细胞的ALP 活性最高,成骨分化能力明显。
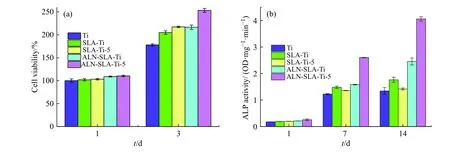
图 6 C2C12 细胞在钛片表面共培养1、3 d 后的增殖行为(a);rBMSCs 细胞在钛片表面共培养1、7、14 d 时的ALP 活性(b)Fig. 6 Proliferation of C2C12 cells after co-culture on the surface of titanium for 1 d and 3 d (a); ALP activity of rBMSCs cells on the surfaces of titanium for 7 d and 14 d (b)
3 结 论
(1)ALN-SLA-Ti-5 表面形成直径约5 μm 的微球涂层,并保留了SLA-Ti 表面的孔洞结构,为后期细胞的黏附、增殖提供了有利的条件。
(2)通过调节蛋白质固载方式、喷涂时间可调控蛋白质的载入量;随着CS 涂层降解,蛋白质可实现持续、高效的释放,缓解了突释现象。
(3)固载rhBMP-2 的ALN-SLA-Ti-5 表面更有利于细胞的黏附和增殖,促进细胞早期成骨分化。

