自噬在大鼠脑缺血再灌注损伤中的作用及机制研究
陈运转 吕爱红 王军杰 辛 凯 赵 曼△
1)郑州人民医院,河南 郑州 450000 2)河南中医药大学第三附属医院,河南 郑州 450000
研究报道缺血性脑血管疾病占脑卒中的80%[1],严重危害人类健康。大脑缺血后,如果脑组织坏死前闭塞的脑血管再通,会导致脑神经损伤进一步加重,即脑缺血再灌注损伤,这是多种脑血管疾病的重要病理生理基础。脑缺血后不可避免地发生缺血再灌注损伤,脑缺血再灌注损伤的确切机制尚未完全阐明,目前研究表明氧化应激、炎症、凋亡在其中起非常重要的作用[2-5]。自噬(autophagy)指细胞内的溶酶体降解自身损坏的细胞器和其他无用的大分子过程,对于维持缺氧、营养缺乏等压力条件下的细胞稳态和生存具有至关重要的作用[6-7]。最近的研究显示自噬可能参与对脑缺血/再灌注后的神经元损伤,其不仅可以通过经典的溶酶体途径清除受损的细胞器和生物大分子,而且可以通过影响凋亡和坏死的发生、发展调控神经元死亡[8]。微血管病变和血栓形成所致的脑神经损伤是狼疮脑病的主要病理基础,有研究发现自噬障碍与狼疮脑病的发生有关。然而,目前对脑缺血再灌注损伤中自噬现象的研究尚不深入。脑缺血再灌注损伤后,自噬如何激活以及自噬参与脑神经损伤的作用机制尚未明确。因此,本实验旨在通过研究自噬在脑缺血再灌注中发挥的作用,以期进一步了解自噬在神经细胞损伤中的机制,为将来通过调控细胞自噬治疗狼疮脑病提供理论依据。
1 材料与方法
1.1实验动物健康雄性SD大鼠(n=108),鼠龄3~4个月,体质量220~250 g(北京华阜康公司)。
1.2主要试剂3-甲基腺嘌呤(美国Sigma公司),10%水合氯醛(北京化工三厂),2,3,5-氯化三苯基四氮唑(TTC)(北京中杉金桥生物技术有限公司)。
1.3动物分组及模型制作
1.3.1 动物分组:选用健康SD大鼠(n=108),随机分为3组各36只:①假手术组;②对照组;③3-MA组,然后根据再灌注时间(6 h、12 h和24 h)将各组再随机分为3个亚组各12只。假手术组:手术分离右侧颈总动脉;对照组:脑缺血再灌注损伤模型建立前30 min,左侧侧脑室注射0.9%氯化钠注射液0.6 μL;3-MA组:脑缺血再灌注损伤模型建立前30 min,左侧侧脑室注射3-MA溶液0.6 μL(约合600 nmoL)。
1.3.2 建立模型:参照以往实验方法并改良,建立脑缺血再灌注动物动物模型:①10%水合氯醛(3.0 mL/kg)腹腔注射麻醉;②麻醉后将大鼠固定在操作台上,取仰卧位;③颈部正中纵行切开长约3.0 cm的皮肤,游离皮下组织;④游离右侧颈总动脉,并向头部游离,自颈总动脉分叉处向远端分离颈外动脉和颈内动脉;⑤动脉夹夹闭颈内动脉;颈总动脉末端处剪一小口,向近端牵拉颈总动脉残端结扎线,将颈总动脉末端和颈内动脉方向一致,将线栓处理端置入,留线适当结扎;⑦取下动脉夹,向远端插入线栓,插入深度18~20 mm;⑧结扎颈总动脉残端插线处,固定线栓,将结扎丝线剪断;皮肤外保留线栓尾端10 mm,逐层缝合;⑨2 h后,大鼠麻醉状态下向近端牵拉线栓使血供恢复,并剪断线栓尾端。
1.4模型成功的判定假手术组大鼠术后未见神经功能缺失,对照组和3-MA组大鼠经过手术后可见,栓塞对侧的大鼠肢体出现行走异常或活动性功能障碍,严重的出现昏迷,据此证实大鼠局灶性脑缺血再灌注损伤模型制作成功。
1.4.1 神经行为学评分:采用Longa 5[9]分法,根据实验分组在相应时点对大鼠神经行为学进行评分。评分标准:0分:无神经功能缺失症状;1分:提尾悬空后不能伸展左侧前爪;2分:行走向左侧转圈;3分:行走困难,并向左侧倾倒;4分:不能自发行走或昏迷。评分1~3分大鼠纳入研究。
1.4.2 TTC染色:根据实验分组在相应时点,10%水合氯醛以剂量4.0 mL/kg注射于大鼠腹腔,麻醉满意后处死。取出脑组织,将小脑、脑干低位切除出来,冷冻在-20 ℃冰箱 min,冠状位,由前向后将脑组织切成5片,快速放入2%TTC溶液中,在37 ℃恒温干燥箱中避光染色30 min(中间翻转几次,均匀、充分染色),最后将脑组织切片用4%多聚甲醛溶液固定,24 h后拍照,正常脑组织与TTC反应呈红色,脑梗死组织呈苍白色。TTC图像分析系统测定梗死面积与脑片面积百分比值。
1.4.3 脑组织含水量:根据实验分组在相应时点,10%水合氯醛麻醉后断头处死。快速取出脑组织,将嗅球、小脑、脑干分离出来,分离后的脑组织沿中线分为左右半球,将右侧大脑半球放在精密电子天平,称重为脑组织湿质量。后置于电热恒温(70 ℃)干燥箱,72 h后恒质量(连续两次脑组织称质量差<0.001 g),称重为脑组织干质量。根据Elliot公式,计算出各组大鼠脑组织干湿质量百分比。Elliot公式:脑组织含水量%=(湿质量-干质量)/湿质量×100%。
1.4.4 透射电子显微镜:①电镜标本制作:根据实验分组在相应时点,10%水合氯醛麻醉后断头处死。快速取出脑组织,在冰上将右侧海马组织分离出来,后将其切割成体积约1 mm3的组织块,预冷2.5%戊二醛溶液,将组织块迅速放入其中,4 ℃冰箱保存,完成预固定。②电镜切片制备流程及染色:漂洗→后固定→脱水→浸透→包埋→切片及染色→摄片(透射电子显微镜观察海马神经细胞)。

2 结果
2.1神经行为学评分依据Longa 5分法,对大鼠神经行为学进行评分。假手术组大鼠相应时点未出现神经功能缺失症状,对照组和3-MA组大鼠相应时点出现神经功能缺失症状,如行走向左侧画圈、向左侧倾倒、偏瘫、追尾现象、前爪抓力下降、后肢向后移位、爬行困难等。对照组和3-MA组大鼠相应时点Longa评分与假手术组组间比较差异均有统计学意义(P<0.05)。对照组和3-MA组大鼠相应时点Longa评分组间比较差异均有统计学意义(P<0.05)。见表1。
2.2TTC染色假手术组大鼠相应时点脑组织未见梗死灶,呈红色,均匀一致。对照组和3-MA组大鼠相应时点左侧脑组织呈红色,均匀一致,未见梗死灶,右侧脑组织见边界清楚、面积不等的呈苍白色的梗死灶。对照组和3-MA组大鼠相应时点脑梗死体积百分比与假手术组组间比较差异均有统计学意义(P<0.05)。对照组和3-MA组大鼠相应时点脑梗死面积百分比组间比较差异均有统计学意义(P<0.05)。见表2、图1。
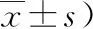
表1 各组大鼠Longa评分结果 (分,
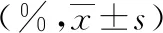
表2 各组大鼠脑梗死面积百分比结果
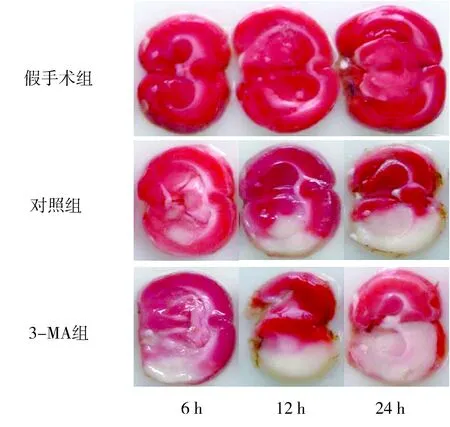
图1 各组大鼠TTC染色观察Figure 1 TTC staining observation of rats in each group
2.3脑组织含水量假手术组大鼠相应时点脑组织含水量大致保持恒定,对照组和3-MA组大鼠脑组织含水量随着时间的推移而升高。对照组和3-MA组大鼠相应时点脑组织含水量与假手术组组间比较差异均有统计学意义(P<0.05)。对照组和3-MA组大鼠相应时点脑组织含水量组间比较差异均有统计学意义(P<0.05)。见表3。
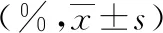
表3 各组大鼠脑组织含水量结果
2.4透射电子显微镜假手术组大鼠相应时点海马神经细胞中细胞器(线粒体、高尔基体)结构完整,细胞核膜完整,细胞核内染色质均匀分布,未见细胞自噬现象。对照组大鼠在6 h时海马神经细胞内见线粒体肿胀,内质网破坏,部分嵴断裂,可见少量初级、次级溶酶体,可见少量自噬溶酶体,可以观察到略有固缩凝集的细胞核染色质;在12 h、24 h时对照组大鼠的海马神经细胞内见明显肿胀的线粒体,且出现空泡样线粒体,内质网破坏较前更加严重,嵴断裂更加明显,各级溶酶体数量较前增多,出现空泡状自噬溶酶体,同时可以观察到大鼠海马神经细胞出现细胞凋亡时的形态改变,细胞核染色质附着于细胞核膜下,呈半月状或结节状团块,细胞核膜破裂。见图2。

图2 各组大鼠透射电子显微镜观察(×12 000)Figure 2 Transmission electron microscope observation of rats in each group (×12 000)
3 讨论
脑是机体最重要的器官之一,其重量虽然仅占人体质量的2%~3%,但其所需血流量却占心输出量的20%,血供非常丰富,因此脑组织对血流灌注依赖性非常强。脑缺血再灌注时脑组织非常依赖的微循环发生障碍、细胞代谢紊乱,一系列病理生理改变相继发生,最终导致大脑出现形态结构损伤性改变、功能障碍等[10-11]。实验研究表明鼠颈动脉被阻断后脑膜内微血管收缩显著,有些微血管周围能够见到渗出,通过再灌流,脑膜缺血的情况虽然得到部分改变,但仍然不能达到阻断前水平[12]。脑对缺氧高度敏感,且神经细胞高度依赖葡萄糖酵解提供能量,故长时间脑缺血势必将导致缺血区域神经细胞水肿、电活动停止、功能障碍,细胞自噬和细胞凋亡被激活,神经细胞甚至极有可能会发生不可逆的损伤。
对于脑缺血再灌注损伤,以往研究的其病理机制主要集中在线粒体损伤、氧自由基损伤、兴奋性氨基酸的细胞毒性作用、炎症反应、神经细胞内钙离子超载以及凋亡基因激活等方面[13],如脑缺血再灌注损伤后产生的大量自由基,会破坏线粒体结构和功能,导致一些酶活性丢失,从而引发一系列的病理过程。自噬广泛存在于真核细胞内,是一种溶酶体依赖的降解过程,属高度保守的生理机制,与细胞分化、存活和维持内环境的稳态密切相关[14-15]。近年来,越来越多的研究表明自噬参与了脑缺血再灌注损伤的发生发展过程[16-18]。脑缺血再灌注损伤可以诱导自噬现象的发生[19-20]。当脑组织缺血、缺氧后,组织内发生能量代谢障碍、大量的氧自由基产生堆积、兴奋性氨基酸的释放及内质网应激等,这些因素都可诱导自噬的发生。
然而自噬在缺血再灌注损伤过程中到底起着保护还是损伤的作用一直是有争议的[21-23]。近年来的研究更多显示,在脑缺血再灌注损失中自噬的激活可以起到保护神经元、减轻缺血性损伤的作用。自噬发挥神经细胞保护作用[24],机制可能包括以下几方面:(1)细胞内耗能产物降解,内环境稳态维持,细胞死亡延迟;(2)受损线粒体降解,细胞凋亡抑制[25];(3)神经突触降解,能量提供[26]。PENG等[27]在神经元的原代培养试验中发现,线粒体融合蛋白Mitofusin-2可以通过促进自噬的发生显著改善脑缺血再灌注损伤。CARLONI等[28]研究发现,新生大鼠缺血缺氧后可以在短时间内观察到自噬的激活,当用自噬抑制剂三甲基腺嘌呤或渥曼霉素后,新生大鼠损伤加重;相反,当应用自噬激动剂雷帕霉素后可以使新生大鼠的脑损伤程度减轻。研究显示,在大鼠局灶性脑缺血再灌注模型中再灌注阶段可以观察到自噬的激活,从而起到对神经元的保护作用,不论是用自噬抑制剂3-MA还是敲除自噬相关基因Atg7基因都会增加细胞色素C的释放和细胞凋亡的发生,从而对加重神经元的损害[25]。CAI等[29]研究也发现,甘氨酸对缺氧缺血性脑损伤保护作用,可能是通过AMPK途径调节线粒体自噬进而实现的。上述研究均表明自噬在脑缺血再灌注过程中是具有保护作用的。
本研究中假手术组大鼠相应时点脑组织未见梗死灶,对照组和3-MA组大鼠左侧脑组织未见梗死灶,右侧脑组织见边界清楚、面积不等呈苍白色的梗死灶。对照组和3-MA组大鼠相应时点梗死灶面积占比比较差异均有统计学意义。HE染色见假手术组大鼠相应时点海马神经细胞形态完整,呈层状分布;3-MA组大鼠海马神经细胞出现不同程度消失,海马神经细胞正常结构大部分破坏;较3-MA组,对照组大鼠相应时点海马神经细胞虽然也消失,但大部分海马神经细胞正常结构尚存在。本研究可见脑缺血再灌注可致神经细胞损伤,细胞出现自噬现象,表现为大鼠神经功能缺失,缺血侧脑组织见梗死灶,梗死灶内海马神经细胞受损。
本研究表明,脑缺血再灌注损伤中3-MA作为自噬的抑制剂可致神经元损伤加重,自噬的激活可能发挥神经保护作用。缺血再灌注可致神经细胞损伤,细胞出现自噬现象,表现为大鼠神经功能缺失,缺血侧脑组织见梗死灶,梗死灶内海马神经细胞受损,细胞内自噬溶酶体显著增多;在脑缺血再灌注损伤中抑制细胞自噬可致神经元损伤加重,自噬的激活可能对神经细胞发挥保护作用。

