云南省猪场猪呼吸道疾病综合征主要病原调查分析*
杨润焕 ,毕峻龙,2,赵 谦,刘 霄,杨贵树,尹革芬
(1.云南农业大学 动物医学院,云南 昆明 650201;2.楚雄州动物疫病预防控制中心,云南 楚雄 675000)
猪呼吸道疾病综合征(porcine respiratory disease complex,PRDC) 是由潜在的原发病原和继发病原,以及环境应激、不良的饲养管理和猪体免疫力降低等因素相互作用引起的疫病[1],PRDC 是引发猪场经济损失的重要原因之一[2],引起PRDC 的主要病原有猪伪狂犬病病毒(PRV)[2]、猪繁殖与呼吸综合征病毒(PRRSV)[3]、猪瘟病毒(CSFV)、猪圆环病毒2 型(PCV2)[4-5]、猪肺炎支原体(MH)[6]、传染性胸膜肺炎放线杆菌(APP)[7]和副猪嗜血杆菌(HPS)[8]等。在规模化猪场养殖过程中,PRDC 由多种病原混合感染引起,常见以病毒的、细菌的、病毒与细菌间多种组合的多重混合感染的形式出现。据临床统计,PRRSV和PCV2 混合感染较为常见[9],对PRDC 发生起着不可忽视的影响。
为调查2016—2017 年云南省规模化猪场及散养户间PRDC 主要病原的感染状况,本研究对云南省16 个县市送检的406 份疑似PRDC 病料,通过PCR 或RT-PCR 方法进行检测,从而为有效防控地方PRDC 提供科学依据。
1 材料与方法
1.1 病料信息
本研究所用样品来自云南省16 个县市送检的疑似PRDC 病料,主要采集于咳嗽、呼吸困难和体温升高等疑似PRDC 发病猪的肺、肾和淋巴结等组织病料和血液,2016 和2017 年分别送检样品113 和293 份,合计406 份。
1.2 主要试剂
RNAiso Plus Total RNA、1 000 DNA Marker、6×Loading Buffer 购自大连Takara 公司;细胞/组织基因组DNA 提取试剂盒购自北京百泰克生物技术有限公司;EasyScript RT/RI Enzyme Mix、2×ES Reaction Mix、2×TransTaqHiFiSuper MixⅡ购自北京全式金生物技术有限公司;DEPC (分析纯)、异丙醇、氯仿和无水乙醇均购自国药集团化学试剂有限公司;EasyScript RT/RI Enzyme Mix、琼脂糖购自白赛勤化学技术有限公司。
1.3 引物
引物参考NCBI 上公布的相关基因组序列,利用Primer 6.0 在其保守序列设计特异性引物(表1),由昆明硕擎生物科技有限公司合成。
1.4 DNA 提取及PCV-2、PRV、MH、HPS 和APP 的PCR 检测
将样品进行研磨、离心等处理后,使用DNA 提取试剂盒提取DNA,按照相关说明书进行。将提取的样品DNA 利用特异性引物进行PCR 扩增,方法参照文献[10]并加以改进。扩增反应条件为:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 35 s,34 个循环;72 ℃后延伸5 min;4 ℃保存。PCR 扩增结束后取10 μL 产物于1.5%琼脂糖凝胶(含0.2% EB)电泳30 min 保持电压120 V,在凝胶成像系统上观察结果。
1.5 RNA 提取及CSFV、PRRSV 检测
将样品进行研磨、离心等处理,在装有200 μL 样品的离心管中加入1 000 μL TRIzol 细胞裂解液,4 ℃静置10 min,10 000 r/min 离心10 min;取上清后,往上清中加入一半体积的氯仿,4 ℃静置10 min,10 000 r/min 离心10 min;取上清后加入等体积异丙醇,4 ℃静置10 min,10 000 r/min 离心10 min;弃去管中液体后往管中加入1 000 μL 75%乙醇,10 000 r/min 离心5 min。室温放置5~10 min,最后溶于20 μL 无RNA 酶水中,立刻进行反转录。CSFV 采用巢氏PCR 进行检测,PRRSV 检测为普通PCR。CSFV 第1 轮扩增程序为:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 45 s,72 ℃ 30 s,循环34 次;72 ℃后延伸5 min;4 ℃保存。将第1 轮PCR 产物稀释300 倍用于第2 轮扩增,扩增程序为:94 ℃ 5 min;94 ℃ 30 s,56 ℃40 s,72 ℃ 40 s,循环34 次;72 ℃后延伸5 min;4 ℃保存。PRRSV 扩增程序为:94 ℃ 5 min;94 ℃30 s,59 ℃ 45 s,72 ℃ 30 s,循环34 次;72 ℃后延伸5 min;4 ℃保存。取10 μL 产物于1.5%琼脂糖凝胶(含0.2% EB)电泳30 min,保持电压120 V,在凝胶成像系统上观察结果。

表1 引物信息Tab.1 Primer information
1.6 数据统计与分析
用Microsoft Excel 2010 软件进行数据处理。
2 结果与分析
2.1 PRDC 检测
结果(图1、2) 表明:PCR 扩增的电泳条带与预期条带大小基本相符。
2.2 送检样品病原阳性率
对于单一感染而言,云南省2016—2017 年病毒性病原中PCV2 总阳性率最高为59.00%,其次是PRRSV,总阳性率为35.79%;细菌性病原中MH 总阳性率最高为28.57%,APP 总阳性率最低为9.09%。2017 年CSFV、PRRSV、PCV2、PRV、MH 和APP 感染较2016 年感染率上升;HPS 较2016 年感染率下降;PRV 在2016 年感染率最低,但仍有检出,检出率为1.11% (表2)。

图1 PCR 扩增HPS、PRV、PRRSV 和CSFV 结果Fig.1 The image of PCR amplification of HPS,PRV,PRRSV and CSFV
2.3 送检样品混合感染情况
在检测到的阳性样品中,混合感染情况表现复杂,以二重感染最为普遍,以PCV2+PRRSV感染率最高,为9.19%;其次是CSFV+PRRSV,为4.46%,PRRSV+PRV 和PCV2+MH 感染率最低,都为0.56%;调查中还发现了三重和五重混合感染,其中三重感染PCV2+CSFV+PRRSV 感染率最高(2.51%),PCV2+PRRSV+PRV 感染率最低(0.28%),五重感染CSFV+PRRSV+PCV2+APP+HPS 为0.28%;未发现四重感染(表3)。
2.4 2016—2017 云南省16 个县市PRDC 感染情况
PRDC 在云南省各地州的流行普遍存在,2016—2017 年CSFV 和PRRSV 阳性率都以禄丰最高,分别为80.00% 和83.33%;PCV2 阳性率以昆明最高,达90.00%;MH 和APP 阳性率以安宁最高,分别为60.00%和42.86%;HPS 阳性率以曲靖最高,为50.00%;PRV 阳性率以大理最高,为33.33% (表4)。
3 讨论
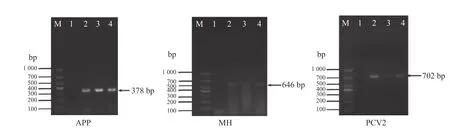
图2 PCR 扩增APP、MH 和PCV2 结果Fig.2 The image of PCR amplification of APP,MH and PCV2

表2 2016—2017 送检样品病原阳性率Tab.2 The positive rates for individual pathogen from 2016 to 2017 %

表3 2016—2017 送检样品混合感染情况Tab.3 The occurrences of multiple co-infections for individual pathogen from 2016 to 2017

表4 2016—2017 年云南省各县市送检样品病原的阳性率Tab.4 The positive rates for each pathogen from 2016 to 2017 from 16 cities/counties in Yunnan Province %
猪呼吸道病综合征先后在北美和欧洲流行[11],该疫病往往不是由一种病原体感染所致,而是由多种病原体混合感染引起;一类是潜在的原发性病原,主要为病毒;另一类是继发性病原,继发性病原是导致病猪大量死亡的主要原因[12]。本实验室前期做了大量调查,宋春莲等[13]调查发现:云南省2012—2016 年PCV2 阳性率最高,为40.25%。而来自北京、河北、广东、浙江等省(市)的265 份疑似样本中,PCV2 阳性率为16.6%,PCV3 阳性率为14.7%,二者混合感染率为6.8%[14],有时混合感染率高达15.8%[15]、42.9%[16]。2016—2017 年,云南省以PCV2 阳性率最高,为59.00%,其次是PRRSV,为35.79%;与河北、浙江等省前期数据相比,二者阳性率大大升高,主要原因是PCV2 能侵害猪免疫系统,造成猪免疫系统的抑制,使猪的抗病能力明显减弱,同时流行毒株进化速度快,变异性强,从而PCV2 流行更广[17-20]。2017 年CSFV、PRRSV、PCV2、PRV、MH 和APP 感染较2016 年感染率上升,说明近年PRDC 病例显著上升,防控形式加剧。对APP、MH 和HPS 3 种细菌性病原进行调查,结果显示:MH 感染阳性率最高,为28.57%;MH 是目前全球各地猪群中最常见的传染性呼吸系统疾病之一,是主要的继发性病原,PCV2 入侵后免疫力大幅度下降使得其余病原体更易入侵机体,造成感染率迅速上升[21]。同时APP 和HPS也是诱发猪呼吸道疾病的另一重要因素,而且常与免疫抑制性病原混合感染[22]。
随着现代化养猪水平的逐步提高,猪呼吸道疾病综合征在临床症状表现方面出现了新变化,亚临床和隐性感染病例显著上升,多种病原混合感染已成为普遍现象,病猪的临床症状与病理变化也变得愈加复杂[23]。刘晓东等[24]报道了多重感染的流行病学调查,发现CSFV 与PRRSV(5/106)、CSFV 与PCV2 (1/106)、CSFV 与PCV3(5/106)、PRRSV 与PCV2 (9/106)、PCV2 与PRV(4/106)、PCV2 与PCV3 (3/106) 6 种类型的二重感染,CSFV+PRRSV+PCV2 (4/106)、CSFV+PRRSV+PRV (1/106)、CSFV+PRRSV+PCV3 (1/106)、CSFV+PCV2+PCV3 (3/106) 4 种类型的三重感染,比例都不高。云南省PRDC 猪群中混合感染以PCV2+PRV 最为常见[25],宋春莲等[13]调查发现:二重感染中,以PRRSV+PCV2 感染数最多,阳性率为6.32%;CSFV+PRV 最少,为0.62%;三重感染较少,CFSV+PRV+PVC2、PRRSV+PRV+PCV2 阳性率分别为0.71% 和0.68%,无四重感染;在本次调查中发现在二重感染中,以PCV2+PRRSV 混合感染最为突出,感染率为9.19%。在各县市中,CSFV 和PRRSV 阳性率以禄丰的最高,PCV2 以昆明最高,MH 和APP 以安宁最高,HPS 以曲靖最高,PRV 以大理最高,呈现较为复杂的感染状况。在实际生产中,由于PRRSV 和PCV2 均有免疫抑制性,是作为云南省内各个规模化养殖场及散养户的猪呼吸道疾病感染的主要病原,它与细菌性或病毒性病原共同作用,发生继发感染、多重混合感染的推动因素着实不可小觑[26]。因此,在规模化猪场疫病防控过程中需要对PRRSV 和PCV2 两种病毒加以足够重视,首要围绕这两种病毒进行有效防控。另外,调查中发现有1 份病料为CSFV+PRRSV+PCV2+APP+HPS 五重混合感染,阳性率为0.28%,目前未见有关文献报道,更值得关注和重视。
4 结论
PRDC 在云南省各州市普遍流行,以多种病毒性疾病和细菌性疾病混合存在,在当前猪病防控的严峻形势下,有必要加强对猪群的疫病监测和疫苗使用。

