铁基磁共振造影剂的研究现状与临床应用展望*
中山大学药学院(深圳) (广东 深圳 518100)
李胜斌# 许戴芸 吕永辉 李咏霄 王俊卿*
自20世纪以来,有机-金属配位化学极大地推动了磁共振造影剂(MRCAs)的发展和应用。基于低分子量配位化合物的MRCAs可极大地提高空间和时间分辨率并实现在体内的快速代谢, 是目前临床MRI检查中应用最广泛的造影剂(CAs)类型[1]。理论上多种过渡金属和镧系金属如铬(Cr)、锰(Mn)、铁(Fe)、钆(Gd)、镝(Dy)等都可用于设计MRCAs,但Gd一直以来都被作为顺磁性CAs的首选金属,这是由于钆离子配位化合物具有其独特的优势[2],包括钆(Gd3+)的七个不成对电子产生的高磁矩,f-block元素特有的多齿配位潜力以及一个自由配位点。此外,相对长的电子弛豫时间以及适当的水交换速率使得钆离子能非常好地满足MRCAs的设计需求。然而,近年来越来越多的研究表明,钆基(Gd3+)配合物造影剂(gadoliniumbased contrast agents,GBCAs)在严重肾功能不全的患者中的肾清除率不足会引起肾原性系统性纤维化(nephrogenic systemic fibrosis,NSF)症状[3]。其他研究表明重复使用GBCAs会导致其在骨骼、人脑等组织中积聚[4]。滞留在体内的钆离子通过与铜、锌或钙等离子的金属置换作用而增加了副作用的可能性。美国FDA因其潜在的安全性问题,对其临床应用提出了警告。此外,从环境和经济角度分析,GBCAs可能引起钆离子在地下水中的沉积[5],而且钆的可获取性极其有限,这很大程度上影响了它的价格。
GBCAs的各种潜在问题使重新评估内源性金属如铁和锰作为MRCAs具有新的意义。铁作为一种顺磁性金属,是生物体内一种必需元素,三价铁有五个未成对电子,也具有较强的弛豫增强效果。早在20世纪80年代就有研究人员首次尝试通过铁基配合物增强MRI对比度[6-7]。但由于在当时图像质量较差且低场强(0.35T)下的铁的驰豫效能不如钆,因此要达到相同的对比效果需要更高的剂量,而高剂量下的急性耐受性是一个重要的风险因素。而钆的优点在于它的弛豫优势和在有效剂量下的毒性风险最小。以上因素可能是阻碍铁基造影剂(ironbased contrast agents,IBCAs)发展的主要原因。
本文基于研究现状介绍了IBCAs的铁离子配体的设计原理,根据弛豫理论描述其动力学特征、热力学稳定性和结构关系等方面的设计要求,综述了利用体内生物学效应实现更高效率的加速质子弛豫方面所取得的研究进展。最后分析了通过配体设计对调控铁离子氧化还原活性的重要性,并讨论了由这一问题产生的潜在毒性及临床应用潜力。
1 MRCAs的设计原理
磁共振成像利用核磁共振原理对水质子的驰豫现象,在强磁场中对1H核中的一小部分非零核自旋的能量分裂进行分析并转化为信号对比。在磁共振断层扫描仪的静态磁场中(1.5T或3.0T),质子的弛豫(自旋从激发态返回到基态过程)由两个部分组成:纵向驰豫和横向驰豫,弛豫时间被分别定义为T1和T2。受组织中不同成分(如蛋白、脂肪、骨骼等)含量的影响,不同组织中的水分子具有不同的弛豫时间,这种效应主要是由水分子扰动性(Mobility)的变化引起的。在实际扫描过程中,通过施加外部梯度磁场和空间编码的射频激发脉冲可以将记录的信号进一步转换为三维图像,通过调节扫描参数和改变信号权重可获得T1或T2相关的加权图像(WI),即T1WI和T2WI,从而实现医学诊断。
T1MRCAs的对比效率由其纵向弛豫效能(r1)和浓度[CA]所决定。MRCA水溶液观察到的纵向顺磁弛豫速率(R1=1/ T1)与r1的关系可由式(1)表示[8]。r1以L-1·mM-1·s-1为单位,其值受磁场和温度影响。
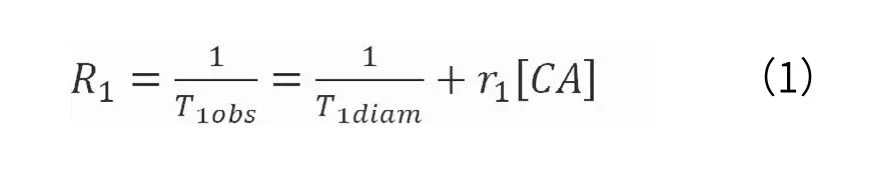
(1)式中,1/T1obs为顺磁性物质存在下所观测到的纵向弛豫速率(R1);1/T1diam为无顺磁性物质存在时体系的弛豫速率;r1为线性关系的斜率,反应了每单位浓度(通常为1mmol/L的CA)引起R1改变的程度,即纵向弛豫效能,它表征MRCA弛豫能力的大小。
根据造影剂作用机理,Bloembergen[9]、Solomon[10]和Lauffer[11]将MRCA与水分子的相互作用划分为内球层机制和外球层机制(图1)。内球层的弛豫效应源自水分子与顺磁性金属离子的直接配位作用(即第一配位域,the first coordination sphere)以及配体极性和氢键基团参与的间接相互作用(即第二配位域,the second coordination sphere),见式(2)和(3)。而外球层的弛豫效应主要依赖于顺磁性金属离子与紧密扩散的水分子之间的弱相互作用。一般而言,内球层贡献了大约60%的弛豫效应。

图1 影响造影剂T1弛豫效率的因素包括外球层和内球层影响因素,内球层分为第一配位域和第二配位域。
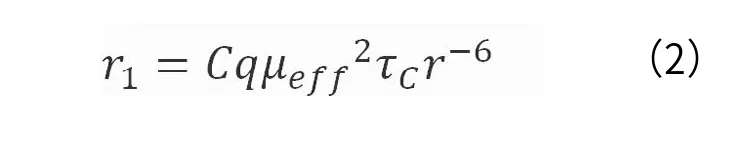
(2)式中,C为常数;q为内层水分子数;μeff为有效磁矩;τC为分子关联时间;r为金属与H质子的距离。
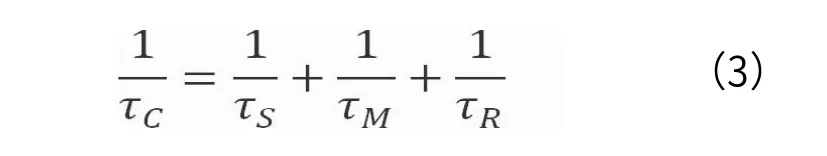
(3)式中,τS为电子关联时间;τM为质子滞留时间;τR为旋转相关时间。
(2)式中的τC取决于(3)式中的τS、τM和τR,并且(2)式仅在τM≈10ns时有效。需要注意的是,水分子在第一配位域中的滞留时间过长会降低弛豫速率(relaxation rates)[12-14]。研究发现配体分子中带有极性氢键位点的基团(如烷氧基)会延长第二配位域中质子滞留时间(τM),从而延长水分子的滞留时间(俘获效应,trapping effect)。因此,在配体分子中引入亲脂性(如苯基)基团可有效排斥水分子并通过增强水分子的直接配位作用来提高弛豫效能(r1)[15]。此外,配体化合物的带电性与溶解度和渗透压有关,一般在影响渗透压不很大的前提下,可以接受较小的负电荷或正电荷。另一方面,MRCAs与生物大分子的相互作用可延长其旋转相关时间(τR)。因此,通过引入对生物大分子(如血清白蛋白)具有高亲和力的配体可有效实现受体诱导的磁化增强效应(receptor-induced magnetization enhancement,RIME)[16]。亲脂性MRCAs更倾向于肝脏的聚集,而一般认为的MRCAs为血池造影剂,通常具有足够的亲水性和分子量以延长在血管内的停留时间。如需将MRCAs靶向淋巴系统或跨越血脑屏障,需要考虑其配体结构因素、靶向基团和复合物的净电荷。
2 铁基造影剂的设计策略和最新研究进展
2.1 铁离子的驰豫特性 铁作为一种d-block金属,其具有不成对电子排布和氧化还原作用以及重要的生物化学活性。Fe3+与弱场配体(weak-field ligands)配位可形成高自旋的d5八面体配合物。这些不成对电子促进了靠近金属中心的质子弛豫过程。研究发现,经典GBCAs的驰豫效能在低场强下(<1.5T)能发挥最佳对比效果[17],因此相对于GBCAs,IBCAs的驰豫效能不具有优势。然而,高场强磁共振成像系统目前在全世界变得更加普遍。依赖于τR的GBCAs在高场下的驰豫效能可能显著下降。相比之下,铁离子配合物的行为往往更能适应高场成像[11]。

图2 用于磁共振成像的铁基配合物和经典的钆基配合物结构。注:(a):MGD-3-FCAT(3.5mg,12.1μmol),FAC(4.0μmol),TFA(2.0μmol),PBS(1.0mL),R1=2.119s-1;(b):MGD-3-FCAT(1.2mg,4.1μmol),FAC(4.0μmol),TFA(2.0μmol),PBS(1.0mL)β-gal(E801A,10units);(c):MGD-3-FCAT(2.4mg,8.3μmol),FAC(4.0μmol),TFA (2.0μmol),PBS(1.0mL),β-gal(E801A,10units);(d):MGD-3-FCAT(3.5mg,12.1μmol),FAC(4.0μmol),TFA(2.0μmol),PBS(1.0mL),β-gal(E801A,10units)。
2.2 增强IBCAs驰豫效能的设计策略 造影剂研究的目标之一是提高造影剂的驰豫效能并进一步降低所需的剂量,从而产生足够的对比度来实现医学诊断。根据造影剂设计的理论,顺磁性金属配合物产生的水质子弛豫增强作用可分解为三部分:内球层贡献、外球层贡献和水交换贡献(图1)。因此,如何提高这些贡献是实际设计中主要的努力目标。根据 Solomon-Bloembergen-Mogan方程[11],为提高内球层贡献,,应从以下几方面着手:(1)选择有效磁矩μeff大的顺磁中心;(2)在保证配合物有足够稳定性的前提下, 增多配位水分子数目(q);(3)缩短配位水分子与顺磁中心的距离(M-H距离),以获得最有效和快速的弛豫;(4)在满足质子完全弛豫的前提下,提高配位水分子的交换速率(1/τM); (5)延长配合物旋转相关时间τR, 这可以通过将顺磁中心与生物大分子或聚合物偶联来实现[18]。
由于铁具有的显著氧化还原活性使得水分子的直接配位在大多数情况中是不利的。因此,IBCAs通常被设计为饱和配合物,此类配合物具有极高的稳定性,Davies等[19]已对这些研究进行了深入讨论。此外,Schwert等[20]发表了关于3,5-二取代磺酰胺儿茶酚配体的铁(Fe3+)配合物[Fe(DSC-L)3]3-的研究(图2)。Davies等[19]初步制备的[Fe(tironate)3]9-配合物具有较高的弛豫效能(r1=3mmol-1·s-1),但表现出较高的毒性。Schwert等[20]通过将tironate转化为其磺酰胺衍生物降低了其生物毒性,但这也导致它们在水中的驰豫效能被限制在2mmol-1·s-1,虽然血浆驰豫效能是水中的两倍,但较[Gd(EOB-DTPA)]2-经典造影剂低两倍(图2)。
为了将第二配位域的水分子进行活化,同时避免tironate配合物的高毒性,在Lauffer关于以N,N'-乙基双(2-[2-羟基苯基]甘氨酸)、EHPG作为Fe3+潜在造影剂配体的研究基础上[21],Kuznik等[22]筛选了几个潜在的氢键能力较高的配体(图2)。如苯环上修饰甲氧基([Fe(EHPG-OMe)]-)较未修饰的[Fe(EHPG)]-配合物有更高的驰豫效能,并且在血清中得到进一步提升。这归因于增强的第二配位域相互作用和配合物与血清白蛋白之间的相互作用延长了配体的旋转相关时间。Kuznik等[18]还探索了与N,N'-乙基双(2-[2-羟基苯基]甘氨酸)、EHBG结构相似但更具灵活性的配体(图2)。这些配合物除了具有热力学稳定性之外,它们还倾向于铁的第三氧化态,是这些配合物氧化还原活性的重要影响因素[23]。Kuznik等[18]分别分析了在苯环上带有极性(例如-NHAc)和氢键取代基(-OMe)的EHBG配合物[Fe(EHBG-NHAc)]-和[Fe(EHBG-OMe)]-。酰胺取代基(NHAc)被证明能更有效地吸引水分子,然而,-OMe衍生物在血清中表现出比酰胺衍生物更好的驰豫效能。这再次证明,在第二配位域中配位的水分子数目和配合物较慢的翻滚二者作用的叠加增加了配合物的驰豫效能。
在另一项研究中,Yu等[24]将柠檬酸铁铵(FAC)和一种酚衍生物在β-半乳糖苷酶作用下形成[Fe(MGD-3-FCAT)3]的饱和配位结构(图3),由于在苯酚的苯环上引入了一个19F原子,因此顺磁性金属离子(如Gd3+、Fe3+和Mn2+)可以通过顺磁性弛豫增强(PRE)效应缩短19F核的弛豫时间,其中19F核与顺磁中心之间的距离对于PRE效应至关重要。根据该报告,观察到水质子的纵向弛豫速度从FAC的T1=0.33s缩短到0.067s,其中Fe3+的浓度为0.01mmol/L。该结构中的两个因素可能促进了水分子更有效的相互作用:配体的极性取代基和形成的配合物的大小,其中极性取代基(氨基脲部分和氟原子)激发了H键和偶极-偶极相互作用,此外,[Fe(MGD-3-FCAT)3]更缓慢的翻滚可能是相对于FAC的驰豫效能增强的因素之一。通过生物酶促作用活化糖部分释放水分子的自由配位点来实现驰豫效能的增强是生物响应型IBCAs的一个重要研究方向[25]。
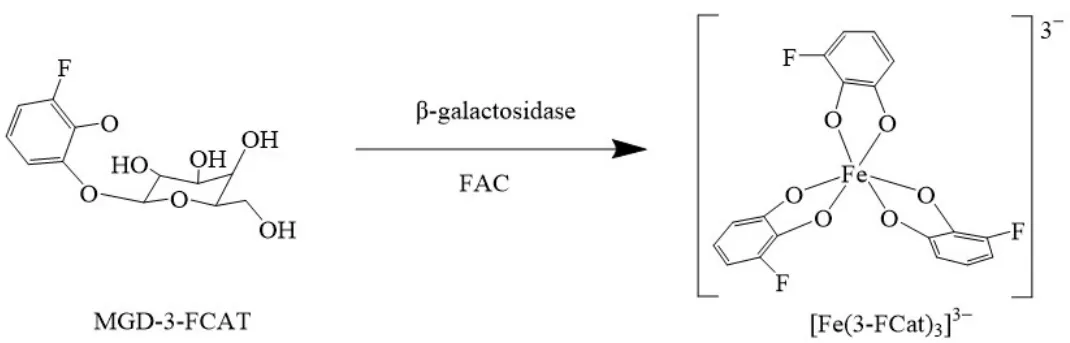
图3 MGD-3-FCAT与β-半乳糖苷酶的反应及随后与FAC的反应。
另外的一个例子是,Boehm-Sturm等[26]合成并表征了反式环己烷二胺四乙酸(Fe-tCDTA)和戊烯酸(Fe-DTPA)的Fe3+配合物(图2),并与Gd-DTPA进行了对比研究。在相同浓度下,Fe-tCDTA和Fe-DTPA的T1加权图像上的信号强度增加低于Gd-DTPA(图2)。然而,在造影剂浓度较高的情况下,它们的T1效应是相当的。在1.5~7T场强下的弛豫值和相关的对比度增强研究表明,Gd-DTPA较Fe-tCDTA和Fe-DTPA分别高约2倍和5倍(图4)[26]。造成两种Fe3+配合物之间的差异主要归因于Fe-DTPA中不存在可交换的配位水分子。随后,作者观察了在1.5T场强下异种移植肿瘤小鼠在给药后3~10min时的静态T1加权MR图像(图5)。发现在Fe-tCDTA和Fe-DTPA的给药剂量分别为GBCA(0.1mmol/kg)的2倍(0.2mmol/kg)和5倍(0.5mmol/kg)情况下,可以产生大约等同的增强效果,表明这三种螯合物具有相似的药代动力学和消除特征。在较高的场强下,Fe3+配合物尤其是Fe-tCDTA与Gd-DTPA的成像效应差异略有减小并维持在同一数量级上。与GBCA相比,IBCA的r2值较小,已知GBCA的r2随着场强的增加而增加[27],这可能导致GBCA在较高的场强下的弛豫效能有所下降。尽管如此,GBCA仍然可以更好地适应现代较高磁场的MRI断层成像系统。

图4 曲线图显示了在不同场强下Gd-DTPA、Fe-DTPA和Fe-tCDTA的T1成像效应的浓度依赖性。通过典型的动态对比增强(DCE-MRI)评估在A:1.5T、B:3T和C:7T血清模型的T1加权的信号强度比与CAs的浓度关系。此图片摘自Radiology,2018,286(2):537-546.
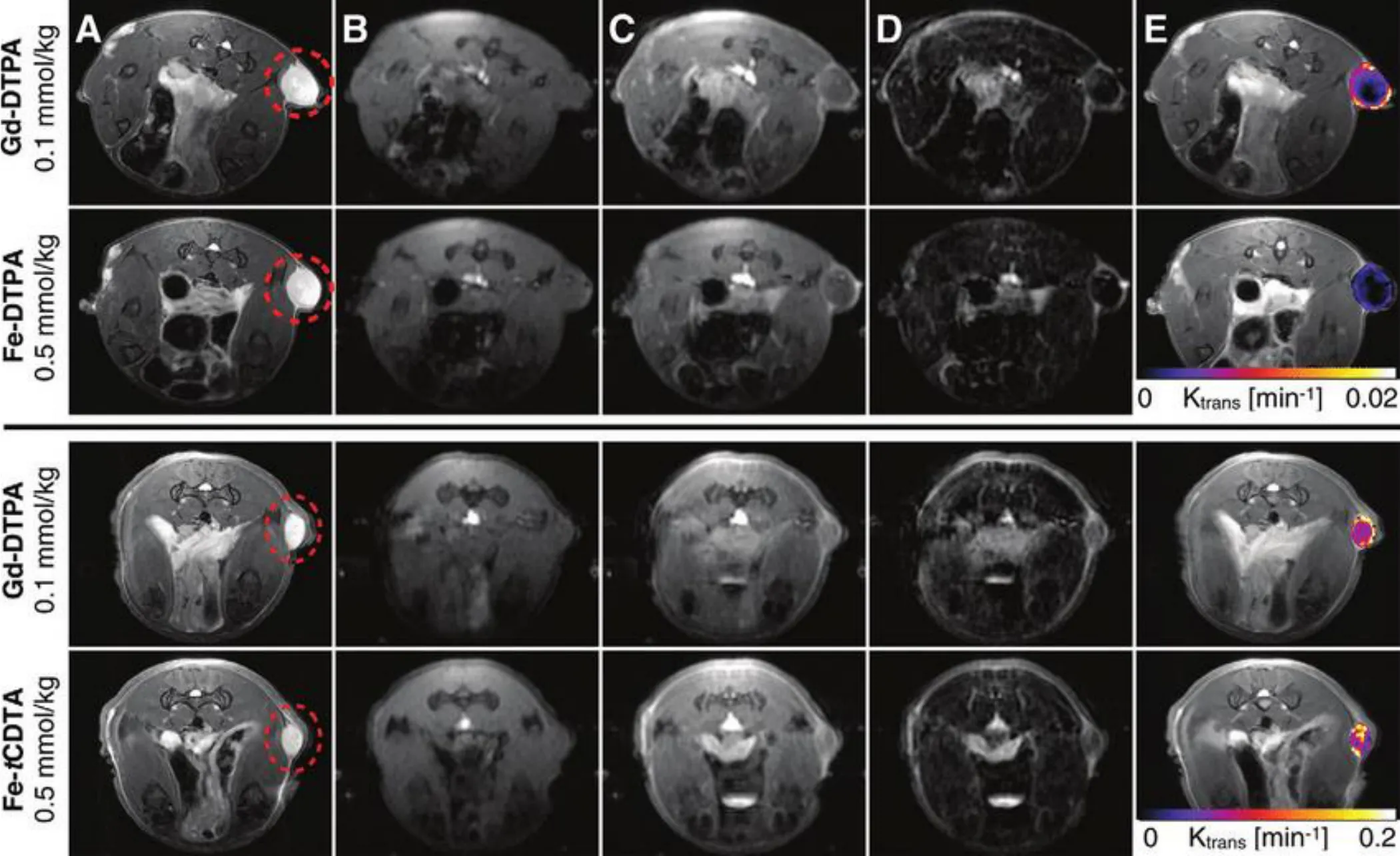
图5 MR图像显示了Fe-DTPA、Fe-tCDTA与Gd-DTPA在7T场强下小鼠体内T1对比度效果和DCE-MRI参数。图像为10只小鼠中代表性的两只,上两排分别为第一天注射Fe-DTPA和第二天注射Gd-DTPA(n=5),下两排分别为第一天注射Fe-tCDTA和第二天注射Gd-DTPA(n=5)。A为注射前T2加权图像,肿瘤由虚线圆圈表示; B为预注入,相同位置的T1加权图像;C为注射几分钟后相同位置T1加权图像;D为B和C的减影图像;E是覆盖在T2加权图像上的肿瘤的伪彩Ktrans参数图。此图片摘自Radiology,2018,286(2):537-546.
综上所述,水分子直接配位进入金属中心可能是驰豫效能升高的原因。尽管这种设计将增加铁配合物氧化还原活性的风险,但从物理化学的角度来看第二配位域是根据外部的流体静力半径来确定的[15],并且水分子与金属中心在空间上可能直接相互作用,因此第一配位域与第二配位域之间没有严格的边界。由于[Fe(EDTA)]-配合物可以在其第七个配位点容纳水分子,这种情况对于其他结构不太拥挤但特别变形的配合物也是可行的。目前,大多数研究都集中在增加取代基的极性和引入良好的氢键以及限制分子的迁移率方面。对于血池造影而言,通常利用RIME效应来增强驰豫效能。例如,Schwert等[20]发现,铁(Fe3+)配合物[Fe(DSC-L)3]3-和血清蛋白之间的相互作用可能比钆(Gd3+)更有效,铁(Fe3+)配合物可使驰豫效能增长超过1倍,而钆(Gd3+)配合物仅使驰豫效能提高60%。Fe3+配合物及其衍生物对人血清白蛋白(HSA)亲和力的不同会显著影响驰豫效能的增强效果。
2.3 铁配合物的氧化还原活性和其他毒性问题 Fe3+/Fe2+适中的氧化还原电位适用于各种物质的多种电子转移过程。铁离子失去或获得电子的电子转移(氧化还原反应)过程对配体稳定性和介质酸度非常敏感。因此,尽管在体外对铁的简单氧化还原行为进行了许多研究,但由于生物体系统的复杂性,很难将这些研究与体内条件对等。铁的氧化还原活性导致的最直接的后果是自由基的产生。Fe2+配合物导致自由基形成主要是基于铁离子参与的Haber-Weiss循环和Fenton循环在生物体中,一般假设的是设计完全饱和的配体以禁用内层电子转移。由于小而柔性的配体(如EDTA)为第七个配位点留出足够的空间,并且水分子倾向于占据该位置,使催化活性更加复杂。另一个风险可能是已知但罕见的铁超载的情况。尽管铁配合物的急性毒性与钆配合物相当,但由于铁属内源性金属且代谢调节良好,从铁配合物中潜在释放的微量铁的长期毒性应低于游离钆。目前也没有明确的研究表明铁配合物会导致严重的有害作用。此外,使用配体过量的造影剂给药是降低铁离子释放风险的可行方法。值得注意的是,铁摄取量增加是肿瘤细胞快速增值的特异性特征之一,这可能是由于肿瘤细胞通过增加铁的吸收和储存,同时减少铁的外排来调节细胞内的铁代谢,以促进铁的积累。摄入细胞的铁离子将存储在具有生物活性的不稳定铁池(LIP)中,为代谢和增殖提供铁源[29]。因此,这也是铁分子探针涉及的有趣领域。
3 结论与展望
铁配合物作为MRCAs的潜在应用正在研究中。该领域有几个新趋势引起了特别关注,并描绘了铁配合物在这一应用中未来可能的发展方向。耦合各种诊断技术的尝试在最近的文献中以指数形式出现,这种方法也涉及铁造影剂。例如,Hasserodt等[30]提出了一个有趣的Fe2+配合物,通过体内ROS引发的自旋交叉导致反磁性低自旋配合物转变为高自旋顺磁性配合物。这种关/开系统已被证明可通过化学或酶还原剂的作用将其配位体从6N转变为5N1O,从而在MRI扫描仪中产生显著信号[31-33]。此外,Dorazio等[34]已成功实现了另一种基于paraCEST的磁共振成像方法。由顺磁性物质引起的化学交换饱和转移(CEST)的方法使的水分子信号改变[35]。铁造影剂发展新领域中的另一个方向是纳米材料的应用。虽然超顺磁性氧化铁纳米粒(SPIOs)是一种经FDA批准的造影剂,但各种纳米材料的开发和改性的快速发展也已成为成像领域一个极具吸引力的发展方向。IBCAs在20世纪80年代曾被探索,但由于磁共振场强的限制,没有很好地开发为MRCAs。随着MR成像系统的磁强度增加以及设备的进步,IBCAs为安全的诊断和治疗带来了新的机遇。因此,从长远来看,IBCAs可能是比GBCAs更安全的替代物,但在未来的研究中需要广泛研究其急性和长期毒性。此外,IBCAs可以为开发非快速排泄型T1造影剂铺平道路,例如蛋白质结合型、靶向分子探针型造影剂等。
致谢
李胜斌参与了论文选题、文献资料收集并起草了论文初稿;李胜斌、许戴芸、吕永辉和李咏霄参与论文选题、文献资料收集并完善和修改了论文;王俊卿教授指导了论文选题、提出修改意见并审阅论文。
感谢国家青年科学基金项目(82001887);广东省基础与应用基础研究基金项目(2019A1515110326)提供经费支持。
团队介绍
李胜斌,于2017年6月在广东药科大学获得学士学位,于2019年9月录取为中山大学硕士研究生,现于中山大学药学院(深圳)王俊卿老师课题组进行学习和研究工作。E-mail:lishb28@mail2.sysu.edu.cn
许戴芸,于2019年6月在福建医科大学获得学士学位,于2019年9月录取为中山大学硕士研究生,现于中山大学药学院(深圳)王俊卿老师课题组进行学习和研究工作。E-mail:xudy8@mail2.sysu.edu.cn
吕永辉,于2020年6月在郑州大学获得学士学位,于2020年9月录取为中山大学硕士研究生,现于中山大学药学院(深圳)王俊卿老师课题组进行学习和研究工作。E-mail:lvyh9@mail2.sysu.edu.cn
李咏霄,于2020年6月在山东大学获得学士学位,于2020年9月录取为中山大学硕士研究生,现于中山大学药学院(深圳)王俊卿老师课题组进行学习和研究工作。E-mail:liyx356@mail2.sysu.edu.cn
王俊卿,于2019-至今,中山大学“百人计划” 药学院(深圳)副教授、硕导。主要从事生物(内源性)响应的前药/探针、双层脂质组装体的设计和通过集成诊断成像技术促进纳米医学的临床转化。E-mail:wangjunqing@mail.sysu.edu.cn

