一株对茶丽纹象甲高毒力白僵菌菌株的筛选、鉴定与培养研究
王定锋,李良德,李慧玲,张辉,吴光远
一株对茶丽纹象甲高毒力白僵菌菌株的筛选、鉴定与培养研究
王定锋,李良德,李慧玲,张辉,吴光远*
福建省农业科学院茶叶研究所,福建 福州 350013
茶丽纹象甲()是一种重要的茶树害虫,当前对其防治仍以化学手段为主。为寻找一种高效、安全和可持续的生物防治方法,本研究采用浸虫法从12株原寄主为鞘翅目昆虫的白僵菌spp.中筛选出一株对茶丽纹象甲成虫高毒力的Bbr1552菌株。室内生物测定结果表明,用每毫升含5.0×107个孢子的孢悬液(25℃)处理茶丽纹象甲成虫的LT50值为4.49 d,处理7 d,茶丽纹象甲的累计校正死亡率为100%,僵虫率为69.44%,LC50值为每毫升1.55×106个孢子。对菌株Bbr1552进行形态学鉴定与rDNA-ITS序列和Bloc序列分析,明确其为布氏白僵菌。此外,对该菌株的最适培养基和培养温度研究发现,其最适生长和产孢培养基均为PPDA培养基;最适生长和产孢温度均为25℃。
茶丽纹象甲;布氏白僵菌;毒力;鉴定;培养条件
茶丽纹象甲(Voss)属鞘翅目(Coleoptera)象甲科(Curculionidae),又名茶叶象甲、茶小绿象甲,俗称“茶鲎”,是一种重要的茶树害虫。该虫在中国各茶区均有分布,并在局部茶区为害严重。其主要以成虫嚼食茶树叶片形成不规则弧形缺刻,既影响茶叶产量和品质,又损伤树势,对绿茶区的夏茶和乌龙茶区的春茶为害尤为严重。除茶树外,还为害油茶、桃、梨等多种经济作物[1-3]。当前,茶丽纹象甲田间防治主要仍以化学防治为主[3-6],而由此引起的农业“3R”(农药残留、有害生物再度猖獗及生物抗药性)问题阻碍了茶产业的健康可持续发展。随着人们对茶叶食品安全问题的重视,急需寻找对该虫有效,对生态环境和人类健康安全、无害的防治方法。
白僵菌()是一类重要的昆虫病原真菌,包含20多个种[7-11];其属内常见种球孢白僵菌()和布氏白僵菌()在多种农林害虫生物防治中发挥重要作用[12]。据报道,全球(除中国外)先后有171个真菌杀虫剂产品问世,其中以球孢白僵菌和布氏白僵菌为有效成分的制剂分别占33.9%和4.1%[13]。我们在前期的研究中已筛选到一株对茶丽纹象甲高毒力球孢白僵菌菌株[14],为筛选出更多对茶丽纹象甲高毒力的白僵菌菌株,以便更好地开发出相应的生防菌剂,本研究利用室内生物测定法从12株分离自鞘翅目昆虫的白僵菌中筛选出一株对茶丽纹象甲高毒力的菌株,并对该菌株的分类归属和培养特性进行了研究,旨在为今后更好地利用白僵菌防治茶丽纹象甲及其他鞘翅目害虫奠定基础。
1 材料与方法
1.1 供试菌株
本试验所用的12株白僵菌菌株,原寄主均为鞘翅目害虫(表1),保存于超低温冰箱(–70℃)中。所有供试菌株均采用SDAY培养基在25℃下培养活化备用。
1.2 供试虫源
2016年5月3日,于福建省农业科学院茶叶研究所2号山茶叶试验基地(27.21N,119.57E)选择茶丽纹象甲发生严重的地块。采用茶行间铺塑料膜震落法,从前一天预先拍打收集过一次的固定茶行中再拍打一遍,收集同日龄成虫(茶丽纹象甲成虫具有陆续出土为害的特性),带回养虫室[温度25℃,相对湿度(RH)80%]用新鲜茶梢饲养于网兜中。1 d后挑取健康活泼、大小基本一致的成虫用于后续生物测定试验。
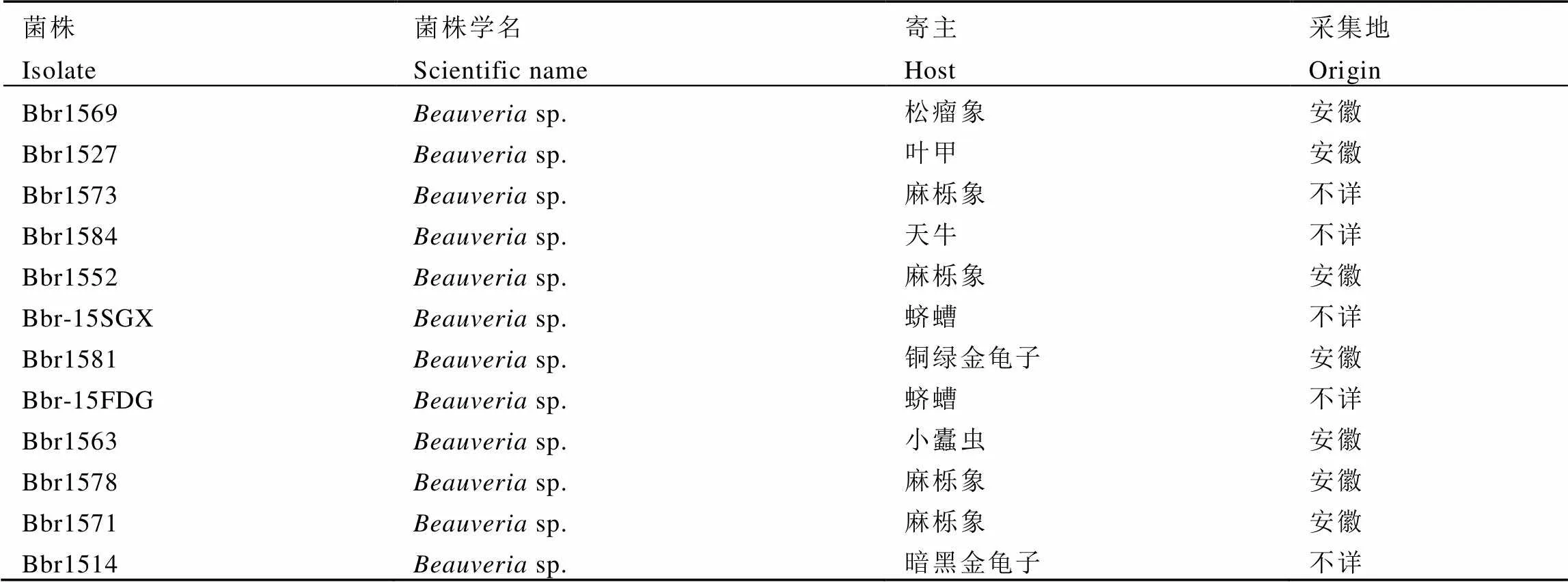
表1 供试菌株
1.3 培养基配制
萨氏培养基(SDAY):蛋白胨10 g、葡萄糖40 g、酵母10 g、琼脂20 g,补充蒸馏水至1 000 mL。1/4 SDAY培养基:除琼脂外,其余成分都为SDAY培养基的1/4。马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g煮沸过滤液、葡萄糖20 g、琼脂20 g,加热溶解后补充蒸馏水至1 000 mL。蛋白胨马铃薯葡萄糖琼脂培养基(PPDA):在PDA培养基中添加1%蛋白胨。察氏培养基(Czapek):NaNO33 g、K2HPO41 g、KCl 0.5 g、MgSO4·7H2O 0.5 g、FeSO4·7H2O 0.01 g、蔗糖30 g、琼脂15 g,蒸馏水1 000 mL。上述培养基的pH值均为7.0,高压灭菌锅121℃灭菌20 min。
1.4 茶丽纹象甲成虫毒力测定
1.4.1 不同菌株对茶丽纹象甲成虫的毒力测定
从SDAY平板上分别收集培养了15 d的各菌株分生孢子,并将各孢子粉用0.05% Tween-80溶液分别配成每毫升5.0×107个孢子的孢悬液。采用王定锋等[14]浸虫法处理茶丽纹象甲,每个菌株作为1个处理,每个处理设3个重复,每个重复12头茶丽纹象甲成虫;以0.05% Tween-80处理作为对照。接种后放置在人工气候箱中(25℃,RH=90%,12L/12D)培养,每2 d更换一次新的茶梢。接菌完第2天起,每天定时观察处理组和对照组茶丽纹象甲存活情况并记录;将虫尸转移至无菌培养皿内保湿培养,并观察是否有真菌菌丝长出。死亡率、校正死亡率和僵虫率计算公式如下:

1.4.2 不同浓度Bbr1552菌株对茶丽纹象甲成虫的毒力测定
从1.4.1章节结果中挑选出对茶丽纹象甲毒力最强的菌株,并按照1.4.1章节孢悬液配制法配成5个浓度梯度(每毫升5.0×107、1.0×107、5.0×106、1.0×106、5.0×105个孢子)接种茶丽纹象甲成虫。每个浓度为1个处理,每个处理设3个重复,每个重复15头象甲成虫,以0.05% Tween-80处理作为对照。试虫的处理方法、饲养条件和死亡率计算等方法同1.4.1章节。
1.5 菌株Bbr1552的分类鉴定
1.5.1 形态学鉴定
将菌株Bbr1552接种于PDA培养基上,25℃,12L/12D下培养8 d;并观察菌落形态特征、菌株产孢结构和分生孢子形态等显微结构。
1.5.2 白僵菌Bbr1552菌株的分子鉴定
采用引物ITS5(5'-GGAAGTAAAAGTCGTAACAAGG-3')/ITS4(5'-TCCTCCGCTTATTGATATGC-3')[15]与引物B5.1F(5'-CGACCCGGCCAACTACTTTGA-3')/B3.1R(5'-GTCTTCCAGTACCACTACGCC-3')[16]分别从Bbr1552基因组中PCR扩增rDNA-ITS序列与Bloc序列。两个序列的PCR反应体系均为:2×Mix 10 μL,模板DNA 1 μL,引物(10 mmoL)各1 μL,ddH2O 12 μL,合计25 μL。PCR反应程序均为:94℃预变性5 min;94℃变性30 s,58℃退火30 s,70℃延伸30 s,30个循环;70℃延伸5 min。用1%琼脂糖凝胶电泳检测PCR产物,使用凝胶回收试剂盒(天根)纯化回收后,委托铂尚生物技术(上海)有限公司进行核苷酸测序。通过NCBI Blast程序分别将rDNA-ITS序列和Bloc序列测序结果进行初步分析。选择Rehner等[7]报道中分类地位明确的14种白僵菌(球孢白僵菌,布氏白僵菌,,,,,,,,,,,和.)的rDNA-ITS序列和Bloc序列,并以蝉棒束孢()相应序列为外源种。按照Mega 4.0软件中邻接法(Neigbor-joining method,NJ)分别构建系统发育树,并用Bootstrap(1 000次重复)对系统发育树进行检验[17]。
1.6 最适培养基和最适培养温度的筛选
1.6.1 菌株Bbr1552在不同培养基上的生长与产孢试验
参照1.4.1章节方法收集Bbr1552分生孢子,并配成每毫升1.0×106个孢子的孢悬液。然后用移液器将2 μL孢悬液分别点植于SDAY培养基、PDA培养基、PPDA培养基、1/4SDAY培养基和Czapek培养基平板中央。每种培养基为1个处理,每个处理3次重复,于25℃,14L/10D下培养14 d。菌落直径采用直尺十字交叉法测量;产孢量采用菌块测定法,即从菌落中心至边缘距离的1/2处用打孔器(直径6 mm)打取菌块,置于0.05% Tween-80溶液充分搅拌,并用血球计数板观察,计算单位面积产孢量。
1.6.2 菌株Bbr1552在不同温度下的生长与产孢试验
参照1.6.1章节菌液点植法,将孢悬液(每毫升1.0×106个孢子)接种于PPDA平板上,然后分别置于5个不同温度(15、20、25、30℃和35℃)下,光照(14L/10D)培养14 d。每个温度为1个处理,每个处理3次重复。培养14 d后,菌落直径和产孢量测定参照1.6.1章节。
1.7 数据处理
使用SPSS 17.0进行数据分析。不同白僵菌菌株对茶丽纹象甲成虫的校正死亡率和僵虫率分析前先进行反正弦平方根转换,并利用Tukey多重比较检验试验数据差异显著性;接种浓度和处理时间对茶丽纹象甲的死亡率影响情况采用双因素方差分析;茶丽纹象甲的致死中时(LT50)和致死中浓度(LC50)采用probit方法计算。
2 结果与分析
2.1 不同白僵菌菌株对茶丽纹象甲成虫的毒力
由表2可知,供试的12株白僵菌对茶丽纹象甲成虫的毒力存在显著差异(<0.05),茶丽纹象甲死亡率为35.15%~100%,僵虫率为0%~69.44%,LT50值为4.59~7.78 d。虽然大部分菌株处理后,茶丽纹象甲的僵虫率较低,只有菌株Bbr1552的僵虫率超过60%,但菌株Bbr1527、Bbr1573、Bbr1552、Bbr1581、Bbr1563、Bbr1578、Bbr1571和Bbr1514对茶丽纹象甲成虫的校正死亡率都大于90%,LT50值小于5.59 d,显示出较强的杀虫毒力。综合校正死亡率、LT50值和僵虫率3个指标,在12个菌株中,菌株Bbr1552对茶丽纹象甲成虫具有最强的杀虫毒力,校正死亡率达100%,LT50值达4.59 d,僵虫率达69.44%。
2.2 不同浓度Bbr1552对茶丽纹象甲成虫的毒力试验结果
白僵菌的接种浓度和茶丽纹象甲的处理时间对茶丽纹象甲的死亡率分析结果表明,白僵菌的接种浓度(5,72=124.49,<0.01)、茶丽纹象甲的处理时间(5,72=147.34,<0.01)以及两者的交互作用(25,72=8.08,<0.01)均极显著影响茶丽纹象甲成虫的死亡率。由图2可知,随着白僵菌Bbr1552接种浓度的增大,茶丽纹象甲成虫的累计死亡率不断增高,呈现出明显的剂量效应。低浓度孢悬液(每毫升5.0×105个孢子)处理7 d,茶丽纹象甲累计死亡率仅为22.22%。中浓度孢悬液(每毫升5.0×106、1.0×106个孢子)处理时,从第5天开始,茶丽纹象甲死亡率才开始大量增加,第7天累计死亡率分别为64.44%和51.11%。高浓度孢悬液(每毫升5.0×107个孢子)处理时,第4天茶丽纹象甲就开始大量死亡;处理7 d的累计死亡率达100%。从死亡率随时间变化的趋势来看(图1和表3),同一接种浓度下,茶丽纹象甲成虫死亡率随着处理时间的延长而逐步增大。LT50值随着孢悬液浓度的增加而递减,当孢子浓度为每毫升5.0×105~5.0×107个孢子时,LT50值为8.912~4.493 d;处理7 d,茶丽纹象甲成虫累计死亡率为22.22%~100%。从SPSS软件计算得到白僵菌Bbr1552处理丽纹象甲7 d的LC50值为每毫升1.55×106个孢子,95%置信限为每毫升3.49×105~3.86×106个孢子。
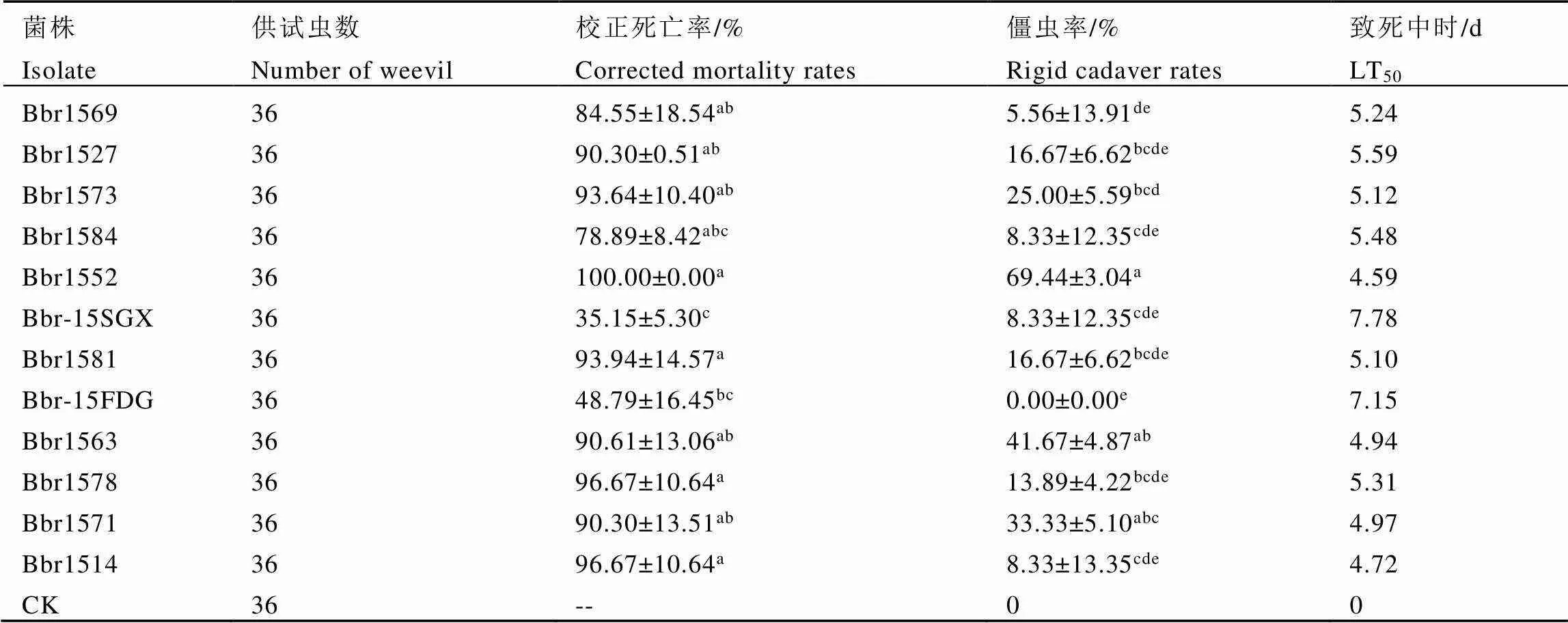
表2 白僵菌不同菌株对茶丽纹象甲成虫的毒力
注:数据为平均值±标准差,同列数据后不同小写字母表示0.05水平上存在显著差异
Note: Data were mean±SD. Date with different lowercase letters in the same column indicated significantly different at 0.05 level
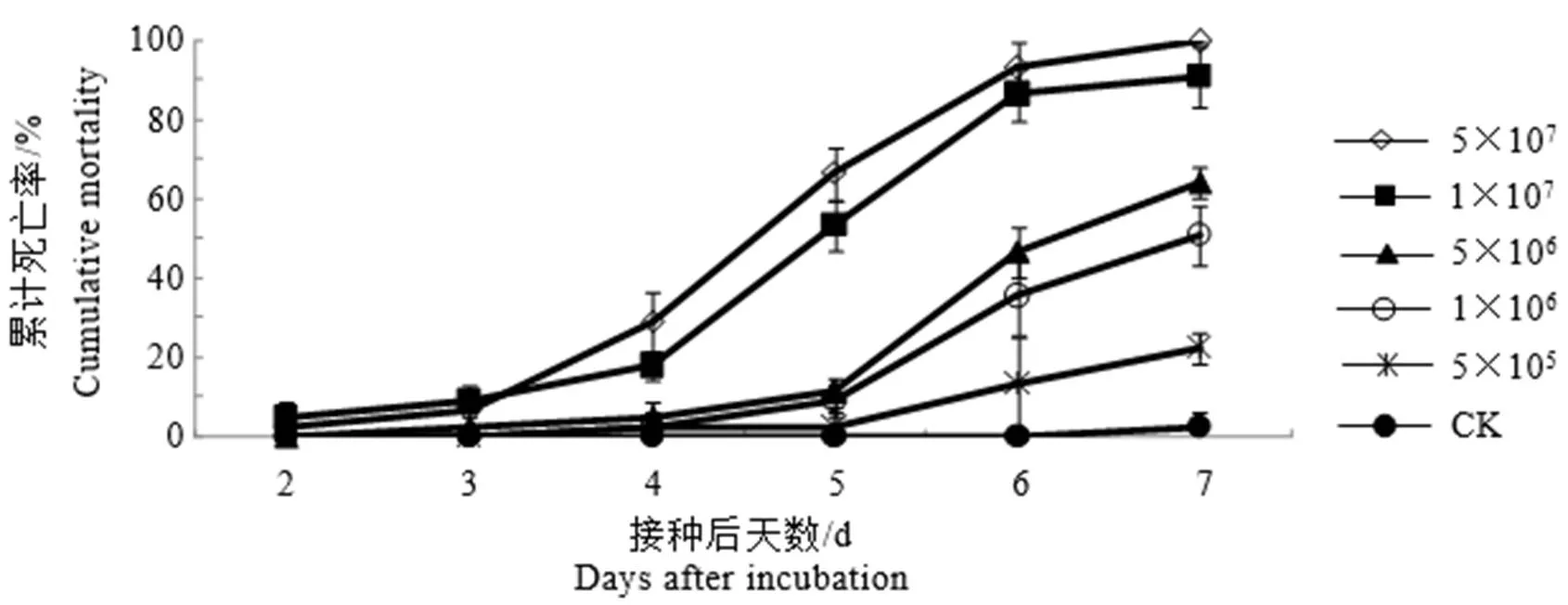
图1 不同孢子浓度Bbr1552对丽纹象甲成虫的毒力
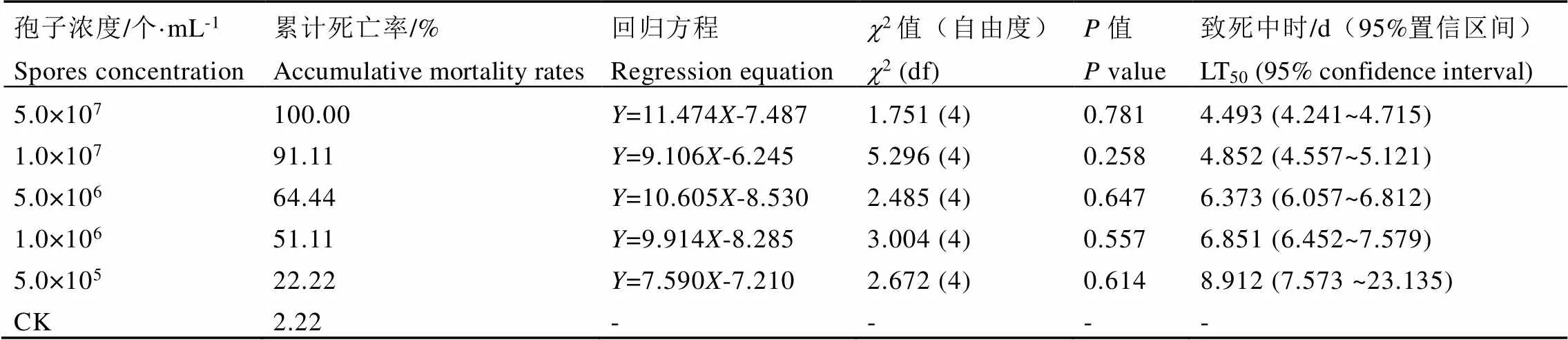
表3 不同孢子浓度Bbr1552对丽纹象甲成虫的毒力
注:式中是几率值,是时间的对数
Note:means probit,is log of time
2.3 白僵菌Bbr1552的鉴定
在PDA培养基上白僵菌Bbr1552菌落为白色粉状,培养几天后自菌落中心形成白色的孢子层(图2-A)。显微镜观察发现,产孢细胞单生,很少簇生;产孢轴纤细,膝状弯曲,具小齿突;分生孢子透明、光滑、椭圆形,大小约为(2.5~3.5) μm×(1~2) μm(图2-B)。白僵菌Bbr1552形态学特征符合《昆虫真菌学》[12]中布氏白僵菌的特征,将该菌株初步鉴定为布氏白僵菌。
通过对白僵菌Bbr1552菌株的rDNA-ITS序列和Bloc序列PCR扩增、测序,分别获得长度为557 bp和1 465 bp的基因片段。通过GenBank中Blast程序比对基因库中的核酸序列,结果发现,与Bbr1552菌株的rDNA-ITS序列相似性达100%的大部分序列为布氏白僵菌;而与Bbr1552菌株Bloc序列相似性达100%的大部分序列也是布氏白僵菌。对菌株Bbr1552的rDNA-ITS序列和Bloc序列构建系统进化树发现,Bbr1552的rDNA-ITS序列与其他布氏白僵菌聚在一个较小的进化分支上,Bootstrap值为72%,具有较高的同源性(图3);Bbr1552的Bloc序列也与其他布氏白僵菌聚在一个较小的进化分支上,Bootstrap值为91%,具有很高的同源性(图4)。综合形态学鉴定和分子鉴定结果,判定Bbr1552菌株为布氏白僵菌。
2.4 菌株Bbr1552最适培养基和培养温度
2.4.1 培养基对Bbr1552生长速率和产孢量的影响
菌株Bbr1552生长速率在各培养基之间存在显著差异(<0.05),其中在PPDA上生长速度最快,14 d菌落直径达46.33 mm,是生长速率最慢的PDA培养基的1.8倍。PPDA培养基最适合菌株Bbr1552产孢,培养14 d产孢量达每平方毫米3.96×105个孢子,显著高于其他4种培养基;在PDA、1/4SDAY和Czapek上的产孢性能较差,且三者之间差异不显著(图5)。总体而言,菌株Bbr1552的最适生长和最适产孢培养基均为PPDA培养基。
2.4.2 温度对Bbr1552菌株生长速度和产孢量的影响
菌株Bbr1552除了在35℃下不能生长外,在其他几个测试温度下,菌株生长速率存在显著差异(<0.05)。在25℃下菌株生长速度最快,培养14 d菌落直径达46.33 mm,显著高于其他温度。菌株Bbr1552在20℃和25℃下产孢量较大,培养14 d产孢量分别达每平方毫米105个孢子和4.11×105个孢子,且两者之间不存在显著差异,但都与其他温度(15℃和30℃)之间存在显著差异(图6)。总体而言,菌株Bbr1552的最适生长和最适产孢温度均为25℃。
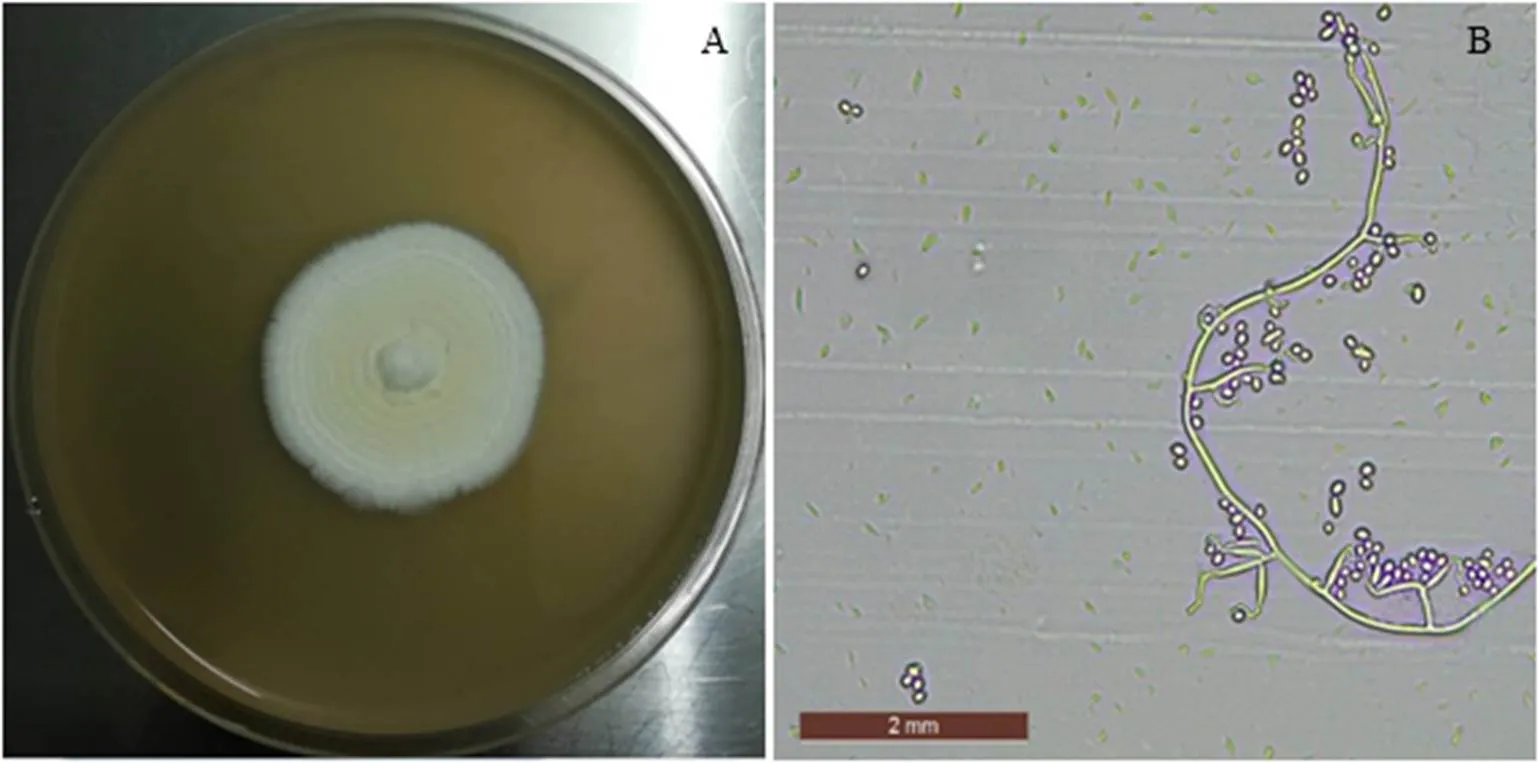
注:A. PDA上25℃,生长8 d的菌落。B. 产孢梗和分生孢子(400倍)
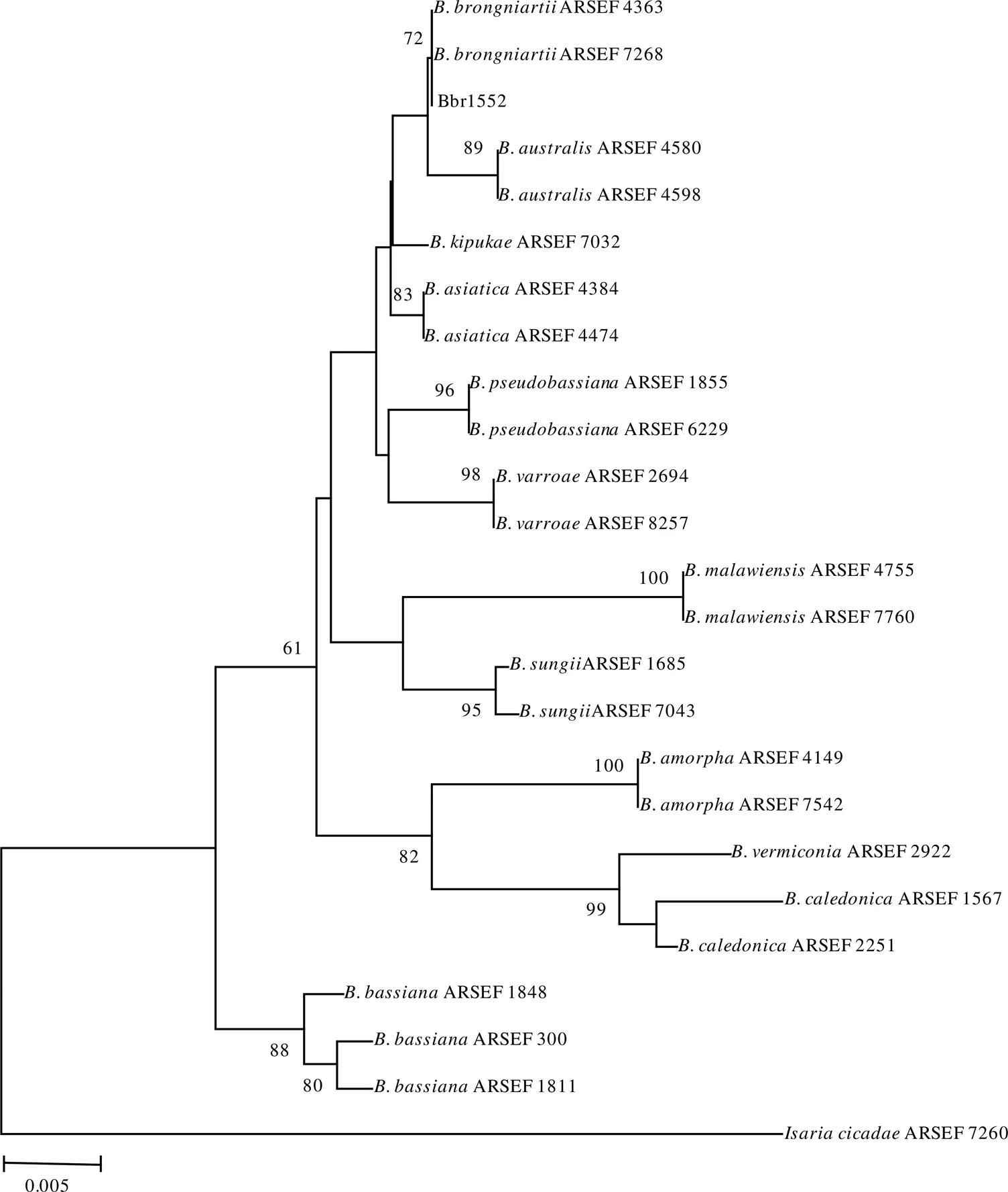
图3 基于rDNA-ITS序列同源性的Bbr1552菌株系统发育树
3 讨论
虫生真菌对靶标害虫的杀虫毒力高低是判断其生物防治潜力的重要指标之一,也是菌株能否进行商业化生产的关键。虽然依据菌落的形态特征、生长速率、产孢量和蛋白酶等生物学特性可对虫生真菌高效菌株开展初步筛选[18-19],但直接通过室内生物学测定方法筛选出对靶标害虫高毒力生防真菌菌株,其结果往往更直接、可靠[20-22]。本研究通过对12株白僵菌菌株进行直接生物学测定,初步筛选发现Bbr1552菌株对茶丽纹象甲成虫毒力最强;进一步的毒力复测试验也表明Bbr1552菌株对茶丽纹象甲成虫有很强的杀虫毒力。该结果说明直接生物学测定法是一种直接、可靠的高效菌株筛选方法。考虑到虫生真菌不同菌株对寄主可能存在专化性问题,本研究选取的12株原寄主都是鞘翅目昆虫的白僵菌菌株。研究结果表明,供试的12个白僵菌菌株中,菌株Bbr1527、Bbr1573、Bbr1552、Bbr1581、Bbr1563、Bbr1578、Bbr1571和Bbr1514等8个菌株对茶丽纹象甲成虫具有较强的毒力,校正死亡率都大于90%,LT50值小于5.59 d。该研究结果与其他研究者发现的从原寄主或原寄主近缘种上分离的生防真菌菌株对靶标害虫往往具有更高毒力的结果相一致[22-24]。
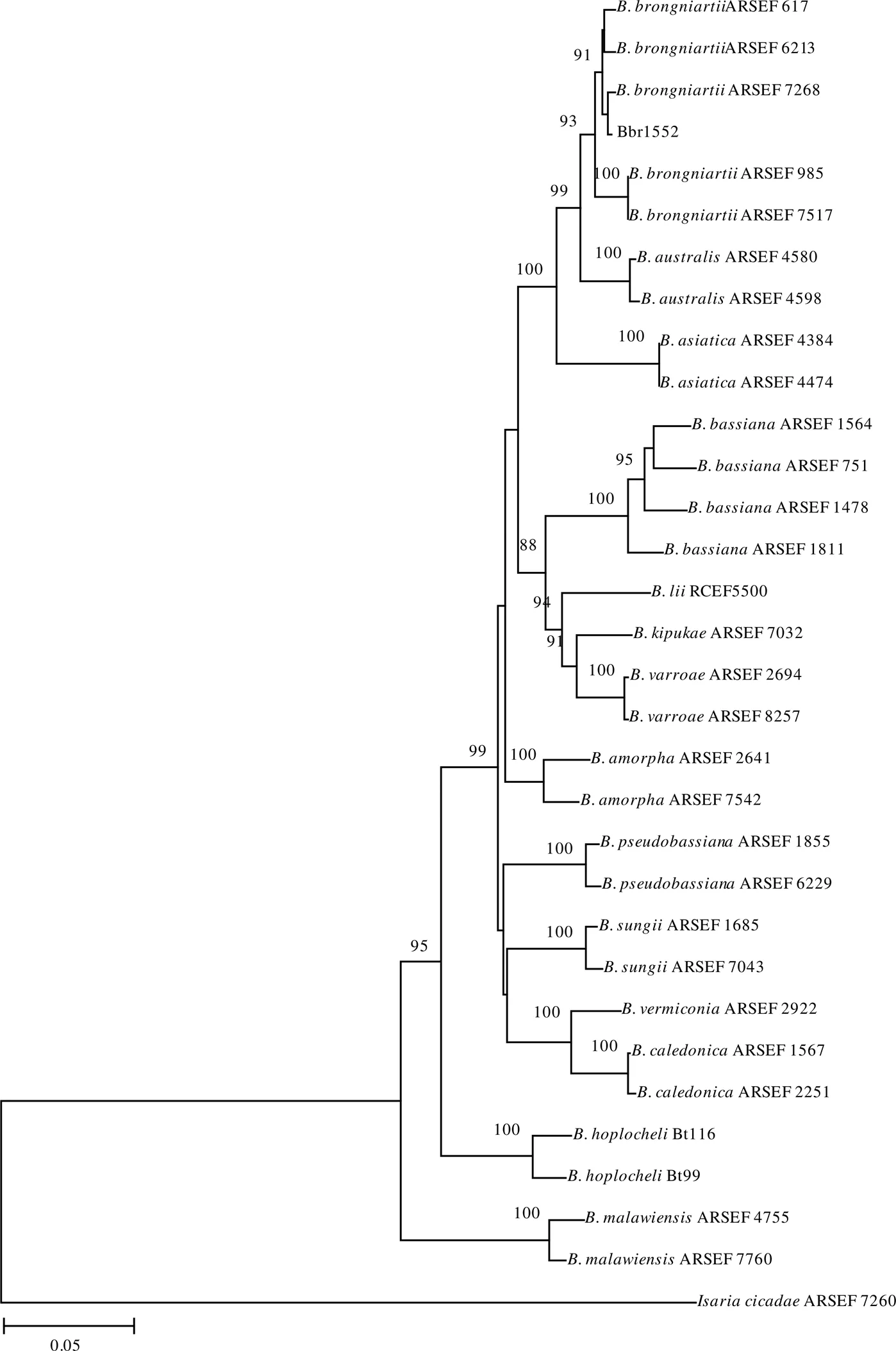
图4 基于Bloc序列同源性的Bbr1552菌株系统发育树
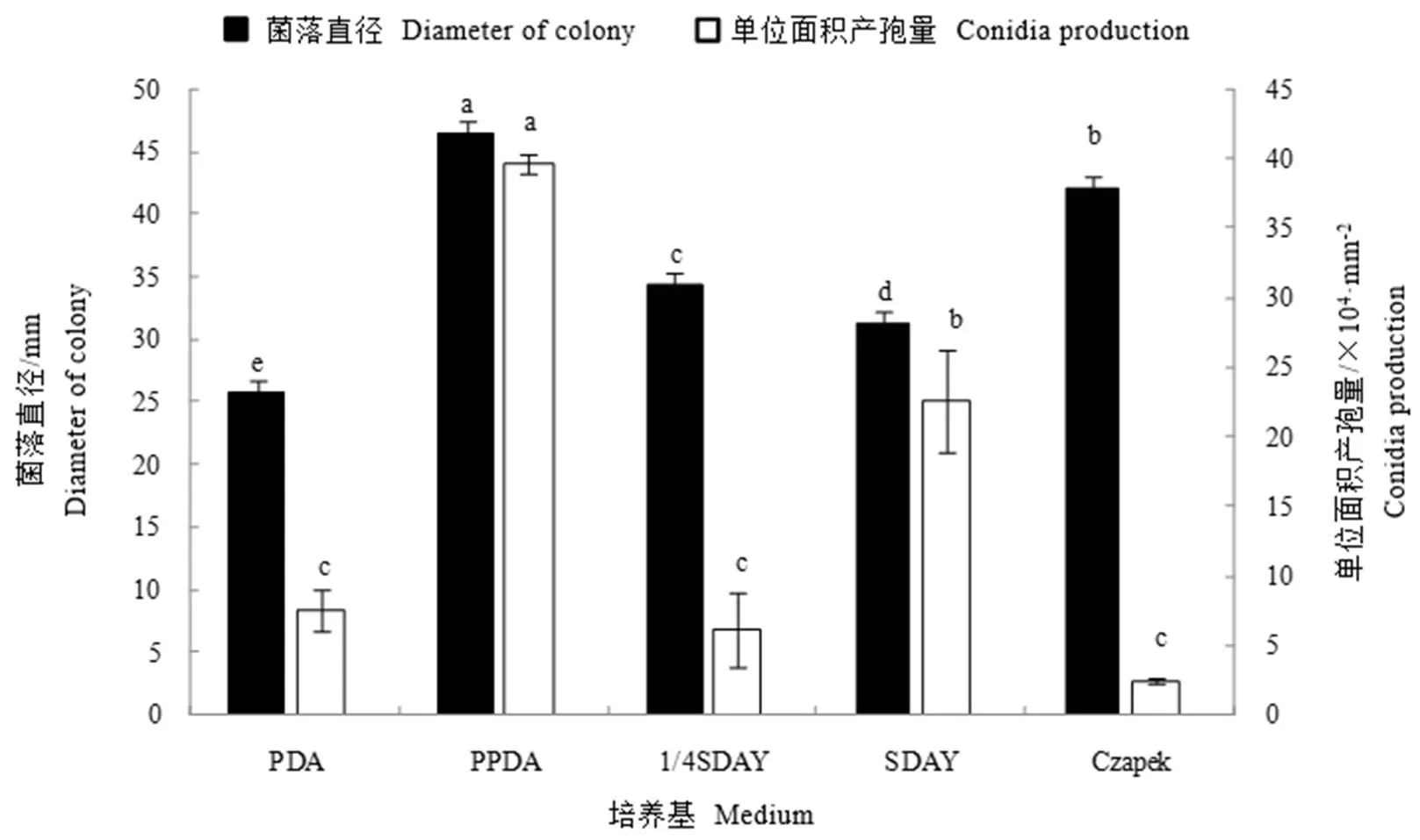
注:图中同一指标(相同颜色条形图)上不同小写字母表示在0.05水平上不同处理之间存在显著差异。下同
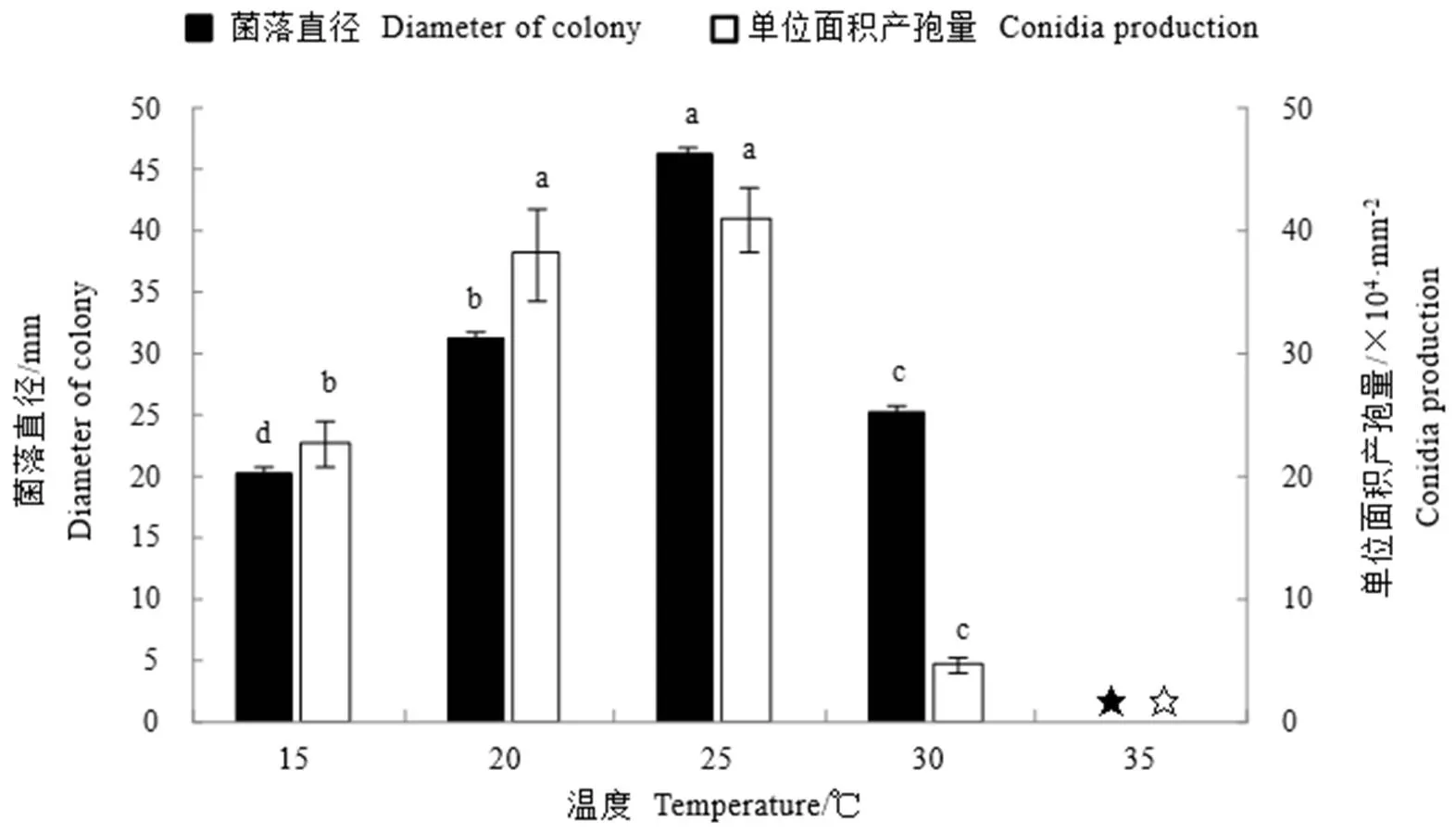
注:图中★和☆表示在35℃下菌株死亡,没有生长和产孢数值
白僵菌作为一个复合种,只依靠传统形态学鉴定方法往往难以取得理想的效果。近年来,rDNA-ITS、Bloc、RPB1、RPB2和TEF等标记基因在白僵菌属内的隐秘种鉴定中发挥越来越重要的作用,使得越来越多的新种被鉴定出来[7-11]。本研究在形态学初步明确Bbr1552菌株为布氏白僵菌的基础上,进一步的利用rDNA-ITS和Bloc序列从分子生物学的角度对该菌株进行鉴定,结果表明,该菌株为布氏白僵菌。研究结果进一步丰富了针对茶丽纹象甲的生防真菌资源库。Mega进化树构建中,Bootstrap值大于70%相当于统计学概率的95%,一般75%以上认为是可信的[25]。从图4可以看出,Bbr1552的Bloc序列与其他布氏白僵菌聚在一个较小的进化分支上,Bootstrap值高达91%。Bbr1552的rDNA-ITS序列虽然与其他布氏白僵菌聚在一个较小的进化分支上,但Bootstrap值仅72%(图3);这与Rehner等[7]报道的rDNA-ITS序列在白僵菌种内建树时包含信息较少的结果相一致。
本研究发现,布氏白僵菌Bbr1552菌株最适生长和产孢培养基均为PPDA培养基,林华峰等[26]研究发现布氏白僵菌和金龟子绿僵菌两变种的最适宜的培养基也均为PPDA。菌株Bbr1552的最适生长和产孢温度均为25℃,与Fargues等[27]研究结果相一致。而菌株Bbr1552孢悬液点植于PPDA平板上,在35℃时未能长出菌落,说明孢子在该温度下不能萌发,这与前人报道的大多数真菌萌发的最适温度范围为20~30℃,在低于5℃或高于35℃条件下,一般不能萌发的结果较一致[28]。茶丽纹象甲成虫发生期通常是在4—6月份,期间田间气温常接近或超过35℃,而本研究发现高毒力菌株Bbr1552在35℃时孢子不能萌发,这不利于菌剂的田间应用。鉴于此,我们在利用菌株Bbr1552防治丽纹象甲时应该改变防治策略,避开成虫发生的高温季节;选择气温较低的1—3月份进行土壤施菌,针对茶丽纹象甲若虫或者蛹,可能会取得较好的田间防治效果。
白僵菌具有对环境友好、害虫不易产生抗药性、易于培养和可持续控制害虫等优点[12],在茶园害虫生物防治中具有很大的应用潜力。但与其他真菌杀虫剂类似,其在田间应用中易受到高温[29]、紫外辐射[30]和昆虫自身生理和行为调节[31]等逆境的影响,导致杀虫速度较慢和田间防效不稳定。针对上述弊端,我们在白僵菌制剂田间应用时可以考虑把白僵菌制剂与其他化学农药或者植物源农药联合使用,以期提高白僵菌杀虫速度,并降低茶园化学农药的用量。此外,白僵菌制剂应用时应尽量选择阴天或者傍晚以避开高温和阳光的直接照射。在人们对茶叶食品安全问题关注度日益增加和我国政府大力提倡茶园农药减施的大背景下,积极开展以白僵菌等生物防治手段为主的茶园害虫防控策略,可以有效解决茶叶食品安全和茶园农药的减量使用等问题,对保障我国茶产业健康、可持续发展具有积极的意义。
[1] 曾明森, 吴光远, 王庆森. 我国茶丽纹象甲的研究进展[J]. 河南科技大学学报(农学版), 2003, 23(4): 16-20. Zeng M S, Wu G Y, Wang Q S. Research progress onVoss in China [J]. Journal of Henan University of Science and Technology (Agricultural Science), 2003, 23(4): 16-20.
[2] 张汉鹄, 谭济才. 中国茶树害虫及其无公害治理[M]. 合肥: 安徽科学技术出版社, 2004: 234-235. Zhang H G, Tan J C. Chinese tea tree pests and their population-free treatment [M]. Hefei: Anhui Science and Technology Press, 2004: 234-235.
[3] 中国农业科学院植物保护研究所, 中国植物保护学会. 中国农作物病虫害[M]. 3版. 北京: 中国农业出版社, 2015: 88-91. China society of plant protection, Institute of plant protection, Chinese academy of agricultural sciences. Diseases and pests affecting chinese crops [M]. 3rd ed. Beijing: China Agriculture Press, 2015: 88-91.
[4] 吴光远, 林阿祥, 郭剑雄. 巴丹防治茶丽纹象甲丽纹象甲的效果初报[J]. 茶叶科学技术, 1995(2): 17-18, 44. Wu G Y, Lin A X, Guo J X. A preliminary report on the efficacy of cartap against[J]. Tea Science and Technology, 1995(2): 17-18, 44.
[5] 王庆森, 曾明森. 应用锐劲特防治茶丽纹象甲的效果试验[J]. 福建茶叶, 2002(3): 6-7. Wang Q S, Zeng M S. Experiment on the efficiency of using Ruijingte to prevent and control tea stripe weevil (sp.) [J]. Tea in Fujian, 2002(3): 6-7.
[6] 龙同, 乐群芬, 杨国琼, 等. 几种杀虫剂对茶丽纹象甲的室内、田间药效比较试验[J]. 湖北农业科学, 2019, 58(24): 109-112. Long T, Yue Q F, Yang G Q, et al. The laboratory and field comparative effects of several pesticides against[J]. Hubei Agricultural Sciences, 2019, 58(24): 109-112.
[7] Rehner S A, Minnis A M, Sung G H, et al. Phylogeny and systematics of the anamorphic, entomopathogenic genus[J]. Mycologia, 2011, 103(5): 1055-1073.
[8] Bustamante D E, Oliva M, Leiva S, et al. Phylogeny and species delimitations in the entomopathogenic genus(Hypocreales, Ascomycota), including the description ofsp. nov [J]. MycoKeys, 2019(58): 47-68.
[9] Chen W H, Liu M, Huang Z X, et al., a new entomopathogenic fungus from Guizhou, China [J]. Phytotaxa, 2018, 333(2): 243-250.
[10] Chen W H, Han Y F, Liang Z Q, et al. A new araneogenous fungus in the genusfrom Guizhou, China [J]. Phytotaxa, 2017, 302(1): 57-64.
[11] Kepler R M, Luangsa-ard J J, Hywel-Jones N L, et al. A phylogenetically-based nomenclature for() [J]. IMA Fungus, 2017, 8(2): 335-353.
[12] 蒲蛰龙, 李增智. 昆虫真菌学[M]. 合肥: 安徽科学技术出版社, 1996: 301-302. Pu Z L, Li Z Z. Insect mycology [M]. Hefei: Anhui Science and Technology Press, 1996: 301-302.
[13] de Faria M R, Wraight S P. Mycoinsecticides and Mycoacaricides: A comprehensive list with worldwide coverage and international classification of formulation types [J]. Biology Control, 2007, 43(3): 237-256.
[14] 王定锋, 黎健龙, 李慧玲, 等. 茶丽纹象甲白僵菌广东分离株的鉴定及生物学特性研究[J]. 茶叶科学, 2015, 35(5): 449-457. Wang D F, Li J L, Li H L, et al. Identification and biology characteristics research of a-strain isolated from Guangdong province [J]. Journal of Tea Science, 2015, 35(5): 449-457.
[15] Innis M A, Gelfand D H, Sninsky J J, et al. PCR protocols: a guide to methods and applications [M]. San Diego: Academic Press, 1990: 315-322.
[16] Rehner S A, Posada F, Buckley E P, et al. Phylogenetic origins of African and Neotropicalpathogens of the coffee berry borer,[J]. Journal of Invertebrate Pathology, 2006, 93(1): 11-21.
[17] Tamura K, Dudley J, Nei M, et al. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0 [J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599.
[18] 刘玉军, 张龙娃, 何亚琼, 等. 栎旋木柄天牛高毒力球孢白僵菌菌株的筛选[J]. 昆虫学报, 2008, 51(2): 143-149. Liu Y J, Zhang L W, He Y Q, et al. Screening of high virulent strains ofagainst a dangerous forest cerambycid beetle,(Coleoptera: Cerambycidae) [J]. Acta Entomologica Sinica, 2008, 51(2): 143-149.
[19] 王定锋, 李良德, 黎健龙, 等. 茶角胸叶甲高毒力球孢白僵菌菌株的筛选[J]. 茶叶科学, 2017, 37(3): 229-236. Wang D F, Li L D, Li J L, et al. Screening of thestrain with high virulence to(Coleoptera: Chrysomeloidea) [J]. Journal of Tea Science, 2017, 37(3): 229-236.
[20] 张建伟, 王中康, 申剑飞, 等. 小菜蛾高致病力绿僵菌的筛选、鉴定及培养特性研究[J]. 中国生物防治学报, 2012, 28(1): 53-61. Zhang J W, Wang Z K, Shen J F, et al. Screening, identification and culture characteristics of a highly pathogenic strain ofagainst[J]. Chinese Journal of Biological Control, 2012, 28(1): 53-61.
[21] 许齐爱, 李佳颖, 任顺祥. 红火蚁高致病力黄绿绿僵菌菌株的筛选[J]. 中国生物防治学报, 2013, 29(3): 384-388. Xu Q A, Li J Y, Ren S X. Selection ofisolates to control the red imported fire ant[J]. Chinese Journal of Biological Control, 2013, 29(3): 384-388.
[22] 侯明明, 刘义豪, 王滨. 昆虫病原真菌对梨网蝽防治潜力的室内评测[J]. 中国生物防治学报, 2015, 31(6): 853-859. Hou M M, Liu Y H, Wang B. Laboratory assessment on virulence of entomogenous fungi against[J]. Chinese Journal of Biological Control, 2015, 31(6): 853-859.
[23] Poprawski T J, Marchal M, Robert P H. Comparative susceptibility ofand(Coleoptera: Curculionidae) early stage to five entomopathogenic hyphomycetes [J]. Environment Entomology, 1985(14): 247-253.
[24] Soares G G, Marchal M, Ferron P. Susceptibility of(Coleoptera: Curculionidae) larvae toand(Deuteromycotina: Hyphomycetes) at two different temperatures [J]. Environment Entomology, 1983(12): 1886-1890.
[25] 叶利芹, 吴小芹, 叶建仁. 竹叶锈病重寄生现象及重寄生菌鉴定[J]. 菌物学报, 2011, 30(3): 414-420. Ye L Q, Wu X Q, Ye J R. Hyperparasitism of bamboo leaf rust and identification of the mycoparasite [J]. Mycosystema, 2011, 30(3): 414-420.
[26] 林华峰, 王萍莉, 张磊, 等. 布氏白僵菌和金龟子绿僵菌两变种的生长性状及其对蛴螬的毒力测定[J]. 中国生物防治, 2006, 22(2): 123-127. Lin H F, Wang P L, Zhang L, et al. Growth ofand two varieties ofand their virulence against white grubs [J]. Chinese Journal of Biological Control, 2006, 22(2): 123-127.
[27] Fargues J, Mania N K, Delmas J C, et al. Influence of temperature on the in vitro growth of entomopathogenic hyphomycetes [J]. Agronomie, 1992, 12(7): 557-564.
[28] Butt T M, Jachson C, Magan N. Fungi as biocontrol agents: progress, problems and potential [M]. UK: CABI, 2001: 23-69.
[29] Roberts D, St Leger R.spp., cosmopolitan insect-pathogenic fungi: mycological aspects [J]. Advances in Applied Microbiology, 2004, 54: 1-70.
[30] Rangel D E, Braga G U, Flint S D, et al. Variations in UV-B tolerance and germination speed ofconidia produced on insects and artificial substrates [J]. Journal of Insect Physiology, 2004, 87(2/3): 77-83.
[31] Hunt V L, Charnley A K. The inhibitory effect of the fungal toxin, destruxin A, on behavioural fever in the desert locust [J]. Journal of Insect Physiology, 2011, 57(10): 1341-1346.

Screening, Identification and Culture Conditions of a High-virulent Isolate ofagainst
WANG Dingfeng, LI Liangde, LI Huiling, ZHANG Hui, WU Guangyuan*
Tea Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350013, China
(Coleoptera: Curculionidae) is one of the most important pests in tea plantation, and chemical control is the usual treatment method for this weevil at present. In order to explore alternative strategy for sustainable control of the weevil, dip method was employed to test the virulence of 12 isolates ofsp., which isolated from insects of Coleoptera. When inoculated with spore suspension (5.0×107spores·mL-1), the strain Bbr1552 showed the highest virulence against the adults of, which caused the highest corrected mortality rates of 100%, shortest LT50of 4.49 d and highest cadaver rates of 69.44%. The LC50value was 1.55×106spores·mL-1on 7 d (25℃) after inoculation with Bbr1552. According to morphological identification and analysis of rDNA-ITS and Bloc sequences, the strain Bbr1552 was identified to be aBesides, the PPDA medium and 25℃ were the most optimal conditions for the colony growth and sporulation of the strain Bbr1552.
,, virulence, identification, cultural condition
S571.1;S435.711
A
1000-369X(2021)01-101-12
2020-07-21
2020-11-01
福建省公益类科研院所基本科研专项(2019R1029-4)、福建省农业科学院茶叶研究所重点项目(2014-cys-02)、国家茶叶产业技术体系咀嚼式害虫防控岗位(CARS-19)
王定锋,男,副研究员,主要从事害虫生物防治研究。*通信作者:gywupt@163.com
(责任编辑:黄晨)

