β-二酮二氟化硼衍生物的合成及生物成像研究
沈舒婷,于 坤,王亚轩,吴运军,王 慧
(皖南医学院 药学院,安徽 芜湖 241002)
有机硼化合物作为一种新兴的光电功能材料,具有量子产率高、平面性好、近红外发光、结构易修饰、组装形式多样等优势,已被广泛用于发光二极管(OLEDs)、生物显影、生物传感、化学传感等领域[1-3]。目前,有机硼化合物主要包括N,N-二齿型、N,O-二齿型和O,O-二齿型三种结构类型[4-5]。其中N,N-二齿型化合物是目前研究最多的一类,虽然此类化合物具有优良的光学性质,但也存在着产率低、合成原料价格高、溶解性差等不足之处。随着研究的不断深入,科研工作者们发现β-二酮化合物是一类很好的螯合有机配体,可与三氟化硼反应生成O,O-二齿型有机二氟化硼化合物,即β-二酮二氟化硼化合物[6]。研究表明,β-二酮二氟化硼化合物具有较高的量子产率、较高的光稳定性和电子迁移率、较大的斯托克斯位移等特点,在光电材料、生命科学、生物医药、生物化学传感等领域具有潜在的应用价值[7-8]。因此,开发新型的β-二酮二氟化硼衍生物并探索其在生物体内的应用具有重要的科学意义。
咪唑是一种五元含氮杂环化合物,也是一种重要的有机合成中间体,其衍生物具有抗肿瘤、抗菌、抗病毒等多种生物活性,在药物化学和生物医学领域应用较为广泛[9]。基于此,本文以咪唑和β-二酮二氟化硼为原料,设计合成了一种有机化合物L(图1),研究了化合物L在不同溶剂中的光物理性质,探索了化合物L在细胞和组织中的成像情况。
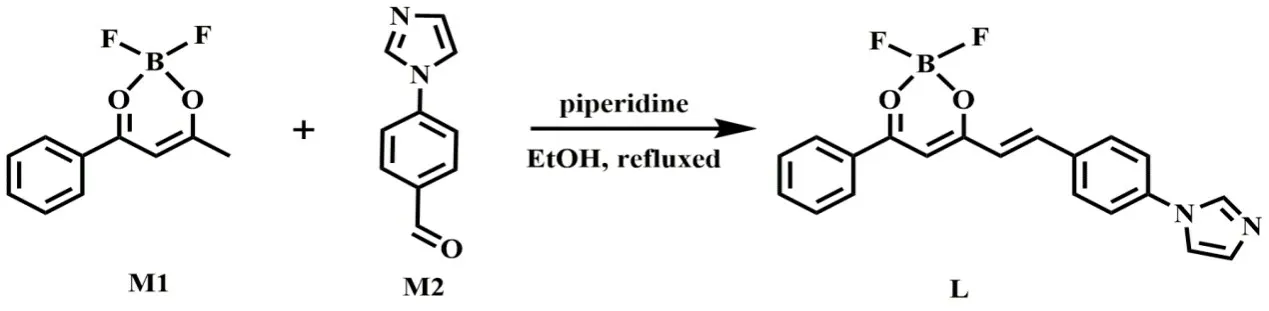
图1 化合物L的合成路线图Figure 1 The synthetic route of compound L
1 材料与方法
1.1 仪器与试剂
仪器:Bruker Avance 600型核磁共振仪,德国Bruker公司;Finnigan LCQ 型质谱仪,美国Thermo Finnigan公司;UV-5900 PC型紫外可见分光光度计,上海元析仪器有限公司;Leica TCS SP8共聚焦显微镜,德国徕卡微系统有限公司;HITACHI F-4600型荧光分光光度计(实验参数:激发波长为410 nm,狭缝宽度均为5 nm,电压为500 V),日本日立公司;Nicolet FTIR is5 型傅里叶变换红外光谱仪,美国尼高力仪器公司。
试剂:苯甲酰丙酮(98%),三氟化硼二甲醚,咪唑(99%),对氟苯甲醛(98%),其他药品为分析纯,购于上海阿拉丁试剂有限公司。人肝癌细胞株(HepG2)来源于皖南医学院药学院中心实验室。
1.2 化合物L的合成
中间体M1和M2的合成参照文献[10-11]。在100 mL圆底烧瓶中加入0.21 g M1(1 mmol),用30 mL乙醇使其完全溶解,然后加入0.17 g M2(1 mmol)和100µL哌啶,回流反应20 h,反应结束后,冷却至室温,减压抽滤,粗产品用乙醇重结晶,得到黄色固体0.29 g。1H NMR(600 MHz,d6-DMSO),δ 8.47(d,J=12.6 Hz,1H),8.17(d,J= 7.6 Hz,1H),8.02~7.98(m,2H),7.92~7.83(m,3H),7.78(m,1H),7.72(d,J= 16.0 Hz,1H),7.64(m,2H),7.57~7.53(m,1H),7.30(d,J=16.0 Hz,1H),7.17(s,1H),7.03(d,J=16.0 Hz,1H)。13C NMR(151 MHz,d6-DMSO),δ 181.14,160.41,146.99,140.89,139.37,136.02,131.68,130.15,129.98,129.39,129.19,127.70,122.11,120.92,118.29,98.47,56.44,18.98。ESI-MS:理论值364.119 5;实验值365.125 6。IR(selected bands,cm-1):2 361,1 631,1 585,1 543,1 490,1 381,1 303,1 250,1 188,1 111,1 083,1 005,960,832,685,654。
2 结果与讨论
2.1 化合物L的光学性质研究
首先测试了化合物L在七种不同极性的溶剂中的紫外可见吸收光谱和荧光光谱。在所有测试中,化合物L的浓度为10µM,溶剂分别为二甲基亚砜(DMSO)、乙腈(CH3CN)、乙醇(EtOH)、四氢呋喃(THF)、乙酸乙酯(EA)、苯(Benzene)和PBS缓冲溶液(pH=7.40)。图2(A)是化合物L在不同溶剂中的紫外可见吸收光谱,从图2(A)中可以看出,化合物L在350~500 nm之间有一个很强的吸收峰,可归属于分子内电荷跃迁或ππ*跃迁[10]。此外,与其他极性的溶剂相比,化合物L在大极性溶剂(DMSO)中(PBS除外)的最大吸收峰发生了明显的红移,这可能是由于在化合物分子轨道的π-π*跃迁过程中,其激发态的极性大于基态的极性,所以在极性较大的溶剂中,尽管基态和激发态的能量都有所降低,但激发态降低得更多,导致分子轨道的电子跃迁所需能量较极性较小的溶剂中减小,因而吸收带向长波方向移动[12]。图2(B)是化合物L在不同溶剂中的荧光光谱,随着溶剂极性的增加,化合物L的荧光发射峰呈现出明显的红移趋势,且荧光强度也在降低,可解释为激发态比基态具有更大的极性,溶剂化效应与能级降低有关,溶剂与溶质之间偶极-偶极相互作用的增强会导致激发态能级的降低;同时,溶质分子激发态与基态间能级差的降低还引起了非辐射跃迁的增大,从而使化合物荧光强度降低[13]。
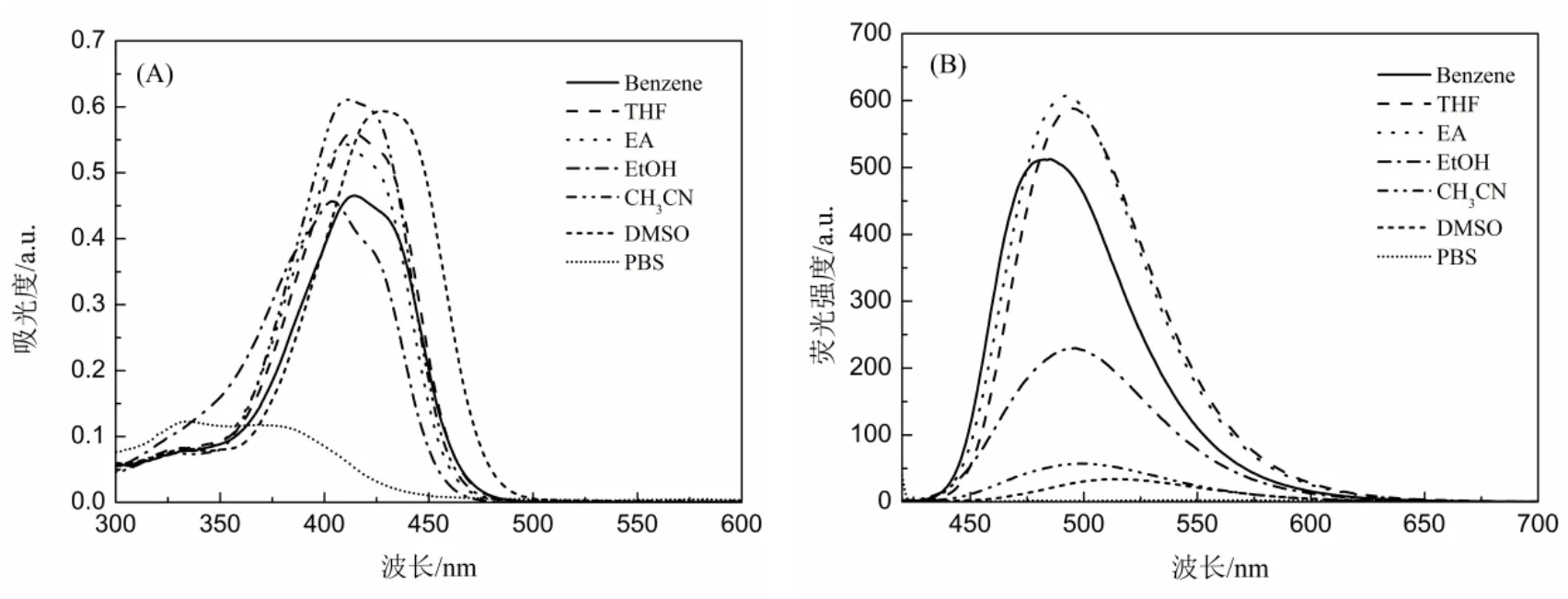
图2 化合物L在不同溶剂中的紫外可见吸收光谱(A)和荧光发射光谱(B)Figure 2 UV-vis absorption(A)and fluorescence emission(B)spectra of compound L in different solvents
2.2 不同分析物和pH对化合物L光学性质的影响
由于生物体内环境复杂,在进一步将化合物L用于生物体内研究之前,考察了生物体内各种分析物和不同的pH对化合物L光学性质的影响,如图3所示。首先配制了pH值为2~11的PBS缓冲溶液和各种不同分析物(包括ADP、Ag+、Al3+、ATP、Ba2+、BSA、Bi3+、Ca2+、Cd2+、Co2+、Cr3+、Cu2+、DNA、Fe3+、GSH、Hg2+、K+、Li+、Mg2+、Mn2+、Na+、Ni2+、ppi、RNA、Zn2+、脂质体、组氨酸、半胱氨酸、苯丙氨酸、丙氨酸、精氨酸、亮氨酸、异亮氨酸、组蛋白)的溶液。测试时,移取50µL的化合物L溶液(母液浓度为10-3mol/L,溶剂为二甲基亚砜),用PBS缓冲溶液定容至5 mL,然后加入20倍当量的各种分析物,摇匀即可。从图3(A)中可以看出,化合物L仅与脂质体(liposome)有荧光增强作用,与其他分析物没有响应,说明化合物L与脂质体之间产生了某些相互作用,从而导致其荧光增强。由于脂质体是一种类似生物膜结构的双分子层微小囊泡,而化合物L具有较好的亲脂性,当二者混合在一起后,化合物L中的亲脂基团使其更倾向于渗入脂质体的封闭囊泡中,分子中单键的旋转受到脂质双分子层结构的限制,最终使得其荧光增强。此结果表明化合物L具有靶向细胞内膜结构的潜在能力。由图3(B)可知,在pH值为6~8范围内,化合物L的荧光强度变化不大,表明化合物L的荧光发射强度不受生理环境pH值的影响。
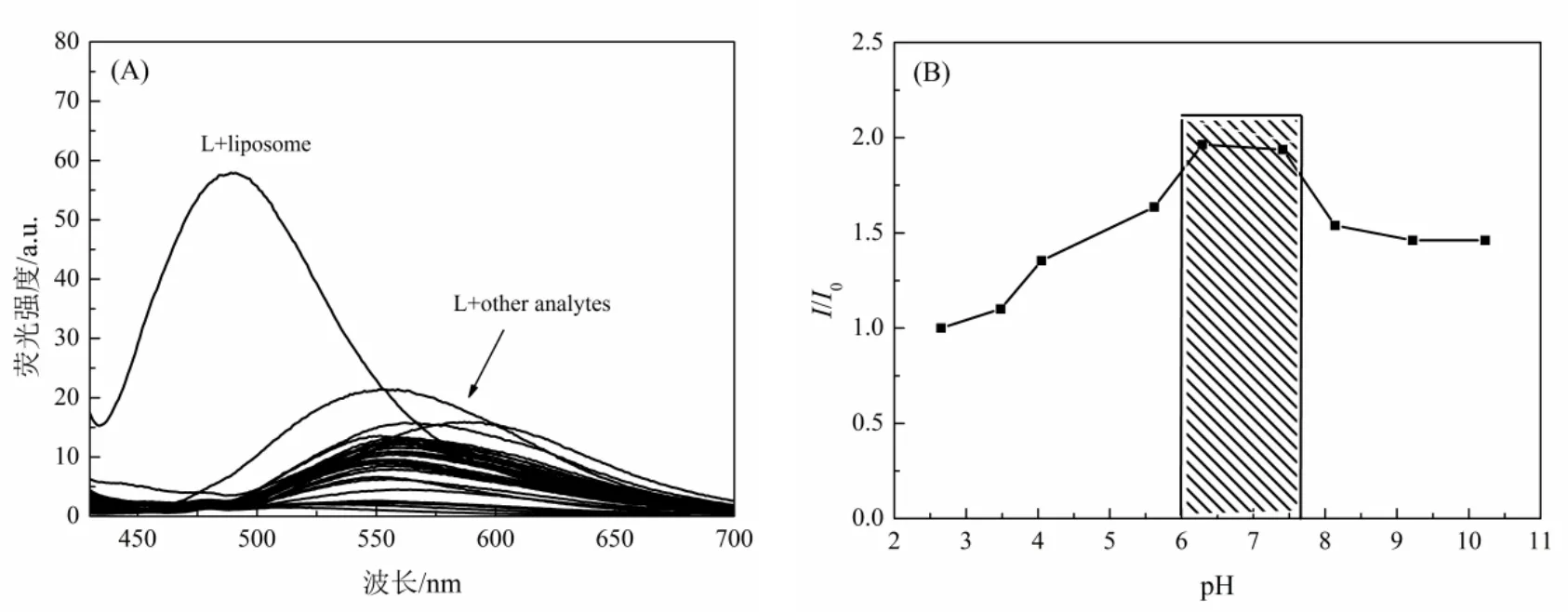
图3 (A)化合物L与各种不同分析物相互作用后的荧光光谱;(B)化合物L在不同pH下的相对荧光强度(I代表化合物L在不同pH下的荧光强度,I0代表化合物L在pH=2.65时的荧光强度)Figure 3 (A)Fluorescence spectra of compound L interacting with various analytes;(B)Relative fluorescence intensity of compound L at different pH(I represents the fluorescence intensity of compound L at different pH values,and I0 represents the fluorescence intensity of compound L at pH=2.65)
2.3 化合物L的细胞和组织成像研究
采用MTT 法[14]研究了化合物L 对HepG2 细胞的毒性实验。如图4 所示,当不同浓度的化合物L 与HepG2细胞共同作用24 h后,细胞的存活率仍在80%以上,表明化合物L具有较高的细胞存活率,可用于活细胞成像研究。
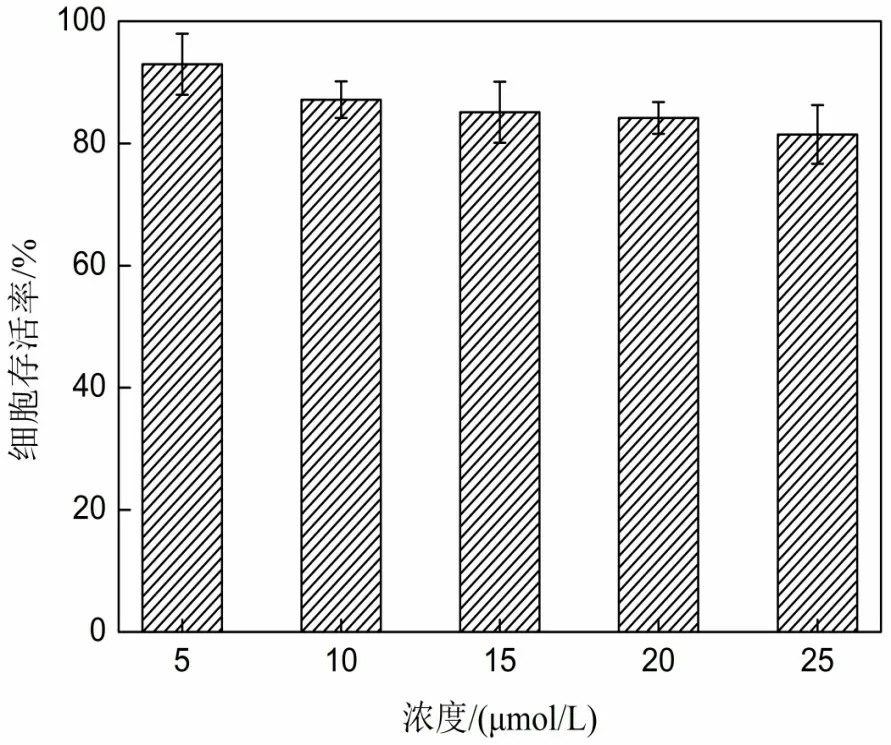
图4 化合物L与HepG2细胞作用24 h后的细胞存活率图Figure 4 Survival rate of HepG2 cells incubated with compound L for 24 h
将HepG2细胞接种于共聚焦小皿中,待皿内细胞密度涨至50%时,移去皿中的培养基,加入新鲜的含有10µM化合物L的培养基溶液,培养30 min后,用PBS缓冲溶液洗涤3遍,用徕卡TCS SP8型显微镜观察,如图5所示。从图5可以看出,化合物L可在30 min内进入细胞,着色细胞的细胞质部位,并在细胞内显示出较强的荧光信号。为了进一步研究化合物L在细胞内的靶向部位,选择商业染料ER tracker(内质网商染,激发波长为587 nm,发射波长为600~640 nm)和Mito tracker Red(线粒体商染,激发波长为579 nm,发射波长为580~620 nm)进行共定位实验。如图6 所示,化合物L 与内质网商染和线粒体商染的皮尔森系数分别为0.86和0.27,说明化合物L主要靶向在细胞中的内质网部位,部分靶向在线粒体上。这种现象可解释为线粒体和内质网是高疏水性的膜质细胞器,化合物L是亲脂性分子,当其进入到细胞后,可与内质网和线粒体膜结构中的亲脂区域重叠。以上实验结果表明化合物L主要定位于细胞内的膜结构上。

图5 化合物L与HepG2细胞共培养30 min后的细胞成像图Figure 5 Image of HepG2 cells incubated with compound L for 30 min
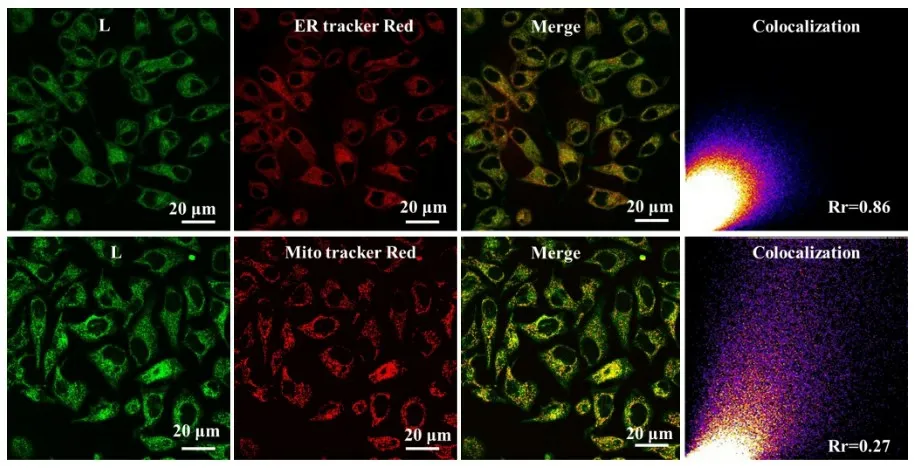
图6 化合物L与商业染料的共定位图Figure 6 Images of HepG2 cells incubated with compound L and different commercial dyes
在细胞显影的基础上又探索了化合物L在组织上的成像研究。选取新鲜的小鼠大脑组织,厚度约为30µm。将含有10µM化合物L的PBS溶液与小鼠大脑组织在37 ℃恒温培养箱中共培养30 min后,用PBS缓冲溶液洗涤3遍,将组织固定在黏附载玻片上,用Leica TSC SP8显微镜观察,实验结果见图7,化合物L可以很好地着色小鼠的大脑组织,渗透深度达到15.8µm,表明化合物L可用于组织成像研究。

图7 (A)化合物L与小鼠大脑组织共培养后的组织成像图;小鼠大脑组织的3D成像图(B)和渗透深度图(C)Figure 7 (A)Tissue image of mouse brain tissue incubated with compound L;3D imaging of mouse brain tis⁃sue(B)and penetration depth(C)after incubated with compound L
3 结论
本文设计合成了一种β-二酮二氟化硼的衍生物L,系统研究了化合物L在七种不同极性溶剂中的光物理性质及不同pH和各种分析物对其荧光强度的影响。结果表明,化合物L具有良好的光物理性质,且在生理环境下不受pH及各种分析物的干扰。生物实验结果表明化合物L可定位于细胞内质网和线粒体中的膜结构区域,也能对小鼠的大脑组织进行成像。此实验结果为后期设计合成靶向细胞内膜结构的化合物奠定了实验基础。

