草酸艾司西酞普兰治疗卒中后抑郁对血清S100β及NSE水平的影响
李 楠 张 续 杨 洋
郑州大学第二附属医院,河南 郑州 450003
卒中是世界范围内引起死亡和长期残疾的主要原因之一[1],卒中后抑郁(post-stroke depression,PSD)是发生在脑卒中后一种严重危害身心健康的神经精神疾病,随着卒中人数的逐年增加,卒中后抑郁患者总数也在迅速增加,约1/3的卒中患者会发展成卒中后抑郁[2-3],主要表现为郁郁寡欢、兴趣下降、情绪低落、睡眠障碍、疲劳、冷漠等症状。PSD 不仅影响患者的功能恢复和生活质量,而且增大患者卒中复发和死亡的风险,具有较高的自杀率和残疾率[4-5]。
临床上已广泛应用选择性5-H T再摄取抑制 剂(selective serotonin reuptake inhibitors,SSRIs)作为PSD 的一线治疗药物。草酸艾司西酞普兰是临床常用的治疗抑郁症的SSRIs药物,研究发现其可以改善患者焦虑抑郁状态[6-8],具有较好疗效及较少的不良反应,可更好地预防复发并减少住院时间。研究表明,西酞普兰的治疗可能会引起多种促炎因子IL-1β、IL-6、IL-22 和TNF-α水平的升高,而这些可能与治疗效果和不良反应的差异有关[9]。
中枢神经特异蛋白(S100β protein,S100β)是钙结合蛋白S100 家族中的一种β同源二聚体蛋白,具有高度特异性,主要存在于星形胶质细胞和其他类型的神经胶质细胞中,也可存在于脂肪细胞、软骨细胞和黑色素瘤细胞中[10]。生理浓度的S100β不仅能够促进神经胶质细胞的增生,还具有神经保护功能,可防止运动神经元变性以及提高神经元的存活率[11],S100 β可以穿透血-脑屏障,因此可以通过检测其血浆水平来测其浓度[12]。神经元特异性烯醇化酶(neuron-specific enolase,NSE)是一种位于神经元胞浆中的糖酵解酶,研究表明NSE可通过激活PI3K/Akt 和MAPK/ERK 信号通路来控制神经元存活、分化和神经突再生[13]。在急性缺血性脑卒中患者的研究中发现,血清S-100β、NSE 水平的升高可能与患者的脑梗死面积和神经功能损害程度有一定的相关性[14-15]。目前,S100β及NSE 已被多项研究证实可作为颅脑损伤及神经系统疾病的生物标志物[10,16-17]。但目前在PSD 患者中研究较少。因此,本研究通过应用草酸艾司西酞普兰治疗PSD患者,观察其对PSD患者的疗效及对血清S100β、NSE水平的影响。
1 资料与方法
1.1 一般资料 前瞻性纳入郑州大学第二附属医院神经内科于2021-01—08 收治的PSD患者54例,纳入标准:(1)经头颅CT或MRI确诊的脑卒中患者;(2)汉密尔顿抑郁量表(HAMD)17 项版本评分≥17 分;(3)患者及家属签署知情同意书。排除标准:(1)既往有脑卒中或精神疾病史且服用过抗抑郁药物;(2)存在严重心、肺、肝、肾疾病及其他严重精神障碍疾病;(3)存在严重的语言功能障碍或意识障碍,不能配合完成量表评估;(4)未按规定执行医嘱或中途退出者。按随机数字表法分为对照组27 例及观察组27 例,收集2 组患者一般资料(包括性别、年龄、高血压、糖尿病、冠心病史),分析比较2组患者一般资料,差异无统计学意义(P>0.05),具有可比性,见表1。本研究已获得医院伦理委员会批准。
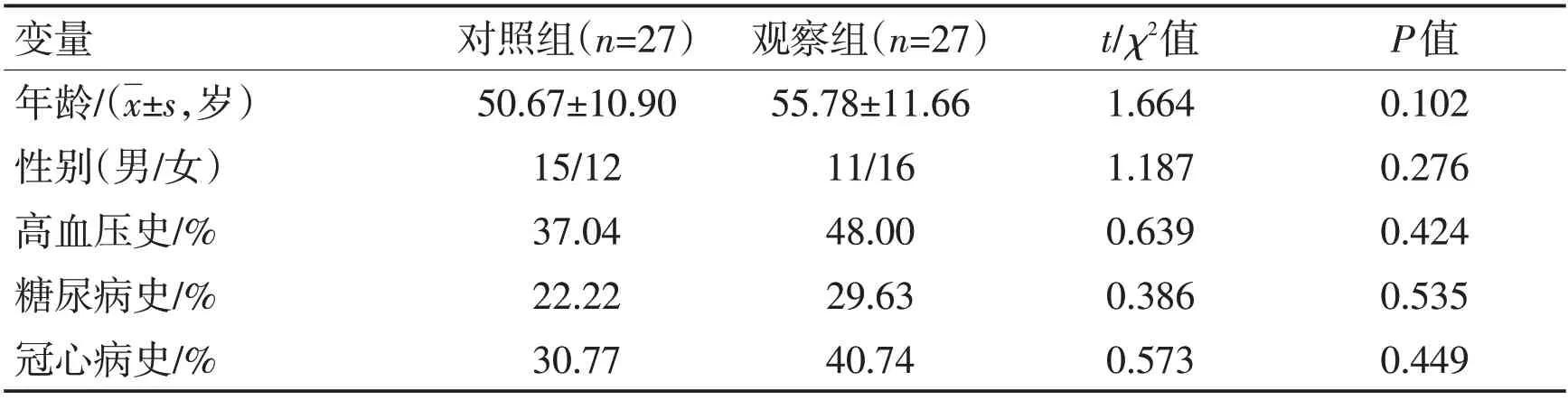
表1 2组一般资料比较Table 1 Comparison of the general data of the two groups
1.2 方法 2组患者均给予基础对症治疗,包括控制血压、血糖、血脂及改善脑循环等。对照组服用盐酸舍曲林片(浙江华海药业股份有限公司,规格:50 mg,初始剂量为50 mg/d,根据病情可增加药物剂量,每次增加50 mg,最大可增至200 mg/d),观察组服用草酸艾司西酞普兰片(四川科伦药业股份有限公司,规格:10 mg,初始剂量10 mg/d,根据病情可调整至最大剂量20 mg/d),均连续治疗8周。
1.3 观察指标 2 组患者均在治疗前后抽取空腹肘静脉血3 mL 置于EDTA 管中,1 000 g离心10 min后取上清,使用S100β ELISA试剂盒(上海碧云天生物技术有限公司)、NSE ELISA试剂盒(上海酶联生物科技有限公司),按照相关说明书步骤进行操作,然后使用酶标仪(Labsystems Dragon Wellscan MK 3)利用标准品的吸光度值计算血清S100β、NSE 水平。患者治疗前后的抑郁程度采用HAMD 评估,并根据HAMD 评分的下降程度判断治疗效果,HAMD评分较治疗前下降>75%为显著有效,下降25%~75%为有效,下降<25%为无效。观察并记录2 组患者用药期间出现的不良反应。
1.4 统计学分析 采用GraphPad Prism 9.0软件进行数据分析,计量资料以均数±标准差(±s)表示,患者治疗前后的比较采用配对t检验,2组间比较采用独立样本t检验,计数资料以率(%)表示,采用χ2检验比较,P<0.05为差异有统计学意义。
2 结果
2.1 2组治疗效果比较 治疗后对照组总有效率92.59%,观察组为88.89%,2 组总有效率相比,差异无统计学意义(P>0.05)。见表2,图1。
图1 2组治疗效果比较Figure 1 Comparison of treatment effects between the two groups
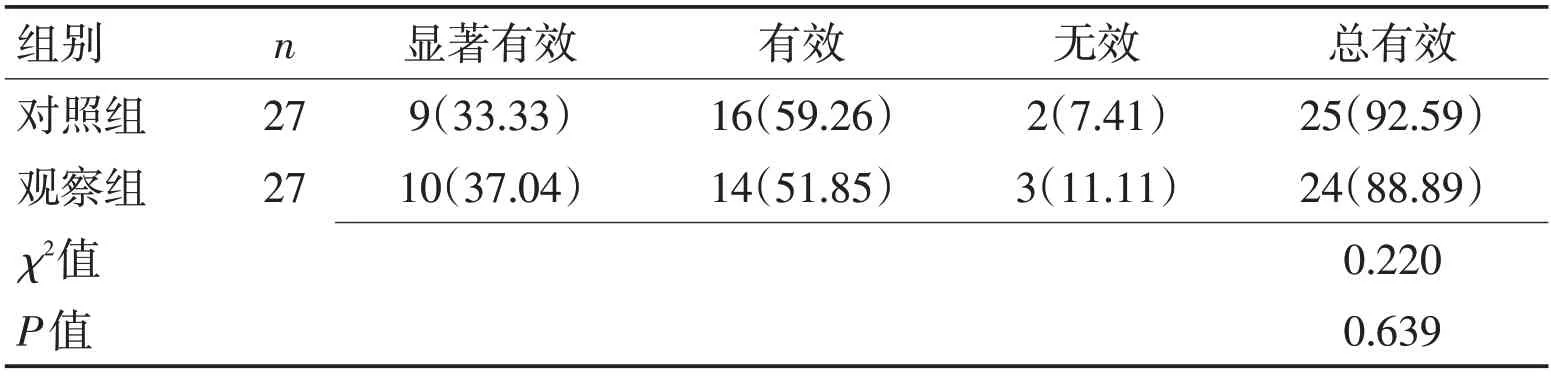
表2 2组治疗效果比较 [n(%)]Table 2 Comparison of treatment effects between the two groups [n(%)]
2.2 2 组治疗前后HAMD 评分比较 2 组患者治疗后HAMD 评分较治疗前均显著下降,差异有统计学意义(P<0.000 1),治疗后HAMD评分观察组与对照组相比,差异无统计学意义(P>0.05)。见表3、图2。
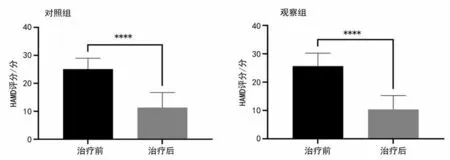
图2 2组治疗前后HAMD评分Figure 2 HAMD scores of the two groups before and after treatment
表3 2组治疗前后HAMD评分比较 (分,±s)Table 3 Comparison of HAMD scores in two groups before and after treatment (scores,±s)
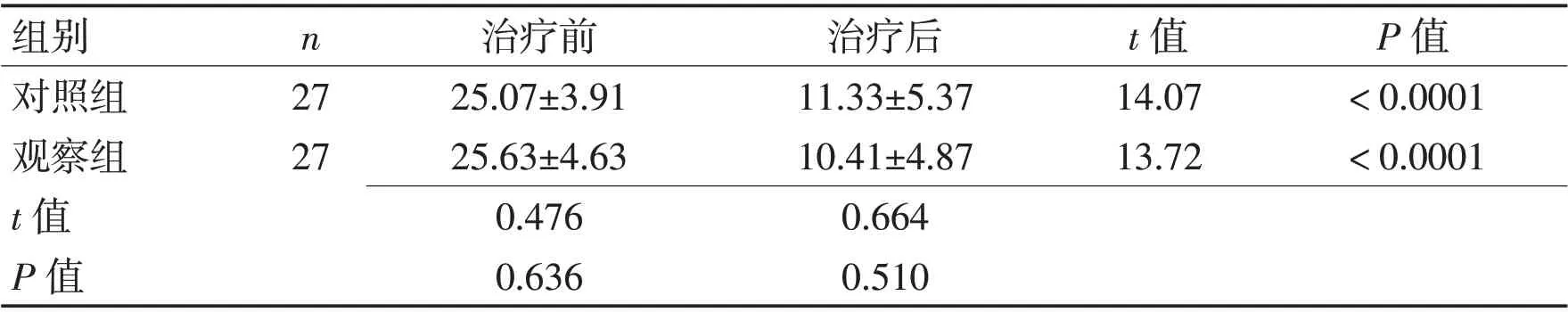
表3 2组治疗前后HAMD评分比较 (分,±s)Table 3 Comparison of HAMD scores in two groups before and after treatment (scores,±s)
组别对照组观察组t 值P 值n 27 27治疗前25.07±3.91 25.63±4.63 0.476 0.636治疗后11.33±5.37 10.41±4.87 0.664 0.510 t 值14.07 13.72 P 值<0.0001<0.0001
2.3 2 组治疗前后血清S100β、NSE 水平比较 治疗前2 组患者血清S100β、NSE 水平相比,P>0.05。治疗后2 组患者血清S100β、NSE水平均较治疗前降低,且观察组患者血清S100β、NSE水平较对照组显著降低,差异有统计学意义(P<0.05)。见表4、图3。
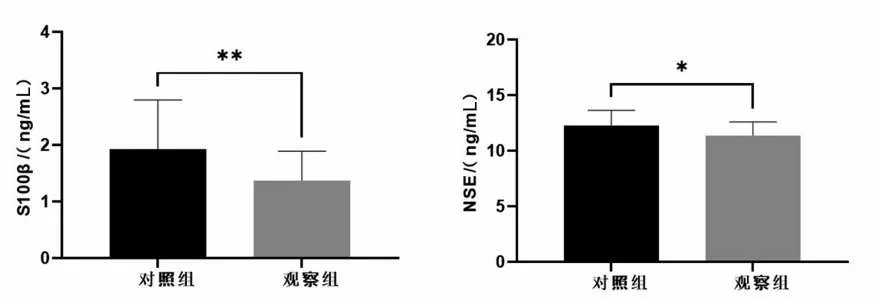
图3 2组治疗后血清S100β、NSE水平比较Figure 3 Comparison of serum S100β and NSE levels between the two groups after treatment
表4 2组治疗前后血清S100β与NSE水平比较 (±s)Table 4 Comparison of serum S100β and NSE levels in the two groups before and after treatment (±s)
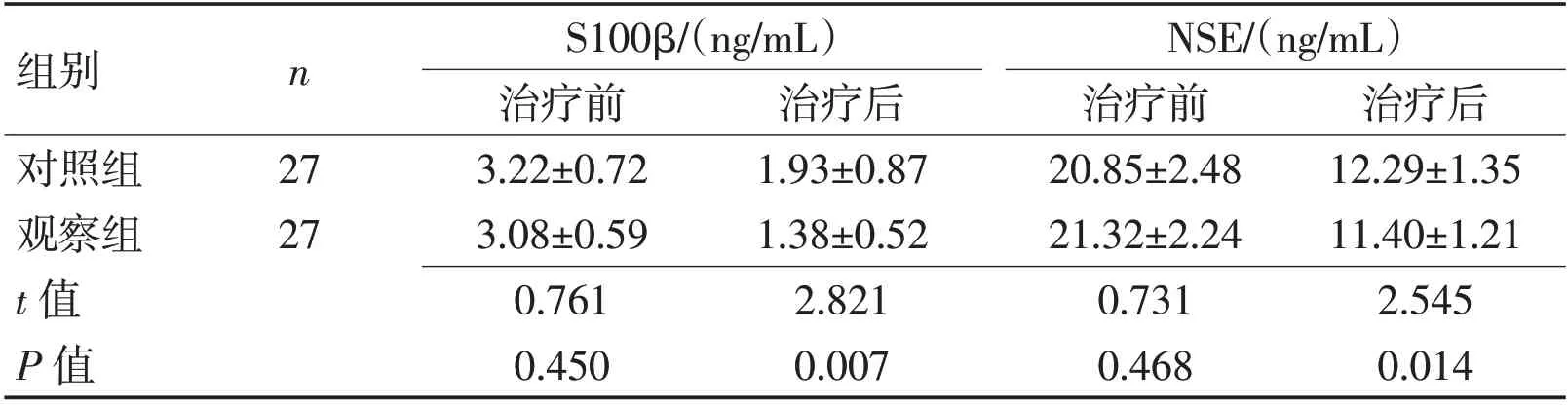
表4 2组治疗前后血清S100β与NSE水平比较 (±s)Table 4 Comparison of serum S100β and NSE levels in the two groups before and after treatment (±s)
组别对照组观察组t 值P 值n 27 27 S100β/(ng/mL)治疗前3.22±0.72 3.08±0.59 0.761 0.450治疗后1.93±0.87 1.38±0.52 2.821 0.007 NSE/(ng/mL)治疗前20.85±2.48 21.32±2.24 0.731 0.468治疗后12.29±1.35 11.40±1.21 2.545 0.014
2.4 2组患者不良反应比较 研究期间共有5例患者服药后发生不良反应(包括头晕、恶心、腹泻、嗜睡),均为轻度,其中对照组3例,观察组2 例。2 组不良反应发生率分别为11.11%和7.41%,差异无统计学意义(χ2=0.220 P=0.639)。见表5、图4。
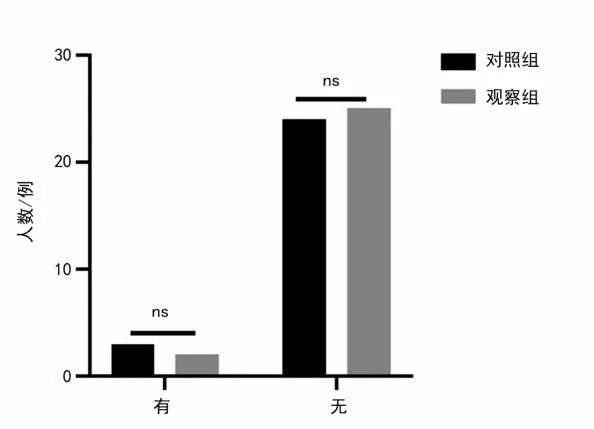
图4 2组不良反应比较Figure 4 Comparison of adverse reactions between the two groups
表5 2组患者不良反应比较 [n(%)]Table 5 Comparison of adverse reactions between the two groups [n(%)]
3 讨论
艾司西酞普兰是西酞普兰的活性S-对映体,主要分子靶点是5-羟色胺转运体(serotonin transporter,SERT)。SERT负责5-羟
色胺(5-HT)在5-羟色胺能神经元终末和胞体的重摄取,也是选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor,SSRI)的靶点[18]。艾司西酞普兰通过选择性地与人5-HT转运蛋白结合来抑制5-羟色胺的再摄取,从而增强中枢神经系统的5-羟色胺能活性[19]。5-HT 作为大脑中的一种神经递质,在情绪稳态中起着重要作用,而5-HT 水平的异常与抑郁症的发生有关[20]。艾司西酞普兰和舍曲林是目前临床常用的抗抑郁药,通过选择性抑制中枢突触前膜摄取5-HT,上调5-HT 在突触间隙中的浓度而起到抗抑郁的作用。多项研究认为,艾司西酞普兰和舍曲林是目前常用的抗抑郁药中疗效和耐受性最好的药物[21]。在一项随机临床研究中发现艾司西酞普兰和舍曲林显示出相似的疗效、有效率分别为75%和70%且均具有良好的耐受性[22]。此外,在一项多重治疗荟萃分析比较中发现,西酞普兰和舍曲林的疗效及可接受性最好,与度洛西汀、氟伏沙明、帕罗西汀、瑞波西汀和文拉法辛相比,导致停药的次数显着减少[23]。这与本研究结果一致,草酸艾司西酞普兰和舍曲林治疗PSD的总体有效率及HAMD 评分相比,差异无统计学意义(P>0.05),提示草酸艾司西酞普兰和舍曲林具有相同的治疗效果。这种治疗作用部分归因于其在SERT 结合位点的作用导致SERT摄取功能受到抑制[24],从而提高5-HT的浓度,改善患者的抑郁状态。
S100β的血浆水平升高可出现在精神分裂症和重度抑郁症患者中[25],与健康对照组相比,患有抑郁症的患者的S100β水平显著升高,而非抑郁症患者的水平正常[26],其水平与患者的抑郁症症状呈负相关[27]。在动物模型中针对大鼠抑郁模型的研究发现,血清中BDNF和S100β的水平与抑郁症的发生密切相关,其中S100β主要影响大鼠的运动能力[28]。另一项基础研究则发现S100B 的分泌在过度刺激和压力下增加,并减少轴突损伤,因此,S100B 的作用可能因其浓度不同而不同[29]。本文在此研究的基础上采用草酸艾司西酞普兰和舍曲林进行治疗,观察这两种抗抑郁药改善患者的抑郁症状是否与降低血浆中S100β的水平有关联。研究结果发现草酸艾司西酞普兰和舍曲林治疗后的PSD 患者血清中S100 β、NSE水平均有下降,且草酸艾司西酞普兰的效果优于舍曲林。NSE作为一种糖酵解酶,在人体能量代谢、神经元分化和神经可塑性中发挥重要作用。由于NSE 在神经元中有选择性表达,并且在生物体液中具有很高的稳定性,NSE 的胞外水平使其成为病理情况下神经元损伤的标志[30],其水平的变化可能会影响情绪障碍相关的代谢变化。因此,我们通过观察NSE水平在PSD患者中的表达,并采用草酸艾司西酞普兰和舍曲林的干预分析了其对NSE水平的影响。本研究表明,经过草酸艾司西酞普兰和舍曲林的干预,PSD患者血液中NSE水平均有所下降,且草酸艾司西酞普兰的效果优于舍曲林。通过对PSD 患者采用草酸艾司西酞普兰和舍曲林进行干预可降低患者血液中S100β、NSE 水平,而S100β、NSE 水平的降低可能与患者的症状改善相关,可能有助于判断PSD患者预后。
对随机对照临床研究中发现,约60%的患者在使用抗抑郁药治疗期间经历了至少一次不良事件。这些不良事件类型通常包括腹泻、头晕、口干、疲劳、头痛、恶心、性功能障碍、出汗、震颤和体质量增加[31]。这与一项针对急性缺血性脑卒中患者的研究是一致的,使用艾司西酞普兰药物干预后部分患者在治疗期间出现头晕、口干及便秘症状,均为轻度,对症治疗后症状均消失[32],本研究中患者也出现腹泻、头晕、恶心及嗜睡但均为轻度,在给予治疗后好转。这些抗抑郁药的不良反应可能与其突触效应有关,即应用抗抑郁药物后对人类的大脑或身体上其他部位突触的一些重要组成部分产生影响,进而引起一些不良反应[33]。
本研究发现草酸艾司西酞普兰对PSD 具有良好的疗效及安全性,可有效改善PSD患者血清中S100β、NSE 的水平,且血清S100β、NSE 水平可能有助于判断PSD 患者的预后。未来仍需要更大样本量的临床试验数据支持,为PSD诊疗提供更多的临床证据。

