动脉瘤术后分流依赖性脑积水的危险因素分析
段 佩 蔡远坤 杨 超 邵钰阳 江普查
武汉大学中南医院,湖北 武汉 430071
颅内动脉瘤是血管管壁结构局限性膨出形成的瘤样病变,是一种常见的脑血管疾病,其在脑血管疾病中发生率较高,仅低于脑血栓形成及高血压脑出血,其预后差,致残率和致死率较高[1]。大多数病人发现动脉瘤以蛛网膜下腔出血首诊入院,且蛛网膜下腔出血的主要病因为动脉瘤破裂引起,占80%以上[2-3]。当发现动脉瘤后大多需要积极处理,特别是病人症状重,出现剧烈颅内高压症状,如头痛、恶心呕吐,或局灶性神经功能障碍,如动眼神经麻痹、肢体活动障碍,甚至出现意识障碍、生命体征不平稳时,结合患者影像学、手术指征明确,此时必须积极处理。常规采取开颅动脉瘤夹闭术或血管内介入手术治疗,以挽救患者生命。但动脉瘤术后也有很多并发症,对患者的生活质量产生严重影响,如动脉瘤术后脑积水,可导致神经功能损伤和认知功能障碍。部分脑积水患者必须行分流手术才能改善症状和生活质量,称为“分流依赖性脑积水”(shunt-dependent hydrocephalus,SDH)。SDH在临床中并不少见,有文献报道动脉瘤术后10%~20%患者发展为SDH,早期患者大多发病不典型,且不同的患者其临床表现不尽相同,轻者思维缓慢、记忆力下降、精神不振等,重者可出现不同程度的意识改变甚至脑疝[4]。若诊断及治疗延误,将严重影响病人预后,直接影响患者致残率和致死率,给其家庭及社会带来沉重负担。目前脑积水的发病机制暂不明确,大多文献报道认为主要影响脑脊液循环通路及蛛网膜颗粒吸收障碍、蛛网膜下腔纤维化等[5]。脑积水的治疗主要包括非手术治疗和手术治疗。非手术治疗常规使用甘露醇、甘油果糖、呋塞米[6];手术治疗常规采用脑脊液分流手术,主要包括脑室-腹腔分流术、腰大池-腹腔分流术、脑室-心房分流术,其中脑室-腹腔分流术应用最多且最广泛[7],但分流术后会带来很多并发症,如分流管堵塞、颅内感染、分流后患者症状改善不明显等,且属于二次创伤,故应尽量减少手术的可能性。因此,分析动脉瘤术后并发SDH的危险因素,对预防动脉瘤术后SDH 的发生具有重要意义,一方面能为临床医师提供参考,另一方面可减少患者术后并发SDH 的概率,缩短住院时间,减轻患者家庭负担,提高生活质量。目前由于各研究者的设计方案不同和各国及各地区、各医院就诊的人群差异,国内外对动脉瘤术后脑积水危险因素的认识意见依旧未达成共识。故本文结合科室多年经验,尽可能纳入相关因素进行分析,探讨SDH 发生的危险因素。
1 资料与方法
1.1 一般资料 回顾性分析2019-01—2019-12 在武汉大学中南医院神经外科接受治疗的246 例动脉瘤患者的临床资料。按是否并发SDH 分为SDH 组(27 例)、非SDH 组(219例)。并发SDH组27例,男9例,女18例,年龄47~81(63.56±8.86)岁。非SDH 组219例,男89 例,女130 例,年龄31~80(57.86±8.94)岁。
1.2 纳入与排除标准 纳入标准:(1)经脑血管造影(digital subtraction angiography,DSA)或脑CT 血管造影(CT angiography,CTA)检查确诊为动脉瘤;(2)手术方式为夹闭或介入;(3)动脉瘤术后存活时间≥3周,能够评估分流依赖性脑积水的形成。排除标准:(1)动脉瘤手术行搭桥或复合手术;(2)CT检查显示由于患者本身脑萎缩或其他原因引起脑室扩大而不是脑积水所引起;(3)合并动静脉畸形、淀粉样变性、烟雾病、颅脑创伤、颅内肿瘤;(4)影像学资料不全或失访患者;(5)既往有动脉瘤手术史或脑出血史。
1.3 研究方法 电子病历收集整理相关研究资料,回顾性分析患者人口学特点、病史特点、手术过程、术前及术后影像学资料等,并对术后发生SDH的危险因素进行logistic回归分析。结合本研究小组的临床所见,探讨可能引起SDH 的相关因素,并经严格的纳入与排除标准后将患者的性别、年龄大小、有无高血压病史、有无吸烟史、术前的GCS 评分、术前的Hunt-Hess分级评分、改良Fisher分级(表1)、手术方式(夹闭/栓塞)、动脉瘤的部位、动脉瘤的大小、持续脑脊液引流、术前急性脑积水、动脉瘤破裂、去骨瓣减压、手术时机、动脉瘤个数纳入研究。为便于分析,按年龄分为<50岁组及≥50岁组。并将动脉瘤的大小经影像学检查后进行测量动脉瘤直径,并按最大直径进行分类:最大径<5 mm 称为小型动脉瘤,最大径介于5~15 mm 称为中型动脉瘤,最大径>15 mm称为大型动脉瘤。并将动脉瘤的位置依据临床上的相关共识进行分类,分为前循环动脉瘤和后循环动脉瘤,其中前循环动脉瘤包括位于颈内动脉、大脑前动脉及大脑中动脉的动脉瘤;后循环动脉瘤包括位于大脑后动脉及椎基底动脉相关动脉发出的动脉瘤。

表1 改良Fisher分级Table 1 Improved Fisher classification
1.4 SDH诊断标准 SDH的诊断标准:(1)有认知或意识障碍、行走不稳、尿失禁、颅内压增高等临床表现。(2)动脉瘤术后2周~1个月内行CT、MRI检查,采用双尾指数(Hensson脑室指数),即同一水平上在尾状核平面两侧脑室前角距离与颅骨内板间的距离的比值,其正常上限值依据患者年龄不同而评判标准不同,超过正常值上限即可诊断为脑积水。年龄参考值:<36 岁=0.16;36~45 岁=0.17;46~55 岁=0.18;56~65 岁=0.19;66~75 岁=0.20;76~85岁=0.21;86~100 岁=0.25。(3)必需行分流术才可能改善症状和生活质量。
1.5 统计学处理 采用SPSS 25.0 软件对所收集的相关数据进行处理。计数资料采用频数(%)表示,2组间比较采用χ2检验,并将有显著性差异的结果纳入多因素logistic 回归分析,探讨动脉瘤术后并发脑积水的独立影响因素。显著性水平取α=0.05。
2 结果
单因素分析显示,患者的性别、年龄大小、有无高血压病史、有无吸烟史、手术干预的时机及手术采取的方式、动脉瘤的个数与SDH发生均无相关性(P>0.05),而术前Hunt-Hess分级、术前改良Fisher 分级、术前患者存在急性脑积水、持续脑脊液引流、动脉瘤破裂、责任动脉瘤的部位、去骨瓣减压、入院GCS评分、动脉瘤的大小与SDH 的发生密切相关(P<0.05,表2)。logistic 回归分析示,持续脑脊液引流、高Hunt-Hess 分级(Ⅲ~Ⅴ级)、后循环动脉瘤与发生SDH 有显著相关性(P<0.05,表3、图1)。

图1 多因素分析结果中3个独立危险因素发生SDH的直方图 A:是否有脑脊液引流SDH的发生情况;B:不同HH分级病人SDH的发生情况;C:不同部位动脉瘤患者SDH的发生情况Figure 1 Histogram of SDH in three patients with independent risk factors in the multivariate results. A:Whether there is an occurrence of SDH with cerebrospinal fluid drainag;B:The occurrence of SDH in patients with different HH grades;C:The occurrence of SDH in patients with aneurysms in different parts
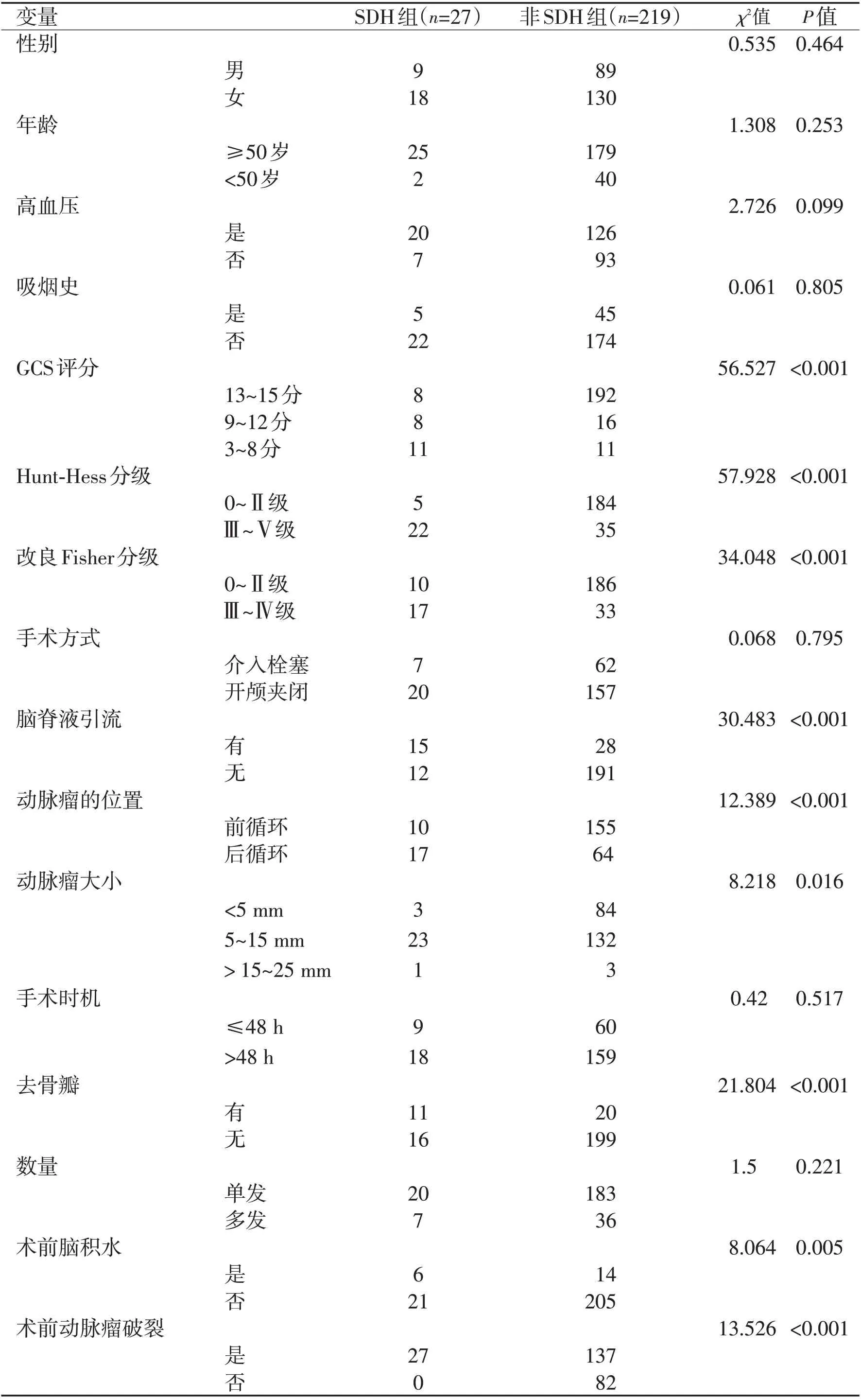
表2 动脉瘤术后病人并发SDH的单因素分析Table 2 Univariate analysis of SDH in patients after aneurysm surgery
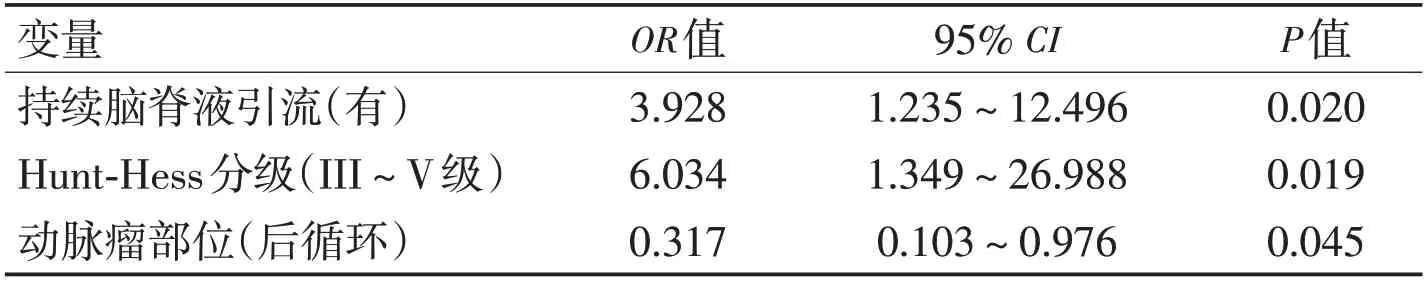
表3 动脉瘤术后病人发生SDH的logistic回归分析Table 3 Logistic regression analysis of SDH in patients after aneurysm surgery
3 讨论
SDH是动脉瘤术后最常见的并发症之一,也是影响患者预后的一个常见并发症,发病率较高,有文献报道在10%~20%[8-9]。SDH 不仅严重影响患者的生活质量,同时也给患者家庭及社会带来沉重的负担。目前对于SDH发生机制尚无统一的共识及标准,既往较多的研究者认为动脉瘤术后由于出血引起脑脊液循环通路受阻,进一步导致脑室脉络丛血管痉挛或功能障碍,从而引起蛛网膜颗粒吸收障碍,并且,一些由血细胞分解的代谢产物和脑组织急性期应激产生的炎症因子破坏血-脑屏障[10-11]。对于未破裂动脉瘤,术后也有出现脑积水的情况,可能与术中打破了原始的脑脊液循环通路,术中出血阻塞脑脊液循环通路有关。本研究将所有动脉瘤(无论破裂与否)纳入研究,经logistic 多因素回归分析发现持续脑脊液引流、高Hunt-Hess分级(Ⅲ~V级)、后循环动脉瘤是动脉瘤术后发生SDH的独立危险因素。
3.1 持续脑脊液引流 当患者意识障碍较重且脑室有积血时,通过早期引流血性脑脊液可以迅速降低颅内压,使术中暴露不至于那么困难,并能降低脑积水的发生率[12-13]。其可能机制为持续脑脊液引流能人为干预脑脊液循环,加快脑脊液的流动,将血性脑脊液更快引流出颅,减轻对脑脊液循环通路影响,从而能够使脑血管痉挛的发生风险明显降低,并进一步减少蛛网膜颗粒对脑脊液吸收的影响[14]。在减少动脉瘤术后脑积水的发生率方面,持续脑脊液引流可能发挥一定的作用,但需要动态观察引流量,并依据患者情况随时调整。过度引流会导致蛛网膜下腔坍塌,导致脑疝或低颅压综合征,但引流不足不仅导致脑脊液通路上血液清除时间延长,并且还使颅内感染的风险较无引流患者明显增加。既往研究表明,引流量在150~250 mL/d 时能够起到降低SDH 的发生率的作用[15]。本研究显示,持续脑脊液引流患者SDH 的发生风险较无脑脊液引流患者高,与既往研究结果不符。一方面,可能是因术前进行脑室外引流的患者本身就已出现脑积水,尽管引流可能会降低脑积水的发生率,但术后脑积水发生率仍会高于正常患者;另一方面,考虑引流的选择受术者临床经验及患者病情严重程度等多种因素影响,本结论需后期扩大样本量的多中心研究进一步加以验证。
3.2 高Hunt-Hess 分级(Ⅲ~Ⅴ级) 为判断患者病情,选择造影及手术时机,评价疗效,国际上常规对动脉瘤患者进行Hunt-Hess 分级,既往研究表明高Hunt-Hess分级(Ⅲ~Ⅴ级)与SDH 发生有很强的相关性,高Hunt-Hess 分级病人SDH 的发生风险较低分级病人高3 倍以上[16],说明患者入院时Hunt-Hess分级越高,病情越重,术后发生并发症的概率越高[17]。相比其他低分级病人,高Hunt-Hess 分级病人出现再次出血及脑血管痉挛的可能性更大,进一步造成蛛网膜下腔纤维化并出现增生反应,导致SDH的发生。本研究与既往研究结果相符,高Hunt-Hess分级病人出现神经功能缺失及意识水平改变,可能还是与动脉瘤破裂后引起蛛网膜下腔出血,进而影响脑脊液循环通路有关。
3.3 后循环动脉瘤 既往多项研究表明,在后循环动脉瘤患者中,发生SDH 的概率明显高于其他部位的动脉瘤[18-19]。本研究表明,后循环动脉瘤是SDH 发生的独立危险因素,其机制可能包括以下几个方面:一是可能由于后循环动脉瘤相较于其他部位动脉瘤所处基底池较宽且较大,动脉瘤破裂后大量的血液淤积难以清除,从而引起基底池堵塞[20-25]。二是血液会逐步渗入三脑室、侧脑室,导致脑室扩张,并经中脑导水管进入四脑室,容易造成四脑室出口阻塞,进而逐步引起SDH[26-29]。同时血液积聚于脑脊液通路,进一步导致脑脊液流动受阻,脑脊液动力学发生改变,进而导致脑积水的发生。三是由于动脉瘤破裂后血液成分会引起炎症性反应,红细胞可能引起大量炎性因子的释放,这些因子可能对胶原合成产生促排放作用,引起胶原合成,并导致蛛网膜下腔及蛛网膜颗粒纤维化[30],引起黏度的改变,导致纤维粘连,造成脑积水[31]。最后,由于动脉瘤所处位置不同,对临床医师的治疗选择也有很大影响。后循环动脉瘤手术多采用介入方式,未对脑脊液循环通路中的血液进行清除,进一步引起纤维化粘连,脑脊液循环受阻,导致脑积水的产生。
3.4 脑积水的治疗 手术指征包括患者出现颅内压增高相关症状,如头痛、呕吐、视神经乳头水肿等或出现意识障碍,经非手术治疗不能缓解,头部CT示脑积水,必须行分流手术。脑积水行分流术后可明显改善患者症状,有文献报道短期内可改善55%,长期可改善25%[32]。脑积水行分流手术后主要的并发症在于分流管堵塞、颅内感染、脑室出血、腹腔感染、引流不足或引流过度等[33]。故术中需更加严格的无菌操作规范,缩短手术时间,并尽可能使用可调压分流管,减少相关并发症的发生。
持续脑脊液引流、高Hunt-Hess 分级(Ⅲ~Ⅴ级)、后循环动脉瘤是动脉瘤术后发生SDH 的独立危险因素。当患者有上述危险因素时,应更加严密关注患者的基本情况,特别是脑积水相关指标的监测,尽可能降低术后SDH 的发生率,改善患者的预后。近年来也有相关文献报道评分系统预测SDH 的发生率[34-35],但最终落脚点还是对SDH相关危险因素的认识,对于入院时合并上述危险因素的患者,如何干预及何时去干预才能有效减少SDH的发生,及减少分流手术对患者造成进一步的创伤和经济负担,是今后脑积水方面研究的一个大方向和重点。由于本研究为单中心研究,存在样本量不足及纳入因素有限等缺陷,后续研究有待多中心大样本量及纳入更多因素进行研究。

