瑞香狼毒花中香豆素成分及生物活性研究
周蕙祯,罗 伟,陈 爽,陈胡兰,李国友,李丽梅
瑞香狼毒花中香豆素成分及生物活性研究
周蕙祯1, 2,罗 伟2,陈 爽3,陈胡兰2,李国友3,李丽梅1*
1. 西南民族大学药学院,四川 成都 610041 2. 成都中医药大学药学院,中药材标准化教育部重点实验室,四川省中药资源系统研究与开发利用重点实验室-省部共建国家重点实验室培育基地,四川 成都 611137 3. 中国科学院成都生物研究所,四川 成都 610041
研究瑞香狼毒花中的香豆素类化学成分及其抗菌和抗氧化活性。综合运用多种色谱分离技术进行分离纯化,并采用现代波谱学分析技术结合文献报道数据进行鉴定。对分离得到的9个香豆素类化合物进行了体内外抗氧化活性和体外抗菌活性研究。首先,采用1,1-二苯基-2-三硝基苯肼(DPPH)、2,2′-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、铁离子还原/抗氧化能力法(FRAP)法评价单体化合物抗氧化活性。然后用模式生物秀丽隐杆线虫建立胡桃醌诱导氧化损伤应激模型,通过H2DCFDA荧光染色实验,评价化合物9对氧化应激条件下秀丽隐杆线虫生存能力及体内活性氧(reactive oxygen species,ROS)水平的影响。此外,采用牛津杯法对单体化合物进行抗大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌和酵母菌的活性筛选。从瑞香狼毒花甲醇提取物中分离得到11个化合物,分别鉴定为7-羟基香豆素- 8--β--葡萄糖苷(1)、瑞香苷(2)、瑞香素(3)、7-羟基-8-甲氧基香豆素(4)、东莨菪葶(5)、5,7-二甲氧基香豆素(6)、伞形花内酯(7)、白瑞香素(8)、双白瑞香素(9)、3--咖啡酰奎尼酸(10)和腺苷(11)。化合物1、6、8、10、11为首次从该植物中分离得到,化合物11为首次从该属植物中分离得到。体外抗氧化活性测试结果显示化合物3和9活性显著。体内抗氧化活性实验证实化合物9(28 μmol/L)能显著延长线虫在氧化应激条件下的寿命(<0.000 1),且可显著降低线虫体内ROS水平(<0.001),增强线虫的抗氧化应激能力。化合物9显示出一定的大肠杆菌抑制活性,其最小抑菌浓度(MIC)值为1.0 mg/mL。
瑞香狼毒花;香豆素;抗氧化活性;抗菌活性;秀丽隐杆线虫;5,7-二甲氧基香豆素;白瑞香素;双白瑞香素;3--咖啡酰奎尼酸;腺苷
瑞香狼毒L.是瑞香科(Thymelaeaceae)狼毒属Linn.植物,又名续毒、山萝卜、生扯拢等,始载于《神农本草经》,为中药狼毒之正品,主要药用部位为根[1]。瑞香狼毒性味辛、苦、平,归肺、脾、肝经,有毒,有泻水逐饮、破积杀虫之效[1]。国内外学者对瑞香狼毒根茎中的化学成分进行了大量研究,发现了双黄酮、木脂素、香豆素、二萜类等成分,香豆素是其中的特征性化学成分,目前有关瑞香狼毒花的研究并不多见[2-3]。近年来,大量研究主要集中于具有强毒及抗肿瘤活性的二萜原酸酯类和双黄酮类成分,而对香豆素及双香豆素类特征性成分活性研究较少[4-5]。香豆素类化合物广泛分布于多种植物中,大量实验研究显示其具有抗凝血、抑菌等多种生物活性,广泛用于多种领域,以医学领域最常用[6]。香豆素相对分子质量较小,毒性较小,大部分香豆素类化合物吸收较快、生物利用度高,且已有双香豆素类成分作为抗凝药物在临床使用,故香豆素类成分已经成为药物研发的重要方向之一[6-7]。
本课题组前期开展了瑞香狼毒花部位中木脂素及黄酮类化学成分和体外抗氧化活性的研究[3],为了更全面地研究和阐明瑞香狼毒的活性物质基础,深入挖掘其药用价值,更好地开发利用该药用植物资源,本研究以瑞香狼毒花为研究对象,对其中的香豆素类成分进行了研究,从其甲醇提取物中分离鉴定了9个香豆素类化合物和2个其他类化合物,依次为7-羟基香豆素-8--β--葡萄糖苷(7- hydroxycoumarin-8--β--glucopyranoside,1)、瑞香苷(daphnin,2)、瑞香素(daphnetin,3)、7-羟基-8-甲氧基香豆素(7-hydroxy-8-methoxycomarin,4)、东莨菪葶(scopoletin,5)、5,7-二甲氧基香豆素(5,7-dimethoxycoumarin,6)、伞形花内酯(umbelliferone,7)、白瑞香素(edgeworthin,8)、双白瑞香素(daphnoretin,9)、3--咖啡酰奎尼酸(3--caffeoylquinic acid,10)和腺苷(adenosine,11)。其中化合物1、6、8、10、11为首次从该植物中分离得到,化合物11为首次从该属植物中分离得到。鉴于既往研究表明瑞香狼毒具有杀虫、抗肿瘤、抗病毒、抗真菌、抗惊厥等多种药理活性,本研究分别采用1,1-二苯基-2-三硝基苯肼(DPPH)、2,2′-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、铁离子还原/抗氧化能力法(FRAP)法和牛津杯法筛选香豆素类化合物1~9体外抗氧化与抗菌活性,结果表明化合物3和9表现出显著的体外抗氧化活性,进一步以模式生物秀丽隐杆线虫氧化应激模型探讨化合物9体内抗氧化活性;抗菌活性实验中,化合物9显示出一定的抗大肠杆菌活性,其最小抑菌浓度(MIC)值为1.0 mg/mL。
1 仪器与材料
1.1 仪器与试剂
Ascend 400 MHz核磁共振波谱仪(瑞士Bruker公司);ODS C18填料(日本YMC公司);Sephadex LH-20(GE Healthcare公司);制备色谱柱(ODS,20 mm×10 mm,10 μm),苏州纳微科技股份有限公司;LC-P100高效液相色谱仪(上海伍丰科学仪器有限公司);RE-2000旋转蒸发仪(上海亚荣生化仪器厂);M5型酶标仪(Molecular Device美国公司);薄层色谱板、柱色谱硅胶(青岛海洋化工厂);D101 大孔树脂(成都科龙化工试剂厂);Nikon- Eclipse Ti-E荧光倒置显微镜;96孔培养板(北京东方大林科技有限公司)。胡桃醌购自美国Sigma- Aldrich公司,其余实验所用试剂均为国产试剂。
1.2 药材、供试虫源与菌种
实验所用药材购自成都市荷花池药材市场,经成都中医药大学王光志教授鉴定为瑞香科狼毒属植物瑞香狼毒L.的花,标本(LMSC201801)保存在西南民族大学药学院。秀丽隐杆线虫野生N2来自美国明尼苏达大学线虫遗传学中心(Caenorhabditis Genetics Center)。抗菌活性筛选所用大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌、酵母菌4种菌种保存于中国科学院成都生物研究所。
2 方法
2.1 提取与分离
取干燥的瑞香狼毒花5.0 kg,粉碎后,用纯甲醇50 ℃回流提取3次,每次3 h,滤过,合并提取液,减压回收后得到总浸膏500.0 g。将总浸膏以温水分散后,依次用醋酸乙酯和正丁醇等体积萃取,分别得到醋酸乙酯部位148.3 g和正丁醇部位113.3 g。正丁醇部位浸膏(113.3 g)经大孔树脂DH-101,甲醇-水(0∶100→100∶0)梯度洗脱,经TLC检测合并得到4个组分Fr. 1~4。Fr. 1(3.0 g)经ODS C18柱色谱,甲醇-水(10∶100→100∶0)梯度洗脱,其中20%甲醇洗脱部位经制备HPLC分离(13%乙腈,8 mL/min,254 nm)得到化合物1(20 mg,R=18 min)、10(20 mg,R=15 min),40%甲醇洗脱部位经Sephadex LH-20柱色谱(甲醇)分离得到化合物2(0.4 g)和3(1.0 g)。Fr. 3(18.6 g)经正相硅胶柱色谱(200~300目),二氯乙烷-甲醇(50∶1→1∶1)梯度洗脱,经TLC检测合并为3个组分Fr. 3-1~3-3。Fr. 3-1(10.0 g)经正相硅胶柱色谱(200~300目),二氯乙烷-甲醇(25∶1→1∶1)洗脱,洗脱流分经Sephadex LH-20柱色谱(甲醇)分离后,重结晶得到化合物4(8 mg)和5(10 mg)。Fr. 4(8.0 g)经硅胶柱色谱(200~300目),二氯乙烷-甲醇(50∶1→1∶1)洗脱,TLC检测合并得到4个组分Fr. 4-1~4-4,Fr. 4-1(0.6 g)经Sephadex LH-20柱色谱[氯仿-甲醇(1∶1)]和制备HPLC分离(33%乙腈,8 mL/min,254 nm)分离得到化合物8(15 mg,R=16 min)。醋酸乙酯部位浸膏(148.3 g)经正相硅胶柱色谱(200~300目),二氯乙烷-甲醇(100∶1→0∶1)梯度洗脱,经TLC检测合并得到5个组分,即Fr. 5~9。Fr. 5(1.0 g)经二次硅胶柱色谱(200~300目),二氯乙烷-甲醇(60∶1→10∶1)梯度洗脱,TLC检测后合并为3个组分Fr. 5-1~5-3。Fr. 5-1(0.1 g)经Sephadex LH-20柱色谱[氯仿-甲醇(1∶1)]分离后,重结晶得到化合物6(10 mg)和7(20 mg)。Fr. 5-3(0.7 g)经制备HPLC分离(35%乙腈,8 mL/min,254 nm)得到化合物9(0.5 g,R=16 min)。Fr. 6经Sephadex LH-20柱色谱[氯仿-甲醇(1∶1)]分离得到化合物11(10 mg)。
2.2 体外抗氧化与抗菌活性测试
2.2.1 FRAP法测定总抗氧化能力 总抗氧化能力检测参照文献采用FRAP法[8],总抗氧化能力用FRAP表示。
FRAP工作液的配制:pH 3.6的醋酸缓冲液、10.0 mmol/L Fe3+-三吡啶三嗪(TPTZ)溶液和20.0 mmol/L FeCl3溶液按比例10∶1∶1混合,现配现用。FRAP工作液配制后37 ℃水浴15 min,并于3 h内使用完毕。
标准曲线的绘制:于96孔板中依次加入浓度为0.5、0.4、0.3、0.2、0.1 mmol/L的硫酸亚铁溶液5.0 μL,加入180.0 μL FRAP工作液,混匀后37 ℃孵育10 min,于593 nm处测定吸光度(),由值()与硫酸亚铁浓度()得到线性回归方程=1.156 4+0.120 2,2=0.998。
取化合物按照上述方法测定值,根据标准曲线计算样品FRAP值。
2.2.2 DPPH法测定自由基清除率 DPPH自由基清除率测定参照文献方法[8]进行。准确称取DPPH 2.0 mg,以甲醇溶解,配制成0.2 mol/L DPPH贮备液,避光冷藏备用。选取维生素C(Vc)为阳性对照,准确称取1.0 mg Vc和样品溶解于DMSO中,稀释成系列浓度(100.00~0.05 μmol/L)溶液,备用。DPPH贮备液使用时用甲醇稀释,在517 nm处测得值为(0.45±0.05)~(0.80±0.05)。取100.0 μL DPPH贮备液加至96孔板中,再向各孔中加入一系列样品溶液和阳性对照溶液,室温黑暗中放置30 min,反应完全后用酶标仪在517 nm处测定值(每个样品设置3个复孔,取平均值)。样品对DPPH自由基清除率按照公式计算,DPPH的清除能力用半数抑制浓度(IC50)表示。
DPPH清除率=[0-(-1)]/0
0为未加样品的DPPH值,为样品与DPPH反应后的值,1为溶剂与DPPH的值
2.2.3 ABTS•+法测定自由基清除率 ABTS•+自由基清除率测定参照文献方法[8]测定。ABTS•+工作母液:分别量取7.0 mmol/L ABTS•+溶液和2.45 mmol/L 过硫酸钾水溶液1 mL,两者等体积混合,室温避光反应12~16 h。ABTS•+工作液用甲醇稀释30~60倍,在734 nm处测定值为(0.45±0.05)~(0.80±0.05)。取100.0 μL ABTS•+工作液加至96孔板中,再向各孔中加入一系列样品溶液(100.0~0.05 μmol/L)和阳性对照(Vc)溶液,避光反应1 h,反应完全后用酶标仪在734 nm处测定值(每个样品设置3个复孔,取平均值)。样品对ABTS•+自由基清除率按照公式计算,ABTS•+的清除能力用IC50表示。
ABTS•+清除率=[0-(-1)]/0
0为未加样品的ABTS•+的值,为样品与ABTS•+反应后的值,1为溶剂与ABTS•+的值
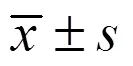
2.2.5 牛津杯法测试抗菌活性 实验采用牛津杯法[9]对化合物1~9进行抗大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌、酵母菌的活性筛选,将样品溶于DMSO,加入对应的牛津杯中,并以DMSO为阴性对照,置于恒温培养箱(细菌37 ℃,真菌30 ℃)培养12~24 h后,检查抑菌圈的有无。并通过倍比稀释法测定具有一定抗菌活性化合物的MIC值。
2.3 体内抗氧化活性测试
2.3.1 线虫同期化及寿命实验 参考文献方法[10-12],秀丽隐杆线虫N2株系于线虫培养基(NGM)固体培养基上20 ℃培养,NGM固体培养基上涂布大肠杆菌OP50作为线虫食物来源。将处于产卵期的秀丽线虫用M9缓冲液洗涤收集,采用Bleach裂解法对秀丽线虫进行同期化处理,处理后洗涤收集虫卵,加M9缓冲液后置于恒温摇床(20 ℃)同步培养12 h,待虫卵孵化至L1期后转移至新的NGM固体培养基。
NGM的配制:称取1.2 g NaCl、1.0 g蛋白胨、7.0 g琼脂溶于400 mL水中,高压灭菌后待温度降至60~65 ℃,加入400 μL抽滤除菌的K2HPO4/ KH2PO4缓冲液(1 mol/L)、MgSO4(1 mol/L)、CaCl2(1 mol/L)及胆固醇溶液(0.01 mol/L)。
M9缓冲液的配制:称取3 g KH2PO4,6 g Na2HPO4和5 g NaCl溶于1 L超纯水中,最后加入1 mL 1 mmol/L MgSO4。
实验分为对照组和给药组,实验中给予线虫的药物及对照组处理均为直接添加入NGM固体培养基,每组3个平行板,每板约50条,置于20 ℃恒温培养箱培养。从其进入产卵期起,每24小时将其转至新的已涂布OP50的NGM固体培养基中,至非产卵期后,隔天转板1次,直至各组秀丽线虫全部死亡,以秀丽线虫个体对机械性刺激无反应视为死亡,钻入琼脂内或逃至皿盖而干死不计入内。
参考文献方法[10-12],初筛实验分为低、中、高剂量(5、17、28 μmol/L)组和对照组(M9缓冲液),低、中剂量组与对照组无明显差异,故仅采用高剂量组(28 μmol/L)进一步测试其抗氧化应激能力与线虫体内ROS水平。
2.3.2 胡桃醌诱导秀丽隐杆线虫体内氧化应激模型的建立及其寿命测试 参考文献方法[10-11],线虫同期化处理同“2.3.1”项,待测药物用20.0 μL DMSO溶解后加入S-bassal液体培养基中(终浓度28 μmol/L),实验分为对照组(20.0 μL DMSO)、模型组(胡桃醌250 μmol/L)和给药组(化合物9 28 μmol/L)。秀丽线虫孵育至L1期,将线虫转移至含药S-bassal液体培养基,置于恒温摇床20 ℃培养72 h,离心制备线虫悬浊液,并于显微镜下计数,调整线虫悬浊液至每约30条/100 μL。取96孔板,每孔加入100 μL线虫悬浊液及胡桃醌(终浓度250 μmol/L)处理3 h,每隔1在显微镜下计线虫存活数,直至所有实验组的线虫全部死亡,实验重复3次。
2.3.3 胡桃醌诱导的秀丽隐杆线虫氧化应激模型体内ROS水平检测 参考文献方法[10-11],实验分为模型组和给药组(28 μmol/L化合物9),胡桃醌诱导秀丽隐杆线虫体内氧化应激模型同“2.3.2”项,加入2′,7′-二氯二氢荧光素二乙酸酯(H2DCFDA)荧光探针,使其终浓度50 μmol/L,20 ℃孵育2.5 h,将线虫挑至1%琼脂制片的载玻片中,于荧光显微镜(激发波长480 nm,发射波长530 nm)下观察拍照。
2.3.4 统计学处理 以Image-Pro Plus软件分析染色线虫图像,并测量荧光密度。采用Graphpad Prism 5.0软件对线虫进行Kaplan-Meier生存分析,两组间比较采用检验。
3 结果与分析
3.1 结构鉴定
化合物1:白色粉末(甲醇),ESI-MS/: 341.28 [M+H]+。1H-NMR (400 MHz, DMSO-6): 7.94 (1H, d,= 9.5 Hz, H-4), 7.31 (1H, d,= 8.5 Hz, H-5), 6.87 (1H, d,= 8.5 Hz, H-6), 6.23 (1H, d,= 9.5 Hz, H-3), 4.96 (1H, d,= 7.7 Hz, H-1′), 3.61~3.16 (6H, m, H-2′~6′);13C-NMR (100 MHz, DMSO-6): 160.3 (C-2), 153.9 (C-7), 148.2 (C-9), 145.2 (C-4), 131.6 (C-8), 124.5 (C-5), 113.7 (C-3), 112.6 (C-10), 112.1 (C-6), 104.4 (C-1′), 77.7 (C-3′), 76.8 (C-5′), 74.4 (C-2′), 70.4 (C-4′), 61.6 (C-6′)。上述数据与文献报道一致[13],故鉴定化合物1为7-羟基香豆素-8--β--葡萄糖苷。
化合物2:白色针晶(甲醇),ESI-MS/: 363.28 [M+Na]+。1H-NMR (400 MHz, DMSO-6): 7.96 (1H, d,= 9.5 Hz, H-4), 7.13 (2H, overlapped, H-5, 6), 6.32 (1H, d,= 9.5 Hz, H-3), 5.15 (1H, d,= 4.7 Hz, H-1′), 5.10 (1H, d,= 7.4 Hz, H-6′α), 4.86 (1H, d,= 7.4 Hz, H-6′β), 4.64 (1H, t,= 5.0 Hz, H-2′), 3.77 (1H, m, H-5′), 3.48 (1H, m H-4′), 3.23 (1H, m, H-3′);13C-NMR (100 MHz, DMSO-6): 160.1 (C-2), 148.2 (C-7), 144.7 (C-4), 142.6 (C-9), 133.9 (C-8), 118.3 (C-5), 114.5 (C-10), 113.4 (C-3), 112.1 (C-6), 101.8 (C-1′), 77.3 (C-3′), 75.7 (C-5′), 73.3 (C-2′), 69.7 (C-4′), 60.7 (C-6′)。上述数据与文献报道一致[14],故鉴定化合物2为瑞香苷。
化合物3:淡黄色针晶(甲醇),ESI-MS/: 179.10 [M+H]+。1H-NMR (400 MHz, DMSO-6): 7.89 (1H, d,= 9.4 Hz, H-4), 7.01 (1H, d,= 8.4 Hz, H-5), 6.79 (1H, d,= 8.4 Hz, H-6), 6.18 (1H, d,= 9.4 Hz, H-3);13C-NMR (100 MHz, DMSO-6): 160.3 (C-2), 149.7 (C-7), 145.0 (C-4), 143.7 (C-9), 132.1 (C-8), 118.8 (C-5), 112.8 (C-6), 112.0 (C-10), 111.1 (C-3)。上述数据与文献报道一致[14],故鉴定化合物3为瑞香素。
化合物4:黄色簇晶(甲醇),ESI-MS/: 191.05 [M-H]−。1H-NMR (400 MHz, CDCl3): 7.63 (1H, d,= 9.5 Hz, H-4), 7.11 (1H, d,= 8.5 Hz, H-5), 6.89 (1H, d,= 8.5 Hz, H-6), 6.24 (1H, d,= 9.5 Hz, H-3), 4.10 (3H, s, 8-OCH3);13C-NMR (100 MHz, CDCl3): 160.2 (C-2), 151.9 (C-7), 147.0 (C-9), 144.2 (C-4), 133.4 (C-8), 123.1 (C-5), 113.0 (C-10), 112.2 (C-3), 112.0 (C-6), 61.3 (8-OCH3)。上述数据与文献报道一致[14],故鉴定化合物4为7-羟基-8-甲氧基香豆素。
化合物5:淡黄色针晶(二氯乙烷-甲醇),ESI-MS/: 191.17 [M-H]−。1H-NMR (400 MHz, DMSO-6): 7.91 (1H, d,= 9.4 Hz, H-4), 7.22 (1H, s, H-5), 6.78 (1H, s, H-8), 6.21 (1H, d,= 9.4 Hz, H-3), 3.81 (3H, s, 6-OCH3);13C-NMR (100 MHz, DMSO-6): 160.8 (C-2), 151.6 (C-7), 149.5 (C-9), 145.3 (C-6), 144.6 (C-4), 111.7 (C-10), 110.6 (C-5), 107.5 (C-3), 102.7 (C-8), 56.0 (6-OCH3)。上述数据与文献报道一致[15],故鉴定化合物5为东莨菪葶。
化合物6:淡黄色针晶(二氯乙烷-甲醇),ESI-MS/: 207.19 [M+H]+。1H NMR (400 MHz, CDCl3): 8.09 (1H, d,= 9.8 Hz, H-4), 7.66 (1H, d,= 2.1 Hz, H-8), 7.09 (1H, d,= 2.1 Hz, H-6), 6.37 (1H, d,= 9.8 Hz, H-3), 4.15 (3H, s, 7-OCH3), 4.03 (3H, s, 5-OCH3);13C-NMR (100 MHz, CDCl3): 145.5 (C-8), 140.2 (C-4), 113.8 (C-3), 104.6 (C-6), 62.5 (5-OCH3), 61.3 (7-OCH3)。上述数据与文献报道一致[16],故鉴定化合物6为5,7-二甲氧基香豆素。
化合物7:淡黄色针晶(二氯乙烷-甲醇),ESI-MS/: 163.4 [M+H]+。1H-NMR (400 MHz, DMSO-6): 7.93 (1H, d,= 9.5 Hz, H-4), 7.52 (1H, d,= 8.5 Hz, H-5), 6.78 (1H, dd,= 8.5, 2.2 Hz, H-6), 6.71 (1H, d,= 2.2 Hz, H-8), 6.19 (1H, d,= 9.5 Hz, H-3);13C-NMR (100 MHz, DMSO-6): 160.2 (C-2), 160.1 (C-7), 155.4 (C-9), 144.5 (C-4), 129.6 (C-5), 113.0 (C-6), 111.2 (C-10), 111.3 (C-3), 103.1 (C-8)。上述数据与文献报道一致[14],故鉴定化合物7为伞形花内酯。
化合物8:淡黄色粉末(二氯乙烷-甲醇),ESI-MS/: 339.01 [M+H]+。1H-NMR (400 MHz, DMSO-6): 8.02 (1H, d,= 9.5 Hz, H-4), 7.88 (1H, s, H-4′), 7.69 (1H, d,= 8.5 Hz, H-5), 7.13 (1H, d,= 2.2 Hz, H-8), 7.08 (1H, dd,= 8.5, 2.2 Hz, H-6), 6.99 (1H, s, H-5′), 6.82 (1H, s, H-8′), 6.36 (1H, d,= 9.5 Hz, H-3);13C-NMR (100 MHz, DMSO-6): 160.1 (C-2), 159.9 (C-2′), 157.2 (C-7), 155.1 (C-9), 149.8 (C-9′), 146.6 (C-7′), 144.2 (C-6′), 143.5 (C-4), 135.4 (C-3′), 131.5 (C-4′), 129.9 (C-5), 114.4 (C-10), 113.9 (C-3), 113.4 (C-6), 112.3 (C-5′), 110.5 (C-10′), 103.8 (C-8′), 102.7 (C-8)。上述数据与文献报道一致[17],故鉴定化合物8为白瑞香素。
化合物9:白色羽状晶体(二氯乙烷),ESI-MS/: 353.02 [M+H]+。1H-NMR (400 MHz, DMSO-6): 8.04 (1H, d,= 9.5 Hz, H-4), 7.87 (1H, s, H-4′), 7.71 (1H, d,= 8.6 Hz, H-5), 7.21 (1H, s, H-5′), 7.19 (1H, d,= 2.4 Hz, H-8), 7.11 (1H, dd,= 8.6, 2.4 Hz, H-6), 6.86 (1H, s, H-8′), 6.38 (1H, d,= 9.5 Hz, H-3), 3.81 (3H, s, 6-OCH3);13C-NMR (100 MHz, DMSO-6): 159.8 (C-2), 159.8 (C-2′), 156.9 (C-7), 154.9 (C-9), 150.3 (C-9′), 147.4 (C-7′), 145.6 (C-6′), 143.9 (C-4), 135.7 (C-3′), 130.7 (C-4′), 129.8 (C-5), 114.3 (C-10), 113.8 (C-3), 113.4 (C-6), 110.1 (C-10′), 109.5 (C-5′), 103.9 (C-8′), 102.7 (C-8), 58.0 (6-OCH3)。上述数据与文献报道一致[14],故鉴定化合物9为双白瑞香素。
化合物10:淡黄色粉末(甲醇),ESI-MS/: 353.37 [M-H]−。1H-NMR (400 MHz, DMSO-6): 7.42 (1H,= 15.9 Hz, H-7′), 7.05 (1H, s, H-2′), 6.98 (1H, d,= 8.2 Hz, H-6′), 6.76 (1H, d,= 8.2 Hz, H-5′), 6.15 (1H, d,= 15.9 Hz, H-8′), 5.06 (1H, d,= 4.2 Hz, H-3), 3.92 (1H, dd,= 8.4, 5.1 Hz, H-4), 3.60 (1H, m, H-5), 2.09~1.69 (4H, m, H-2, 6);13C-NMR (100 MHz, DMSO-6): 175.9 (C-7, COOH), 166.9 (C-9′), 148.8 (C-4′), 145.9 (C-7′), 145.8 (C-3′), 125.9 (C-1′), 121.1 (C-6′), 116.6 (C-5′), 115.4 (C-2′), 74.0 (C-1), 71.9 (C-4), 71.1 (C-3), 68.3 (C-5), 37.9 (C-2), 37.6 (C-6)。上述数据与文献报道一致[18],故鉴定化合物10为3--咖啡酰奎尼酸。
化合物11:白色粉末(甲醇)。ESI-MS/: 268.04 [M+H]+。1H-NMR (400 MHz, DMSO-6): 8.35 (1H, s, H-8), 8.13 (1H, s, H-2), 7.35 (2H, s, NH2), 5.87 (1H, d,= 6.2 Hz, H-1′), 5.44 (2H, m, 2′, 5′-OH), 5.20 (1H, brs, 3′-OH), 4.60 (1H, d,= 5.2 Hz, H-2′), 4.14 (1H, brs, H-3′), 3.96 (1H, d,= 3.1 Hz, H-4′), 3.65 (1H, m, H-5′a), 3.55 (1H, m, H-5′b);13C-NMR (100 MHz, DMSO-6): 156.6 (C-6), 152.8 (C-2), 149.5 (C-4), 140.4 (C-8), 119.8 (C-5), 88.4 (C-1′), 86.4 (C-4′), 73.9 (C-2′), 71.1 (C-3′), 62.1 (C-5′)。以上数据与文献报道基本一致[19],故鉴定化合物11为腺苷。
3.2 体外抗氧化与抗菌活性结果
3.2.1 FRAP、DPPH、ABTS法抗氧化活性测试结果 采用3种不同的评价体系对分离得到的香豆素类化合物进行了体外抗氧化活性测试,实验结果(表1)显示化合物3、9的DPPH、ABTS清除能力均优于阳性对照Vc,总抗氧化能力大于其他化合物。说明化合物3、9体外抗氧化能力显著。
3.2.2 抗菌实验结果 实验结果表明,化合物9显示出一定的抗大肠杆菌活性,其余化合物未显示出明显活性。通过连续倍比稀释法测定化合物9的MIC值为1.0 mg/mL。

表1 化合物1~4、7~9的抗氧化活性
3.3 体内抗氧化活性测试结果
3.3.1 化合物9对野生型秀丽隐杆线虫寿命的影响 依据体外抗氧化活性测试结果,以秀丽线虫为模型,采用胡桃醌(终浓度250 μmol/L)诱导线虫急性氧化损伤模型评价其体内抗氧化活性。如图1所示,与对照组相比,化合物9(28 μmol/L)对线虫寿命无明显影响,而化合物9预处理的线虫在急性氧化应激条件下寿命明显提高,通过Log-rank(Mantel-Cox)计算,化合物9与模型组存在显著差异(<0.000 1)。
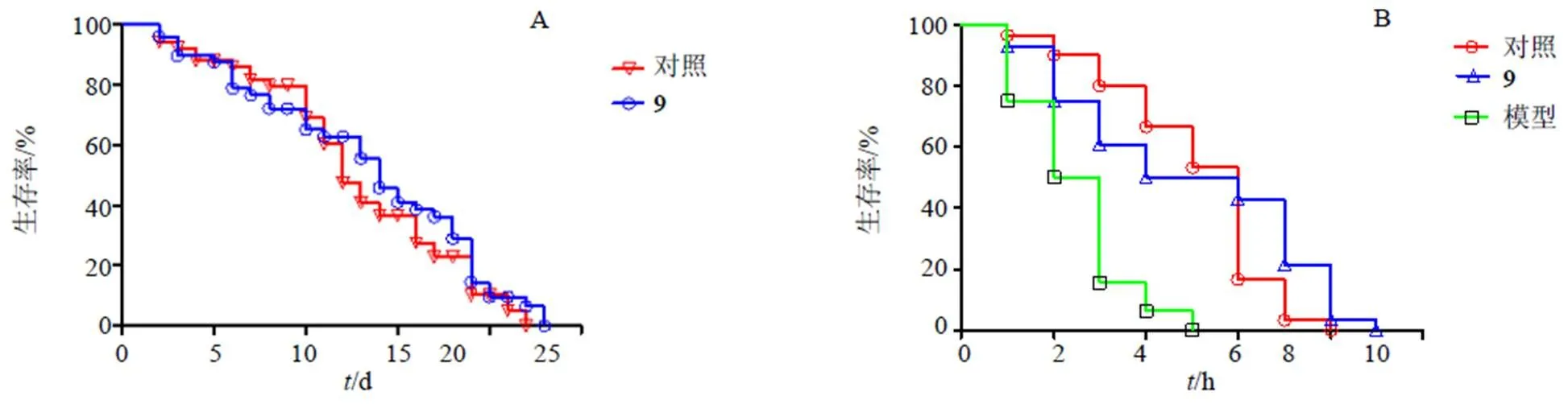
3.3.2 化合物9对氧化应激状态线虫体内ROS水平的影响 实验采用荧光探针H2DCFDA标记秀丽隐杆线虫体内ROS,ROS水平越高,荧光强度越大,相对荧光密度越大。结果表明(图2),与对照组(荧光密度146.40±10.32)相比,化合物9(28 μmol/L)作用后的线虫体内荧光强度(荧光密度值117.23±11.93)降低,ROS水平降低,且两组数据有极显著差异(<0.01),表明28 μmol/L的化合物9能够抑制线虫体内ROS的产生,对氧化损伤的线虫具有保护作用。
A-化合物9对正常状态下线虫寿命的影响 B-化合物9对氧化应激条件下线虫寿命的影响
A-氧化应激条件下秀丽隐杆线虫体内ROS水平 B-化合物9作用后氧化应激条件下秀丽隐杆线虫体内ROS水平 C-各组相对荧光密度值,与模型组比较:**P<0.01
4 讨论
体外抗氧化实验(DPPH、ABTS、FRAP)方便快速,但测试环境与动物体内氧化环境不同,很难仅通过体外实验来评价化合物的抗氧化能力。因此,本研究采用体内外抗氧化评价体系综合评价单体化合物的抗氧化活性。
3种体外抗氧化活性测试结果具有一致性,化合物3、9的自由基清除能力优于或约等于阳性对照Vc,表现出较强的体外抗氧化活性。体内活性实验显示化合物9能显著延长氧化应激条件下线虫的寿命,且可显著降低应激状态下线虫体内ROS水平,增强线虫的抗氧化应激能力。体内抗氧化活性结果与体外抗氧化活性测试结果一致,表明化合物9具有较强的抗氧化活性。实验结果表明,双香豆素具有一定体内外抗氧化活性,具体的作用机制尚需深入研究。
随着研究的深入,现已发现的许多疾病均与自由基或者人体氧化应激状态有关,包括肿瘤、血管动脉粥样硬化、神经保护、阿尔茨海默病、衰老等,因而抑制自由基的产生、清除自由基的方法越来越受到重视。同时,已有临床采用自由基清除剂作为辅助治疗的手段,也有相关文献表明香豆素抗肿瘤、抗炎作用与其抗氧化作用有关[20-22]。现代药理研究[5]表明瑞香狼毒具有一定的抑菌活性,许多香豆素类成分与抑菌活性相关[6-7],本研究初步筛选了瑞香狼毒中香豆素类成分对4种菌的抑菌作用,丰富了该植物化学成分与生物活性研究内容,为临床合理用药提供了一定参考,同时对阐明其药用物质基础,扩大瑞香狼毒药用部位,进一步开发利用瑞香狼毒植物资源具有重要意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 南京中医药大学. 中药大辞典 [M]. 上海: 上海科学技术出版社, 2006: 2673.
[2] 吴春雨. 瑞香狼毒花化学成分的研究 [D]. 呼和浩特: 内蒙古大学, 2013: 7-15.
[3] 周蕙祯, 汤良杰, 龚宇, 等. 瑞香狼毒花化学成分及其抗氧化活性研究 [J]. 中草药, 2020, 51(9): 2395-2401.
[4] 赵猛, 亢晶. 瑞香狼毒的民族植物学、植物化学及其药理学研究进展 [J]. 中国野生植物资源, 2019, 38(3): 70-74.
[5] 沈佳钰. 瑞香狼毒药理活性研究进展 [J]. 内蒙古中医药, 2017, 36(8): 151-152.
[6] 雷震, 马卫东, 於凯芹, 等. 香豆素类化合物的体内代谢研究进展 [J]. 中国药业, 2016, 25(23): 5-8.
[7] 杨丽君, 丁超, 高川, 等. 双香豆素衍生物的生物活性 [J]. 国外医药: 抗生素分册, 2019, 40(1): 56-64.
[8] Lee C L, Liao K C, Chen C C,. Characterization of secondary metabolites from the rhizome ofand their antioxidant properties [J]., 2019,doi: 10.1080/14786419.2019.1645664.
[9] 白欢欢, 吴林蔚, 杨涛, 等. 细丽毛壳霉次级代谢产物的分离鉴定及其抗菌活性 [J]. 应用与环境生物学报, 2015, 21(2): 274-278.
[10] Wei C C, Yu C W, Yen P L,. Antioxidant activity, delayed aging, and reduced amyloid-β toxicity of methanol extracts of tea seed pomace fromtenuifolia [J]., 2014, 62(44): 10701-10707.
[11] Peixoto H, Roxo M, Krstin S,. Anthocyanin-rich extract of Acai (Mart.) mediates neuroprotective activities in[J]., 2016, 26: 385-393.
[12] Cheng S C, Li W H, Shi Y C,. Antioxidant activity and delayed aging effects of hot water extract fromvar.leaves [J]., 2014, 62(18): 4159-4165.
[13] Xue B L, Zhou L B, Liu J W,. Biotransformation of hydroxycoumarin derivatives by cultured suspension cells of[J]., 2012, 67(5): 467-471.
[14] 扈晓佳. 四种药用植物的化学成分及活性研究 [D]. 上海: 上海交通大学, 2009.
[15] 陈兴湘, 张广杰, 崔慧敏, 等. 倒吊笔根的化学成分研究 [J]. 国际药学研究杂志, 2017, 44 (12): 1137-1140..
[16] Glowniak K, Mroczek T, Zabza A,. Isolation and structure elucidation of 5, 7-disubstituted simple coumarins in the fruits of[J]., 2000, 38(4): 308-312.
[17] 董俊丽, 黄传奇, 黄伟, 等. 绿萝花化学成分及其抗氧化活性 [J]. 中成药, 2019, 41(7): 1578-1582.
[18] 李菁, 于德泉. 灯盏花化学成分研究 [J]. 中国中药杂志, 2011, 36(11): 1458-1462.
[19] 黄玉玲, 马丽英, 荣先国, 等. 佩特曲霉菌次生代谢产物的研究 [J]. 中成药, 2017, 39 (7): 1415-1419.
[20] Markesbery W R, Carney J M. Oxidative alterations in Alzheimer's disease [J]., 1999, 9(1): 133-146.
[21] 张娜, 陈文娟, 柳青青, 等. 香豆素类化合物清除自由基及抗肿瘤活性研究 [J]. 食品研究与开发, 2016, 37(1): 1-5.
[22] 骆海坤, 袁耀辉, 王丽华. 自由基清除剂依达拉奉的作用机制及临床应用 [J]. 北方药学, 2018, 15(6): 138-139.
Coumarins from flowers ofand their biological activities
ZHOU Hui-zhen1, 2, LUO Wei2, CHEN Shuang3, CHEN Hu-lan2, LI Guo-you3, LI Li-mei1
1. School of Pharmacy, Southwest Minzu University, Chengdu 610041, China 2. Key Laboratory of Standardization of Chinese Herbal Medicines, Ministry of Education, State Key Laboratory Breeding Base of Systematic Research, Development and Utilization of Chinese Medicine Resources, Co-construction by Province and Ministry, College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 3. Chengdu Institute of Biology, Chinese Academy of Sciences, Chengdu 610041, China
To study the coumarins from the flowers ofand their antioxidant and antimicrobial activities.The chemical constituents were isolated by column chromatography packed with macroporous resin DH-101, silica gel, Sephadex LH-20, and ODS C18 silica gel, respectively, and the structures of the purified compounds were elucidated on the basis of spectroscopic analyses. Firstly, theantioxidant activities of compounds 1-9 were evaluated by DPPH, ABTS, and FRAP assays. Then, theantioxidant activity of compound 9 was further investigated on model organismstrain N2, which was evaluated by the survival ofunder juglone-induced oxidative stress and the intracellular ROS level ofwas determined by H2DCFDA. Moreover, the activities of compounds 1-9 against,,, andwere studied by oxford cup method.The structures of compounds 1-11 were respectively identified as 7-hydroxycoumarin-8--β--glucopyranoside (1), daphnin (2), daphnetin (3), 7-hydroxy-8-methoxycomarin (4), scopoletin (5), 5,7-dimethoxycoumarin (6), umbelliferone (7), edgeworthin (8), daphnoretin (9), 3--caffeoylquinic acid (10), and adenosine (11). Compounds 1, 6, 8, 10 and 11 are obtained from this plant for the first time. Compound 11 is firstly isolated from.Compounds 3 and 9 showed significant antioxidant activity. And compound 9 (28 μmol/L) significantly increased the lifespan (< 0.0001) and attenuated the ROS accumulation inunder oxidative stress (< 0.01). Meanwhile, compound 9 showed moderate activity againstwith the MIC value of 1.0 mg/mL.
flowers ofL.; coumarin; antioxidant activity; antimicrobial activity;; 5,7-dimethoxycoumarin; edgeworthin; daphnoretin; 3--caffeoylquinic acid; adenosine
R284.1
A
0253 - 2670(2021)04- 0943 - 08
10.7501/j.issn.0253-2670.2021.04.006
2020-09-27
中央高校基本科研业务费专项资金项目(2020NTD05);四川省青年科技创新研究团队专项计划项目(2016TD0006)
周蕙祯,硕士研究生,专业方向为中药有效成分分析。E-mail: 1312161673@qq.com
李丽梅,博士,教授,研究方向为中药及民族药的研究与开发。E-mail: limeili@swun.edu.cn
[责任编辑 王文倩]

