水蛭冻干粉对糖尿病肾病大鼠肾组织损伤的保护作用
杨 帆,曹 晨,方 敬,郭 帅,李雅纯,陈志强
• 药理与临床 •
水蛭冻干粉对糖尿病肾病大鼠肾组织损伤的保护作用
杨 帆1,曹 晨2,方 敬1,郭 帅1,李雅纯1,陈志强3*
1. 河北中医学院,河北 石家庄 050091 2. 上海中医药大学附属岳阳中西医结合医院,上海 200437 3. 河北省中医院,河北 石家庄 050011
探讨水蛭冻干粉对糖尿病肾病大鼠肾组织损伤的保护作用。SD大鼠随机选取8只作为对照组,其余大鼠给予高脂饲料喂养联合ip链脲佐菌素(35 mg/kg)建立糖尿病肾病模型,成模大鼠随机分为模型组及水蛭冻干粉低、中、高剂量(0.3、0.6、1.2 g/kg)组。给药16周后,检测大鼠24 h尿微量白蛋白(24 h urinary microalbumin,24 h-mALB)、空腹血糖、尿素氮(urea nitrogen,BUN)、肌酐(creatinine,Scr)水平和肾质量/体质量;采用TBA法和羟胺法测定大鼠血清超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)水平;采用ELISA法检测大鼠血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和单核细胞趋化因子-1(monocyte chemokine-1,MCP-1)水平;Western blotting法检测大鼠肾组织Janus蛋白酪氨酸激酶2/信号转导和转录激活子1、3(janus kinase 2/signal transducer and activator of transcription1、3,JAK2/STAT1/STAT3)通路相关蛋白表达。与对照组比较,模型组大鼠24 h-mALB、空腹血糖、肾功能(BUN、Scr)、肾质量/体质量指标均显著升高(<0.01),血清MDA、TNF-α、IL-1β和MCP-1水平显著增加(<0.01),SOD活性显著降低(<0.01),肾组织JAK2/STAT1/STAT3通路被激活(<0.05、0.01)。与模型组比较,水蛭冻干粉组大鼠24 h-mALB排泄降低(<0.01),肾功能(BUN、Scr)、肾质量/体质量改善(<0.05、0.01),氧化损伤减轻(<0.05、0.01),血清炎症因子水平下降(<0.05、0.01),肾组织JAK2/STAT1/STAT3通路被抑制(<0.05、0.01)。水蛭冻干粉可能通过抑制糖尿病肾病大鼠氧化应激及炎症因子的产生,抑制肾组织JAK2/STAT1/STAT3信号通路活化,从而降低mALB排泄,改善肾功能,进而发挥肾脏保护作用。
糖尿病肾病;水蛭冻干粉;JAK2/STAT1/STAT3通路;氧化应激;炎症
糖尿病肾病是糖尿病微血管并发症之一,严重危害人类健康,加重经济和社会负担。糖脂代谢紊乱、血液动力学改变、肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)的激活、氧化应激、炎症等均可能参与糖尿病肾病的发生和发展,其中氧化应激和慢性炎症在糖尿病肾病的发生发展中起着重要作用[1-2]。氧化应激可引起细胞内和细胞间的代谢紊乱,内源性活性氧自由基(reactive oxygen species,ROS)可刺激炎症因子的表达[3],从而引起基质蛋白在肾脏过度沉积导致肾脏结构及功能异常。Janus蛋白酪氨酸激酶/信号转导和转录激活子(janus kinase/signal transducer and activator of transcription,JAK/STAT)信号通路是调控炎症因子表达的枢纽[4],其中JAK2/STAT1/STAT3是在糖尿病肾病发生和发展过程中被最明确识别的JAK和STAT形式[5]。
中医学认为瘀血阻滞肾脏络脉是糖尿病肾病的主要病机之一[6]。现代医学研究证实血瘀的病理机制与炎症病理过程有关[7]。水蛭味咸、苦,性平,有小毒,归肝经,是常用的活血化瘀通络类动物中药。《神农本草经》:“主逐恶血,瘀血,月闭,破血瘕积聚,无子,利水道”。胡筱娟等[8]认为糖尿病凡有瘀血征象,甚或无明显瘀血表现时均可酌情选用水蛭,只要运用得当,疗效甚佳。然而水蛭治疗糖尿病肾病的具体机制尚不明确,本研究采用ip链脲佐菌素联合高脂饲料复制糖尿病肾病大鼠模型,考察水蛭冻干粉对糖尿病肾病大鼠肾组织的保护作用及氧化应激及炎症因子的影响,阐明水蛭冻干粉对糖尿病肾病大鼠肾脏保护作用的可能机制。
1 材料
1.1 动物
SPF级雄性SD大鼠48只,4~5周龄,体质量60~80 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006。于温度(24±1)℃,湿度50%~70%条件下适应性饲养1周,自由进食饮水。动物实验经河北中医学院伦理委员会批准(批准号DWLL2015002)。
1.2 药品和试剂
水蛭冻干粉(批号Z10970056,每克水蛭冻干粉相当于56个抗凝血酶活性单位)购自重庆多普泰制药股份有限公司;链脲佐菌素(批号04081408)购自美国Enzo Life Sciences公司;高脂饲料(蛋白质24.2%、碳水化合物42.1%、脂肪25.4%)购自北京博泰宏达生物技术有限公司;尿素氮(urea nitrogen,BUN)、肌酐(creatinine,Scr)试剂盒(批号分别为AUZ3611、AUZ3562)购自贝克曼库尔特实验系统有限公司;尿微量白蛋白(urinary microalbumin,mALB)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)试剂盒(批号分别为H127-1-2、A003-1-2、A001-3-2)均购自南京建成生物工程研究所;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、单核细胞趋化因子-1(monocyte chemokine-1,MCP-1)试剂盒(批号分别为SXR063、SXR026、SXR043)均购自上海森雄科技实业有限公司;抗兔JAK2抗体(批号3230)、抗兔STAT1抗体(批号14994)、抗兔STAT3抗体(批号4904)、抗兔磷酸化JAK2抗体(批号3776)、抗兔磷酸化STAT1抗体(批号7649)、抗兔磷酸化STAT3抗体(批号9145)均购自美国CST公司;β-actin抗体(批号AF0003)购自碧云天生物技术有限公司;HRP标记羊抗兔抗体(批号GB23303)、ECL增强化学发光试剂盒(批号G2014)、蛋白酶抑制剂和磷酸化酶抑制剂(批号G2007)购自武汉赛维尔生物科技有限公司;BCA蛋白定量分析试剂盒(批号A53225)购自美国Thermo Fisher Scientific公司。
1.3 仪器
One Touch血糖仪和稳豪血糖试纸(美国强生Lifescan公司);Infinite 200多功能酶标仪(瑞士Tecan公司);RM2050石蜡切片机(德国Leica公司);Dimension RxL Max全自动生化分析仪(西门子公司);Olympus光学显微镜(日本Olympus公司);ImageQuant LAS4000成像系统(美国GE医疗公司);SDS-PAGE电泳仪(美国伯乐公司);Allegra-64R高速冷冻离心机(美国Beckman公司)。
2 方法
2.1 模型制备、分组与给药
随机选取8只SD大鼠作为对照组给予普通饲料饲养,其余40只大鼠给予高脂饲料喂养联合ip小剂量链脲佐菌素复制糖尿病肾病大鼠模型。高脂饲料喂养6周后大鼠禁食不禁水12 h,造模大鼠ip 1%链脲佐菌素溶液(35 mg/kg),对照组ip等体积0.1 mmol/L柠檬酸缓冲液(pH 4.3),72 h后尾静脉采血测血糖,血糖≥16.7 mmol/L则视为造模成功[9]。造模过程中有2只大鼠死亡,1只大鼠因血糖<16.7 mmol/L,予以剔除。根据人与大鼠体表面积换算和文献报道[10-11],将剩余37只糖尿病大鼠随机分为模型组10只、水蛭冻干粉低剂量(0.3 g/kg)组9只,水蛭冻干粉中剂量(0.6 g/kg)组9只,水蛭冻干粉高剂量(1.2 g/kg)组9只。水蛭冻干粉溶于蒸馏水中配制成30%混悬液,水蛭冻干粉低、中、高剂量组ig混悬液(1、2、4 mL/kg),对照组和模型组ig等体积蒸馏水,1次/d,连续16周,给药期间观察大鼠的一般状态。
2.2 水蛭冻干粉对糖尿病肾病大鼠24 h-mALB水平的影响
给药结束后,将大鼠置于代谢笼中留取尿液,4 ℃、3500 r/min离心10 min,取上清,按照ELISA试剂盒说明书测定24 h-mALB水平。
2.3 水蛭冻干粉对糖尿病肾病大鼠血糖、BUN和Scr水平的影响
给药结束后,大鼠禁食不禁水12 h,3%异氟烷吸入麻醉,称定体质量,股动脉取血,采用全自动生化分析仪检测血糖、BUN和Scr水平。大鼠脱颈椎处死后剖开腹腔,迅速分离肾脏,用冰生理盐水冲洗后称定左肾质量,计算肾质量/体质量。
2.4 水蛭冻干粉对糖尿病肾病大鼠血清SOD活性及MDA、TNF-α、IL-1β和MCP-1水平的影响
大鼠股动脉取血,4 ℃、1500 r/min离心10 min分离血清,按照试剂盒说明书分别测定血清中SOD活性及MDA、TNF-α、IL-1β和MCP-1水平。
2.5 水蛭冻干粉对糖尿病肾病大鼠肾组织病理变化的影响
肾脏组织在4%多聚甲醛中固定24 h,脱水、常规石蜡包埋、切片(厚度4 μm),切片后分别用苏木精-伊红(HE)和Masson染色,于显微镜下观察肾组织的病理变化。
2.6 水蛭冻干粉对糖尿病肾病大鼠肾组织JAK2/STAT1/STAT3通路相关蛋白表达的影响
取约100 mg大鼠肾组织研磨至粉末状,加入含HALT蛋白酶/磷酸酶抑制剂的RIPA裂解液,于冰上裂解,4 ℃、10 000 r/min离心10 min,提取总蛋白,采用BCA法测定组织上清液蛋白质量浓度,用上样缓冲液稀释蛋白样品,100 ℃沸水浴5 min使蛋白变性。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转至PVDF膜,用5%脱脂奶粉室温封闭2 h,TBST洗涤3次,分别加入JAK2抗体(1∶600)、STAT1抗体(1∶600)、STAT3抗体(1∶600)、磷酸化JAK2抗体(1∶750);磷酸化STAT1抗体(1∶750)、磷酸化STAT3抗体(1∶750)、β-actin抗体(1∶1000),4 ℃孵育过夜,TBST洗涤3次,加入HRP标记的山羊抗兔IgG抗体,于室温孵育1 h。TBST洗涤后置ECL发光液中显色,使用ImageQuant LAS4000成像系统拍摄。
2.7 统计学方法

3 结果
3.1 各组大鼠的一般情况
对照组大鼠活动灵活,体质量增加,反应灵敏,毛色光亮洁白;模型组大鼠多饮、多尿、多食,精神萎靡,体形消瘦,反应迟钝,毛色枯黄无光泽,部分大鼠出现脓疮、腹部包块等现象;水蛭冻干粉组大鼠上述情况得到明显改善,活动量增加,体质量增加,毛色变白有光泽。模型组大鼠死亡3只,水蛭冻干粉低剂量组大鼠死亡2只,水蛭冻干粉中、高剂量组大鼠各死亡1只。
3.2 水蛭冻干粉对糖尿病肾病大鼠24 h-mALB、血糖和肾功能的影响
如表1所示,与对照组比较,模型组大鼠24 h- mALB、血糖、BUN、Scr水平均明显升高(<0.01),肾质量/体质量显著增加(<0.01);与模型组比较,各剂量水蛭冻干粉组大鼠24 h-mALB、BUN、Scr水平均显著降低(<0.05、0.01),肾质量/体质量显著降低(<0.01),呈剂量相关性,大鼠血糖无明显变化。表明水蛭冻干粉可以改善糖尿病肾病大鼠相关肾损伤参数,但对血糖无明显影响。

表1 水蛭冻干粉对糖尿病肾病大鼠24 h-mALB、血糖水平和肾功能的影响()
与对照组比较:**<0.01;与模型组比较:#<0.05##<0.01,下表同
**< 0.01control group;#< 0.05##< 0.01model group, same as below tables
3.3 水蛭冻干粉对糖尿病肾病大鼠血清MDA水平和SOD活性的影响
如表2所示,与对照组比较,模型组大鼠血清中MDA水平显著升高(<0.01),SOD活性明显著降低(<0.01);与模型组比较,各剂量水蛭冻干粉组大鼠血清MDA水平均显著降低(<0.01),SOD活性均显著恢复(<0.05、0.01),呈剂量相关性。表明水蛭冻干粉可通过抑制氧化应激的产生,进而改善糖尿病肾病大鼠肾组织损伤。

表2 水蛭冻干粉对糖尿病肾病大鼠血清MDA水平和SOD活性的影响()
3.4 水蛭冻干粉对糖尿病肾病大鼠血清TNF-α、IL-1β和MCP-1水平的影响
如表3所示,与对照组比较,模型组大鼠血清中TNF-α、IL-1β和MCP-1水平均显著升高(<0.01);与模型组比较,各剂量水蛭冻干粉组大鼠血清TNF-α、IL-1β和MCP-1水平均显著降低(<0.05、0.01),呈剂量相关性。表明水蛭冻干粉具有抗炎作用,可有效降低糖尿病肾病大鼠血清中炎症因子水平。

表3 水蛭冻干粉对糖尿病肾病大鼠血清TNF-α、IL-1β和MCP-1水平的影响()
3.5 水蛭冻干粉对糖尿病肾病大鼠肾组织病理变化的影响
如图1所示,对照组大鼠肾小球、肾小管及间质未见明显的组织病理学改变;模型组大鼠肾小球基底膜增厚,系膜扩张伴肾小球肥大,囊腔狭窄,部分节段出现球囊黏连,肾小管萎缩/扩张,炎性细胞浸润,肾间质出现部分纤维化。水蛭冻干粉各剂量组大鼠肾小球肥大、囊腔狭窄、基底膜增厚及系膜扩张趋势均被抑制,炎性细胞浸润和胶原沉积减少。
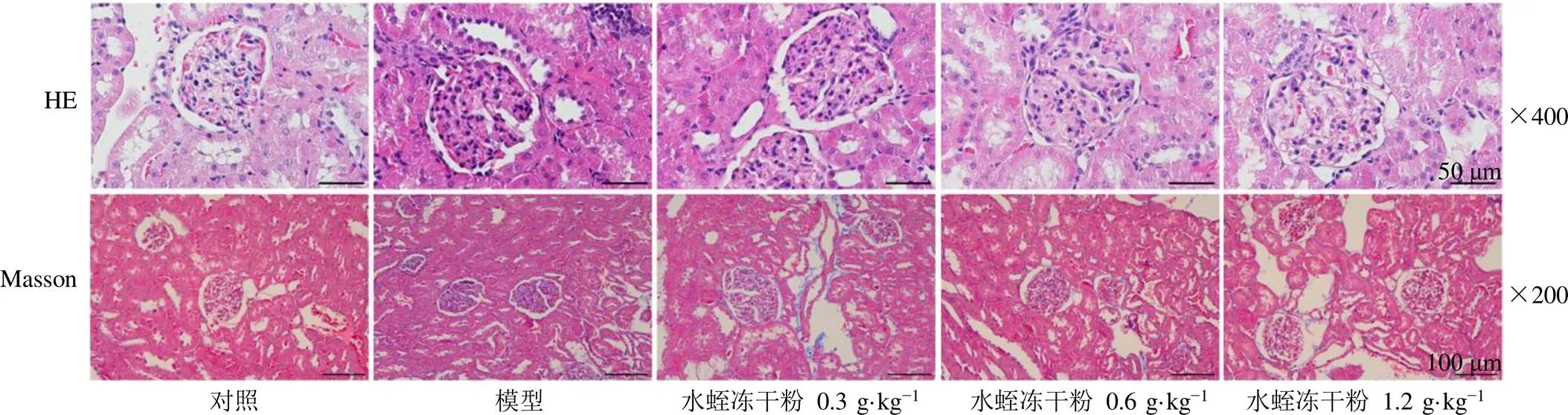
图1 水蛭冻干粉对糖尿病肾病大鼠肾组织病理变化的影响
3.6 水蛭冻干粉对糖尿病肾病大鼠肾组织JAK2/ STAT1/STAT3通路相关蛋白表达的影响
如图2所示,与对照组比较,模型组大鼠肾组织p-JAK2/JAK2、p-STAT1/STAT1、p-STAT3/STAT3蛋白表达均明显升高(<0.05、0.01),提示糖尿病肾病大鼠肾组织JAK2/STAT1/STAT3信号通路激活;与模型组比较,水蛭冻干粉组大鼠肾组织p-STAT1/STAT1、p-STAT3/STAT3蛋白表达显著降低(<0.05、0.01),呈剂量相关性,表明水蛭冻干粉可抑制JAK2/STAT1/STAT3信号通路的活化。

与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01
4 讨论
随着对糖尿病肾病的深入研究,许多中药或中药组分对糖尿病导致的肾损害有较好的预防和治疗作用[12]。糖尿病肾病病程较长,迁延难愈,多为久病痼疾。久病多虚,久病入络,气虚无以推动血行形成瘀血,阻于肾脏络脉,引起肾脏结构和功能异常。因此化瘀通络、保持络脉气血通畅是治疗糖尿病肾病的关键。水蛭是常用的活血化瘀通络中药,张锡纯称之为“祛瘀血而不伤新血,纯系水之精华生成”“凡破血之药,多伤气分,惟水蛭味咸专入血分,于气分丝毫无损,而瘀血默消于无形,真良药也”。水蛭具有抗凝、抗血小板聚集、抗血栓形成、抗动脉粥样硬化、抗炎止痛、抗肿瘤、降低血液黏度、保护脑缺血再灌注损伤等多种药理作用[13-14]。
氧化应激在糖尿病肾病的发生发展中起着重要作用[1]。慢性高血糖通过干扰氧化剂与抗氧化剂之间的平衡(如降低SOD活性)来诱导ROS的产生[15]。在链脲佐菌素诱导的糖尿病小鼠中SOD的过表达可减轻糖尿病肾损伤[16]。本研究发现,高脂饲料联合链脲佐菌素复制的糖尿病肾病大鼠MDA产生增加,SOD活性降低,水蛭冻干粉可有效抑制糖尿病肾病大鼠MDA产生,增加SOD活性,从而抑制氧化应激所导致的肾脏损伤。
氧化应激与炎症密切相关[17],炎症因子可使肾脏细胞外基质合成增多、降解减少,导致肾小球硬化[18]。JAK/STAT是一种重要的ROS敏感转录因子,在氧化应激和炎症的串扰中起关键作用[19]。JAK/STAT信号通路主要由酪氨酸激酶相关受体、酪氨酸激酶JAKs和转录因子STATs组成[4]。细胞因子与酪氨酸激酶相关受体结合后,受体亚基发生二聚化或多聚化,可诱导结合于受体亚基上的JAK相互靠近而被激活,活化受体胞浆段的酪氨酸,使STATs与受体结合并在JAKs的作用下被磷酸化,磷酸化的STAT从受体复合物中解离形成异源或同源二聚体,然后易位到细胞核与特定的基因启动子序列结合,调控下游炎症基因的表达[20]。本研究发现,糖尿病肾病大鼠肾脏组织中p-JAK2、p-STAT1、p-STAT3蛋白表达和血清炎症因子水平显著上调,提示JAK2/STAT1/STAT3信号通路被激活;水蛭冻干粉组大鼠肾组织p-JAK2、p-STAT1、p-STAT3蛋白表达均显著降低,血清炎症因子水平明显下降,表明水蛭冻干粉可以抑制JAK2/STAT1/STAT3信号通路活化,抑制炎症因子的表达,从而发挥肾脏保护作用。
综上,水蛭冻干粉可通过抑制糖尿病肾病大鼠氧化应激及炎症因子的产生,抑制肾组织JAK2/STAT1/STAT3信号通路活化,降低尿微量白蛋白排泄,改善肾功能,减轻肾脏病理损伤,从而发挥肾脏保护作用。
利益冲突 所有作者均声明不存在利益冲突
[1] Feng Q, Liu D W, Lu Y F,. The interplay of renin-angiotensin system and toll-like receptor 4 in the inflammation of diabetic nephropathy [J]., 2020, 2020: 1-11.
[2] Araújo L S, Torquato B G S, da Silva C A,. Renal expression of cytokines and chemokines in diabetic nephropathy [J]., 2020, 21(1): 308.
[3] McGovern T K, Chen M, Allard B,. Neutrophilic oxidative stress mediates organic dust-induced pulmonary inflammation and airway hyperresponsiveness [J]., 2016, 310(2): 155-165.
[4] Ciobanu D A, Poenariu I S, Crîngus L I,. JAK/STAT pathway in pathology of rheumatoid arthritis (Review) [J]., 2020, 20(4): 3498-3503.
[5] Huang J S, Lee Y H, Chuang L Y,. Cinnamaldehyde and nitric oxide attenuate advanced glycation end products-induced the JAK/STAT signaling in human renal tubular cells [J]., 2015, 116(6): 1028-1038.
[6] Bai L, Huo B, Chen Z,. Effect of Huayu Tongluo herbs on reduction of proteinuria via inhibition of wnt/β-catenin signaling pathway in diabetic rats [J]., 2017, 2017: 3054145.
[7] 付长庚. 现代血瘀证学的形成与发展概述 [J]. 山东中医杂志, 2016, 35(12): 1081-1084.
[8] 胡筱娟, 姬爱青, 沈璐. 糖尿病肾病与血瘀的相关性探讨 [J]. 陕西中医, 2009, 30(4): 447-448.
[9] 李志杰, 张悦. 糖尿病肾病动物模型的研究进展 [J]. 生命科学, 2011, 23(1): 90-95.
[10] 谢永祥, 史伟, 龙春莉, 等. 基于iTRAQ技术探讨水蛭干预IgA肾病大鼠模型蛋白质组学研究 [J]. 临床肾脏病杂志, 2019, 19(3): 202-207.
[11] 吴晶魁, 杨乔, 李洋洋, 等. 水蛭通过p38MAPK信号通路对早期动脉粥样硬化大鼠VSMCs的影响 [J]. 中国中药杂志, 2017, 42(16): 3191-3197.
[12] Wen Y, Yan M, Zhang B,. Chinese medicine for diabetic kidney disease in China [J]., 2017, 22(4): 50-55.
[13] Wang X, Niu M, Wu S N,. Leeches attenuate blood hyperviscosity and related metabolic disorders in rats differently than aspirin [J]., 2019, 238: 111813.
[14] 刘涛, 朱宏涛, 戴黎明, 等. 水蛭素调节断指再植大鼠皮瓣成活、血管生成、炎症因子表达的作用[J]. 药物评价研究, 2018, 41(1): 73-77.
[15] Vodošek Hojs N, Bevc S, Ekart R,. Oxidative stress markers in chronic kidney disease with emphasis on diabetic nephropathy [J]., 2020, 9(10): 925.
[16] Craven P A, Melhem M F, Phillips S L,. Overexpression of Cu2+/Zn2+superoxide dismutase protects against early diabetic glomerular injury in transgenic mice [J]., 2001, 50(9): 2114-2125.
[17] Hsu J D, Wu C C, Hung C N,.extract improves diabetic nephropathy via suppression of oxidative stress and inflammation in streptozotocin- nicotinamide mice [J]., 2016, 24(4): 730-737.
[18] Rayego-Mateos S, Morgado-Pascual J L, Opazo-Ríos L,. Pathogenic pathways and therapeutic approaches targeting inflammation in diabetic nephropathy [J]., 2020, 21(11): 3798.
[19] Charras A, Arvaniti P, Le Dantec C,. JAK inhibitors and oxidative stress control [J]., 2019, 10: 2814.
[20] Chuang P Y, He J C. JAK/STAT signaling in renal diseases [J]., 2010, 78(3): 231-234.
Protective effects of hirudo lyophilized powder on renal injury in diabetic nephropathy rats
YANG Fan1, CAO Chen2, FANG Jing1, GUO Shuai1, LI Ya-chun1, CHEN Zhi-qiang3
1. Hebei College of Traditional Chinese Medicine, Shijiazhuang 050091, China 2. Yueyang Hospital of Integrated Traditional Chinese and Western Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai 200437, China 3. Hebei Provincial Hospital of Traditional Chinese Medicine, Shijiazhuang 050011, China
To explore the intervention of hirudo lyophilized powder in the renal tissue injury of diabetic nephropathy rats.Eight SD rats were selected as control group, and the remaining rats were used to establish diabetic nephropathy models by high-fat diet combined with ip streptozotocin (35 mg/kg). Diabetic nephropathy rats were randomly divided into model group, hirudo lyophilized powder low-, medium-, high-dose (0.3, 0.6, 1.2 g/kg) group. After administered with corresponding drug for 16 weeks, the 24 h-urine microalbumin, blood glucose, urea nitrogen (BUN), creatinine (Scr) and KW/BW were detected; The activity of superoxide dismutase (SOD) and level of malondialdehyde (MDA) in serum were measured by TBA and hydroxylamine method respectively; The levels of tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β), and monocyte chemokine-1 (MCP-1) in serum were analyzed by ELISA; The related protein expressions of JAK2/STAT1/STAT3 pathway were detected in renal tissues by western blotting.Compared with control group, 24-h urine microalbumin, fasting blood glucose, BUN, Scr, and KW/BW were significantly increased (< 0.01); The serum levels of MDA, TNF-α, IL-1β, and MCP-1 were significantly increased (< 0.01); The activiy of SOD was significantly inhibited (< 0.01); The JAK2/STAT1/STAT3 signaling pathway was activated in renal tissues of model group (< 0.05, 0.01). Compared with model group, the 24 h urinary microalbumin excretion was reduced (< 0.01), renal function (BUN, Scr) and KW/BW were significantly improved (< 0.05, 0.01), the degree of oxidative stress and serum inflammatory factor levels were decreased (< 0.05, 0.01), and the activation of JAK2/STAT1/STAT3 signaling pathway was inhibited in hirudo lyophilized powder group (< 0.05, 0.01).Hirudo lyophilized powder could inhibit oxidative stress and inflammation injury, inhibit the activation of JAK2/STAT1/STAT3 signaling pathway, reduce urinary microalbumin excretion, and improve renal function, and thus exert renal protective effects.
diabetic nephropathy; hirudo lyophilized powder; JAK2/STAT1/STAT3 pathway; oxidative stress; inflammation
R285.5
A
0253 - 2670(2021)04 - 1020 - 06
10.7501/j.issn.0253-2670.2021.04.014
2020-10-12
国家自然科学基金资助项目(81373804);河北省科研能力提升重点项目(KTZ2019024)
杨 帆(1983—),男,博士研究生,主治医师,研究方向为慢性肾脏病的中医药治疗及机制研究。Tel: 13831192776 E-mail: hbxlydc@163.com
陈志强 Tel: 13930486188 E-mail: chenzhqiang2011@163.com
[责任编辑 李亚楠]

