基于网络药理学和分子对接研究白花蛇舌草和半枝莲药对治疗宫颈癌的作用机制
吴朗杰,赵春燕,战丽彬
基于网络药理学和分子对接研究白花蛇舌草和半枝莲药对治疗宫颈癌的作用机制
吴朗杰,赵春燕,战丽彬*
南京中医药大学中医学院· 中西医结合学院,江苏 南京 210023
通过网络药理学与分子对接方法探究白花蛇舌草和半枝莲药对治疗宫颈癌的潜在活性成分及作用机制。通过中药系统药理学数据库分析平台(TCMSP)和STITCH数据库搜集白花蛇舌草和半枝莲药对的活性成分和靶点,在DisGeNET网站下载宫颈癌疾病靶点;以String平台数据为基础,利用Cytoscape软件构建白花蛇舌草和半枝莲药对与宫颈癌共同靶点的蛋白质-蛋白质相互作用(protein-protein interaction network,PPI)网络;利用CytoHubba筛选ub基因),构建靶点的拓扑网络图;绘制“活性成分-靶点-通路”网络图;采用Schrodinger软件对活性成分与靶点进行分子对接。“活性成分-靶点-通路”网络显示,白花蛇舌草和半枝莲药对有25个主要活性成分,38个主要靶点,与18个信号通路有关。分子对接结果显示,白花蛇舌草和半枝莲药对25个活性成分与38个靶点部分或全部对接成功。白花蛇舌草和半枝莲药对通过多成分、多靶点、多通路参与宫颈癌细胞凋亡。
宫颈癌;白花蛇舌草;半枝莲;网络药理学;分子对接
宫颈癌主要由感染人乳头瘤病毒(human papilloma virus,HPV)引起[1-2]。2019年国家癌症中心发布的有关中国恶性肿瘤流行情况分析显示,宫颈癌占中国女性恶性肿瘤发病的6.24%[3]。中药活性成分在抗肿瘤方面具有多途径、多靶点、不良反应小等优势[4]。白花蛇舌草Willd.与半枝莲D. Don药对在宫颈癌的中医治疗中体现出一定的疗效[5-9]。该药对含有黄酮类、萜类、多糖类等化学成分,具有抗肿瘤活性[10-12]。本研究通过搜集白花蛇舌草和半枝莲药对的潜在活性成分,探究其作用于宫颈癌的靶点及作用机制,为白花蛇舌草和半枝莲药对治疗宫颈癌的体内外研究提供参考。
1 资料与方法
1.1 数据库与软件
DisGNET(https://www.disgenet.org/),中药系统药理分析平台(TCMSP,http://tcmspw.com/),STITCH网站(http://stitch.embl.de/cgi/input.pl),Uniprot网站(https://www.uniprot.org),String网站(https://string-db.org/),PDB数据库(https://www. rcsb.org/),PubChem数据库(http://pubchem.ncbi. nlm.nih.gov),DAVID网站(https:// david.ncifcrf.gov/ home.jsp),Cytoscape 3.7.2软件,Schrodinger 2018软件,BioinfoGP(https://bioinfogp.cnb.csic.es)。
1.2 白花蛇舌草和半枝莲药对的活性成分和靶点筛选
以类药性(drug-likeness,DL)≥0.18、口服生物利用度(oral bioavailability,OB)≥30%为筛选条件,在TCMSP平台搜集白花蛇舌草和半枝莲的活性成分,记录活性成分的PubChem ID、靶点名称,通过挖掘文献补充由于OB和DL过小被遗漏的活性成分。以PubChem ID寻找SMILE表达式,在STITCH网站中寻找相关靶点,Uniprot网站确定各靶点的Uniprot ID。
1.3 宫颈癌疾病靶点筛选
DisGeNET网站中以“宫颈癌”为疾病名称,检索得到宫颈癌疾病靶点,去除不具有Uniprot ID的靶点,去除具有相同Uniprot ID的不同靶点,保留唯一Uniprot ID的靶点。利用BioinfoGP中VENNY2.1工具,将白花蛇舌草和半枝莲药对主要活性成分的预测靶点与宫颈癌相关靶点进行交集分析并绘制韦恩图,提取白花蛇舌草与宫颈癌、半枝莲与宫颈癌的交集靶点。
1.4 宫颈癌与白花蛇舌草和半枝莲药对共同靶点的蛋白质-蛋白质相互作用(protein-protein interaction network,PPI)关系
将白花蛇舌草与宫颈癌、半枝莲与宫颈癌的交集靶点导入STRING平台,绘制PPI网络图。将筛选得到的互作靶点输入DAVID网站,进行基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集。
1.5 互作靶点拓扑关系图与信号通路关键基因(Hub基因)分析
利用Cytoscape软件进行拓扑分析并绘制网络图,利用CytoHubba插件计算度值≥25的Hub基因。
1.6 “活性成分-靶点-通路”网络的构建
利用Cytoscape软件绘制“活性成分-靶点-通路”网络图。
1.7 活性成分与靶点的分子对接验证
选择“活性成分-靶点-通路”网络图中的主要活性成分与靶点进行分子对接。在PDB数据库寻找靶点的PDB文件,在PubChem数据库寻找活性成分的SDF文件,利用Schrodinger 2018软件进行分子对接。
2 结果
2.1 白花蛇舌草和半枝莲药对的活性成分和靶点筛选
如表1所示,白花蛇舌草包含37个活性成分,经过筛选得到8个主要活性成分和88个相关靶点;如表2所示,半枝莲包含94个活性成分,经过筛选得到29个主要活性成分和170个相关靶点。
表1 白花蛇舌草的活性成分信息
Table 1 Active ingredient of

MOL ID化合物名称PubChem编号靶点数量 MOL000358β-sitosterol22228435 MOL0016702-methoxy-3-methyl-9,10-anthraquinone1051494626 MOL000449stigmasterol528079426 MOL000098quercetin528034313 MOL000511ursolic acid6494510 MOL0016633-epioleanolic acid118696583 MOL001659poriferasterol52813302 MOL000771p-coumaric acid6375421
表2 半枝莲的活性成分信息

Table 2 Active ingredient of Scutellaria barbata
2.2 宫颈癌相关靶点的筛选
共得到宫颈癌相关靶点859个,将白花蛇舌草和半枝莲药对主要活性成分的靶点与宫颈癌相关靶点进行交集并绘制韦恩图如图1所示,宫颈癌与白花蛇舌草共有靶点25个,宫颈癌与半枝莲共有靶点46个,白花蛇舌草、半枝莲、宫颈癌潜在靶点总数为53个。
2.3 宫颈癌与白花蛇舌草和半枝莲药对共有靶点的PPI分析
将53个互作靶点导入STRING网络平台,如图2所示,PPI互作有53个节点,633条边,平均节点度值为23.9,平均局部聚类系数为0.775,<1.0×10−16,表明该组互作靶点与随机相似靶点组合对比具有显著差异。

图1 白花蛇舌草和半枝莲药对与宫颈癌靶点的韦恩图
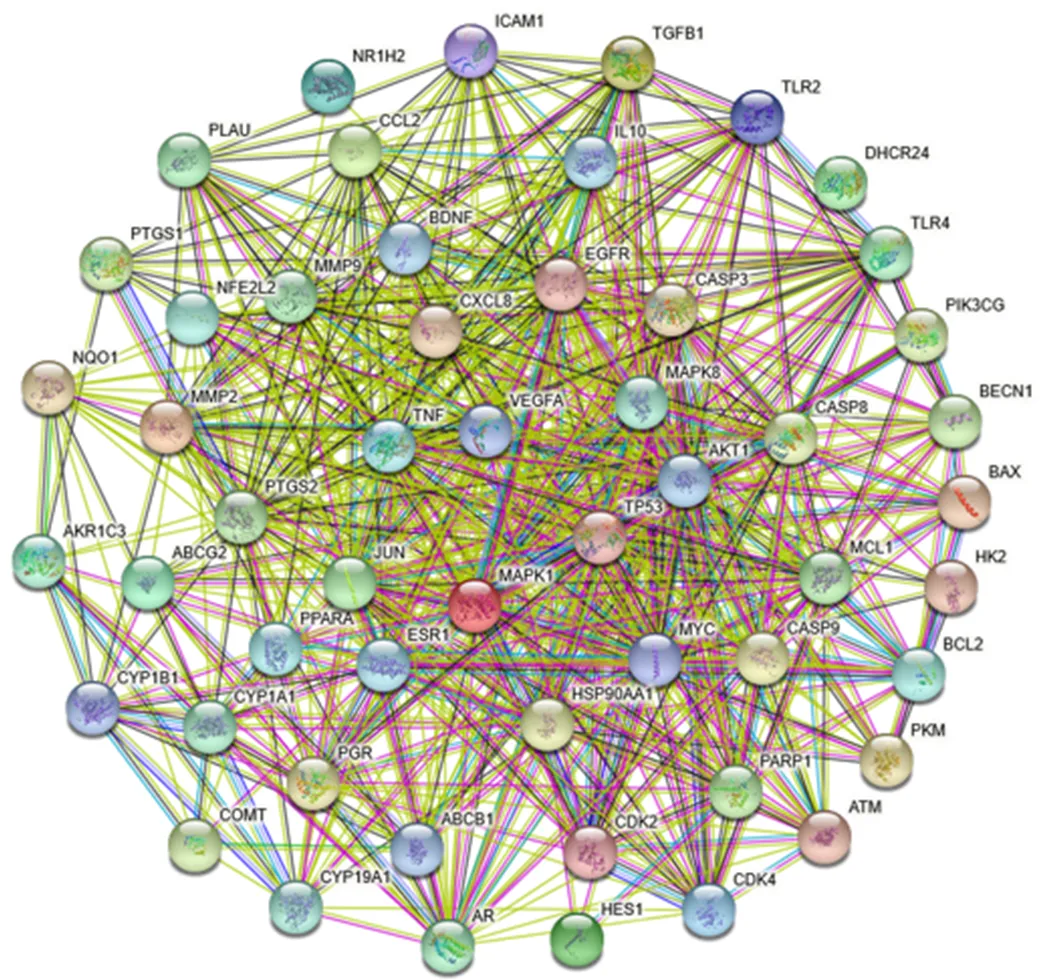
图2 宫颈癌与白花蛇舌草和半枝莲药对共有靶点PPI网络
2.4 互作靶点通路与功能分析
将53个靶点输入DAVID网站,进行GO功能富集分析,互作靶点与258个生物过程相关,与25个细胞组分相关,与53个分子功能相关。以基因数≥10的GO条目进行条形图绘制,如图3所示,生物过程主要富集在对药物的反应、缺氧反应、凋亡过程的正负调控、炎症反应、基因表达的正调控、细胞增殖正负调控、凋亡过程、信号转导、RNA聚合酶Ⅱ启动子转录的正负调控等;细胞组分主要富集在线粒体、核、胞浆、细胞表面、细胞质、核质、内质网膜、膜、细胞外间隙、胞外区、质膜、酶结合等;分子功能主要富集在相同蛋白结合、蛋白质结合、转录因子结合、序列特异性DNA结合、蛋白质同源二聚活性、ATP结合、转录因子活性、序列特异性DNA结合、DNA结合等。
KEGG富集分析涉及85条信号通路,以基因数≥8筛选得到37条KEGG通路,前20条通路如图4所示,包括15个与宫颈癌明显无关的疾病通路,如乙型肝炎、查加斯病(美国锥虫病)、肺结核、弓形虫病、非酒精性脂肪肝、甲型流感、人类嗜T细胞病毒Ⅰ型(human T-cell lymphoma-leukemia virus-Ⅰ,HTLV-Ⅰ)感染、类风湿性关节炎、EB病毒感染、丙型肝炎、单纯疱疹感染、疟疾、利什曼病、百日咳、阿米巴病;4个其他恶性肿瘤如结直肠癌、胰腺癌、前列腺癌、膀胱癌、小细胞肺癌相关信号通路;与18个宫颈癌发生、发展相关的信号通路,如癌症的途径、癌症中的蛋白多糖、癌症中的microRNAs、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinases,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、细胞凋亡、病毒致癌作用、Toll样受体信号通路、雌激素信号通路、神经营养素信号通路、叉头盒子(forkhead box O,FoxO)信号通路、癌症的中心碳代谢、肿瘤抗原p53(tumor antigen p53,TP53)信号通路、核因子-κB(nuclear factor-κB,NF-κB)信号通路、缺氧诱导因子1(hypoxia inducible factor-1,HIF-1)信号通路、鞘脂信号通路、局灶性黏连。KEGG富集于多种癌症通路,表明恶性肿瘤发病机制存在共同特征。药物与疾病的53个互作靶点富集于PI3K-Akt、TNF、MAPK、p53信号通路、NF-κB信号通路、细胞凋亡等通路,提示白花蛇舌草和半枝莲药对可能作用于多条信号通路的多个靶点发挥抑癌作用。

图3 GO功能富集分析

图4 共有靶点的前20条KEGG通路
2.5 互作靶点拓扑关系图与Hub基因分析
如表3、图5所示,活性成分与宫颈癌互作的Hub靶点可能是TP53、AKT1、MYC原癌基因蛋白(MYC proto-oncogene,MYC)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、JUN原癌基因(Jun proto-oncogene,JUN)、半胱氨酸蛋白酶-3(Caspase-3,CASP3)、TNF、雌激素受体1(estrogen receptor 1,ESR1)、MAPK8、MAPK1、表皮生长因子受体(epidermal growth factor receptor,EGFR)、前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2,PTGS2)等。
2.6 “活性成分-靶点-通路”网络分析
“活性成分-靶点-通路”网络如图6所示,选择KEGG富集中的与宫颈癌发生、发展相关的18条信号通路,集中展示白花蛇舌草和半枝莲药对作用靶点的所在通路。25个主要活性成分可能通过作用于38个靶点,在18条信号通路中发挥作用,表明白花蛇舌草和半枝莲药对可能通过多成分、多靶点、多通路抑制宫颈癌的发生、发展。
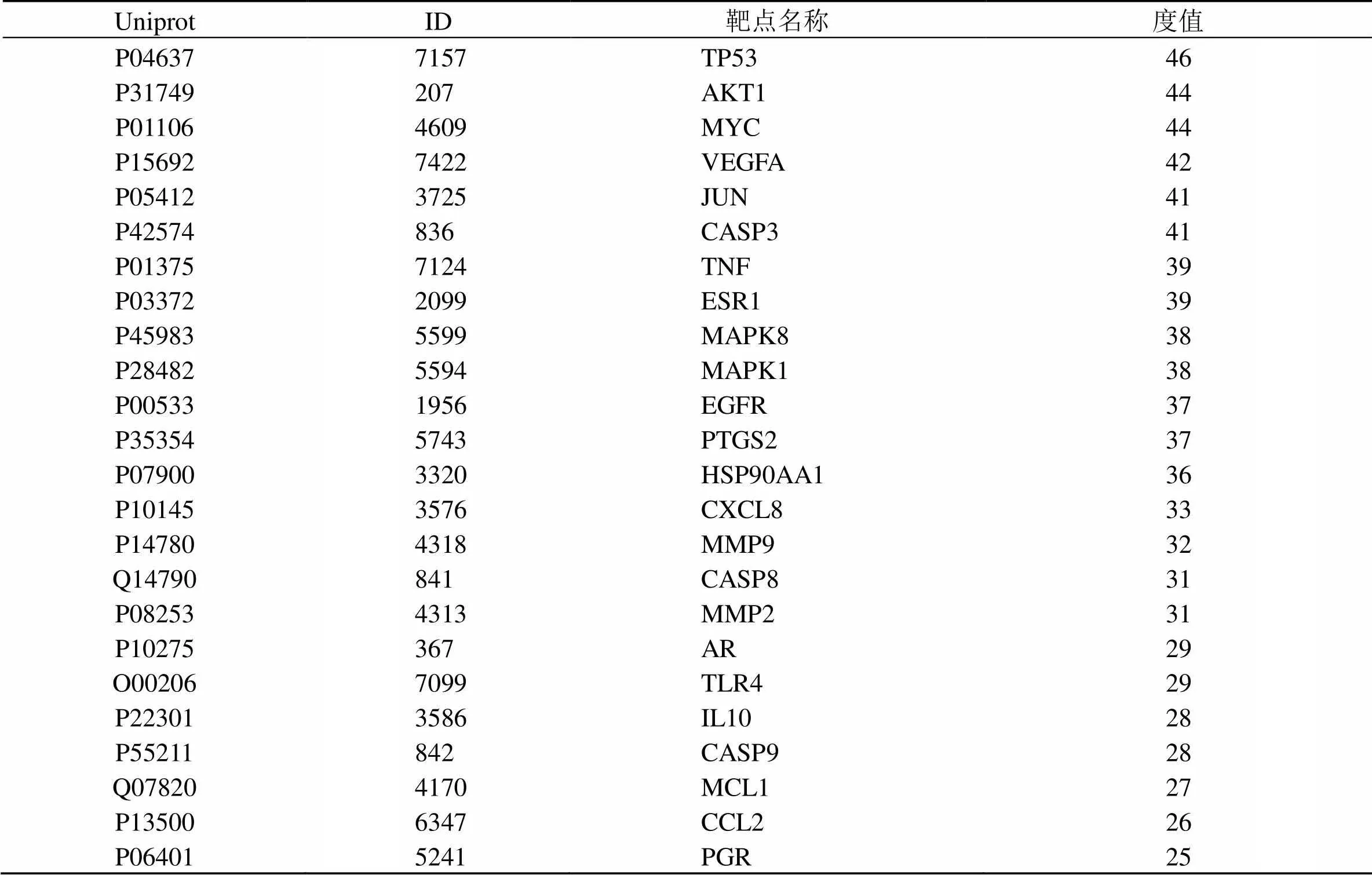
表3 Hub基因在拓扑网络中的特点
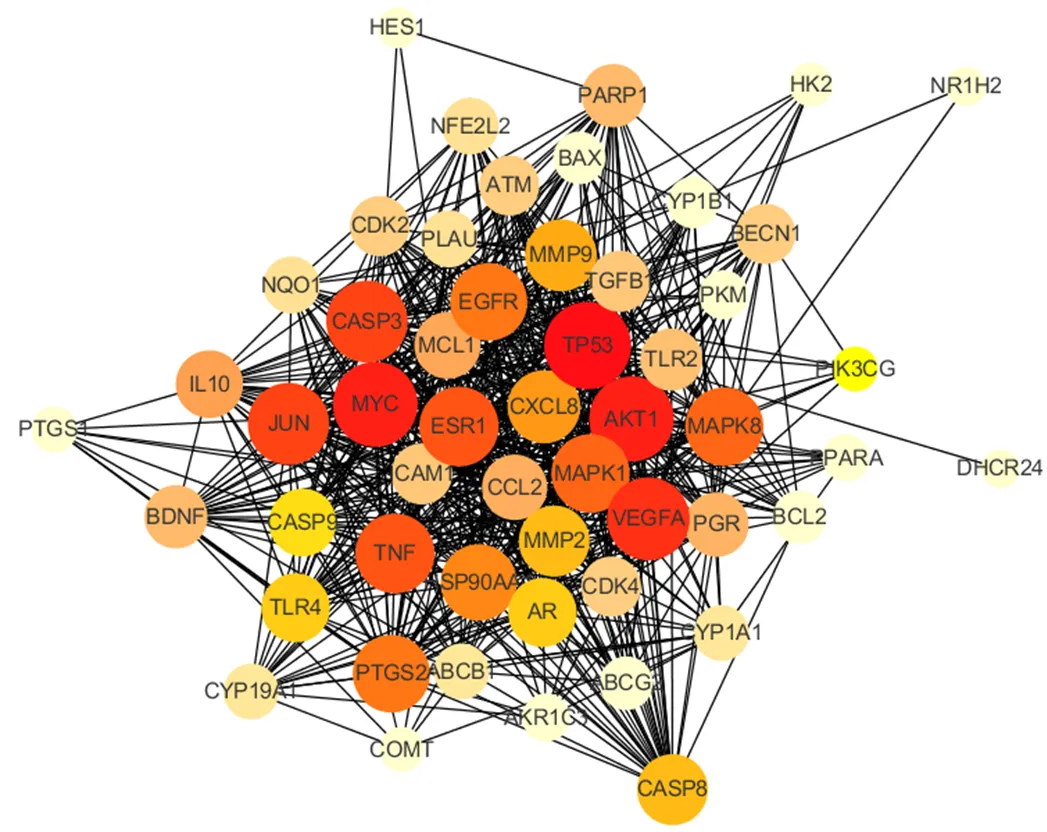
图5 互作靶点拓扑网络图
2.7 活性成分与靶点的分子对接验证
将25个活性成分的分子配体与36个靶点进行对接,得到800多组对接数据。表4为对接能力前12个靶点与前17个活性成分的交叉数据,活性成分与细胞色素P450 1B1(cytochrome P450 1B1,CYP1B1)、热休克蛋白90α(heat shock protein 90α,HSP90A)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、雄激素受体(androgen receptor,AR)、ESR1、EGFR、PTGS2、MAPK8、MAPK1等靶点的分子对接能力均较好。
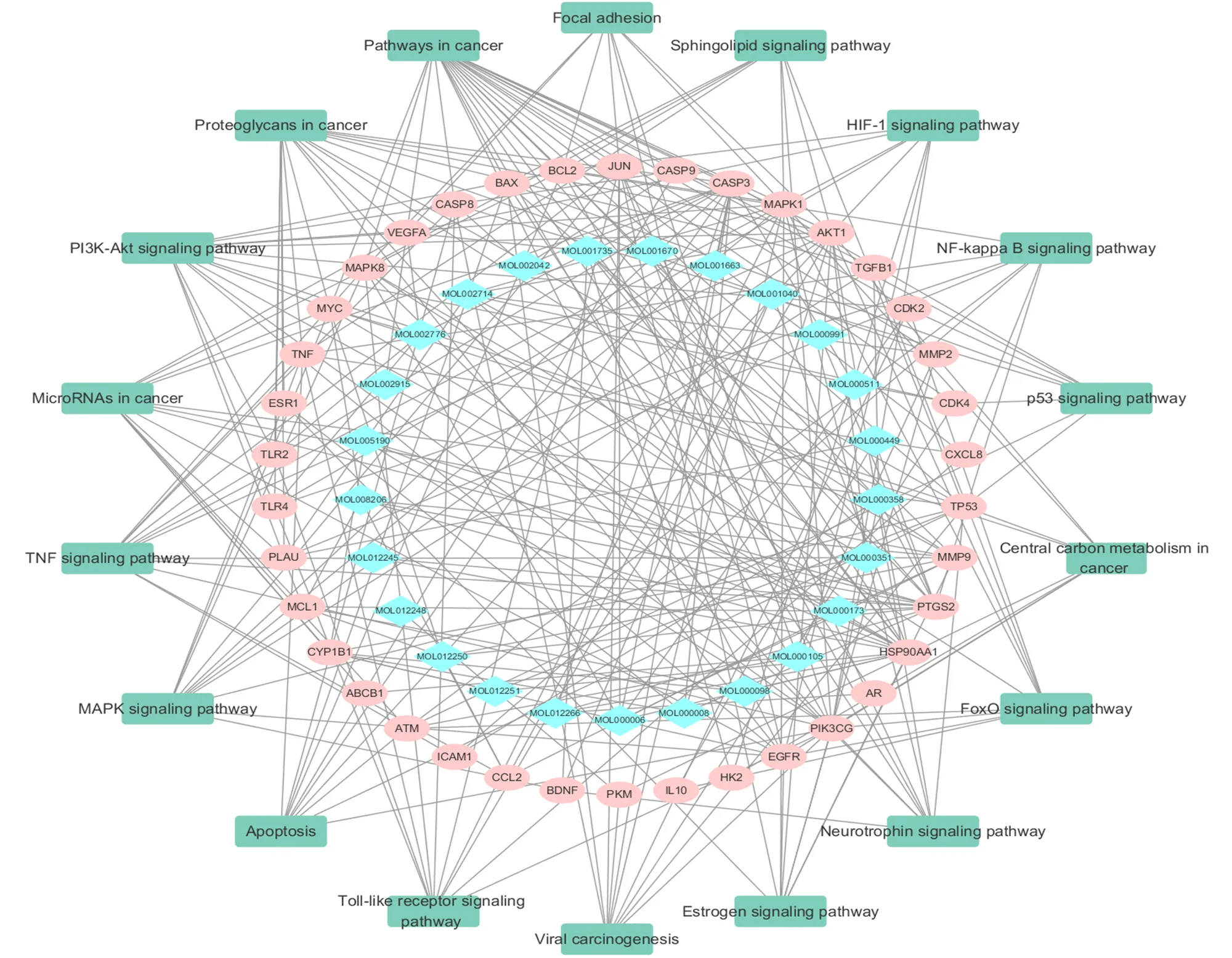
图6 “活性成分-靶点-通路”网络

表4 活性成分与靶点的分子对接结果
以CYP1B1与半枝莲种素的分子对接为例,如图7所示,CYP1B1靶点中含有铁离子且具有较好的分子口袋,与半枝莲种素的结合能为38.98 kJ/mol。
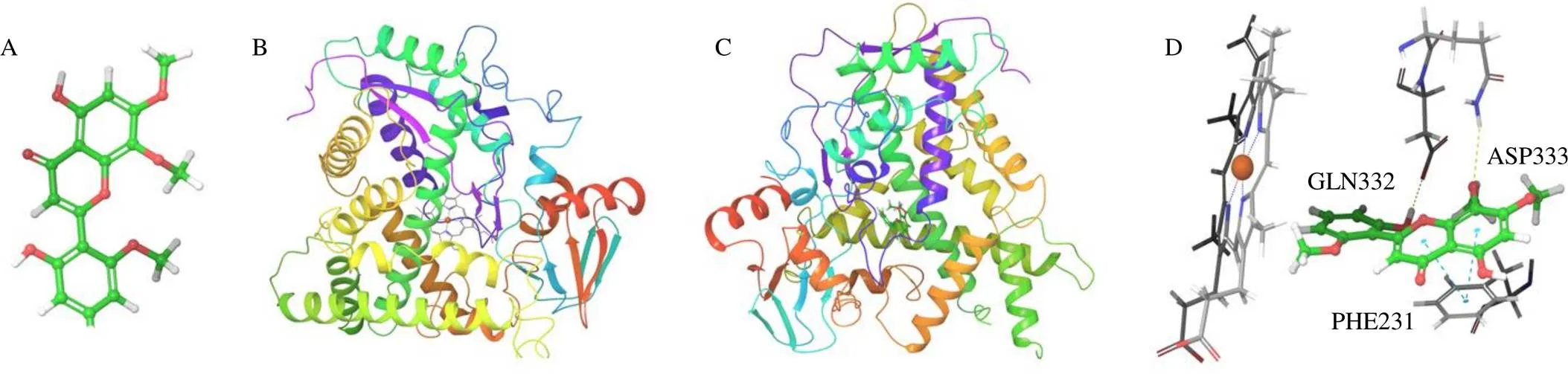
图7 半枝莲种素(A) 与CYP1B1 (B) 分子对接位置模型(C)和分子对接键模型(D)
3 讨论
白花蛇舌草和半枝莲作为清热解毒中药,在临床上常被作为药对应用于抗肿瘤治疗中。两药配伍具有协同增效作用,该药对可促进胃癌细胞[12-13]、肝癌细胞[12]、非小细胞肺癌细胞[12]、乳腺癌细胞[14-15]、宫颈癌细胞[12]、胰腺癌细胞[16]凋亡,抑制肿瘤细胞增殖;该药对在肝癌荷瘤小鼠[17-18]、S180肉瘤荷瘤小鼠[19-20]中均表现出较好的抑瘤作用;该药对所含多种成分如黄酮类、萜类、多糖类等具有抗瘤活性[10-12]。本研究发现白花蛇舌草和半枝莲药对的25个活性成分与36个宫颈癌疾病靶点相关性较为密切。分子对接实验发现,半枝莲种素、甲基鼠李素、三裂鼠尾草素、芹菜素、荠苎黄酮、柚皮素、槲皮素、黄芩素、木犀草素、白杨素、圣草酚等25个活性成分与宫颈癌疾病靶点可部分或全部成功对接,其中槲皮素、豆甾醇、植物甾醇、熊果酸、2-甲氧基-3-甲基-9,10-蒽醌酮为白花蛇舌草的活性成分。
黄酮类化合物具有较好的抗肿瘤活性[21-22]。槲皮素[23-26]、黄芩素[27-28]、黄芩苷[29-32]、汉黄芩素[27-33]、白杨素[34]、柚皮素[35]、陈皮素[36]、木犀草素[37]、芹菜素[38]可促进宫颈癌细胞凋亡,抑制肿瘤增殖与侵袭。圣草酚存在于益母草[39]、石韦[40]、杨树花[41]等植物中,具有抗氧化、抗炎、抗肿瘤、神经保护等多种药理活性[42];圣草酚可以防治1,2-二甲基肼诱导的雄性白化Wistar大鼠实验性结肠癌[43];圣草酚可以抑制小鼠上皮细胞JB6C141向癌细胞的转化[44]。高车前素可抑制结肠癌细胞[45]、肝癌细胞[46]增殖;高车前素可通过抑制B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)蛋白表达从而抑制肝癌细胞增殖,发挥抗结肠癌作用[45-47]。鼠李素又称甲基鼠李素,可以通过下调神经源性位点Notch同源蛋白1(neurogenic locus notch homolog protein 1,Notch-1)的表达从而抑制乳腺癌细胞MCF-7增殖、侵袭和迁移[47];异鼠李素可通过抑制多条信号通路从而抑制肾癌细胞生长[48]。三裂鼠尾草素可抑制结肠癌细胞SW620[49]和胃癌细胞SGC7901[50]活性。目前尚无半枝莲种素、荠苎黄酮、百里香酚、原儿茶酸、7-羟基-5,8-二甲氧基-2-苯基-色酮、5-羟基-7,8-二甲氧基-2-(4-甲氧基苯基色酮)、2-甲氧基-3-甲基-9,10-蒽醌抗癌活性的相关报道。
熊果酸为五环三萜类化合物,已有大量研究表明熊果酸对肝癌[51]、胃癌[52]、乳腺癌[53]、前列腺[54]、结直肠癌[55]具有较好的抑制活性。但本研究结果发现,熊果酸可成功对接的靶点较少,且对接能力欠佳。本研究中部分对接能力较强的靶点如CYP1B1、AR、EGFR等与宫颈癌发生、发展的联系尚并不明确。细胞色素P450参与多种人体代谢功能,CYP1B1的基因多肽性可能在宫颈癌的发生、发展中发挥作用[56]。ESR1、AR作为性激素受体,在促性激素和抑制性激素分泌的药物研究中较为多见,ESR1拮抗剂如三苯氧胺、来曲唑等可抑制乳腺癌患者性腺轴分泌,AR拮抗剂如比卡鲁胺、恩杂鲁胺、阿比特龙等可抑制AR信号轴活性,但目前尚无AR参与宫颈癌发生、发展的相关研究。Scambia等[57]指出EGFR水平与宫颈癌的死亡、复发风险均无关,提示EGFR与宫颈癌的发生、发展机制无关。化合物活性与药动学特性密切相关,提示分子对接只能作为筛选活性成分的一种有效手段,后续仍需进行体内外实验验证。
HSP90A是细胞内普遍存在且保守的蛋白,在细胞内发挥着重要的功能。研究表明,HSP90A过表达与大肠癌[58]、卵巢癌[59]、乳腺癌[60]、肺癌[61]等多种肿瘤细胞增殖有关,其机制可能为HSP90A对EGFR、受体酪氨酸蛋白激酶erbB-2(receptor tyrosine-protein kinase erbB-2,ERBB2)、血小板源性生长因子受体(platelet-derived growth factor receptor,PDGFR)等信号通路的抑制[61]。姜黄素可抑制HSP90活性,促进其下游蛋白AKT和人类表皮生长因子受体-2(human epidermal growth factor receptor-2,Her-2)降解,从而促进人宫颈癌HeLa细胞凋亡[62]。BDNF是神经促性腺激素家族的成员之一,BDNF/酪氨酸激酶受体B通路被认为是预防宫颈癌细胞增殖、侵袭、转移的有效靶点[63]。苦参碱可通过上调BDNF-反义长链非编码RNA表达,从而抑制宫颈鳞状细胞癌增殖[64]。本研究发现,白花蛇舌草和半枝莲药对的多种活性成分如芹菜素、柚皮素、槲皮素等均能与BDNF成功对接,且对接能力较强。
MAPK信号通路中的MAPK1、MAPK8参与宫颈癌细胞增殖、分化、迁移、转化和程序性死亡等多种过程。柚皮素[35]、木犀草素[65]、槲皮素[66]可通过调控MAPK通路,抑制宫颈癌细胞增殖、侵袭与转移。柚皮素可诱导HeLa细胞中活性氧自由基(reactive oxygen species,ROS)的产生,可通过激活ROS/c-Jun末端激酶(c-Jun-terminal kinase,JNK)/Bcl-2通路诱导细胞凋亡、抑制细胞增殖和迁移[35]。蟾蜍灵作用于ROS/JNK通路诱导宫颈癌C33A细胞自噬,发挥抗肿瘤作用。槐耳清膏通过激活p-JNK通路抑制C33A细胞与人宫颈癌SiHa细胞的增殖、迁移与侵袭[67]。PI3K-Akt信号通路对宫颈癌细胞的增殖、分化和凋亡具有重要的调节作用。黄岑苷对HeLa细胞具有放射增敏作用,可使细胞周期阻滞于G2/M期,其机制与抑制PI3K/Akt信号通路有关[68]。苦参碱[69]、去氢骆驼蓬碱[70]、虎杖苷[71]可通过抑制PI3K/Akt信号通路从而抑制宫颈癌细胞生长。PTGS包括组成性表达的PTGS1和可诱导的PTGS2,参与细胞的环氧合酶途径与炎症激活。各种物理、化学损伤均能激活PTGS2,PTGS2通过激活VEGF、PI3K-Akt等通路促进新生血管生成,在癌症发展、转移中发挥重要作用[72]。PTGS2的选择性抑制剂赛来昔布能特异性诱导宫颈癌组织内PTGS2和细胞增殖核抗原Ki67蛋白表达,抑制新生血管生成,进而诱导肿瘤细胞凋亡并阻滞细胞生长[73]。大麻素类似物能通过下调PTGS2表达,诱导HeLa细胞和C33A细胞凋亡[74]。
综上所述,白花蛇舌草和半枝莲药对的活性成分与多个细胞凋亡相关靶点及周期蛋白如BCL2、JUN、CASP3、TP53、CDK2等成功对接,可作用于MAPK、PI3K/Akt、PTGS2等多条信号通路,促进细胞凋亡、阻滞细胞生长,从而抑制宫颈癌的发生发展,表明白花蛇舌草和半枝莲药对具有多成分、多靶点、多通路的作用特点。
利益冲突 所有作者均声明不存在利益冲突
[1] de Sanjose S, Quint W G, Alemany L,. Human papillomavirus genotype attribution in invasive cervical cancer: A retrospective cross-sectional worldwide study [J]., 2010, 11(11): 1048-1056.
[2] Herrero R, González P, Markowitz L E. Present status of human papillomavirus vaccine development and implementation [J]., 2015, 16(5): 206-216.
[3] 张思维, 曾红梅, 赫捷, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28.
[4] 张红娜, 邹佳楠, 李昆, 等. 基于网络药理学推测和分子生物学验证探讨半枝莲抗胰腺癌的活性成分及其作用机制[J]. 中草药, 2020, 51(12): 3234-3245.
[5] 田野, 李舒. 战丽彬治疗恶性肿瘤用药规律的数据挖掘分析 [J]. 中医杂志, 2014, 55(8): 657-660.
[6] 简小兰, 蒋益兰, 曾普华. 蒋益兰教授论治宫颈癌学术经验拾菁 [J]. 湖南中医药大学学报, 2015, 35(7): 27-29.
[7] 刘弘, 李佩文. 李佩文辨治子宫颈癌临床经验撷英 [J]. 中国中医药信息杂志, 2015, 22(12): 98-99.
[8] 郭秀伟, 张培彤, 孙桂芝. 孙桂芝诊疗宫颈癌经验浅析 [J]. 辽宁中医杂志, 2017, 44(12): 2514-2516.
[9] 赵延华. 周仲瑛辨治宫颈癌与卵巢癌学术传承及创新研究 [D]. 南京: 南京中医药大学, 2019.
[10] 李波. 白花蛇舌草的化学成分和药理作用研究进展 [J]. 天津药学, 2016, 28(5): 75-78.
[11] 杨连梅, 刘量, 胡荣, 等. 半枝莲化学成分的提取和含量测定方法研究 [J]. 江苏中医药, 2010, 42(2): 78-80.
[12] 赖昌威. 药对白花蛇舌草与半枝莲提取物的体外抗肿瘤活性研究 [D]. 广州: 广东药科大学, 2019.
[13] 范燕燕, 陈有志, 卢英恺, 等. 白花蛇舌草-半枝莲药对组分对胃癌SGC-7901细胞增殖、线粒体自噬及凋亡的影响 [J]. 中医学报, 2020, 35(1): 130-135.
[14] 杜江洋, 徐元, 王楠, 等. 白花蛇舌草-半枝莲药对组分诱导三阴性乳腺癌细胞凋亡的机制 [J]. 中国实验方剂学杂志, 2018, 24(17): 99-107.
[15] 王信林, 宋歌, 王艳新, 等. 白花蛇舌草与半枝莲配伍对乳腺癌细胞MCF-7增殖的影响 [J]. 泰山医学院学报, 2019, 40(1): 31-33.
[16] 伍友春, 张昆, 康志龙, 等. 白花蛇舌草醇提物和半枝莲醇提物联用抗胰腺癌作用及机制研究 [J]. 药物评价研究, 2020, 43(7): 1233-1238.
[17] 李洁, 孙静. 中药半枝莲对肝癌H22荷瘤小鼠抑瘤作用的研究 [J]. 时珍国医国药, 2009, 20(5): 1233-1234.
[18] 隋在云, 王爱洁. 白花蛇舌草和半枝莲微粉配伍对小鼠H22肝癌细胞周期及凋亡的影响 [J]. 中国实验方剂学杂志, 2012, 18(23): 290-292.
[19] 陈玉, 冯大刚, 胡荣, 等. 半枝莲和白花蛇舌草总多糖对S180荷瘤小鼠的抗肿瘤作用研究 [J]. 新中医, 2013, 45(5): 171-174.
[20] 王艳杰, 康芯荣, 梁颖, 等. TUNEL法检测白花蛇舌草-半枝莲抑制S180荷瘤小鼠肿瘤生长的实验研究 [J]. 时珍国医国药, 2017, 28(6): 1329-1331.
[21] 陈明, 王举涛, 吴珍妮, 等. 半枝莲总黄酮通过PI3K/AKT/mTOR通路诱导肿瘤细胞自噬的体内实验研究 [J]. 中国中药杂志, 2017, 42(7): 1358-1364.
[22] 廖月霞. 半枝莲黄酮活性成分双向调节肿瘤免疫作用及机制 [D]. 扬州: 扬州大学, 2014.
[23] Bishayee K, Ghosh S, Mukherjee A,. Quercetin induces cytochrome-c release and ROS accumulation to promote apoptosis and arrest the cell cycle in G2/M, in cervical carcinoma: Signal cascade and drug-DNA interaction [J]., 2013, 46(2): 153-163.
[24] Luo C L, Liu Y Q, Wang P,. The effect of quercetin nanoparticle on cervical cancer progression by inducing apoptosis, autophagy and anti-proliferation via JAK2 suppression [J]., 2016, 82: 595-605.
[25] 徐文斌, 周青峰, 朱雪琼. 槲皮素抗宫颈癌作用的研究进展 [J]. 中国中西医结合杂志, 2019, 39(10): 1276-1279.
[26] 朱晓芹, 刘志强, 王博龙. 基于生物分子网络和分子对接研究槲皮素抗宫颈癌的机制 [J]. 天然产物研究与开发, 2020, 32(1): 23-31.
[27] 王丽娇. 黄芩素-汉黄芩素复合物对Hela细胞凋亡作用及机制的研究 [D]. 秦皇岛: 燕山大学, 2019.
[28] 王永周, 夏纪毅, 唐小平, 等. 黄芩素通过抑制胞外信号调节激酶1/2(ERK1/2)促进HeLa细胞凋亡 [J]. 细胞与分子免疫学杂志, 2016, 32(11): 1507-1512.
[29] 苏嘉文, 卜亚丽, 李瑄, 等. 黄芩苷对Hela细胞凋亡的影响 [J]. 中成药, 2020, 42(1): 209-212.
[30] 张悦, 符乔珊, 刘韡, 等. 黄芩苷对宫颈癌HeLa细胞侵袭转移的抑制作用及其机制 [J]. 西安交通大学学报: 医学版, 2016, 37(4): 599-603.
[31] 刘峰, 俞勇, 禹林昌, 等. 黄芩苷对人宫颈癌HeLa细胞增殖和凋亡影响机制研究 [J]. 中华肿瘤防治杂志, 2015, 22(9): 661-665.
[32] 陈璐, 张娟, 栾丽平. 黄芩苷通过增强自噬介导顺铂对宫颈癌C-33A/cis细胞敏感性的影响 [J]. 中药药理与临床, 2018, 34(5): 44-47.
[33] 余娅. 汉黄芩素对人宫颈癌细胞PNI相关RET、pRET、GDNFR-α1和CX3CR1蛋白表达的作用研究 [D]. 成都: 成都中医药大学, 2016.
[34] 董巍檑. NF-κB/Twist信号通路介导白杨素逆转宫颈癌HeLa细胞EMT和CSCLC的作用研究 [D]. 广州: 南方医科大学, 2017.
[35] 赖银璇, 王明蕊, 杨海丽, 等. 柚皮素通过ROS/JNK/Bcl2通路抑制宫颈癌HeLa细胞增殖和迁移 [J]. 中药药理与临床, 2018, 34(1): 40-43.
[36] 苏明媛, 牛江龙, 李林, 等. 川陈皮素的体外抑癌活性及其机制研究 [J]. 中成药, 2011, 33(9): 1479-1483.
[37] Horinaka M, Yoshida T, Shiraishi T,. Luteolin induces apoptosis via death receptor 5 upregulation in human malignant tumor cells [J]., 2005, 24(48): 7180-7189.
[38] 金波, 邱慧玲, 李玉萍. 芹菜素通过PI3K/Akt信号通路诱导Hela细胞凋亡 [J]. 现代肿瘤医学, 2017, 25(3): 367-371.
[39] 黄正, 霍会霞, 任易, 等. 大花益母草的化学成分研究 [J]. 中草药, 2017, 48(9): 1724-1729.
[40] 马辰, 周圆, 刘爱茹. 高效液相色谱法测定中药石韦2种成分的含量 [J]. 药学学报, 2003, 38(4): 286-289.
[41] 侯勇, 厉博文, 张广杰, 等. 杨树花化学成分的分离鉴定Ⅱ [J]. 中国实验方剂学杂志, 2018, 24(23): 77-81.
[42] 吕凤, 杜倩, 奚鑫, 等. 圣草酚药理作用研究进展 [J]. 中草药, 2019, 50(23): 5907-5912.
[43] Mariyappan P, Kalaiyarasu T, Manju V. Effect of eriodictyol on preneoplastic lesions, oxidative stress and bacterial enzymes in 1,2-dimethyl hydrazine-induced colon carcinogenesis [J]., 2017, 6(5): 678-692.
[44] Liu K D, Cho Y Y, Yao K,. Eriodictyol inhibits RSK2-ATF1 signaling and suppresses EGF-induced neoplastic cell transformation [J]., 2011, 286(3): 2057-2066.
[45] 刘凯莉. 高车前素通过JAK2/STAT3信号通路下调PIM1靶点抑制结肠癌细胞的生长和转移 [D]. 青岛: 青岛大学, 2019.
[46] 张涛. 高车前素对肝癌细胞增殖的抑制作用及作用机制研究 [J]. 中国药物与临床, 2014, 14(10): 1349-1351.
[47] 张淑艳, 张方, 姬颖华. 鼠李素下调Notch-1的表达对乳腺癌MCF-7细胞增殖、侵袭和迁移的调节作用 [J]. 中国临床解剖学杂志, 2018, 36(6): 632-636.
[48] 杜倩倩, 黄璐璐, 刘春霞, 等. 异鼠李素与索拉非尼联合对肾癌的抑制作用及作用机制 [J]. 药学学报, 2019, 54(8): 1424-1430.
[49] 陈洋, 费素娟, 周燏, 等. 三裂鼠尾草素对人γδT细胞杀伤结肠癌SW-620细胞的影响 [J]. 广东医学, 2015, 36(22): 3425-3429.
[50] 王军生, 吴克俭, 刘军权, 等. 三裂鼠尾草素在CIK细胞增殖及其胃癌细胞杀伤中的作用 [J]. 胃肠病学和肝病学杂志, 2015, 24(10): 1179-1182.
[51] Son H S, Kwon H Y, Sohn E J,. Activation of AMP-activated protein kinase and phosphorylation of glycogen synthase kinase3 β mediate ursolic acid induced apoptosis in HepG2 liver cancer cells [J]., 2013, 27(11): 1714-1722.
[52] Xiang F F, Pan C Y, Kong Q Q,. Ursolic acid inhibits the proliferation of gastric cancer cells by targeting miR-133a [J]., 2014, 22(5/6): 267-273.
[53] Luo J, Hu Y L, Wang H. Ursolic acid inhibits breast cancer growth by inhibiting proliferation, inducing autophagy and apoptosis, and suppressing inflammatory responses via the PI3K/AKT and NF-κB signaling pathways[J]., 2017, 14(4): 3623-3631.
[54] Meng Y, Lin Z M, Ge N,. Ursolic acid induces apoptosis of prostate cancer cells via the PI3K/Akt/ mTOR pathway [J]., 2015, 43(7): 1471-1486.
[55] Shan J Z, Xuan Y Y, Zhang Q,. Ursolic acid synergistically enhances the therapeutic effects of oxaliplatin in colorectal cancer [J]., 2016, 7(8): 571-585.
[56] 李瑶. 山西大同地区CYP1B1基因A119S、L432V位点多态性与宫颈癌的易感性研究 [D]. 太原: 山西医科大学, 2017.
[57] Scambia G, Ferrandina G, Distefano M,. Epidermal growth factor receptor (EGFR) is not related to the prognosis of cervical cancer [J]., 1998, 123(2): 135-139.
[58] Nagaraju G P, Long T E, Park W,. Heat shock protein 90 promotes epithelial to mesenchymal transition, invasion, and migration in colorectal cancer [J]., 2015, 54(10): 1147-1158.
[59] Jiao Y S, Ou W B, Meng F G,. Targeting HSP90 in ovarian cancers with multiple receptor tyrosine kinase coactivation [J]., 2011, 10: 125.
[60] Schulz R, Streller F, Scheel A H,. HER2/ErbB2 activates HSF1 and thereby controls HSP90 clients including MIF in HER2-overexpressing breast cancer [J]., 2014, 5: 980.
[61] 董鹏飞, 邓晓明. 非小细胞肺癌患者血清热休克蛋白90α的临床意义研究 [J]. 中国全科医学, 2015, 18(19): 2354-2356.
[62] 王静, 张雅雅, 刘涛, 等. Hsp90潜在抑制剂姜黄素诱导人宫颈癌Hela细胞凋亡的机制 [J]. 现代肿瘤医学, 2014, 22(11): 2561-2565.
[63] Yuan Y, Ye H Q, Ren Q C. Upregulation of the BDNF/TrKB pathway promotes epithelial-mesenchymal transition, as well as the migration and invasion of cervical cancer [J]., 2018, 52(2): 461-472.
[64] 刘平, 陈晓杰. 苦参碱上调LncRNA BDNF-AS抑制宫颈鳞癌细胞增殖的机制研究 [J]. 中草药, 2020, 51(6): 1593-1599.
[65] 潘磊, 黄超, 周健, 等. 木犀草素对宫颈癌细胞增殖、迁移及Ras-MAPK通路的影响 [J]. 中国妇幼保健, 2019, 34(18): 4310-4313.
[66] 种楠, 李勤, 冯艳红, 等. 槲皮素抑制宫颈癌Siha细胞增殖和侵袭实验研究 [J]. 中华实用诊断与治疗杂志, 2019, 33(2): 113-116.
[67] 闫莉. 槐耳清膏对人宫颈癌细胞的抑制作用及其机制研究 [D]. 济南: 山东大学, 2016.
[68] 惠双. 黄岑苷对宫颈癌细胞株HeLa的放射增敏作用 [J]. 中国病理生理杂志, 2015, 31(12): 2126-2129.
[69] 陆蓉, 尹红, 郁胜胜, 等. 苦参碱对大鼠宫颈癌组织PI3K/AKT信号转导通路的影响 [J]. 肿瘤药学, 2018, 8(3): 347-350.
[70] 刘诗伶. 去氢骆驼蓬碱对宫颈癌的抑制作用及其分子机制研究 [D]. 南昌: 南昌大学, 2018.
[71] 潘纪红, 王海滨, 杜晓飞, 等. 虎杖苷通过PI3K/AKT/mTOR信号通路诱导人宫颈癌细胞凋亡的初步研究 [J]. 中国中药杂志, 2017, 42(12): 2345-2349.
[72] 赵相轩, 温锋, 孙巍, 等. 宫颈癌相关细胞凋亡通路研究进展 [J]. 现代肿瘤医学, 2016, 24(23): 3849-3852.
[73] Ferrandina G, Ranelletti F O, Legge F,. Celecoxib modulates the expression of cyclooxygenase-2, ki67, apoptosis-related marker, and microvessel density in human cervical cancer: A pilot study [J]., 2003, 9(12): 4324-4331.
[74] Eichele K, Ramer R, Hinz B. R(+)-methanandamide- induced apoptosis of human cervical carcinoma cells involves A cyclooxygenase-2-dependent pathway [J]., 2009, 26(2): 346-355.
Mechanism ofandin treatment of cervical cancer based on network pharmacology and molecular docking
WU Lang-jie, ZHAO Chun-yan, ZHAN Li-bin
School of Chinese Medicine & School of Integrated Chinese and Western Medicine, Nanjing University of Chinese Medicine, Nanjing 210023, China
To study the active ingredients and mechanism ofandin the treatment of cervical cancer based on network pharmacology and molecular docking.The active compounds and predicted targets ofandwere collected from TCMSP and STITCH database. Cervical cancer disease targets were downloaded on the DisGeNET website. Cytoscape software was used to construct protein-protein interaction (PPI) network of common target for drugs and cervical cancer based on the data of String platform. CytoHubba was used to analyze the hub genes and construct a network diagram of the target. The network of “active compounds-target-pathways” was established and Schrodinger software was used for verification of active compounds via molecular docking with targets.“Active compounds-target-pathways” network showed that there were 25 major active compounds, 38 major target related with 18 signaling pathways. Molecular docking results showed that 25 active compounds were successfully docked with some or all of the 38 target.andmay promote the apoptosis of cervical cancer cells through multi-compound, multi-target, and multi-pathway.
cervical cancer;Willd.;D. Don; network pharmacology; molecular docking
R285.5
A
0253 - 2670(2021)04 - 1049 - 10
10.7501/j.issn.0253-2670.2021.04.018
2020-08-16
国家自然科学基金资助项目(81730111);江苏省双创团队资助项目(20182036)
吴朗杰(1983—),女,博士研究生,主要从事中医药治疗肿瘤的研究。E-mail: jielang2004@126.com
战丽彬,教授,博士生导师,主要从事中西医结合防治老年病的基础与临床研究。E-mail: zlbnj@njucm.edu.cn
[责任编辑 李亚楠]

