基于“质量标志物-生物活性”关联分析评价丹参的等级
杨宁娟,刘妍如,唐志书,宋忠兴,段金廒,陈 琳,刘 峰,陈衍斌,许 刚,史鑫波
基于“质量标志物-生物活性”关联分析评价丹参的等级
杨宁娟1,刘妍如1*,唐志书1*,宋忠兴1,段金廒4,陈 琳1,刘 峰2,陈衍斌3,许 刚3,史鑫波1
1. 陕西中医药大学 陕西省中药资源产业化协同中心,省部共建协同秦药特色资源研究与开发重点实验室(培育),陕西省创新药物研究中心,陕西 咸阳 712083 2. 陕西国际商贸学院,陕西 咸阳 712083 3. 陕西步长制药有限公司,陕西 西安 710075 4. 南京中医药大学 江苏省方剂高技术研究重点实验室,江苏省中药资源产业化过程协同创新中心,江苏 南京 210023
基于“成分反映活性,活性指向功效”的中药质量控制研究思路,建立用于丹参饮片等级评价的Logistic回归模型。采用超高效液相色谱法(UPLC)测定丹参质量标志物(quality marker,Q-marker)含量,以凝血酶时间(thrombin time,TT)、羟自由基抑制率、DPPH自由基清除率作为生物活性评价指标,运用Logistic回归分析法将质控指标和生物活性指标进行关联分析,最后建立Logistic回归模型。Logistic模型结果显示,31批丹参饮片被分成了优、良、中、差4个等级,样本等级预测概率()值均大于90%,说明本研究所建立的模型其准确性和预测能力均较好。基于含量测定及生物活性结果建立的Logistic回归模型可用来评价丹参饮片质量高低,为丹参整体质量控制提供参考依据。
丹参;二分类Logistic回归分析;生物活性;超高效液相色谱;质量标志物
丹参是唇形科植物丹参Bunge.的干燥根或根茎,收载于《中国药典》2015年版[1],是中医临床常用大品种中药饮片之一。主要分布在我国华北、华东、西北地区[2]。丹参味微辛、苦,归心经、肝经[3],具有抑制血小板聚集、抗心肌缺血、抗动脉粥样硬化等功效。临床上常用于治疗心肌缺血、心力衰竭以及动脉粥样硬化等心血管疾病[4-6]。近年来,通过野生品、栽培品[7]、产地[8]、直径[9]以及根皮颜色[10]与有效成分含量的相关性对丹参进行等级分类的研究甚多,但饮片是由药材经除去杂质和残茎、洗净、润透、切厚片、干燥等加工工序制成,炮制方法不同,有效成分的含量都会受到影响,因此不能完全依照丹参有效成分的含量标准评价丹参饮片质量,及时修订丹参饮片的质量标准是亟待解决的问题。
中药化学成分复杂多样给中药质量控制带来了巨大的挑战。刘昌孝院士[11]于2016年首次提出中药质量标志物(quality marker,Q-markers)新概念,使中药质量控制体系更加完善。刘妍如等[12]对脑心通胶囊中Q-marker进行预测分析,指出丹参中的丹酚酸B和丹参酮IIA可作为丹参的Q-marker,故可通过测定其含量增加质量控制结果的准确性。范华英[13]指出丹参酮IIA能降低血液黏度,抑制凝血酶活化和加速纤维蛋白降解;丹酚酸B可以减少血小板激活和动脉血栓的形成。因此本课题组将凝血酶时间(thrombin time,TT)作为评价丹参抗凝血作用的主要指标。此外,丹参在治疗心脑血管疾病的作用与其提取物具有抗氧化活性有关,其机制为通过抑制自由基的产生而保护心脏免受伤害[14],故选用羟自由基和1,1-二苯基-2-三硝基苯肼(2,2-diphenyl-1-picrylhydrazyl,DPPH)自由基清除率作为评价丹参抗氧化能力的指标。
本研究以31批不同产地的丹参饮片为研究对象,采用Logistic回归分析法对质控指标和TT、羟自由基清除率及DPPH自由基清除率等生物活性指标进行关联分析,最后建立用于丹参等级评价的Logistic回归模型,为建立科学、可靠的丹参饮片分级标准提供新思路。
1 材料与仪器
1.1 材料
1.1.1 动物 SPF级SD大鼠,雄性,体质量 (240±10) g,购于成都达硕实验动物有限公司,实验动物许可证号SCXK(川)2015-030。保持温度 (22±3) ℃,相对湿度(50±10)%,自由饮水摄食,适应性饲养1周。实验动物的饲养和使用,以及动物的处理严格遵循中国实验动物伦理委员会的相关规定。
1.1.2 试剂 丹酚酸B(批号MUST-18070503,质量分数98.51%)、丹参酮IIA(批号MUST-17022502,质量分数99.64%)购于成都曼思特生物科技有限公司;凝血酶时间TT测定试剂盒(上海长岛生物技术有限公司);羟自由基试剂盒(批号W27F10E81251,南京建成生物工程研究所);DPPH(批号W27F10E81251,源叶生物公司);含枸橼酸钠添加剂一次性真空采血管(批号181201,江苏康健医疗用品有限公司);0.9%氯化钠注射液(辰欣药业股份有限公司);甲酸(FlukaTM,色谱纯,美国霍尼韦尔公司);甲醇、乙腈为色谱纯,购于德国默克公司;其他试剂均为分析纯。实验用水为屈臣氏蒸馏水。
1.1.3 药材 本研究收集31批丹参饮片,经陕西中医药大学刘世军教授鉴定为唇形科植物丹参Bunge. 的干燥根和根茎。丹参对照药材(批号SGAS-QTQ3)购于中国食品药品检定研究院;31批丹参基本信息见表1。
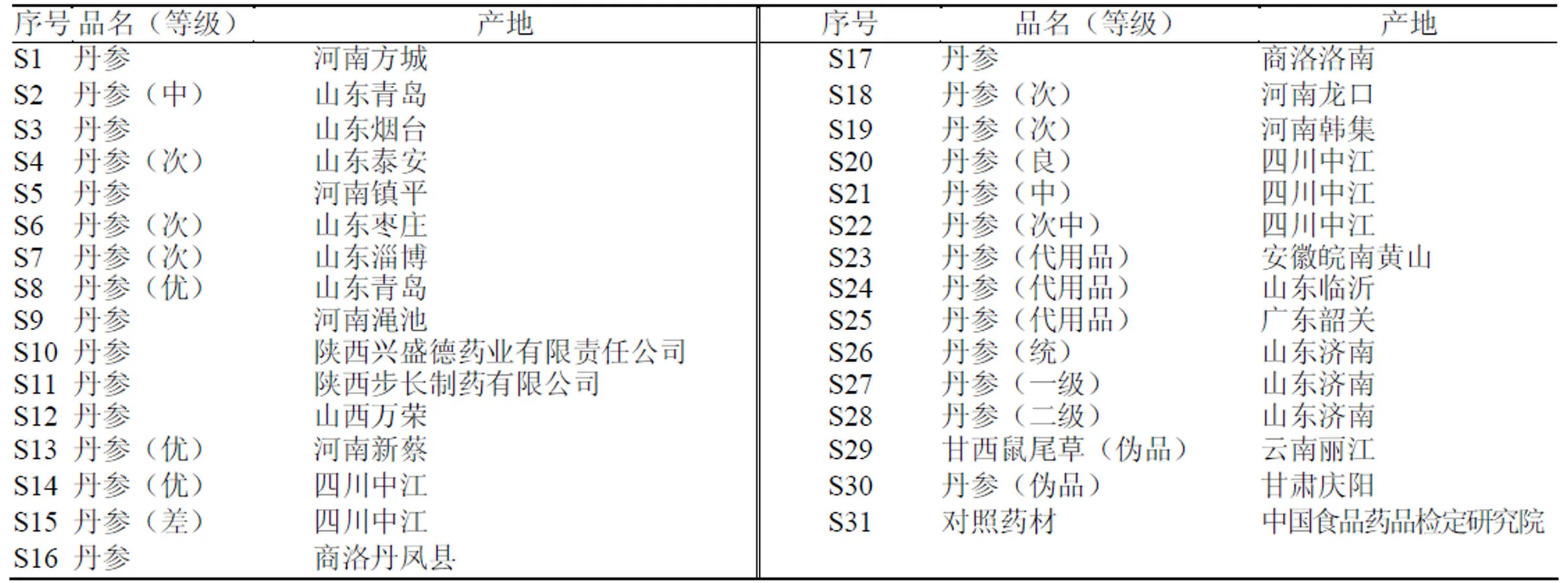
表1 31批丹参药材信息
1.2 仪器
Acquity H-CLASS型超高效液相色谱系统(美国沃特世公司);包括二元超高压溶剂系统、FTN自动进样管理器、PDA检测器和Empower 3色谱工作站;1510型全波长酶标仪(美国Thermo公司);Sartorius CPA225D十万分之一分析天平(德国赛多利斯科学仪器有限公司);Thermo Micro 17R微量低温冷冻离心机(上海珂淮仪器有限公司);C2000-A型全自动凝血分析仪(北京普利生仪器有限公司)。
2 方法
2.1 样品的制备
2.1.1 对照品溶液的制备 分别取丹酚酸B和丹参酮IIA对照品适量,精密称定,置棕色量瓶中,加甲醇制成丹酚酸B和丹参酮IIA质量浓度均为0.22 mg/mL的混合对照品溶液,备用。
2.1.2 供试品溶液的制备 取本品粉末(过4号筛)约0.3 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,密塞,称定质量,超声处理(功率140 W、频率42 kHz)30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,0.22 μm微孔滤膜滤过,取续滤液,即得。
2.2 色谱条件
色谱柱为ACQUITY UPLC®BEH C18(50 mm×2.1 mm,1.7 µm);流动相为0.1%甲酸-水溶液(A)-乙腈溶液(B);梯度洗脱条件为0~2 min,2% B;2~10 min,2%~100% B;10~13 min,100% B;13~15 min,100%~2% B,后运行5 min;体积流量0.2 mL/min;柱温25 ℃;检测波长270 nm;进样量2 μL。色谱图见图1。
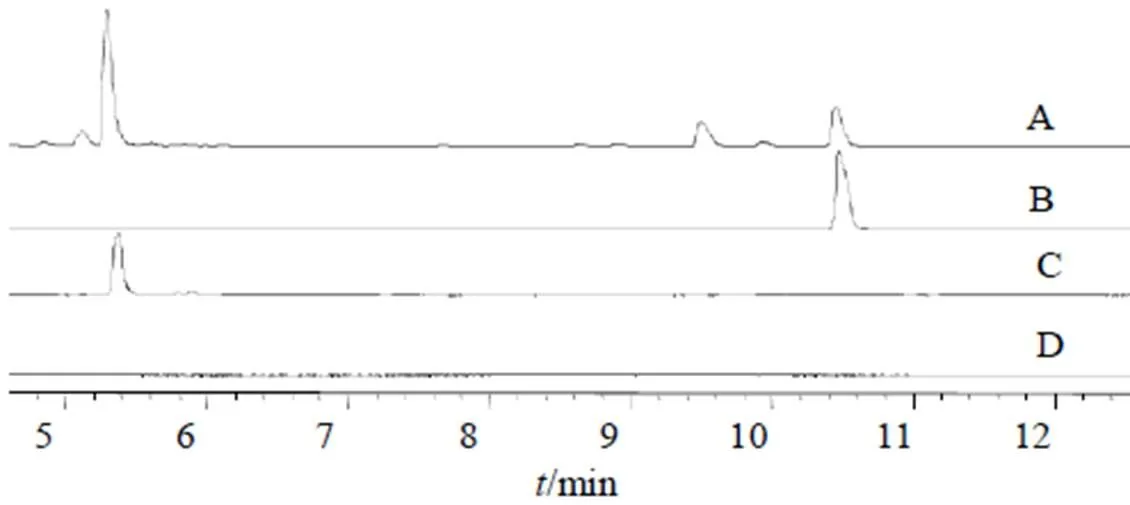
图1 丹参提取物 (A)、丹酚酸B (B)、丹参酮ⅡA (C) 及空白对照 (D) 的色谱图
2.3 方法学考察
2.3.1 系统适用性考察 将“2.1.1”和“2.1.2”项下的对照品及供试品溶液,按照“2.2”项下的色谱条件分别进样2 μL,记录270 nm波长下的UPLC谱图,比较在线紫外光谱图和保留时间,此条件下丹酚酸B、丹参酮IIA强度适中且与相邻峰分离较好且理论塔板数不低于8000。
2.3.2 线性关系考察 分别精密移取混合对照品溶液0.25、0.5、1.0、2.0、3.0、4.0 mL,分别置于10 mL量瓶中,加1∶1的甲醇水溶解至刻度,摇匀。按“2.2”项下色谱条件分析,以对照品峰面积为纵坐标(),质量浓度为横坐标(),绘制标准曲线。丹酚酸B线性范围为30.0~150.0 μg/mL,丹参酮IIA线性范围为20.0~70.0 μg/mL,表明各对照品在实验质量浓度范围内线性关系良好
2.3.3 精密度试验 吸取“2.1.2”项下供试品溶液适量,以“2.2”项下色谱条件连续测定6次,记录保留时间和峰面积,结果显示丹酚酸B、丹参酮IIA的相对保留时间RSD分别为0.02%、0.06%,相对峰面积RSD分别为0.39%、0.76%。
2.3.4 稳定性试验 吸取“2.1.2”项下供试品溶液适量,分别于室温放置0、3、6、12、18、24、36 h,按“2.2”项下色谱条件进样测定,记录保留时间和峰面积,结果显示丹酚酸B、丹参酮IIA的相对保留时间RSD分别为0.04%、0.08%,相对峰面积RSD分别为0.41%、0.82%。
2.3.5 重复性试验 按“2.1.2”项下方法制备6份供试品溶液,以“2.2”项下色谱条件测定,记录保留时间和峰面积,结果丹酚酸B、丹参酮IIA的相对峰面积RSD为0.19%、0.67%,相对保留时间RSD分别为0.01%、0.02%。
2.3.6 加样回收率试验 按“2.1.2”项下方法制备6份供试品溶液,按照低、中、高3个添加水平(80%、100%、120%)进行加样回收测定,以“2.2”项下色谱条件平行测定6次,记录峰面积。丹酚酸B和丹参酮IIA加样回收率为101.05%、99.86%,RSD值分别为0.16%、0.56%。
2.4 体内抗凝血活性测定[15]
2.4.1 血浆制备 大鼠腹主动脉取血,采用3.2%枸橼酸钠抗凝,全血与抗凝剂比例为9∶1,将血液分装在离心管内,2500 r/min,离心15 min,取血浆备用。
2.4.2 丹参粉末的前处理 精密称取丹参粉末1.00 g,加0.9%的生理盐水至10 mL,超声20 min,然后将其分装在离心管内,用离心机以5000 r/min离心10 min,取上清液,再以5000 r/min离心5 min,取上清液,用0.22 μm针头过滤器滤过,得丹参粉末提取原液。
2.4.3 TT测定 取血凝仪测试杯,每通道精密加入血浆90 μL,分别加入不同浓度的丹参溶液50 μL,用全自动血凝仪测定TT值,为保证测量的准确性,测定应在4 h内完成,且不可冷冻保存和过度震荡。
2.4.4 量效关系考察 将S11提取原液用0.9%氯化钠注射液稀释成质量浓度为13.30、10.60、8.50、6.80、5.40、4.40、3.40、2.80、2.20、1.80、1.40 mg/mL溶液(剂间比0.8),按“2.4.3”项方法,分别测定含药血浆的TT,每个浓度平行测定3次,见图2。结果发现,S11丹参提取液浓度较低时,体外抗凝血作用不明显,不具有剂量依赖性,而在一定质量浓度范围内剂量依赖性较为明显,并在该质量浓度范围内随着丹参溶液质量浓度的增加,TT值也在增加。通过量效关系考察实验,认为S11样品的一定质量浓度范围,可作为其他批次丹参样品TT测定时质量浓度范围选择的依据。
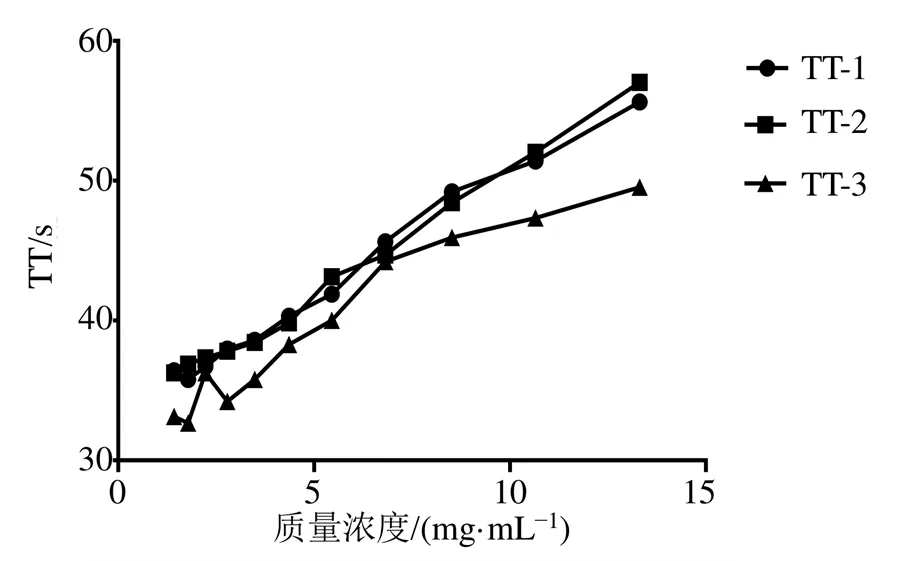
图2 丹参在体外对TT的量效关系考察结果
2.4.5 线性范围考察 根据量效关系考察结果,将S11提取液用0.9%氯化钠注射液稀释成质量浓度为13.30、10.60、8.50、6.80、5.40 mg/mL的溶液,剂间比为0.8,按“2.4.3”项方法,分别测定含药血浆的TT,平行测定3次,以药物质量浓度为横坐标(),TT值为纵坐标()绘制标准曲线,发现丹参提取液的质量浓度在5.40~13.30 mg/mL时,TT与质量浓度的线性关系良好,其回归方程为=2 281.6+26.738,=0.999 6。通过该线性范围考察,明确了S11的线性质量浓度范围,并将该范围的中间质量浓度8.50 mg/mL作为各批次样品测定TT时的质量浓度。
2.4.6 效价定义及各批次丹参TT测定 将质量浓度为8.50 mg/mL的丹参溶液使空白血浆的TT延长1 s定义为1个效价单位(U)。取各批次丹参提取原液,用生理盐水稀释成质量浓度为8.50 mg/mL的标准溶液,按“2.4.3”项下方法连续测定6次,取平均值作为该批样品的效价。
标准品的效价=/(V×C)
为标准品溶液比空白血浆TT延长的时间,为标准品溶液体积,为标准品溶液的浓度
2.4.7 羟自由基清除率测定 参考羟自由基试剂盒说明书,采用微量法进行加样,每个样品设3个复孔,重复2次,测定吸光度()值。根据公式计算样品的羟自由基清除率,取平均值。
羟自由基清除率=(c-s)/s
s为测定管的值,c为对照管的值
2.4.8 DPPH自由基清除率测定 用甲醇配制0.2 mmol/L的DPPH溶液,避光保存备用;另配制2.0 mg/mL的维生素C(Vc)溶液备用,参考文献方法[16],采用微量法在96孔板上进行操作,取150 μL 70%甲醇,加入150 μL 待测液作为空白组;取 150 μL 70 %甲醇,加入150 μL DPPH溶液作为对照组;取150 μL DPPH 溶液,加入150 μL维生素 C(Vc)溶液作为标准组;取150 μL DPPH 溶液,加入150 μL 待测液作为测定组。加样完成后于室温下避光静置30 min,采用酶标仪测定 517 nm 处的吸光度(A)值。每个样品设置 3 个复孔,重复实验2次。根据公式计算丹参提取液的DPPH自由基清除率,取平均值。
DPPH自由基清除率=1-(s-b)/c
s为测定管的值,b为空白管的值,c为对照管的值
2.5 丹参饮片等级评价
2.5.1 主成分(principal component analysis,PCA)分析 PCA是一种将多维数据进行降维处理,简化为少数几个不相关的综合指标(主成分)的多元统计分析方法。其目的在于减少变量的数目使多变量数据集可视化,结合原始变量的线性关系生成影响分类较大的主成分。因此,采用PCA方法观察样品差异情况,将提取的数据进行数据对齐、积分、标准化处理,导入至Simca-p 14.1软件中,以其影响因素(质控含量,生物活性)作为观测值()进行PCA分析,从得到的数据矩阵中提取携带差异变量最多的主成分。提取前2个主成分,得到模型拟合度为83.9%。PC1的贡献率为66.1%,包合差异信息最多,这说明此模型拟合能力较好,其模型预测图见图3-A。
以前2个主成分建立投影,得到散点图见图3-B。采用聚类分析(hierarchical cluster analysis,HCA)方法,对31个批次的丹参数据进行聚类分析,发现样本被自动分为4类(组1~4),由图3可见,丹参正品和伪品有明显的分类距离。浙皖丹参、白花丹参和南丹参等批次是丹参的代用品被分为一类(绿色);甘西鼠尾草和伪品分为一类(红色),其他2类为丹参正品(黄色,蓝色),见图3-C。结果表明,采用PCA的分类具有较高的可靠性。
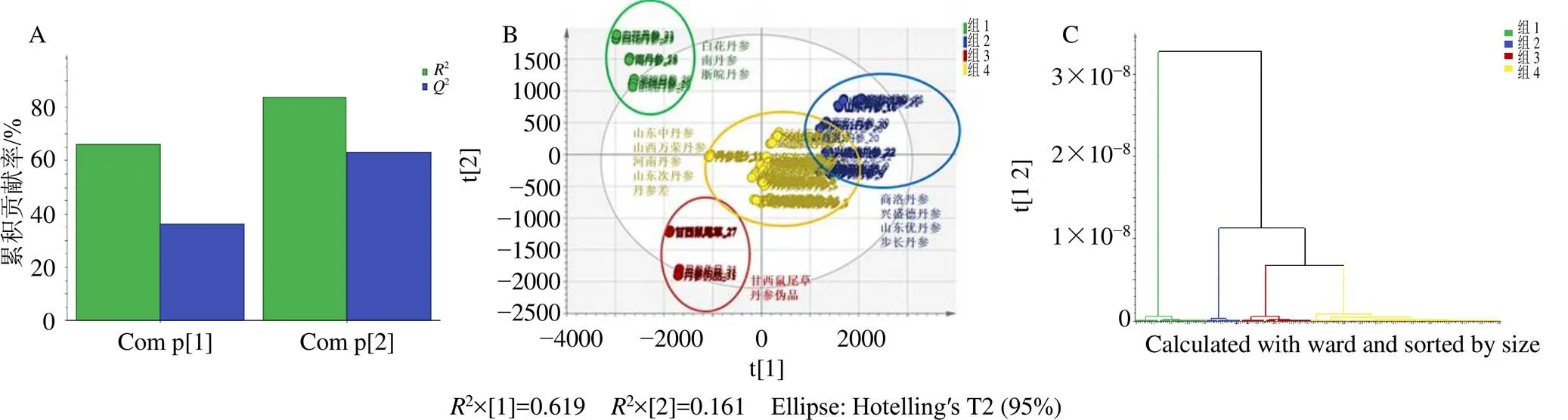
A-模型预测图 B-PCA散点图 C-HCA聚类图
2.5.2 建立Logistic回归模型 目前,已有大量研究采用Logistic回归模型对不同产地的中药材或饮片进行等级分类,这不仅为相关药物的质量评价提供了实验数据,还给生产该药物相关制剂时投料饮片产地来源的选择提供了一定的参考[17-19]。而影响丹参投料饮片的主要因素分为2类:第1类是主要成分的质控含量;第2类是生物活性(抗氧化活性、抗凝血活性),故本研究通过Logistic模型建立各产地的丹参样本对应的主成分(质控含量、生物活性)与归属等级之间的函数关系。根据丹参质控成分,生物活性等测定结果对实验数据进行初步分级,将其分成训练集和测试集2部分,运用SPSS 20.0统计软件对选定的训练集样本进行Logistic回归分析拟合方程,再对测试集样本进行分类预测。
3 结果与分析
3.1 定量测定
取31批丹参样品,按照“2.1.2”项下方法制备3份供试品溶液,精密吸取对照品溶液及供试品溶液各2 μL,注入液相色谱仪,以“2.2”项下色谱条件平行测定6次,记录峰面积和保留时间,计算各批次样品的平均质量分数。结果见表2。
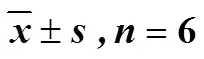
表2 31批丹参质控成分含量测定结果()
3.2 抗凝血活性测定
将31批丹参按“2.4.2”项下方法制备并稀释至质量浓度为8.50 mg/mL的溶液,按“2.4.3”项下方法测定各批次丹参的TT值,平行测定6次。通过效价定义公式计算不同批次丹参的生物效价,见图4。
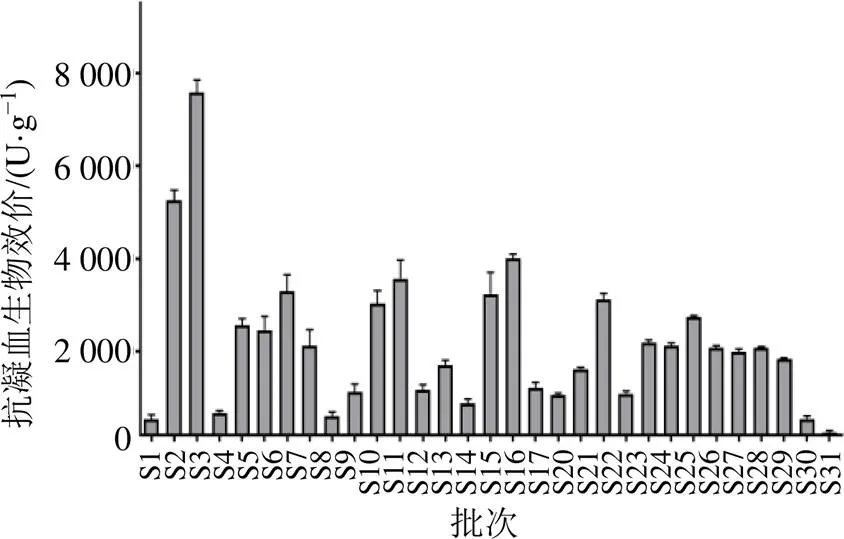
图4 31批丹参抗凝血生物活性测定结果(n=6)
3.3 抗氧化活性测定
取31批丹参样品,按“2.1.2”项下方法制备供试品溶液,以“2.4.7”“2.4.8”项下方法测定丹参体外抗氧化活性,平行测定3次。各批次羟自由基清除率结果见图5-A,DPPH自由基清除率结果见图5-B。
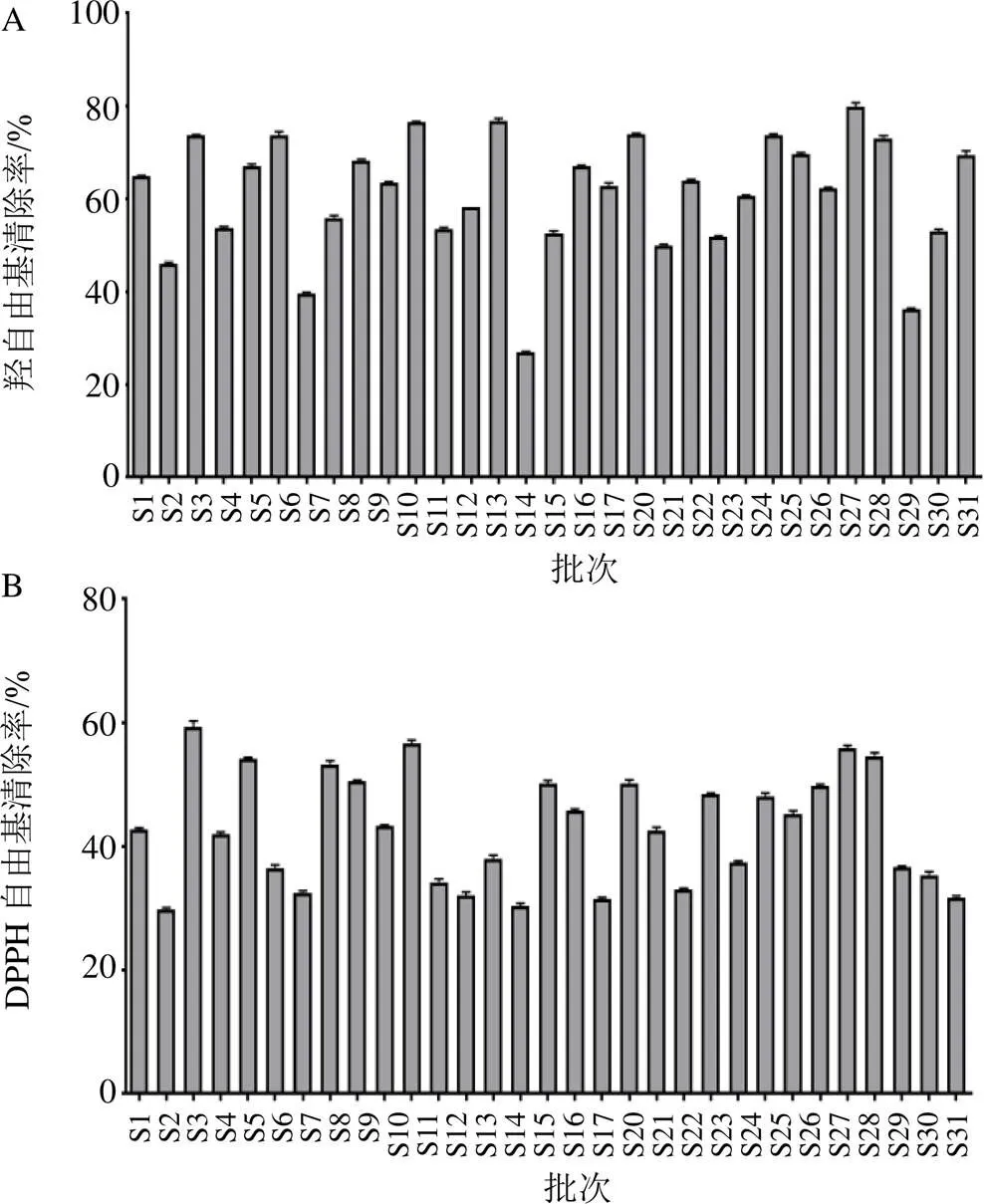
图5 31批丹参羟自由基清除率(A)和DPPH自由基清除率(B)测定结果(n=3)
3.4 等级评价
以“3.1”项下各个批次测定结果作为模式识别的基础,拟将丹参不同批次按照优(1)、良(2)、中(3)、差(4)4个等级分类,分别赋予响应值4、3、2、1。以SPSS软件对Logistic模型参数进行求解,得到模型表达式如下。
优=exp(−85.539+0.121×抗凝血TT+3.845×丹参酮IIA含量+1.166×丹酚酸B含量−0.240×抗氧化DPPH+0.119×抗氧化OH)/[1+exp(−85.539+0.121×抗凝血TT+3.845×丹参酮IIA含量+1.166×丹酚酸B含量−0.240×抗氧化DPPH+0.119×抗氧化OH)]
良=exp(69.307−0.461×抗凝血TT−12.857×丹参酮IIA含量+1.326×丹酚酸B含量−0.771×抗氧化DPPH−1.160×抗氧化OH)/[1+exp(69.307−0.461×抗凝血TT−12.857×丹参酮IIA含量+1.326×丹酚酸B含量−0.771×抗氧化DPPH−1.160×抗氧化OH)]
中=exp(118.369+1.223×抗凝血TT−3.453×丹参酮IIA含量+0.642×丹酚酸B含量−5.175×抗氧化DPPH+0.645×抗氧化OH)/[1+exp(118.369+1.223×抗凝血TT−3.453×丹参酮IIA含量+0.642×丹酚酸B含量−5.175×抗氧化DPPH+0.645×抗氧化OH)]
差=exp(−12.692−0.189×抗凝血TT+1.571×丹参酮IIA含量−1.056×丹酚酸B含量+1.272×抗氧化DPPH−0.152×抗氧化OH)/[1+exp(−12.692−0.189×抗凝血TT+1.571×丹参酮IIA含量−1.056×丹酚酸B含量+1.272×抗氧化DPPH−0.152×抗氧化OH)]
将不同批次丹参的丹酚酸B、丹参酮IIA含量和生物活性(抗凝血效价,抗氧化活性)等指标实测值代入回归模型表达式中,从而确定丹参等级(接近1则判定为该等级),各等级评价结果见表3。由表3可知,不同产地丹参饮片概率均达到90%以上,这说明该模型可以较好地对丹参饮片等级进行评价,其中,优级丹参有6个批次,良级有6个批次,中级有9个批次,其余为差级。而结合表1及表3结果,不难发现,本实验结果与初始定级标准基本相同,但丹参质量等级评价结果与丹酚酸B及丹参酮IIA含量测定结果不呈单纯的线性关系,这提示在判断丹参质量优劣的过程中还应将抗凝血、抗氧化等生物学指标划入考虑范围之内。
4 讨论
4.1 色谱条件优化
本实验考察了乙腈-水、乙腈-磷酸水、乙腈-醋酸水和乙腈-甲酸水作为色谱流动相,结果显示,乙腈-0.1%甲酸水的峰形最佳,分离效果优于其它流动相,故选择乙腈-0.1%甲酸水作为流动相;采用PDA检测器进行全波长扫描,发现在270 nm波长下,样品待测成分的峰型好,基线平稳,响应值高,因此选择270 nm波长作为本实验含量测定的检测波长。此外,还考察了体积流量和进样量对色谱峰峰形以及峰参数的影响,结果显示,体积流量0.2 mL/min,进样量2 μL时峰形最好。
表3 31批丹参的等级评价结果
4.2 测定生物活性的方法选择
现代药理研究表明,丹参水溶性成分有清除羟自由基的功效,能够抑制或降低脂质过氧化反应,起到防治心、脑血管病、肝病、肾脏病的作用[20],本实验选择测定其抗氧化能力作为生物活性评价指标之一。目前,用于评价药物抗氧化能力的方法很多[21-22],主要分为体内和体外2种,体内实验成本高且繁琐,动物个体差异影响大;而体外实验筛选法,具有简便、迅速、影响因素少的特点,适合于中药抗氧化能力的快速评价。据报道,不同中药与DPPH自由基反应达到平衡所需的时间不同,如维生素C与DPPH反应20 min即达到平衡[23],而丹参提取液与DPPH反应时间缓慢,故从实际操作角度出发,本研究确定在加入DPPH溶剂充分反应30 min后统一测定样品,此时样品的吸光度变化趋于平稳,保证测定的准确性。
丹参具有显著的活血化瘀作用[24],本研究通过体外对SD大鼠血浆进行TT测定来评价丹参的抗凝血能力。在实验操作过程中,为最大程度接近人体环境,采用生理盐水作为提取溶剂。为保证实验结果的准确性,本研究严格控制SD大鼠血浆和药物提取液的比例。实验结果表明,丹参对体外SD大鼠血浆TT值有明显的延长作用,且TT值与丹参剂量成依赖性,两者之间也存在明显的线性关系,因此,采用TT值来评价丹参体外抗凝血活性的方法具有较强的可行性。
4.3 Logistic回归模型选择
从模型的通用性和实用性考虑,具有一定数学表达式的模型更易于被理解和应用,其只需将实际数据输入数学表达式中即可计算出预测结果。故本研究采用Logistic回归模型来描述丹参投料饮片等级与影响因素(成分含量、生物活性)之间的映射关系,建立丹参投料饮片预测的数学表达式,计算影响因素属于各等级的概率,最终确定投料饮片等级。结果发现,Logistic回归模型对所选样本的拟合结果与实际结果基本一致,说明本研究所建立的模型可以表达投料饮片等级分类标准。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2015: 76-77.
[2] 蔡良, 徐雄飞, 谭灵芝, 等. 丹参药材产地筛选及炮制工艺的研究 [J]. 广东化工, 2016, 43(20): 93-94.
[3] 陈琴华, 王招玉, 熊琳, 等. 丹参的炮制工艺及分析方法研究 [J]. 中医药导报, 2016, 22(12): 54-57.
[4] 方芳, 王平珍, 邱芸. 中药丹参的临床研究进展 [J]. 内蒙古中医药, 2012, 31(19): 81-82.
[5] 李翔, 吴磊宏, 范骁辉, 等. 复方丹参方主要活性成分网络药理学研究 [J]. 中国中药杂志, 2011, 36(21): 2911-2915.
[6] 罗明, 陈梦洁, 宁艺, 等. 依那普利与丹参多酚酸注射液合用对慢性肺源性心脏病患者的临床实效性评价 [J]. 山西中医, 2015, 31(6): 22-24.
[7] 潘雪梅, 韦辉, 刘毅, 等. 不同产地丹参药材质量研究 [J]. 中草药, 2011, 42(9): 1833-1836.
[8] 邓寒霜, 王新军. 丹参药材分级标准验证实验 [J]. 药学进展, 2006, 30(1): 35-39.
[9] 王海, 严铸云, 沈昱翔, 等. 丹参药材的颜色特征与有效成分的相关性研究 [J]. 中药新药与临床药理, 2014, 25(3): 333-338.
[10] 李春霞, 余洁, 陆远富, 等. 丹参酮类心脑血管保护作用与机制的研究进展 [J]. 中国新药与临床杂志, 2016, 35(8): 542-546.
[11] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[12] 刘妍如, 唐志书, 宋忠兴, 等. 多元统计及“成分-靶点-疾病”在线关联分析脑心通胶囊中质量标志物 [J]. 中草药, 2018, 49(12): 2775-2785.
[13] 范华英. 丹酚酸A抗血小板及抗血栓作用的研究 [D]. 长春: 吉林大学, 2012.
[14] 王研, 温新宝, 秦翠萍, 等. 丹参提取物体外抗氧化活性研究 [J]. 西北农业学报, 2011, 20(11): 160-163.
[15] 谈利红, 杨宗发, 张丹, 等. 中药抗氧化活性成分及评价方法研究进展 [J]. 亚太传统医药, 2017, 13(10): 35-37.
[16] 肖珠, 王志斌, 程源, 等. 益心通络胶囊体外抗凝血的生物活性测定法研究 [J]. 实验动物科学, 2017, 34(3): 20-23.
[17] 闫亚峰, 宋忠兴, 刘妍如, 等. 基于“生物活性-质量标志物”关联的红花等级评价研究 [J]. 中草药, 2019, 50(19): 4683-4690.
[18] 李晓红, 刘妍如, 唐志书, 等. 基于“生物活性-质量标志物”关联的赤芍饮片等级评价方法研究 [J]. 中草药, 2020, 51(10): 2611-2617.
[19] 江大海, 刘妍如, 王梅, 等. 基于二分类Logistic回归分析的桂枝等级预测研究 [J]. 中草药, 2019, 50(19): 4697-4704.
[20] 高兵. 丹参的药理作用及临床应用分析 [J]. 中国现代药物应用, 2018, 12(1): 196-197.
[21] 肖覃, 杨思敏, 胡闽, 等. 丹参-葛根提取物抗氧化能力与活性成分的相关性研究 [J]. 精细化工中间体, 2018, 48(1): 49-54.
[22] 李晶, 沈震亚, 陈超, 等. 南丹参中酚酸类成分抗氧化活性谱效关系研究 [J]. 时珍国医国药, 2017, 28(12): 2895-2897.
[23] 余兰彬, 徐国良, 谭志伟, 等. DPPH法对5种抗衰老中药抗氧化活性的研究 [J]. 江西中医药, 2016, 47(8): 74-76.
[24] 穆娟, 赵明峰, 李玉明. 丹参在药理作用的研究现况 [J]. 当代医学, 2017, 23(27): 182-184.
Grade evaluation ofbased on correlation of “quality marker-biological activity”
YANG Ning-juan1, LIU Yan-ru1, TANG Zhi-shu1, SONG Zhong-xing1, DUAN Jin-ao4, CHEN Lin1, LIU Feng2, CHEN Yan-bin3, XU Gang3, SHI Xin-bo1
1. Drugsand ChineseMedicineFoundationResearch, Xianyang 712083, China 2. Shaanxi International Business College, Xianyang 712083, China 3. Shaanxi Buchang Pharmaceutical Co., Ltd. Xi’an 710075, China 4. Jiangsu Key Laboratory for Traditional Chinese Medical Formula Research, Collaborative Innovation Center of Chinese Medicinal Resources Industrialization of Jiangsu Province, Nanjing University of Chinese Medicine, Nanjing 210023, China
A logistic regression model for grade evaluation ofmedicinal slices was constructed based on the quality control idea of traditional Chinese medicines that “ingredients reflect activity and activity expresses effect”.Q-marker content inwas tested by ultra-high performance liquid chromatography (UPLC). Thrombin time (TT) inhibition rate of hydroxyl radical and DPPH clearance rate were used as evaluation indexes of biological activity. Correlations between quality control indexes and bioactivity indexes were analyzed by the logistic algorithm. Finally, A Logistic regression model was established.The results of Logistic model showed that 31 batches ofmedicinal slices were divided into four grades: excellent, good, medium and poor.values of sample grade prediction were higher than 90%, indicating the high accuracy and prediction ability of the Logistic model.The Logistic model based on content determination and biological activity can be used to evaluate quality ofand provide some reference for quality control.
Bge.;binary logistic regression analysis;bioactivity; UPLC; Q-marker
R286.2
A
0253 - 2670(2021)04 - 1135 - 08
10.7501/j.issn.0253-2670.2021.04.027
2020-06-08
陕西省“特支计划”青年拔尖人才项目;国家中药标准化项目(ZYBZH-C-QIN-45);基于多维整合分析策略的盘龙七片质量标志物发现与大品种技术提升研究(2020ZDLSF05-08)
杨宁娟(1994—),女,硕士研究生,研究方向为中药药剂。Tel: 18291009983 Email: ynj214218@163.com
刘妍如,女,副教授,硕士生导师,主要从事药物分析研究。Tel: (029)38182207 Email: yanzi_2203@aliyun.com
唐志书,男,教授,硕士生导师,主要从事中药制剂制备技术的研究。Tel: (029)38185060 Email: tzs6565@163.com.
[责任编辑 时圣明]

