蔬菜作物中类胡萝卜素研究进展
刁卫楠 朱红菊 刘文革

摘 要:类胡萝卜素是一种重要的天然色素,广泛存在于动植物以及微生物体内,是人体维生素A的主要来源,对人类健康具有重要作用。在蔬菜作物中,不同种类和含量的类胡萝卜素赋予其颜色的多样性。植物类胡萝卜素积累是一个复杂的过程。它与有色体发育有关,由多个结构基因和转录因子调控,还受环境因素影响。本文对蔬菜作物中类胡萝卜素的合成代谢途径及其影响因子进行概述,以期为蔬菜作物的外观及营养品质改良提供理论依据。
关键词:蔬菜作物;类胡萝卜素;积累;颜色
中图分类号:S63+S64+S65 文献标志码:A 文章编号:1673-2871(2021)01-001-08
Research progress on carotenoids in vegetable crops
DIAO Weinan, ZHU Hongju, LIU Wenge
(Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou 450009, Henan, China)
Abstract: Carotenoid is an important natural pigment, which widely exists in animals, plants and microorganisms. It is the main source of human vitamin A and plays an important role in human health. The variety and content of carotenoids in vegetable crops are different, which endows them with color diversity. Carotenoid accumulation in plants is a complex process. It is related to the development of chromoplast, regulated by many structural genes and transcription factors, and also affected by environmental factors. In this paper, the pathway of carotenoid biosynthesis and its influencing factors in vegetables crops are systematically introduced, in order to provide theoretical basis for improving the appearance and nutritional quality of vegetable crops.
Key words:Vegetables crops; Carotenoids; Accumulation; Color
類胡萝卜素是一类重要的天然色素的总称,它是一种含有40个碳的类异戊烯聚合物, 即四萜化合物。最典型的类胡萝卜素是由8个异戊二烯单位首尾相连形成。类胡萝卜素的颜色因共轭双键的数目不同而变化,共轭双键的数目越多,颜色越偏向红色[1]。类胡萝卜素是体内维生素A的主要来源,由于人体自身不能合成类胡萝卜素,必须通过外界摄入。当人体摄入类胡萝卜素时,一些类胡萝卜素被分解成维生素A前体,而缺乏维生素A的儿童可能有严重的视力问题,如夜盲症[2]。类胡萝卜素还具有抗氧化作用,其抗氧化能力对人类健康具有特别重要的意义。饮食中摄入类胡萝卜素对一些广泛而典型的现代文明疾病具有一定的预防和保护作用,可作为自由基清除剂,如预防多种退行性疾病、心血管疾病和癌症等[3]。目前约700种天然类胡萝卜素的化学结构已被鉴定,这些类胡萝卜素与黄色、橙色、红色等有关[4]。在蔬菜作物中,类胡萝卜素的主要存在形式有β-胡萝卜素、叶黄素、番茄红素、β-隐黄质、八氢番茄红素、六氢番茄红素等,在多种蔬菜颜色形成方面占据重要地位,如在番茄、胡萝卜、西瓜等蔬菜中丰富的类胡萝卜素导致了其颜色多样化。
1 蔬菜作物中类胡萝卜素的积累
1.1 蔬菜作物中类胡萝卜素的积累
大多数蔬菜中都富含类胡萝卜素,如番茄、西瓜、甜瓜、胡萝卜、马铃薯等,类胡萝卜素种类和含量的不同导致了蔬菜作物颜色的多样化。番茄被认为是研究类胡萝卜素相关代谢过程的模式植物,类胡萝卜素在不同颜色番茄中的种类和含量各不相同。研究表明,番茄果实中至少含有12种类胡萝卜素,在其成熟果实中主要有番茄红素、β-胡萝卜素和叶黄素,其中番茄红素占主导地位[5]。康保珊[6]发现,番茄黄肉突变体材料‘PI114490与已知的番茄r突变体‘LA3532中的类胡萝卜素组成及含量相似,主要积累叶黄素和β-类胡萝卜素。Nicolle等[7]对20个不同胡萝卜品种中的类胡萝卜素组分和含量研究发现,在紫色和黄色品种中主要含有叶黄素和β-胡萝卜素,在白色品种中几乎不含类胡萝卜素,橙色品种中主要是β-胡萝卜素。玉米黄素、叶黄素、新黄质、紫黄质是黄肉马铃薯中主要存在的类胡萝卜素,白肉马铃薯和黄肉马铃薯具有相似的类胡萝卜素组分,但是由于类胡萝卜素含量的不同导致其颜色不同[8-9]。西瓜中类胡萝卜素种类丰富,Tadmor等[10]发现,橙黄瓤西瓜中含有大量β-胡萝卜素及少量的番茄红素,红瓤西瓜中积累了大量的番茄红素;Bang等[11]发现,在淡黄瓤果肉中主要含新黄质和紫黄质;Li等[12]发现,在西瓜果皮中的色素主要是叶绿素,几乎不含类胡萝卜素。
1.2 类胡萝卜素在蔬菜作物中积累的场所——有色体
质体是类胡萝卜素代谢的场所,在控制胡萝卜素生物活性、类胡萝卜素稳定性和色素多样性方面起着关键作用。根据其不同的形态和功能,质体可分为若干亚型,包括前质体、黄质体、叶绿体、白色体和有色体[13]。不同类型的质体具有不同的合成和积累类胡萝卜素的能力,不同质体的独特功能决定了类胡萝卜素代谢的调控网络,从而导致植物器官中类胡萝卜素的数量增多和种类多样化。除原质体外,所有质体都有生产类胡萝卜素的能力,在绿色植物组织中,类胡萝卜素的生物合成主要发生在叶绿体内膜和类囊体双层中。叶绿体虽然能够积累大量的叶黄素、β-胡萝卜素、紫黄质和新黄质,但叶绿体的绿色掩盖了它们特有的黄色/橙色[14]。有色体主要在不同的水果和蔬菜中合成和积累多种类胡萝卜素化合物,是大量合成和贮存类胡萝卜素的主要质体,形成了合成和积累大量类胡萝卜素的独特机制[15]。
有色体具有多种形态,主要来源于已有的叶绿体或其他非光合质体,如前质体、白色体。在大多数植物中,类胡萝卜素类物质被认为是在有色体的脂蛋白隔离亚结构或质体球滴结构中产生的[16-17]。这些类胡萝卜素隔离亚结构在有色体大量积累类胡萝卜素中起着两个作用:一个作用是促进新合成的类胡萝卜素的分离,以稳定贮存;另一个作用是避免类胡萝卜素生物合成部位的最终产物过载,以实现连续生物合成[18-19]。根据贮存亚结构的变化,有色体被分为5种主要的类型,即球状、结晶状、膜状、纤维状、网状和管状[20]。球状有色体的特征是质体球的堆积,大多数蔬菜作物,如辣椒中含有丰富的质体球滴结构[21]。晶状有色体通常与晶体结构中β-胡萝卜素和番茄红素的超积累有关,典型的如番茄和胡萝卜根中发现的有色体类型[22-23]。在同一有色体中经常发现不止一种类型的类胡萝卜素隔离亚结构,袁平丽[24]发现,在不同倍性的西瓜果肉中有色体以球状、管状等多种形态存在。有色体的形成是一个复杂的过程,有研究表明,有色体的发育与细胞膜增殖有关,而活性脂肪酸的生物合成和脂质代谢则是细胞膜增殖的关键。在番茄有色体发育过程中参与脂肪酸生物合成的有色体编码基因accD的高水平表达,表明脂质的合成在有色体发育中具有重要作用[25]。在花椰菜中发现一个Or基因的功能与一个细胞过程有关,该过程触发前质体或其他非彩色质体分化为有色体,从而积累类胡萝卜素[26]。在马铃薯中进行Or基因的转基因试验也表明,Or基因确实控制着有色体的分化,并且通过对有色体形成的调控可以间接对植物类胡萝卜素的积累产生深远的影响[27]。此后,在对胡萝卜的研究中发现,Or基因的一个突变被认为影响了有色体的结构进而影响了类胡萝卜素的合成与贮藏[28]。尽管许多因素和过程都影响和控制着有色体的分化和发育,目前关于控制有色体发育的相关基因和途径在很大程度上仍未可知。
1.3 蔬菜作物中有色体与类胡萝卜素积累的关系
有色体作为园艺作物花、果、根中合成和积累类胡萝卜素的主要质体,在不同的植物器官中积累的类胡萝卜素种类和含量各不相同。Zhang等[29]在西瓜中鉴定出一种属于PHT4转运蛋白家族中的Pi转运蛋白ClPHT4;2,它可以在胞质和有色体之间转运Pi,在有色体发育过程中起着重要作用,ClPHT4;2基因的高表达与不同西瓜材料中类胡萝卜素含量的增加顯著相关。在西瓜果实成熟过程中,许多类胡萝卜素球从塌陷的色素质体中释放到细胞质中,并在有色的果肉细胞中积累,类胡萝卜素在有色体发育过程中的高积累导致有色体破裂,这在西瓜瓤色发育过程中十分必要。Tzuri等[30]发现,甜瓜中的一个‘Golden SNP导致CmOr蛋白中高度保守的精氨酸变成组氨酸,从而导致β-胡萝卜素的积累。Chayut等[31]的进一步研究发现了一个CmOr无义突变(CmOr lowb),它降低了水果中β-胡萝卜素的含量。Cmor-lowb在开花后30 d至成熟期间抑制了果实中有色体的形成和叶绿体的解体,表明Cmor调节了叶绿体向有色体的转化,影响了类胡萝卜素的含量。有色体在不同蔬菜作物中以不同的形态存在,且在同一作物同一器官中可能存在多种形态的有色体共同调控类胡萝卜素的合成和贮藏。
2 蔬菜作物中类胡萝卜素的合成途径
2.1 类胡萝卜素前体的合成
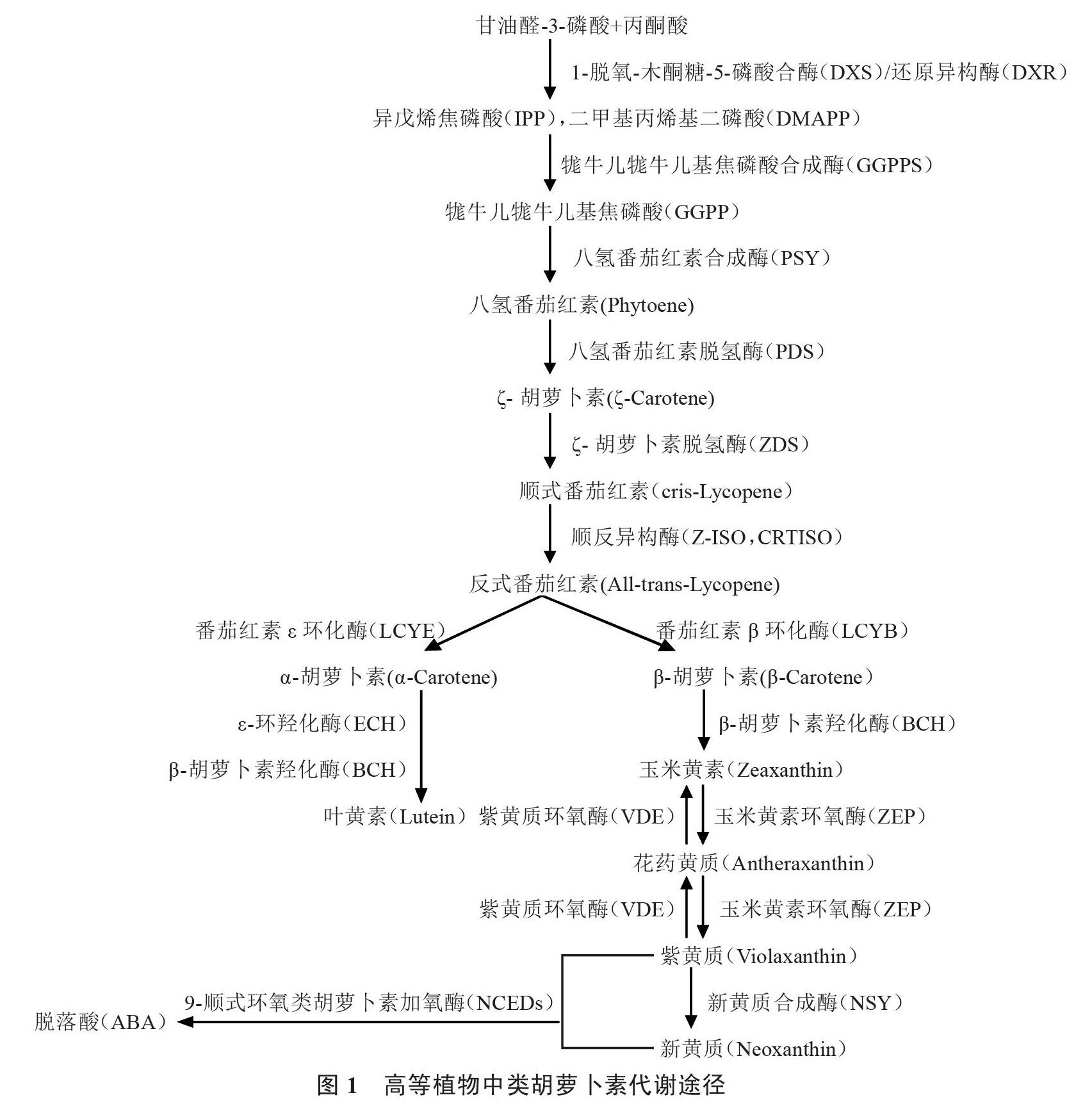
类胡萝卜素的前体物质是异戊烯焦磷酸(IPP)和二甲基丙烯基二磷酸(DMAPP),前体物质的合成主要来自两个途径:2-C-甲基-D-赤藻糖醇-4-磷酸(2-C-Methyl-D-erythritol 4-phosphate,MEP)途径和甲羟戊酸(MVA)途径。MEP途径是在植物细胞器质体中和真菌中发生,MVA途径主要在植物细胞液中和细菌中发生,而在园艺植物中类胡萝卜素的合成和积累主要发生在质体中,因此,在蔬菜作物中类胡萝卜素前体主要通过MEP途径合成[32-33]。MEP途径即丙酮酸和3-磷酸甘油醛通过缩合反应生成1-脱氧-木酮糖-5-磷酸(DXP),并通过1-脱氧-D-木酮糖-5-磷酸合酶(DXS)和5-磷酸脱氧木酮糖还原异构酶(DXR)催化反应生成控制牻牛儿牻牛儿基焦磷酸(GGPP)合成的前体IPP和二甲基丙烯基二磷酸(DMAPP)。IPP和DMAPP通过缩合反应生成牻牛儿焦磷酸(C10),然后在牻牛儿牻牛儿基焦磷酸合成酶(GGPPS)的作用下生成牻牛儿牻牛儿基焦磷酸(GGPP)。
2.2 蔬菜作物中类胡萝卜素的合成
目前关于类胡萝卜素相关合成途径已经比较清楚,笔者根据以往研究对类胡萝卜素的合成通路进行了总结(图1),从GGPP生成第一个类胡萝卜素的物质八氢番茄红素,再经脱氢、环化、羟基化、环氧化等转变为其他类胡萝卜素[34]。即2分子的GGPP在质体中进行缩合反应,并在八氢番茄红素合成酶(PSY)的作用下生成15-顺式-八氢番茄红素(phytoene),此为类胡萝卜素生物合成的第一步,同时也是限速步骤,PSY是此过程中的限速酶。八氢番茄红素在八氢番茄红素脱氢酶(PDS)的作用下生成ζ-胡萝卜素(ζ-carotene),然后在ζ-胡萝卜素脱氢酶(ZDS)的催化作用下形成顺式番茄红素(cris-lycopene)。因为类胡萝卜素在自然界中主要以反式结构存在,因此异构化作用也是类胡萝卜素合成的关键一步,顺式番茄红素在类胡萝卜素异构酶(Z-ISO,CRTISO)的催化下形成红色的反式番茄红素[35],其中CRTISO异构酶的活性取决于黄素腺嘌呤二核苷酸(FAD)结合基序,该基序与辅助因子(FADred)的还原形式结合,进而催化异构反应[36]。
番茄红素环化是类胡萝卜素合成过程中的一个重要分支点,反式番茄红素在番茄红素环化酶(LCYE和LCYB)的催化下进行环化反应分别生成α-胡萝卜素和β-胡萝卜素,该反应是类胡萝卜素代谢的关键步骤,番茄红素的环化产生了类胡萝卜素的多样性。在α支路上,α-胡萝卜素在β-胡萝卜素羟化酶(BCH)和ε-环羟化酶(ECH)等环羟化酶的共同催化作用下生成叶黄素[37]。在β支路上,β-胡萝卜素经过一次BCH羟基化反应生成β-隐黄质,β-隐黄质再经羟基化生成玉米黄质,然后在玉米黄素环氧酶(ZEP)的作用下生成紫黄质,紫黄质在新黄质合成酶(NSY)的催化下生成新黄质,也是该支路上的最后一个产物,紫黄质和新黄质被认为是ABA合成的前体物质[38-39]。
3 蔬菜作物中类胡萝卜素的合成调控
3.1 关键酶基因对蔬菜作物中类胡萝卜素合成的调控
类胡萝卜素的合成受到多方面的调控,在很多研究中发现其直接受到类胡萝卜素相关合成基因和酶的直接调控。八氢番茄红素合成酶(PSY)是类胡萝卜素合成途径上游中关键的调节酶,同样也是一种重要的限速酶,在类胡萝卜素合成中占据重要地位。在拟南芥中,ORANGE(OR)蛋白被证明是PSY的转录后调节因子,通过调节PSY的水平来控制类胡萝卜素的合成[40];后来的研究发现,OR通过保持PSY以适当的折叠方式和防止PSY被Clp蛋白酶降解来调节PSY的水平和活性[41]。在番茄中发现3个PSY 基因(PSY1、PSY2、PSY3),PSY2是叶组织特异表达基因,参与叶中的类胡萝卜素合成;PSY3则被认为是在胁迫条件下的根中起作用;而PSY1基因被定位在3号染色体上,在番茄成熟果实中上调表达,是PSY多基因家族中主要针对果实中类胡萝卜素合成的基因,能够促进番茄果实中番茄红素的积累[42-43],同时也表明不同PSY亚型的表达谱表现出组织特异性。Nakkanong等[44]发现,在南瓜中,PSY1基因在果实发育早期表现出较高的表达水平,这可能会触发果实中的类胡萝卜素积累的增加,导致果实类胡萝卜素含量增加。对不同亚型的PSY蛋白活性及它们的氨基酸残基的研究较少,Cao等[45]以番茄PSY亚型PSY1和PSY2为研究对象,通过定点突变分析和三维结构建模对PSY蛋白进行检测,发现一个PSY核心结构中相邻的芳香族化合物对PSY的高活性至关重要。
无色八氢番茄红素经过八氢番茄红素脱氢酶(PDS)、ξ-胡萝卜素脱氢酶(ZDS)催化脱氢和类胡萝卜素异构酶(CRITSO)催化异构形成红色的反式番茄红素。PDS和ZDS都是膜结合电子受体,在黄素结合基序处结合氧化还原活性辅因子,可以作为胡萝卜素去饱和酶进行氧化还原进而调节类胡萝卜素的生物合成[46]。在番茄中PDS被定位在3号染色体上,ZDS被定位在1号染色体上,且通过对PDS、ZDS进行沉默等发现PDS、ZDS的表达与类胡萝卜素(尤其是番茄红素)的积累成正相关[47-48]。
目前,自然界中的类胡萝卜素大多以反式结构稳定存在,类胡萝卜素异构酶(CRITSO)是催化类胡萝卜素顺反转化的关键酶,能够将番茄红素从顺式构象异构为全反式构象。在番茄中,CRTISO 被定位在10号染色体上,该基因在tangerine突变体的定位中被发现,其突变导致番茄果肉颜色由红色变成橙色[49]。在西瓜中CRTISO基因主要在西瓜成熟果肉中表达,差异表达基因与果肉的颜色无明显相关性,但对其CDSs序列分析的結果表明,CRTISO基因的自然突变可能调节了橙色果肉西瓜品种中原番茄红素的积累[50]。Su等[51]发现,在大白菜中BrCRTISO功能的缺失导致了大白菜内叶中原番茄红素的积累、类胡萝卜素代谢途径中上游合成基因的上调和下游降解基因的下调,有助于促进大白菜内头叶呈现出橙色。在黄瓜中橙色果肉的形成则可能是or基因或BCH1基因的调控[52]。通过对胡萝卜中类胡萝卜素生物合成基因与胡萝卜中类胡萝卜素含量与组分关系的研究发现,总类胡萝卜素含量和β-胡萝卜素含量与ZEP、PDS和CRTISO基因表达显著相关[53]。CRTISO方面的研究在一定程度上弥补了CRTISO在基因功能等方面的研究空白,但其相关功能仍需进一步挖掘。
类胡萝卜素代谢过程中番茄红素的环化是一个重要的分界点,LCYB是催化β-胡萝卜素合成的酶,LCYE是催化α-胡萝卜素生成的一类重要的酶。其中,LCYB基因在西瓜上被定位在4号染色体上,Bang等[54]对亮黄瓤与红瓤西瓜中LCYB的cDNA全长序列进行比较,发现其编码区存在3个单核苷酸多态性(SNP)位点,这些SNPs表现出与瓤色的表现型完全共分离,表明LCYB可能是亮黄瓤或红瓤颜色的遗传因子。豆峻岭等[55]通过对无籽西瓜果实发育过程中番茄红素合成代谢酶基因表达的分析发现,LCYB在控制果实瓤色发育中具有重要作用。Wang等[56]发现,LCYB基因可能在蛋白质水平上调控果实颜色的变化,并利用果肉颜色特异性CAPS标记,建立了一套新的西瓜红、黄果色标记辅助选择系统。LCYE和LCYB是两种存在相互竞争关系的酶,Diretto等[57]发现在马铃薯中对LCYE基因进行沉默,能够导致马铃薯中β-胡萝卜素的增加。由此可见,番茄红素环化酶在类胡萝卜素的组成和含量中占据重要地位,可以通过调节相关环化酶基因来使类胡萝卜素的代谢偏向某一通路或支路进而影响类胡萝卜素的合成。
3.2 转录因子调控对蔬菜作物中类胡萝卜素合成的调控
类胡萝卜素相关转录因子的调控研究逐渐成为研究的一大热点。目前已经发现很多转录因子直接或间接参与蔬菜中类胡萝卜素的相关合成与代谢,主要有MYB家族、BBX家族、NAC家族、MADS-box家族、AP2/ERF家族等。MYB家族、BBX家族及NAC家族中的一些转录因子通过调节或结合类胡萝卜素的相关合成基因来直接调控蔬菜作物中类胡萝卜素的积累;MADS-box家族、AP2/ERF家族中的一些转录因子则是通过调节作物的成熟来间接影响类胡萝卜素的合成(表1)。MADS-box家族的RIN转录因子目前在番茄中研究得比较深入,番茄rin果实突变体中乙烯合成不足导致有色体发育异常,RIN转录因子通过影响果实成熟来影响类胡萝卜素的积累。rin (ripening inhibitor),nor(non-ripening) and Cnr(Colorless non-ripening)是番茄中常见的突变体,Wang等[58]对这些突变体的功能和遗传相互作用进行研究,发现rin和nor在调控果实成熟过程中具有可加性,Cnr等位基因是rin和nor的上位性基因。在番茄中发现一种RIN-MC融合基因,该基因被翻译为一种调控多种成熟基因表达的嵌合转录因子,该转录因子定位于细胞核内,能够与其他MADS-box因子发生蛋白质相互作用,但RIN-MC融合基因在rin突变体中的可能功能尚不清楚[59]。
3.3 环境因素对蔬菜作物中类胡萝卜素合成的影响
各种环境因素在植物生长过程中至关重要,在果实发育过程中也有着不可或缺的作用。李岩等[69]发现,在番茄中红光和红蓝组合光能够通过提高番茄红素生物合成关键酶基因GGPS和PSY1的转录水平和活性,促进果实中番茄红素的合成;王曼曼等[70]發现,番茄果实在着色期会受到高温、低温环境影响;高温条件下可使番茄果实提早转色,但同时也导致果实中的类胡萝卜素含量一直维持在转色期水平,严重影响果实中番茄红素的积累,而温度过低则会造成果实无法转色,同时也发现光照对番茄果实中的类胡萝卜素积累整体影响不大,但是高光条件能够促进果实加速转色。其他因素如种植地区、季节等因素都会影响植物果实中类胡萝卜素的生成,袁平丽等[71]发现在河南新乡、新疆昌吉两地种植的西瓜中番茄红素含量具有明显差异。
在采后处理过程中,环境因素尤其是温度对部分果蔬中类胡萝卜素的积累也有很大影响。Pola等[72]在不同温度下对辣椒进行采后处理,在30 ℃时辣椒中的叶绿素迅速降解并且变红,在20 ℃时则呈橙红色,并且在30 ℃时类胡萝卜素含量较高,与类胡萝卜素合成相关的基因(如PSY、LCYB等)表达上调。Alba等[73]发现,光敏色素对番茄果实的成熟具有不同的调节作用,对收获的成熟绿色果实进行短暂的红光处理,可促进果实中番茄红素含量的增加。采后处理在果蔬生产中占据重要地位,研究不同因素对果蔬中类胡萝卜素含量的影响有助于为产品的贮藏及运输等提供参考。
4 展 望
蔬菜的营养价值随着人们对营养健康的关注被不断挖崛,由于类胡萝卜素种类的多样性及其对人体的重要生理意义,与其相关的研究越来越深入。质体是类胡萝卜素代谢的场所,不同的质体类型都对类胡萝卜素的合成和积累具有很大的影响,可以通过调控质体的发生来影响类胡萝卜素的相关合成和积累进而改善蔬菜品质。蔬菜作物中主要存在的质体类型是有色体,有色体的独特能力为类胡萝卜素的大量合成和积累提供了可能,越来越多的证据显示质体中的隔离亚结构及球滴结构对类胡萝卜素的生物合成和积累具有重要作用。功能基因组学相关工具的普及使人们对有色体的发育机制有了新的认识,目前有许多因素(如植物激素、糖)在蔬菜发育过程中调控有色体的分化,进而影响类胡萝卜素积累,但具体调控机制仍不清楚,需要进一步深入研究。
随着各种园艺作物基因组、转录组及代谢组等相关数据的逐渐完善,类胡萝卜素合成途径中相关的基因和酶也逐渐被广泛研究,人们对类胡萝卜素的研究也更加全面与深入,已经不单单局限于关键酶基因的克隆与验证及各种化合物测定等方面。许多因子在不同水平上影响类胡萝卜素的相关调控。目前对类胡萝卜素的合成途径已经有了比较清晰的认识,但对途径中的关键酶基因的相关调控机制尚待进一步阐明。类胡萝卜素通路基因的转录调控是园艺作物研究的重点,已被证明在调节类胡萝卜素含量和成分方面具有重要意义。尽管目前已经发现许多与类胡萝卜素调控相关的转录因子,但这些转录因子在其调控类胡萝卜素的合成过程中处于什么地位,具体调控哪个类胡萝卜素合成基因,或者通过什么途径或物质来调控类胡萝卜素合成基因,尚不清楚,有待深入研究。对类胡萝卜素代谢、调节和类胡萝卜素衍生物作用的认识仍在发展中。随着类胡萝卜素相关调控新基因及转录因子的不断挖掘,将会为培育富含类胡萝卜素的蔬菜新品种以及相关栽培技术等方面提供充分的依据,从而有效提高作物中类胡萝卜素含量和稳定性,以有利于改善人类营养和健康。
参考文献
[1] 胡珂,李娜.倍受青睐的抗氧化家族:类胡萝卜素[J].大学化学,2010,25(S1):94-98.
[2] SHERWIN J C,REACHER M H,DEAN W H,et al.Epidemiology of vitamin A deficiency and xerophthalmia in at-risk populations[J].Transactions of the Royal Society of Tropical Medicine and Hygiene,2012,106(4):205-214.
[3] FIEDOR J,BURDA K.Potential role of carotenoids as antioxidants in human health and disease[J].Nutrients,2014,6(2):466-488.
[4] GROTEWOLD E.The genetics and biochemistry of floral pigments[J].Annual Review of Plant Biology,2006,57:761-780.
[5] SRIVASTAVA S,SRIVASTAVA A K.Lycopene;chemistry,biosynthesis,metabolism and degradation under various abiotic parameters[J].Journal of Food Science and Technology,2015,52(1):41-53.
[6] 康保珊.番茄材料PI114490黄色果肉形成的分子分析[D].北京:中国农业大学,2014.
[7] NICOLLE C,SIMON G,ROCK E,et al.Genetic variability influences carotenoid,vitamin,phenolic,and mineral content in white,yellow,purple,orange,and dark-orange carrot[J].The Journal of the American Society for Horticultural Science,2004,129(4):523-529.
[8] HAYNES K G,CLEVIDENCE B A,RAO D,et al.Inheritance of carotenoid content in tetraploid × diploidpotato crosses[J].The Journal of the American Society for Horticultural Science,2011,136(4):265–272.
[9] BROWN C R,CULLEY D,YANG C-P,et al.Variation of anthocyanin and carotenoid contents and associated antioxidant values in potato breeding lines[J].The Journal of the American Society for Horticultural Science,2005,130(2):174-180.
[10] TADMOR Y,KING S,LEVI A DAVIS A,et al.Comparative fruit colouration in watermelon and tomato[J].Food Research International,2005,38(8/9):837-841.
[11] BANG H,DAVIS A R,KIM S,et al.Flesh color inheritance and gene interactions among canary yellow,pale yellow,and red watermelon[J].The Journal of the American Society for Horticultural Science,2010,135(4):362-368.
[12] LI B B,ZHAO S J,DOU J I,et al.Genetic mapping and development of molecular markers for a candidate gene locus controlling rind color in watermelon[J].Theoretical and Applied Genetics,2019,132(10):2741-2753.
[13] LOPEZ-JUEZ E,PYKE K A.Plastids unleashed:their development and their integration in plant development[J].International Journal of Developmental Biology,2005,49(5/6):557-577.
[14] SUN T,YUAN H,CAO H,et al.Carotenoid metabolism in plants:The role of plastids[J].Molecular Plant,2018,11(1):58-74.
[15] LI L,YUAN H,ZENG Y L,et al.Plastids and carotenoid accumulation[J].Subcellular Biochemistry,2016,79:273-293.
[16] DERU?RE J,R?MER S,D'HARLINGUE A,et al.Fibril assembly and carotenoid overaccumulation in chromoplasts:a model for supramolecular lipoprotein structures[J].The Plant Cell,1994,6(1):119-133.
[17] SCHWEIGGERT R,CARLE R.Carotenoid deposition in plant and animal foods and its impact on bioavailability[J].Critical Reviews in Food Science and Nutrition,2017,57(9):1807-1830.
[18] YUAN H,ZHANG J,NAGESWARAN D,et al.Carotenoid metabolism and regulation in horticultural crops[J].Horticulture Research,2015,2(1):102-109.
[19] LI L,YUAN H.Chromoplast biogenesis and carotenoid accumulation[J].Archives of Biochemistry and Biophysics,2013,539(2):102-109.
[20] EGEA I,BARSAN C,BIAN W,et al.Chromoplast differentiation:current status and perspectives[J].Plant Cell Physiology,2010,51(10):1601-1611.
[21] FREY-WYSSLING A,KREUTZER E.The submicroscopic development of chromoplasts in the fruit of Capsicum annuum L.[J].Journal of Ultrastructure Research,1958,1(4):397-411.
[22] ROSSO S W.The ultrastructure of chromoplast development in red tomatoes[J].Journal of Ultrastructure Research,1968,25(3):307-322.
[23] KIM J E,RENSING K H,DOUGLAS C J,et al.Chromoplasts ultrastructure and estimated carotene content in root secondary phloem of different carrot varieties[J].Planta,2010,231(3):549-558.
[24] 袁平麗.多倍体西瓜发育过程中番茄红素变化及关键酶基因表达[D].北京:中国农业科学院,2012.
[25] KAHLAU S,BOCK R.Plastid transcriptomics and translatomics of tomato fruit development and chloroplast-to-chromoplast differentiation: chromoplast gene expression largely serves the production of a single protein[J].Plant Cell,2008,20(4):856-874.
[26] LU S,VAN ECK J,ZHOU X,et al.The cauliflower Or gene encodes a DnaJ cysteine-rich domain-containing protein that mediates high levels of beta-carotene accumulation[J].Plant Cell,2006,18(12):3594-36605.
[27] LOPEZ A B,VAN ECK J,CONLIN B J,et al.Effect of the cauliflower Or transgene on carotenoid accumulation and chromoplast formation in transgenic potato tubers[J].Journal of Experimental Botany,2008,59(2):213-223.
[28] ELLISON S L,LUBY C H,CORAK K E,et al.Carotenoid presence is associated with the Or gene in domesticated carrot[J].Genetics,2018,210(4):1497-1508.
[29] ZHANG J,GUO S G,REN Y,et al.High-level expression of a novel chromoplast phosphate transporter ClPHT4;2 is required for flesh color development in watermelon[J].New Phytologist,2017,213(3):1208-1221.
[30] TZURI G,ZHOU X,CHAYUT N,et al.A ‘golden SNP in CmOr governs the fruit flesh color of melon (Cucumis melo)[J].The Plant Journal,2015,82(2):267-279.
[31] CHAYUT N,YUAN H,OHALI S,et al.Distinct mechanisms of the ORANGE protein in controlling carotenoid flux[J].Plant Physiology,2017,173(1):376-389.
[32] EISENREICH W,BACHER A,ARIGONI D, et al. Biosynthesis of isoprenoids via the non-mevalonate pathway[J].Cellular and Molecular Life Sciences,2004,61(12):1401-1426.
[33] RODR?GUEZ-CONCEPCIóN M,BORONAT A.Elucidation of the methylerythritol phosphate pathway for isoprenoid biosynthesis in bacteria and plastids.A metabolic milestone achieved through genomics[J].Plant Physiology,2002,130(3):1079-1089.
[34] NISAR N,LI L,LU S,et al.Carotenoid metabolism in plants[J].Molecular Plant,2015,8(1):68-82.
[35] CAZZONELLI C I,POGSON B J.Source to sink:regulation of carotenoid biosynthesis in plants[J].Trends Plant Science,2010,15(5):266-274.
[36] YU Q,GHISLA S,HIRSCHBERG J,et al.Plant carotene cis-trans isomerase crtiso a new member of the fadred-dependent flavoproteins catalyzing non-redox reactions[J].Journal of Biological Chemistry,2011,286(10):8666-8676.
[37] TIAN L,DELLAPENNA D,ZEEVAART J A.Effect of hydroxylated carotenoid deficiency on ABA accumulation in Arabidopsis[J].Physiologia Plantarum,2004,122(3):314-320.
[38] GóMEZ-GARCíA M D R,OCHOA-ALEJO N.Biochemistry and molecular biology of carotenoid biosynthesis in chili peppers (Capsicum spp.)[J].International Journal of Molecular Sciences,2013,14(9):19025-19053.
[39] LU S,LI L.Carotenoid metabolism:biosynthesis,regulation,and beyond[J].Journal of Integrative Plant Biology,2008,50(7):778-785.
[40] ZHOU X,WELSCH R,YANG Y,et al.Arabidopsis OR proteins are the major posttranscriptional regulators of phytoene synthase in controlling carotenoid biosynthesis[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(11):3558-3563.
[41] WELSCH R,ZHOU X,YUAN H,et al.Clp protease and OR directly control the proteostasis of phytoene synthase,the crucial enzyme for carotenoid biosynthesis in Arabidopsis[J].Molecular Plant,2018,11(1):149-162.
[42] GIULIANO G.Plant carotenoids:genomics meets multi-gene engineering[J].Current Opinion in Plant Biology,2014,19:111-117.
[43] FANTINI E,FALCONE G,FRUSCIANTE S,et al.Dissection of tomato lycopene biosynthesis through virus-induced gene silencing[J].Plant Physiology,2013,163(2):986-998.
[44] NAKKANONG K,YANG J H,ZHANG M F.Carotenoid accumulation and carotenogenic gene expression during fruit development in novel interspecific inbred squash lines and their parents[J].Journal of Agricultural and Food Chemistry,2012,60(23):5936-5944.
[45] CAO H,LUO H,YUAN H,et al.A neighboring aromatic-aromatic amino acid combination governs activity divergence between tomato phytoene synthases[J].Plant Physiology,2019,180(4):1988-2003.
[46] NIEVELSTEIN V,VANDEKERCKHOVE J,TADROS M H,et al.Carotene desaturation is linked to a respiratory redox pathway in narcissus pseudonarcissus chromoplast membranes:involvement of a 23‐kDa oxygen‐evolving‐complex‐like protein[J].European Journal of Biochemistry,1995,233(3):864-872.
[47] MANN V,PECKER I,HIRSCHBERG J.Cloning and characterization of the gene for phytoene desaturase (Pds) from tomato (Lycopersicon esculentum)[J].Plant Molecular Biology,1994,24(3):429-434.
[48] FANTINI E,FALCONE G,FRUSCIANTE S,et al.Dissection of tomato lycopene biosynthesis through virus-induced gene silencing[J].Plant Physiology,2013,163(2):986-998.
[49] ISAACSON T,RONEN G,ZAMIR D,et al.Cloning of tangerine from tomato reveals a carotenoid isomerase essential for the production of β-carotene and xanthophylls in plants[J].The Plant Cell,2002,14(2):333-342.
[50] JIN B,LEE J,KWEON S,et al.Analysis of flesh color-related carotenoids and development of a CRTISO gene-based DNA marker for prolycopene accumulation in watermelon[J].Horticulture,Environment,and Biotechnology,2019,60(3):399-410.
[51] SU T,YU S,WANG J,et al.Loss of function of the carotenoid isomerase gene BrCRTISO confers orange color to the inner leaves of chinese cabbage (Brassica rapa L.ssp.pekinensis)[J].Plant Molecular Biology Reporter,2014,33(3):648-659.
[52] WATERS B M,KIM H,AMUNDSEN K.New genetic sources for orange color in cucumber (Cucumis sativus L.) fruit flesh[J].BioRxiv,2019:1-12.
[53] JOURDAN M,GAGNE S,DUBOIS-LAURENT C,et al.Carotenoid content and root color of cultivated carrot:a candidate-gene association study using an original broad unstructured population[J].PLoS One,2015,10(1):e0116674.
[54] BANG H,KIM S,LESKOVAR D,et al.Development of a codominant CAPS marker for allelic selection between canary yellow and red watermelon based on SNP in lycopene β-cyclase (LCYB) gene[J].Molecular Breeding,2007,20(1):63-72.
[55] 豆峻嶺,刘文革,赵胜杰,等.三倍体无籽西瓜果实发育期番茄红素合成代谢酶基因的表达[J].果树学报,2014,31(4):589-595.
[56] WANG C,QIAO A,FANG X,et al.Fine mapping of lycopene content and flesh color related gene and development of molecular marker-assisted selection for flesh color in watermelon (Citrullus lanatus)[J].Frontiers in Plant Science,2019,10:1-16.
[57] DIRETTO G,TAVAZZA R,WELSCH R,et al.Metabolic engineering of potato tuber carotenoids through tuber-specific silencing of lycopene epsilon cyclase[J].BMC Plant Biology,2006,6(13):1-11.
[58] WANG R,LAMMERS M,TIKUNOV Y,et al.The rin,nor and Cnr spontaneous mutations inhibit tomato fruit ripening in additive and epistatic manners[J].Plant Science,2020,294:1-12.
[59] LI S,XU H,JU Z,et al.The RIN-MC fusion of MADS-Box transcription factors has transcriptional activity and modulates expression of many ripening genes[J].Plant Physiology,2018,176(1):891-909.
[60] WU M,XU X,HU X,et al.SlMYB72 regulates the metabolism of chlorophylls,carotenoids,and flavonoids in tomato fruit[J].Plant Physiology,2020,183(3):854-868.
[61] MENG Y,WANG Z,WANG Y,et al.The MYB activator WHITE PETAL1 associates with MtTT8 and MtWD40-1 to regulate carotenoid-derived flower pigmentation in Medicago truncatula[J].Plant Cell,2019,31(11):2751-2767.
[62] XIONG C,LUO D,LIN A,et al.A tomato B-box protein SlBBX20 modulates carotenoid biosynthesis by directly activating PHYTOENE SYNTHASE 1,and is targeted for 26S proteasome-mediated degradation[J].New Phytologist,2019,221(1):279-294.
[63] ZHU M,CHEN G,ZHOU S,et al.A new tomato NAC (N AM/A TAF1/2/C UC2) transcription factor,SlNAC4,functions as a positive regulator of fruit ripening and carotenoid accumulation[J].Plant and Cell Physiology,2014,55(1):119-135.
[64] MENG X,YANG D,LI X,et al.Physiological changes in fruit ripening caused by overexpression of tomato SlAN2,an R2R3-MYB factor[J].Plant Physiology and Biochemistry,2015,89:24-30.
[65] LI L,WANG X,ZHANG X,et al.Unraveling the target genes of RIN transcription factor during tomato fruit ripening and softening[J].Journal of the Science of Food and Agriculture,2017,97(3):991-1000.
[66] GRASSI S,PIRO G,LEE J M,et al.Comparative genomics reveals candidate carotenoid pathway regulators of ripening watermelon fruit[J].BMC Genomics,2013,14:781-801.
[67] KARLOVA R,ROSIN F M,BUSSCHER-LANGE J,et al.Transcriptome and metabolite profiling show that APETALA2a is a major regulator of tomato fruit ripening(c)(w)[J].The Plant Cell,2011,23(3):923-941.
[68] LEE J M,JOUNG J G,MCQUINN R,et al.Combined transcriptome,genetic diversity and metabolite profiling in tomato fruit reveals that the ethylene response factor SlERF6 plays an important role in ripening and carotenoid accumulation[J].The Plant Journal,2012,70(2):191-204.
[69] 李巖,王丽伟,文莲莲,等.红蓝光质对转色期间番茄果实主要品质的影响[J].园艺学报,2017,44(12):2372-2382.
[70] 王曼曼,薛舒丹,吴廷全,等.光照和温度调控对番茄果实中类胡萝卜素合成的影响[J].分子植物育种,2020:https://kns.cnki.net/kcms/detail/46.1068.S.20200610.1655.012.html.
[71] 袁平丽,刘文革,李 智,等.两种生态条件下西瓜果实番茄红素含量比较[J].中国瓜菜,2017,30(7):4-7.
[72] POLA W,SUGAYA S,PHOTCHANACHAI S.Influence of postharvest temperatures on carotenoid biosynthesis and phytochemicals in mature green chili (Capsicum annuum L.)[J].Antioxidants (Basel),2020,9(3):203-216.
[73] ALBA R,CORDONNIER-PRATT M-M L,PRATT L H.Fruit-localized phytochromes regulate lycopene accumulation independently of ethylene production in tomato[J].Plant Physiology,2000,123(1):363-370.

