短期运动预处理对大鼠脑缺血再灌注中炎症小体活化通路的影响
马海浩,陈柯,赵亚男,周翔,王端浩
(成都体育学院,成都 610041)
脑卒中是全球第三大疾病死亡原因,严重威胁人类的生存与健康。数据显示,2017年我国农村人群脑血管病死亡占居民疾病死亡的比例为23.18%,城市人群为20.52%[1]。运动作为一种新兴的方法可以预防脑卒中的发生。据报道,缺乏身体活动的男性脑卒中的患病率为28.5%,女性为31.5%,并且患病率随着年龄的增长而增加[2]。Meta分析显示,适当的体力活动可以降低25%~30%由脑卒中引起的死亡风险[3]。
在脑缺血再灌注后,细胞外三磷酸腺苷(extracellular adenosine triphosphate,eATP)浓度改变激活嘌呤能受体7(P2X purinoceptor 7,P2RX7),使细胞内阳离子大量外流;阳离子的外流又使细胞质形成炎性复合体,炎性复合体切割下端的天冬氨酸半胱氨酸特异性蛋白酶1(cysteinyl aspartate specific proteinase 1,Caspase-1),Caspase-1切割细胞质中的消皮素D(gasdermin D,GSDMD)蛋白,Caspase-1又能切割、加工炎性因子IL-1β和IL-18,使炎性因子通过胀大的细胞膜孔进入细胞外液。另外,天冬氨酸半胱氨酸特异性蛋白酶11(cysteinyl aspartate specific proteinase 11,Caspase-11)也能切割GSDMD蛋白,促进细胞膜孔的胀大。本研究探讨运动预处理在大鼠脑缺血再灌注中对相关蛋白的影响及可能机制,为临床脑缺血再灌注损伤的运动治疗提供理论基础。
1 材料和方法
1.1 大鼠模型制备及实验分组90只6周龄健康雄性SD大鼠(SPF级)(实验鼠80只,备用鼠10只),体质量160~180 g,购自成都达硕实验动物有限公司,饲养于成都体育学院SPF级动物房。将实验动物随机分为运动组和非运动组(40只/组)。非运动组又进一步分为假手术组(SS组)和模型组(CM组)(20只/组):SS组大鼠自由活动4周,接受假手术模型制作,线栓插入颈总动脉1 cm处,不进行缺血再灌注处理;CM组大鼠自由活动4周,进行大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型制作,2 h后进行缺血再灌注处理。运动组又进一步分为单纯运动组(P组)和运动预处理模型组(EM组)(20只/组):P组大鼠在动物跑台连续运动4周后,不进行模型制作,直接猝死,断头取脑;EM组大鼠在动物跑台连续运动4周后,进行MCAO模型制作,2 h后进行缺血再灌注处理。
运动预处理模型:所有大鼠在实验前进行了1周的自适应跑步机训练,跑台速度为8~10 m/min,20 min/d,0°斜坡行走。运动组大鼠接受大鼠跑台连续训练4周,6 d/周,训练方案为30 m/min,30 min/d,0°斜坡,电流刺激强度设定为1.5 mA;非运动组中的大鼠在笼中自由活动,不使用跑台训练[4]。
动物实验模型根据Reiss等[5]改良的MCAO线栓法制备。大鼠在造模前12 h禁食不禁水,称重,按0.3 mL/100 g剂量腹腔注射10%水合氯醛进行麻醉。将大鼠背位固定在大鼠恒温手术台上,温度(37.0±0.5)℃。沿颈部正中皮肤切开约2 cm手术刀口,分离出右侧颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)和颈外动脉(external carotid artery,ECA)。在右侧CCA近心端挂线但不结扎,用手术线结扎ECA远心端和CCA下方距分叉1.5 cm处,然后在CCA距离分叉处约0.5 cm处用眼科剪剪“v”型小口,将栓塞线(距离线头2 cm处用黑色记号笔标记)经小口插入CCA,用组织摄轻推栓线进入CCA并固定,线栓插入长度为18~22 mm,微感阻力后停止进栓,用细线结扎CCA远心端。腹腔注射青霉素钠0.5 mL,手术切口处滴0.1 mL青霉素钠。2 h后,抽出栓塞线,完成再灌注后缝合伤口,将大鼠放回笼中。SS组只进行麻醉、开口和分离组织等操作,不进行栓塞造模。
1.2 大鼠神经行为学评分在缺血再灌注24 h后处死大鼠,处死前对大鼠进行神经行为学评分。采用Longa评分标准,分数越高,说明其神经行为损伤越严重。首次评分1、2、3分的大鼠视为造模成功。0分、4分或术中死亡的大鼠予以剔除,再从备用组中随机补充。评分由3位实验员独立完成。(表1)
1.3 红四唑(triphenyltetrazolium chloride,TTC)染色深度麻醉动物后,迅速断头取脑,将脑放进大小合适的脑切片模具中,切成1~3 mm厚的切片。将脑片立即置于2%的TTC染色液中,避光孵育、固定、排列、照相、计算脑梗死面积的大小。脑梗死面积计算公式:脑梗死面积百分比=脑片总梗死面积/对侧脑片总面积×100%。

表1 Longa评分标准
1.4 苏木精-伊红 ( hematoxylin-eosin,HE )染色固定组织经全自动脱水机脱水、包埋、切片后进行苏木精染色;横切组织,切片厚5 μm;经脱蜡、水化、染色、脱水、透明、封片等步骤后在镜下拍照。
1.5 ELISA检测血清IL-1β和IL-18水平取血后,以1 510×g离心15 min,分离血清。然后用ELISA检测试剂盒(R&D公司)分别检测各组大鼠血清中细胞因子IL-1β和IL-18的水平。
1.6 Western blotting检测蛋白将大鼠脑样本放入EP管中,加入RIPA裂解液剪碎,于冰上裂解10 min;收集裂解液,4 ℃、24 170×g离心10 min,取上清液,进行上样、电泳、转膜、封闭、一抗孵育[一抗:Caspase-1(武汉三鹰公司),1∶1 000;GSDMDC1(Santa Cruz公司),1∶500;P2RX7(武汉博士德公司),1∶100;Caspase-11(Santa Cruz公司),1∶300;β-actin,1∶5 000。将聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜放入一抗中,4 ℃孵育过夜];用TBST将PVDF膜洗3次,进行二抗孵育[将PVDF膜放入二抗(1∶5 000)中,在摇床上轻摇,室温孵育2~3 h];用TBST将PVDF膜洗3次,最后显影、定影,进行图像分析,得出结果。

2 结果
2.1 各组大鼠体质量的变化所有大鼠在进行MCAO前体质量控制在250~280 g,达到实验要求。4组之间比较,差异均无统计学意义(P>0.05)。
2.2 各组大鼠Longa评分的比较MCAO 24 h后,SS组和P组大鼠均未出现神经功能损伤表现;CM组和EM组大鼠出现明显的神经功能损伤表现,与SS组和P组比较,差异均具有统计学意义(P<0.01);EM组与CM组比较,大鼠神经功能损伤表现减轻 (P<0.05)。(表2)
表2 各组大鼠神经行为学评分的比较
2.3 各组大鼠脑TTC染色及脑梗死面积的比较MCAO 24 h后,SS组和P组大鼠均未出现脑梗死灶;CM组和EM组大鼠脑组织均出现不同程度的梗死灶,与SS组和P组比较,差异均具有统计学意义(P<0.01);EM组与CM组比较,脑梗死面积缩小 (P<0.05)。(表3、图1)
表3 各组大鼠脑梗死面积的比较

图1 各组大鼠脑梗死面积
2.4 各组大鼠大脑皮层缺血半暗带HE染色结果光镜下(×100、×400)观察,SS组和P组大鼠皮质层结构和软脑膜完整、清晰,各细胞层排列较为整齐,神经元形态正常,未见明显变性或坏死。CM组脑组织大面积梗死,神经元呈片状坏死并伴随水肿,细胞崩解,梗死区边缘神经元空泡变性或点状坏死。EM组脑组织出现梗死,部分神经元细胞坏死并伴随水肿,梗死区边缘神经元结构较为正常,神经纤维排列致密,染色较为均匀。(图2)
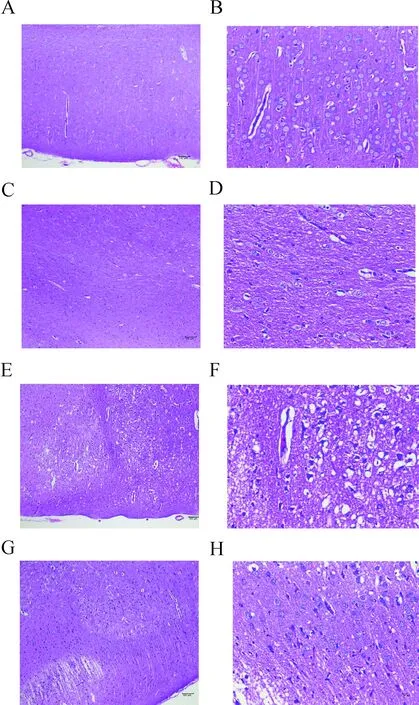
注:A.SS组(HE,×100);B.SS组(HE,×400);C.P组(HE,×100);D.P组(HE,×400);E.CM组(HE,×100);F.CM组(HE,×400);G.EM组(HE,×100);H.EM组(HE,×400)。图2 各组大鼠大脑皮层HE染色结果
2.5 各组大鼠血清IL-1β、IL-18水平的比较CM组、EM组与SS组比较,血清IL-1β、IL-18水平明显升高(P<0.01);与CM组比较,EM组血清IL-1β、IL-18水平明显降低(P<0.01)。(图3)
2.6 各组大鼠大脑皮层缺血半暗带P2RX7、Caspase-1、Caspase-11、GSDMD蛋白水平的比较MCAO 24 h后,与SS组和P组比较,CM组P2RX7蛋白表达增加(P<0.01);与CM组比较,EM组P2RX7蛋白表达明显降低(P<0.01)。(图4)

注:与SS组比较,*P<0.01;与CM组比较,#P<0.01。图3 各组大鼠血清IL-1β、IL-18水平的比较
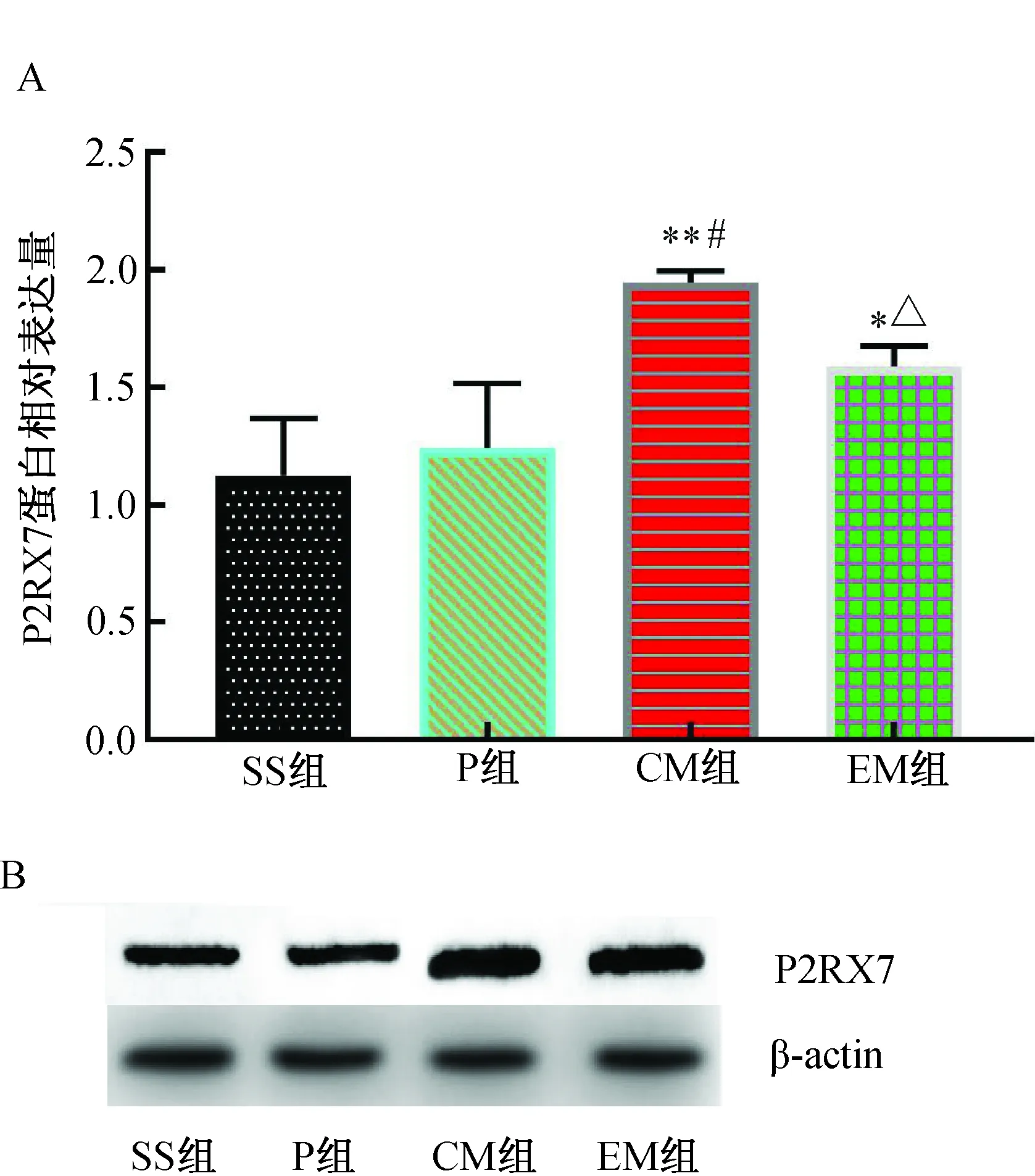
注:A. P2RX7蛋白相对表达水平;B.P2RX7 Western blotting蛋白电泳条带。与SS组比较,*P<0.05,**P<0.01;与P组比较,#P<0.01;与CM组比较,△P<0.01。图4 各组大鼠大脑皮层缺血半暗带P2RX7蛋白表达水平的比较
MCAO 24 h后,与SS组比较,P组Caspase-11蛋白表达相近,差异无统计学意义(P>0.05);与SS组和P组比较,CM组Caspase-11蛋白表达明显增加(P<0.01);与CM组比较,EM组Caspase-11蛋白表达明显降低(P<0.05)。(图5)
MCAO 24 h后,与SS组比较,P组Caspase-1蛋白表达相近,差异无统计学意义(P>0.05);与SS组和P组比较,CM组Caspase-1蛋白表达明显增加(P<0.01);与CM组比较,EM组Caspase-1蛋白表达明显降低(P<0.01)。(图6)
MCAO 24 h后,与SS组比较,P组GSDMD蛋白表达相近,差异无统计学意义(P>0.05);与SS组和P组比较,CM组GSDMD蛋白表达明显增加(P<0.01);与CM组比较,EM组GSDMD蛋白表达明显降低(P<0.01)。(图7)
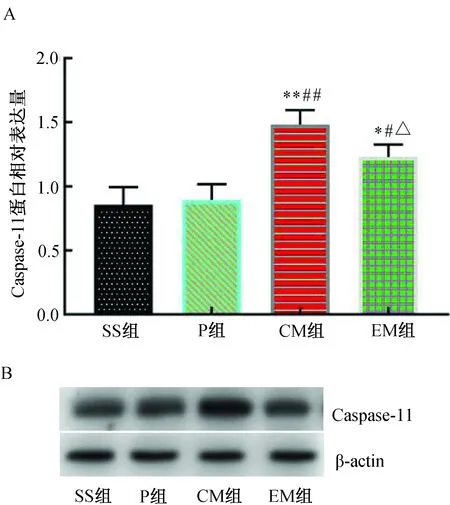
注:A. Caspase-11蛋白相对表达水平;B.Caspase-11 Western blotting蛋白电泳条带;与SS组比较,*P<0.05,**P<0.01;与P组比较,#P<0.05,##P<0.01;与CM组比较,△P<0.05。图5 各组大鼠大脑皮层缺血半暗带Caspase-11蛋白表达水平的比较
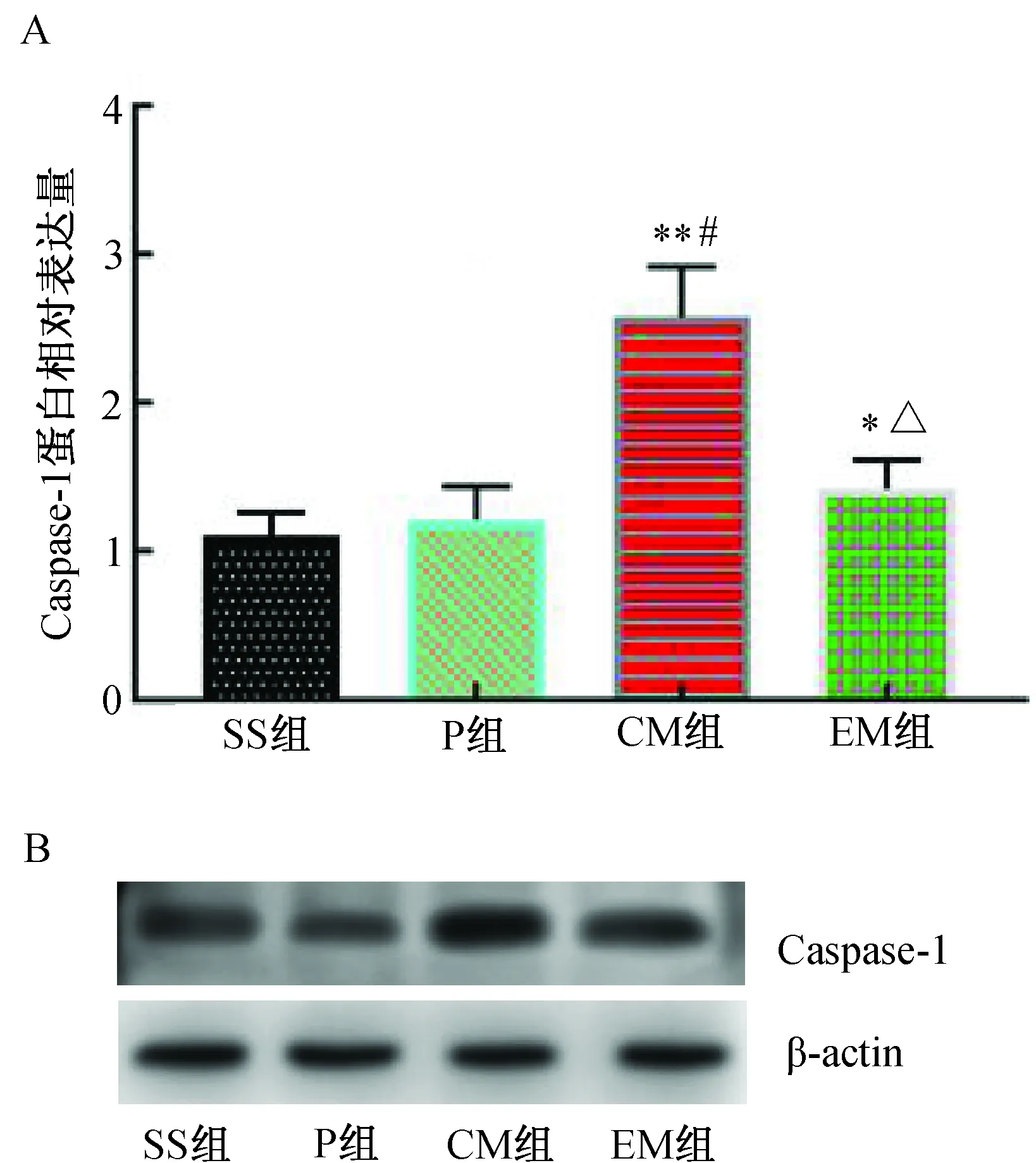
注:A. Caspase-1蛋白相对表达水平;B.Caspase-1 Western blotting蛋白电泳条带。与SS组比较,* P<0.05,**P<0.01;与P组比较,#P<0.01;与CM组比较,△P<0.01。图6 各组大鼠大脑皮层缺血半暗带Caspase-1蛋白表达水平的比较
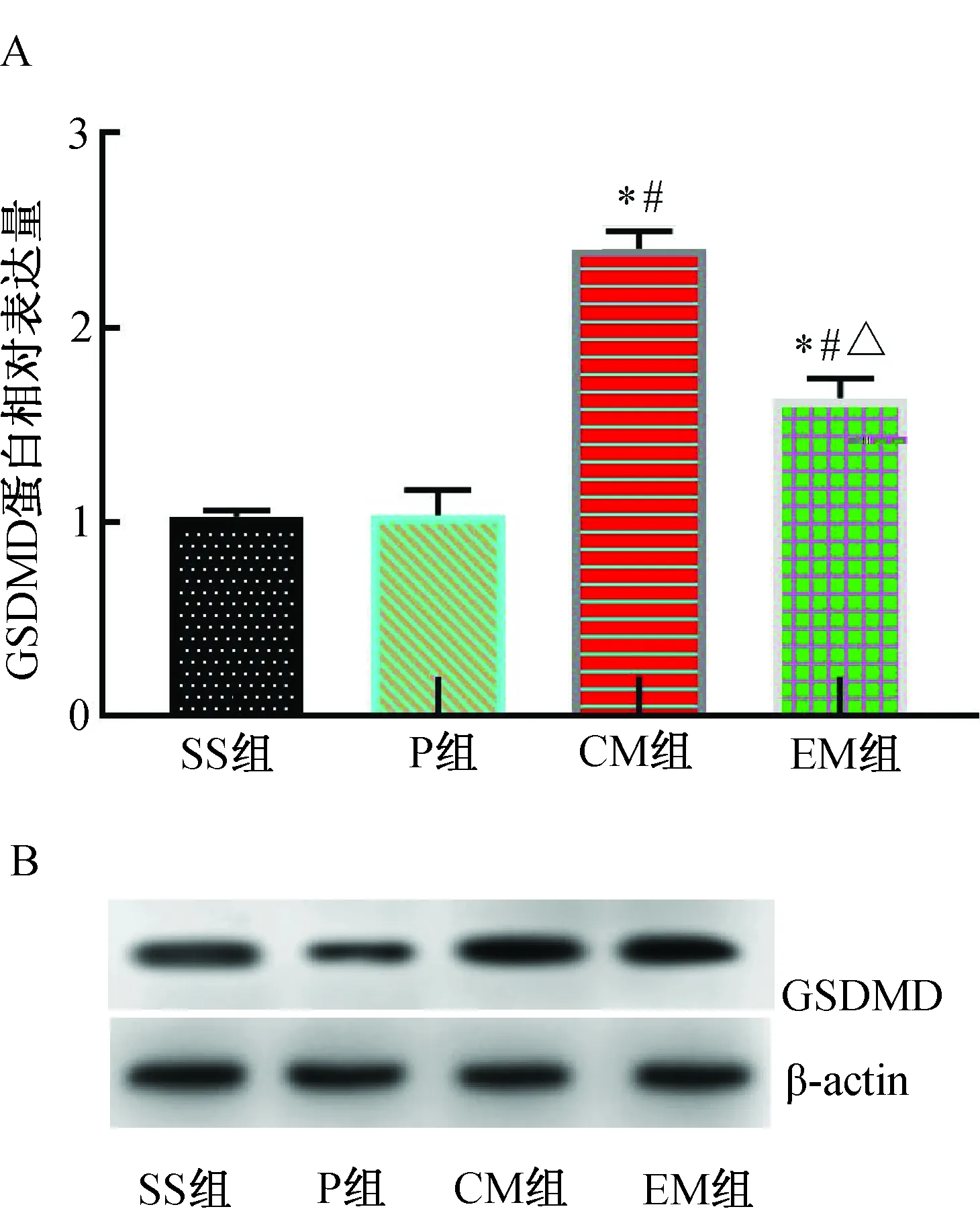
注:A.GSDMD蛋白相对表达水平;B.GSDMD Western blotting蛋白电泳条带。与SS组比较,*P<0.01;与P组比较,#P<0.01;与CM组比较,△P<0.01。图7 各组大鼠大脑皮层缺血半暗带GSDMD蛋白表达水平的比较
3 讨论
HE染色结果显示,运动预处理对脑缺血再灌注损伤在病理学方面有预防作用,进行运动预处理的大鼠在脑缺血术后,组织细胞对缺氧、缺血的耐受性增加;脑梗死面积减小可能是因为再灌注后,半暗带的细胞得到了一部分血液与氧的供应,细胞能继续存活。TTC染色结果显示,运动预处理后的大鼠脑梗死面积较小,且神经功能损伤表现减轻,这提示脑梗死面积与神经学评分有关联。
Ding等[6]研究发现,运动预处理后不进行脑缺血再灌注,大鼠TNF-αmRNA和细胞间黏附因子1的表达水平随运动时间的增加而增加,这提示运动可能增加炎性因子的表达。本研究中,在缺血再灌注处理后,相关炎性因子的表达明显减少,这可能与炎性因子不同有关,也可能与假手术有关,假手术产生创伤也可能增加炎性因子的表达。另外,Comassi等[7]研究发现,正常安静状态下运动员血清IL-1β和IL-18水平显著高于体力活动不足者;一次运动后,体力活动不足者血清IL-1β水平升高,但运动员血清IL-1β水平下降,IL-18水平明显下降,说明运动应激可增加IL-1β和IL-18促炎因子或相关蛋白的表达,长期的运动后,机体可能对单次运动应激反应产生了适应,血清IL-1β、IL-18水平下降可能与机体对应激耐受的提高有关。本研究发现,P组大鼠血清IL-1β、IL-18水平与SS组比较,并无统计学差异,这可能与运动时间或运动周期有关;而EM组与CM组比较,血清IL-1β、IL-18水平明显降低,这提示经过运动预处理后机体可能对应激刺激做出了适应。本研究中,MCAO后大鼠血清炎性因子IL-1β和IL-18水平升高,提示IL-1β和IL-18可能是与正常细胞的细胞膜受体IL-1R和IL-18受体结合,促使细胞通路激活。IL-1β的分泌可能存在其他机制,在中性粒细胞和人单核细胞中,IL-1β可以在没有焦磷酸作用的情况下释放[8]。另外,IL-18与IL-18受体结合并发出信号,在NK细胞中诱导IFN-γ分泌,从而使Th1发生炎症反应,在退行性神经疾病中,IFN-β/IL-1β轴的活化可能对疾病产生影响[9]。Kaiser等[10]研究发现,P2RX7-/-小鼠在MCAO后脑水肿更加明显,并伴随着更严重的神经功能损伤。但Ye等[11]研究发现,小鼠脑缺血再灌注后,P2RX7、Caspase-1在缺血脑组织中的表达显著增加,给予P2RX7抑制剂注射后,小鼠缺血性脑组织中的P2RX7蛋白表达水平降低且脑梗死面积减少,脑卒中后的功能得到改善。本研究中,CM组大鼠脑组织P2RX7、Caspase-1、Caspase-11、GSDMD蛋白显著升高,提示缺血性脑卒中会激活炎症小体活化通路。Young等[12]研究发现,eATP浓度升高,细胞膜上的离子通道打开,ATP大量进入细胞内,细胞内K+大量外流,细胞稳态被破坏,细胞兴奋性毒性增加,这不利于细胞的存活。有研究发现,Caspase-11非经典炎症小体激活的2个标志是IL-1β和IL-18的分泌及磷酸化[13]。目前认为,Caspase-11可能通过炎症小体或直接调控Caspase-1蛋白增加Caspase-1蛋白的表达[14]。本研究中,CM组血清IL-1β和IL-18水平明显增加,EM组血清IL-1β和IL-18水平明显下降,趋势与Caspase-11蛋白表达一致,这提示P2RX7、Caspase-11可能是Caspase-1的上游蛋白,运动预处理可能增加了脑组织在缺血、缺氧情况下的组织耐受,降低Caspase-11蛋白的表达,减少炎性小体的形成和GSDMD的表达。Zhao等[15]研究发现,脑缺血再灌注后3 h注射Caspase-1抑制剂可对大鼠MCAO后海马区域提供神经保护作用,小鼠MCAO造模后30 min内神经元Caspase-1被迅速激活。GSDMD作为Caspase-1的底物,在脑缺血再灌注后表达升高,GSDMD的过表达可以提高IL-1β和IL-18的水平[16]。Yi[17]研究发现,从GSDMD-/-小鼠分离的巨噬细胞,在受到LPS和细菌感染时不会发生细胞焦亡,炎性因子IL-1β分泌减少,并且对LPS诱导的感染产生抗性。本研究发现,MCAO后GSDMD蛋白的表达变化可能是上游蛋白表达升高所致,Caspase-1、Caspase-11等蛋白表达的增加都会导致GSDMD蛋白表达的增加。
综上所述,本研究发现,4周运动预处理可改善大鼠脑缺血再灌注后的梗死面积、细胞坏死和神经功能损伤,对脑组织和神经元具有保护作用,同时可减少大鼠脑缺血再灌注损伤后P2RX7、Caspase-1、Caspase-11、GSDMD蛋白的表达,减少大鼠脑缺血再灌注后血清IL-1β、IL-18的含量,降低炎症水平。本研究结果为防治缺血性脑卒中提供了理论线索和实验依据。

