基于荧光原位杂交法剖析窖泥微生物的预处理条件探究及应用
吴冬梅,袁永飞,田殿梅,薛正楷,3,李 进,周荣清
(1.泸州职业技术学院郎酒学院,四川 泸州 646000;2.泸州老窖股份有限公司,四川 泸州 646000;3.泸州市生物医学工程研究所,四川 泸州 646000;4.四川大学轻纺与食品学院,四川 成都 610065)
中国白酒是世界六大蒸馏酒之一,浓香型、酱香型、清香型、米香型白酒是其四大基本香型白酒,其中尤以浓香型白酒销量最大,占白酒销量的70%左右[1-2]。泥窖固态发酵是浓香型白酒生产的一个重要特征,窖泥质量与浓香型大曲酒质量有一定关系[3],窖泥微生物的优劣直接关系到白酒产品质量的优劣,优质老窖才能生产好酒[4-6],在长期训化过程中,形成了窖泥中独特的微生物群落结构。因此认识白酒酿造过程中微生物的群落结构,尤其是定量地认识不同种类功能菌体的组成特点及变化规律,借此了解微生物作用与白酒质量的关系具有重要意义。
目前,研究白酒酿造过程中微生物群落结构的方法主要有传统可培养分离鉴定法、代谢指纹技术-群落水平生理特征图谱(community level physiological profiles,CLPPs)、基于聚合酶链式反应(polymerase chain reaction,PCR)的现代分子生物学方法(变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)、末端限制性片段长度多态性技术(terminal-restriction fragment length polymorphism,T-RLFP)及基于磷脂脂肪酸(phospholipid fatty acid,PLFA)的生物标记法等方法。如徐占成等[7]采用微生物分离技术从剑南春天益老号窖泥中选育到1株产己酸能力(18 000 mg/L)较高的菌株,并经16S rDNA序列分析和Biolog分析鉴定为生孢梭菌(Clostridium sporogense);卢振等[8]采用PCR-DGGE技术分析窖泥细菌群落,结果表明,窖泥中4个优势门类微生物分别为拟杆菌门(Bacteroidetes)、放线菌门(Actinobacterium)、变形菌门(Proteobacteria)和厚壁菌门(Firmicutes);刘琨毅等[9]采用磷脂脂肪酸生物标记法研究不同老熟方法的窖泥微生物群落结构,结果表明,在使用窖泥老熟方法的窖泥中,革兰氏阳性菌、革兰氏阴性菌、好氧菌、厌氧菌及真菌的含量均随着酿酒轮次的增加而增加,且微生物含量逐渐趋近于50年以上窖龄窖池窖泥;李俊辉等[10]采用高通量分析研究华北地区浓香型白酒窖泥样品中微生物的群落结构,解析浓香型白酒不同窖龄窖泥中优势和特征微生物。但以上方法在微生物群落结构研究中的灵敏度、精确性有待提高。荧光原位杂交技术(fluorescent in situ hybridization,FISH)是指以荧光标记的寡核苷酸探针与处理后的微生物内目标序列以碱基互补配对原则杂交,再通过荧光显微镜观察目标基因微生物的细胞形态、分布以及数量的可视化技术[11],该技术具有快速、精确、原位以及可动态观察等特点[12],能快速、准确、可视化的研究自然或人工环境中的微生物个体。
浓香型白酒酿造微生物的栖息地营养组分复杂,酸度、乙醇含量高,正是由于样品复杂的体系性质及微生物群落多样性,迄今难以客观、全貌、快速、可视化的定量描述微生物群落结构特征,尤其是窖泥中植物残渣、腐殖酸(humic acid,HA)[13]、土壤粒子及矿物质等杂质会导致自荧光,另外窖泥中较高含量的腐殖酸还会干扰核酸延伸与杂交[14-15],影响FISH检测结果。本研究以浓香型白酒窖泥为研究对象,优化窖泥样品的预处理条件,并利用FISH法检测大肠杆菌(Escherichia coli)和植物乳杆菌(Lactobacillus planetarium)的回收率,验证预处理条件的可行性。最后在优化条件下检测不同窖龄窖池窖泥样品中细菌及古菌的数量,开发可视化揭示酿酒微生物群落数量变迁规律的方法,为酿酒微生物(尤其是从种的层面上设计探针、检测菌体)群落结构及变化规律的研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
大肠杆菌(Escherichia coli)DH5α:四川省微生物资源保藏中心;植物乳杆菌(Lactobacillus planetarium)沪1.08:上海市酿造科学研究所。
细菌探针EUB338(5'-GCTGCCTCCCGTAGGAGT-3',5'端cy3标记)、古菌探针ARCH915(5'-GTGCTCCCCCGCCAATTCCT-3',5'端cy3标记):上海生工生物有限公司。
窖泥样品:参考文献[16],从泸州老窖股份有限公司取样,分别为试验窖池(1年)(窖池编号2108、2121)窖泥、50年窖龄窖池(窖池编号2131、2132)窖泥、100年窖龄窖池(窖池编号1960、1962)窖泥及300年窖龄窖池(窖池编号77、79)窖泥。
1.1.2 试剂
腐植酸、多聚赖氨酸(纯度99%):美国Sigma公司;4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)(分析纯):美国Roche公司;抗荧光猝灭封片液:海门碧云天生物技术有限公司;溶菌酶(酶活>20 000 U/mg):上海碧云天生物技术有限公司。
1.2 仪器与设备
BX-51荧光显微镜、CX31RTSF光学显微镜:日本奥林巴斯公司;Lambda 25型紫外可见分光光度计:美国Perkin Elmer公司;TGL16M高速离心机:湘麓离心机仪器有限公司;SW-CJ-2FD型净化工作台:苏州净化设备有限公司。
1.3 方法
1.3.1 浓香型白酒窖泥预处理条件的优化
料液比的确定:称取3.0 g 100年窖龄窖泥于含有约2.0 g波珠(直径3~5 mm)的灭菌离心管内,首次分别以料液比为1∶6、1∶8、1∶10(g∶mL)的样液比加入无菌磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 7.2),涡旋振荡混匀,超声处理30 s(超声频率40 kHz、功率100 W),4 ℃、800 r/min条件下离心10 min,收集上清液;将下层沉淀分别以料液比为1∶3、1∶4、1∶5(g∶mL)加入PBS,重复以上步骤2次。合并3次收集的上清液,4 ℃、10 000 r/min离心10 min,弃上清液后加入PBS 10 mL重复洗涤一次并定容到10 mL,采用显微镜直接计数法[17]测定总菌数。同时,计数原窖泥样品的总菌数,计算菌体损失率,确定最适样液比。菌体损失率计算公式如下:

在此基础上,依次考察离心转速(400~2 000 r/min)、超声波分散时间(0、30 s、60 s、90 s、120 s、150 s、180 s,30 s间歇操作)对窖泥菌体损失率的影响,确定最适离心转速及超声波分散时间。
Al2(SO4)3添加量的确定:分别取3.0 g 100年窖龄窖池窖泥样品于含有玻珠的9支无菌离心管中,在首次加入1/2总体积最优样液比的PBS后分别按浓度0、1.67×10-5mol/g窖泥、2.50×10-5mol/g窖泥、3.33×10-5mol/g窖泥、4.17×10-5mol/g窖泥、5.00×10-5mol/g窖泥、6.67×10-5mol/g窖泥、8.33×10-5mol/g窖泥、10.00×10-5mol/g窖泥加入Al2(SO4)3,其余操作按照前述确定的最优处理条件进行处理,测定总菌数,并计算不同Al2(SO4)3添加量时菌体损失率;同时参照文献[18]测定HA含量,并计算HA去除率,以确定最佳Al2(SO4)3添加量。HA去除率计算公式如下:

1.3.2 细菌回收率测定
将一定量处于稳定期的E.coli和L.planetarium菌悬液分别加入3 g 100年窖龄窖泥样品后,以未添加菌体的100年窖龄窖泥样品为对照,经最优条件预处理后,得到菌体沉淀物。参照吴冬梅等[16,19]所述FISH法略微修改表征样品中的菌体数量,同时FISH法分别计数E.coli和L.planetarium纯菌体的菌体数量,并计算添加菌体的回收率,其计算公式如下:

1.3.3 FISH法在浓香型白酒窖泥样品中的应用
基于细菌探针EUB338和古菌探针ARCH915,以不同窖龄窖池的窖泥为对象,按优化后的条件进行预处理,多聚甲醛固定后采用FISH测定菌体数量。
2 结果与分析
2.1 浓香型白酒窖泥预处理条件的优化
2.1.1 料液比的确定
不同料液比对窖泥样品菌体损失率的影响见图1。由图1可知,随着缓冲液的增加,菌体损失率逐步降低,可能是PBS的增加,在一定程度上降低了样品悬浮液的黏度,改善了传质环境及胶体性质,使更多菌体释放到PBS缓冲液中。当料液比为1∶16和1∶20(g∶mL)时,菌体损失率差异不显著(P>0.05),分别为22.36%、20.77%,因此,综合考虑确定最优料液比为1∶16(g∶mL)。

图1 不同料液比对窖泥菌体损失率的影响Fig. 1 Effect of different ratio of material and solution on the cell loss rate in pit mud
2.1.2 离心转速的确定
离心转速对菌体损失率的影响见图2。由图2可知,随着离心转速的增加,菌体损失率逐渐增大,离心转速为400r/min和800 r/min时,菌体损失率较低,分别为18.30%、24.60%。基于综合考虑低菌体损失率和尽量去除腐殖质等杂质的目标,故选择最优离心转速为800 r/min。

图2 不同离心转速对窖泥菌体损失率的影响Fig. 2 Effect of different centrifugal rotation speeds on the cell loss rate in pit mud
2.1.3 超声波分散时间的确定
超声波分散时间对窖泥样品菌体损失率的影响见图3。由图3可知,超声处理时间在0~120 s的范围时,随着超声处理时间的延长,从窖泥中解吸的总菌数略微增多,菌体损失率略微降低,当处理时间为120 s时菌体损失率最低。但继续延长处理时间,超过150 s后,菌体损失率明显增加,可能是长时间超声处理使其菌体细胞壁破碎[20],减少了检出的总菌数。因此,为了尽量多的洗出菌体及保持菌体活性,选择最优超声分散时间为60 s。
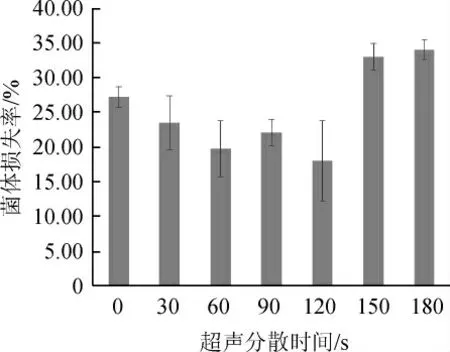
图3 不同超声分散时间对窖泥菌体损失率的影响Fig. 3 Effect of different ultrasonic dispersion time on the cell loss rate in pit mud
2.1.4 Al2(SO4)3添加量的确定
窖泥样品中加入Al2(SO4)3,可将腐植酸等杂质絮凝沉淀除去,减少对探针的干扰,改善FISH的可视化效果[21]。窖泥样品经不同浓度的Al2(SO4)3溶液处理后,窖泥的菌体数、HA含量、菌体损失率及HA去除率见表1。由表1可知,Al2(SO4)3添加量在0.00~10.00×10-5mol/g窖泥范围内,随着Al2(SO4)3添加量的增加,除去HA作用增强,菌体损失率也逐渐增大,当Al2(SO4)3添加量>5.00×10-5mol/g窖泥之后,菌体数较低,HA含量也极低。由于窖泥样品中的腐植酸、矿物质等杂质的自发荧光强烈,严重干扰了真细菌和古生菌的可视化和定量检出,结合HA要有较高的去除率及菌体损失率尽量要少,因此,确定Al2(SO4)3的添加量为4.17×10-5mol/g窖泥。
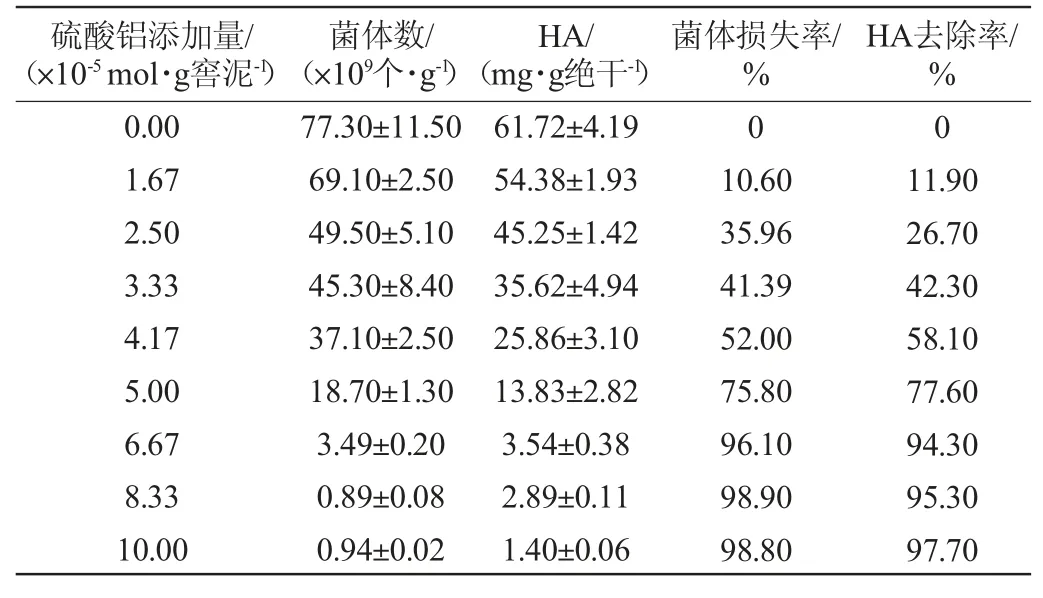
表1 不同Al2(SO4)3添加量对菌体数及腐殖酸含量的影响Table 1 Effects of different Al2(SO4)3 addition on microbial number and humic acid contents
2.2 FISH法测定窖泥样品中细菌的回收率
将纯培养的E.coli、L.planetarium菌体加至窖泥中,采用FISH法测定窖泥样品中E.coli、L.planetarium的菌体数,荧光图见图4。由图4可知,与吴冬梅等[16]的研究结果一致,经过预处理后,菌体在荧光显微镜下清晰可辩,窖泥样品中的腐植酸、矿物质等杂质的自发荧光干扰明显降低;通过对比,可见L.planetarium的菌体个体较大。采用FISH法检测E.coli、L.planetarium的菌体数量,二者菌体的回收率分别为62.50%和55.44%,前者回收率略高,可能是由于该菌是革兰氏阴性菌,探针更易进入菌体,杂交效果较好;还有可能是因为L.planetarium菌体个体相对略大可能在低速离心时菌体损失略大而使得其检出率略低,这与BOUVIER T等[22]的研究结果相似。此外,BATTION T J等[23]基于细菌通用探针EUB338,采用FISH法检测因时间而异冰川溪流泥沙沉积物中菌体的检出率为22%~56%。说明针对窖泥这个复杂样品,该预处理条件对窖泥微生物的FISH检测是可行的。
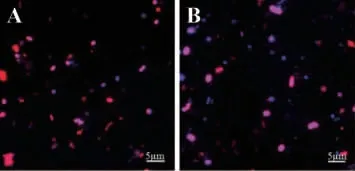
图4 添加大肠杆菌(A)及植物乳杆菌(B)窖泥样品微生物荧光图Fig. 4 Microbial fluorescence of the pit mud samples with Escherichia coli (A) and Lactobacillus planetarium (B) addition
2.3 FISH法检测不同窖龄窖池窖泥微生物数量的结果
不同窖龄窖泥微生物的FISH检测结果见图5及表2。
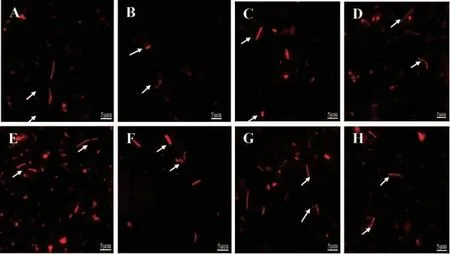
图5 不同窖龄窖泥样品微生物荧光图Fig. 5 Microbial fluorescence of different pit age
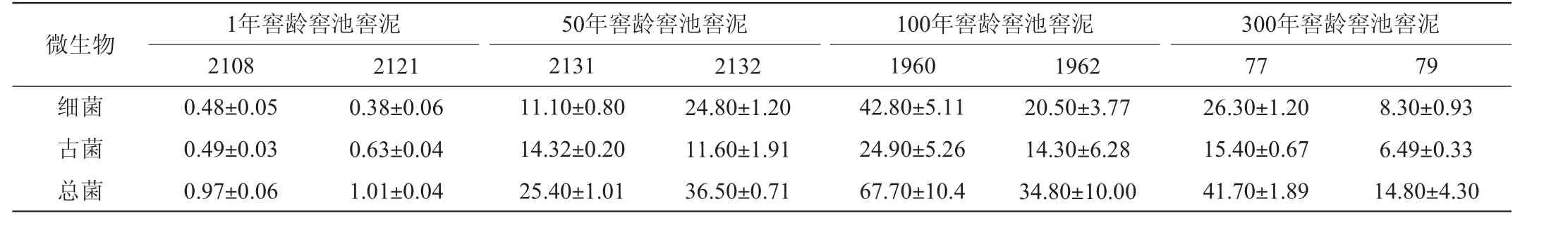
表2 FISH法检测不同窖龄窖泥样品中菌体量Table 2 Number of cells in different pit mud samples detected by FISH×108个/g
由图5可知,窖泥样品经Al2(SO4)3处理后,菌体可辨,菌体呈杆状、螺旋状及球状。由表2可知,随着窖龄的增加,窖泥样品中细菌、古菌及菌体总数总体均呈现出先增加后降低的趋势,且基本上在100年窖龄窖池窖泥中达到最高,而在1年窖龄窖池窖泥中菌体量最少,总菌数仅为1×108个/g左右,这可能是菌体在特定环境中逐渐驯化的结果。这与一些文献中的结论是较吻合的,如岳元媛等[24]利用平板涂布可培法研究泸州老窖不同窖龄窖泥样品中兼性厌氧细菌数量,得出新窖泥中微生物数量较老窖泥低;胡承等[25]研究不同窖龄窖泥样品中微生物数量,结果表明老窖泥中的厌氧异氧菌、甲烷菌、己酸菌及硫酸盐还原菌的数量都比新窖泥中多;余有贵等[26]研究湖南湘窖酒业不同窖龄窖泥样品(0年、2年、16年、33年),结果表明微生物各类群总数呈上升趋势。
3 结论
本研究确定窖泥样品的最优预处理条件为料液比1∶16(g∶mL)、离心转速800 r/min、超声分散时间60 s、Al2(SO4)3添加量为4.17×10-5mol/g窖泥。在此条件下,将E.coli、L.planetarium培养物分别添加到窖泥样品中,采用FISH法检测到两种菌的菌体回收率分别为62.50%和55.44%,说明该条件对于窖泥这个复杂样品的FISH检测是可行的,可以提高总菌数的检出量、准确性和减少窖泥自荧光的干扰,显著改善FISH可视化效果。采用优化后的条件对不同窖龄窖池窖泥进行预处理,应用FISH法研究窖泥样品中微生物群落结构,结果表明,随着窖龄的增加,窖泥样品中细菌、古菌及菌体总数差异明显,总体呈现出先增加后降低的趋势,基本上呈现出在100年窖龄的窖泥样品中,微生物总量最高。

