砧穗互作对菊花嫁接苗耐盐性的影响
孟蕊,刘晔,赵爽,房伟民,蒋甲福,陈素梅,陈发棣,管志勇
砧穗互作对菊花嫁接苗耐盐性的影响
孟蕊,刘晔,赵爽,房伟民,蒋甲福,陈素梅,陈发棣,管志勇
南京农业大学园艺学院/作物遗传与种质创新国家重点实验室/农业农村部景观农业重点实验室,南京 210095
【】揭示黄蒿嫁接菊花对菊花耐盐性的影响,明确砧穗互作影响菊花耐盐性的机理。测定120 mmol·L-1NaCl胁迫下的‘钟山嫣红’的扦插苗(自根苗)、扦插苗的自根嫁接苗(自接苗)、黄蒿砧木嫁接菊花(异根嫁接苗)的生理指标和叶片、茎段的Na+、K+离子含量。NaCl胁迫下,异根嫁接苗叶片受害率低于‘钟山嫣红’的自根苗和自接苗。异根嫁接苗的叶片相对电导率、丙二醛含量、脯氨酸含量均低于自接苗和自根苗,叶绿素含量、超氧化物歧化酶(SOD)、过氧化物酶(POD)含量高于自接苗和自根苗。异根嫁接苗中部与下部叶的Na+含量、Na+/K+比值均最低,其次是自接苗,最高是自根苗。自根嫁接与异根嫁接苗上部叶的Na+含量差异不显著;异根嫁接苗接口以上茎段的Na+含量显著低于自接苗和自根苗,而自接苗和自根苗上部茎段的Na+无显著差异,接口以下的黄蒿茎段Na+浓度和Na+/K+是同为砧木的菊花茎段中的两倍。菊花自接苗运输到中部、下部叶片的离子显著少于自根苗,以黄蒿作为砧木嫁接菊花后,砧木对Na+较高的富集能力降低了Na+在嫁接接口上部的积累,同时,菊花异根嫁接苗表现出更强的光合性能和抗氧化酶活性。因此,以黄蒿作砧木的‘钟山嫣红’异根嫁接苗耐盐性提高,是砧穗愈合导致向上运输到叶片的离子减少和黄蒿砧木滞留更多Na+的共同作用。
嫁接;菊花;黄蒿;生理指标;Na+;K+;耐盐性
0 引言
【研究意义】园林小菊是经长期人工杂交育种所得,其花色艳丽、植株低矮、株型紧凑,是理想的园林造景花卉,被广泛应用于园林、花海等景观营造和城市街道绿化美化[1]。但是菊花在沿海滩涂及干旱内陆盐碱地区栽培易受到盐胁迫而出现生长障碍,或长期在设施条件下栽培由于土壤次生盐渍化而易出现生理障碍[2]。‘钟山嫣红’为笔者课题自主选育并在近年广泛推广的园林小菊之一,该品种灌丛圆整、开花密集、花色浓艳、观赏价值高,但在苏北沿海等盐碱地区使用时,与多数园林小菊品种一样,有明显的盐害症状。因此,研究菊花通过嫁接能否提高其耐盐性,具有园林建设实践需求性及品种代表性。盐胁迫对植物造成的伤害首先是渗透胁迫,然后是离子失调引起的毒害和营养失衡,以及氧化胁迫导致的生理生化代谢紊乱和有毒物质积累,并最终影响植物的生长发育[3-6]。嫁接技术可利用砧木为接穗提供良好的根系,从而提高植株抵抗逆境的能力,保证植物在逆境环境下正常生长[7]。研究砧木嫁接对菊花耐盐性的影响,可以进一步了解砧穗互作影响菊花耐盐性的机制,并且为园林小菊的推广应用提供实践依据。【前人研究进展】研究表明,嫁接可以在多个方面提高植物的耐盐性,包括调节Na+、K+的吸收和分配[8-11],提高光合性能[12-13],增强抗氧化能力[14-15],以及增加可溶性糖、甜菜碱、可溶性蛋白等渗透调节物质的含量[16],这些因素综合构成了嫁接提高植物耐盐性的生理基础。黄蒿()是菊科蒿属的植物[17],以黄蒿为砧木嫁接菊花,可以提高菊花的抗旱性[18]、抗蚜性[19],缓解菊花的连作障碍[20]。可见,以黄蒿为砧木嫁接菊花是提高菊花抗性的有效手段。嫁接菊花的耐盐性研究发现,盐胁迫下以黄蒿为砧木的嫁接苗生物量、净光合速率、呼吸速率、抗氧化酶活性(SOD、CAT、APX)等均显著高于自根苗,而MDA、超氧阴离子自由基(O2-)增幅明显低于自根苗;并且异根嫁接苗茎、叶等部位的Na+含量均显著低于自根苗,砧木根系Na+含量高于自根苗,根、茎、叶的Ca2+、Mg2+、K+含量显著高于自根苗[2]。【本研究切入点】盐胁迫下,离子在异根嫁接苗不同器官的区域化分布是理解嫁接提高菊花耐盐性的重要因素,嫁接操作形成的伤口及愈合过程、不同的砧木与接穗组合是否会影响菊花的耐盐性,离子的分配策略是否因此而发生变化,已有的研究尚不能对上述问题完全阐述清楚。【拟解决的关键问题】本研究以黄蒿为砧木,盐敏感品种园林小菊‘钟山嫣红’为接穗进行嫁接,设置菊花‘钟山嫣红’扦插苗(自根苗)和扦插苗自根嫁接苗(自接苗)2组对照,研究NaCl胁迫条件下[21],嫁接对菊花耐盐性的影响以及盐离子在菊花(含砧木)不同器官的分配策略以及嫁接本身是否也能影响抗性,研究嫁接对菊花生理特性以及菊花不同部位Na+、K+含量的影响,旨在初步揭示嫁接提高菊花耐盐性的机理,为扩大园林小菊的应用范围提供参考。
1 材料与方法
1.1 试验材料
供试植物材料黄蒿()和园林小菊‘钟山嫣红’,均由南京农业大学中国菊花种质资源保存中心提供。
1.2 试验处理
2019年2月中旬在玻璃温室内播种黄蒿种子,栽培基质为复合基质(草炭﹕珍珠岩=2﹕1),4月初选择生长良好的黄蒿幼苗移栽至塑料盆(直径19 cm,高17 cm)中。4月5日从菊花‘钟山嫣红’的母株上选择健壮的插穗进行扦插,4月20日生根后转移至塑料盆中用于菊花自根嫁接,同时扦插菊花‘钟山嫣红’。4月30日,黄蒿长至株高30 cm、茎粗5 mm时,菊花长至8片叶、茎粗5 mm时,采用劈接法,分别以黄蒿和菊花作为砧木进行嫁接。5月15日选择长势一致的异根嫁接苗、自接苗、自根扦插苗各60株进行试验。
将材料移于盛有1/2 Hogland营养液的塑料周转箱(体积23.4 L)内进行通气水培,气泵24 h·d-1通气。缓苗生长7 d后,分别在清水和120 mmol·L-1NaCl条件下进行胁迫处理,胁迫浓度以每日60 mmol·L-1的浓度增加,在同一时间达到不同处理浓度,每5 d更换一次营养液,每处理20株,重复3次。
1.3 测定方法
盐处理后第0、1、4和8天通过描叶称重法[22]结合Smartscape图像分析软件测量受害叶(黄叶、萎蔫叶、干枯叶)叶面积,计算叶片受害面积比率(叶片受害面积比率=受害叶叶面积/单株总叶面积),每处理测定6个单株,取平均值。
盐处理后的第0、1、4和8天,选取自上向下第3片完全展开叶,用美国LI-COR公司产的LI-6400便携式光合测定系统,设定光量子通量密度为800 μmol·m-2·s-1,温度25℃,CO2浓度为390 μL·L-1,于上午9:00—11:00测定净光合速率。
盐处理后的第0、1、4和8天,选取自上向下第3片完全展开叶测定叶绿素含量、叶片相对电导率、丙二醛含量、脯氨酸含量、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性。叶绿素含量采用乙醇浸提比色法[23],质膜透性采用电导率法[24]。游离脯氨酸含量采用酸性茚三酮法[25],MDA含量测定采用硫代巴比妥酸(TBA)比色法[26],SOD活性测定采用氮蓝四唑(NBT)还原法,POD活性测定采用愈创木酚显色法,CAT采用紫外吸收法进行测定[27]。
盐处理后的第0、1、4和8天,取菊花上部(自上向下第1片完全展开叶)、中部(自上向下第3—4片完全展开叶)、下部(自上向下第8片完全展开叶)叶片,嫁接接口处向上1.5 cm的茎和嫁接接口处向下1.5 cm黄蒿的茎(自根苗取与自接苗相同位置菊花的茎),用去离子水冲洗3次,再用干净的吸水纸吸干水分,置于烘箱中105℃杀青15 min,再于75℃下烘干至恒重,用研钵研成粉末,过40目筛。使用微波消解仪进行消解,称取不同部位烘干样品50 mg至干燥消化管中,添加65%浓HNO3和30% H2O2(比例4﹕1)。从室温10 min匀速升温到165℃,保温15 min,然后风冷降温。消解完成后用超纯水定容至25 ml,稀释母液后,用电感耦合等离子体发射光谱仪(ICP-MS)测定Na+、K+浓度[28]。
1.4 数据处理和分析方法
采用Microsoft Excel 2003软件对试验数据进行处理和绘图,使用SPSS 23.0 Duncan’s多重比较法进行统计分析(<0.05)。
2 结果
2.1 嫁接降低了菊花叶面积受害比率
如表1所示,随着NaCl胁迫时间的延长,各处理的叶面积受害比率均有所升高。自根苗、自接苗的叶片分别在盐处理的第1天和第4天开始出现明显的受害症状,叶面积受害比率随着胁迫时间的延长逐渐升高,而异根嫁接苗直到胁迫的第8天才有轻微伤害,且异根嫁接苗的叶面积受害比率明显低于自根苗和自接苗;自根苗、自接苗的根系在第8天有明显发黑现象,而异根嫁接苗黄蒿砧木的茎段粗壮、根系发达,未见明显颜色变化。图1是自根苗、自接苗和异根嫁接苗在无NaCl(图1-A)和120 mmol∙L-1NaCl(图1-B)处理0、1、4和8 d的形态变化。由此可见,黄蒿嫁接缓解了盐胁迫对菊花造成的伤害。
2.2 嫁接对光合速率和叶绿素含量的影响
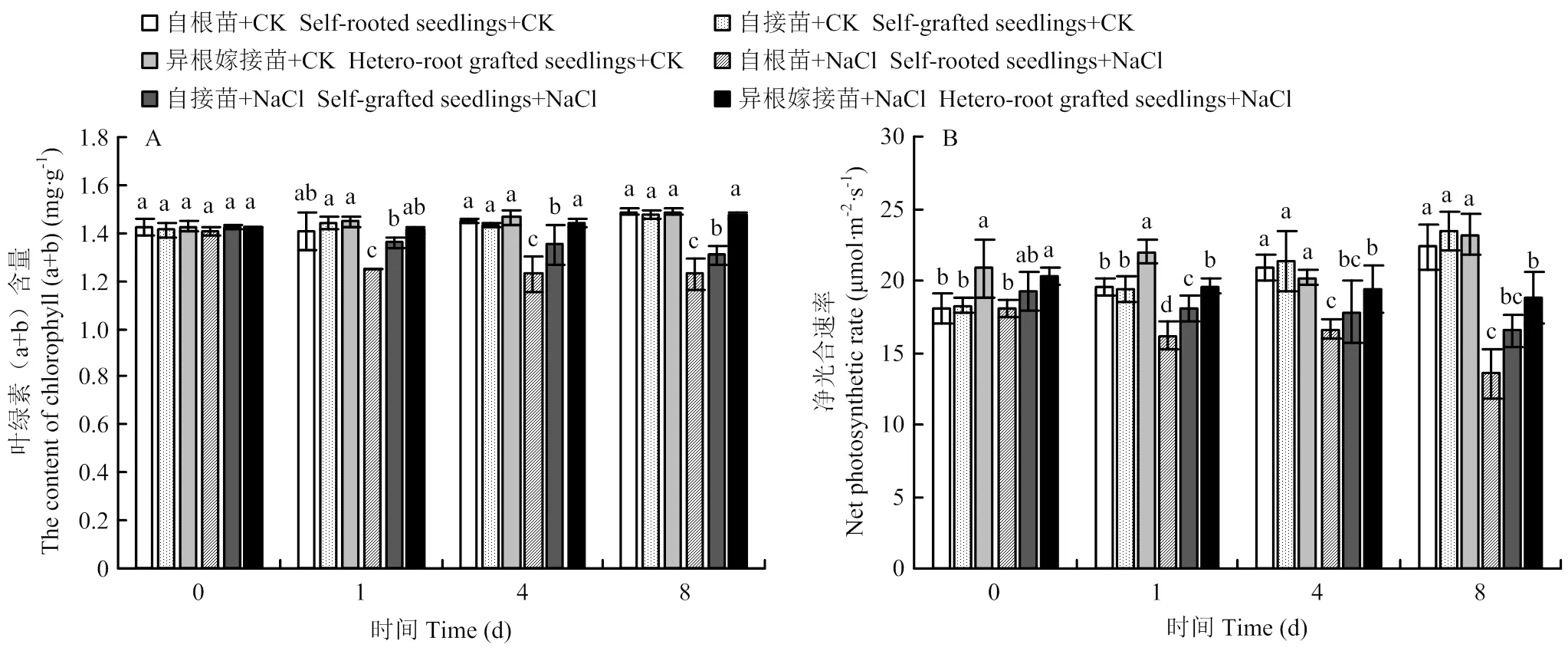
如图2-A所示,随着NaCl胁迫时间的延长,叶绿素(a+b)含量呈逐渐下降的趋势。在整个NaCl处理期间,异根嫁接苗叶绿素含量高于自根苗和自接苗,且降低幅度显著低于自根苗和自接苗。第8天时,自根苗、自接苗和异根嫁接苗叶片叶绿素含量分别为对照的82.47%、88.57%和98.78%。对照条件下,各组材料的净光合速率在整个处理期间保持相对稳定的状态;盐胁迫下,自根苗、自接苗和异根嫁接苗的净光合速率随着时间的延长逐渐下降。第8天时,与对照相比,自根苗、自接苗和异根嫁接苗叶片净光合速率分别降低33.56%、27.57%、15.15%,且异根嫁接苗的净光合速率始终高于自根苗和自接苗(图2-B)。结果表明,嫁接缓解了盐胁迫诱导对菊花幼苗生长的抑制,改善了植株的光合能力。嫁接使叶片光和色素的含量保持在较高水平,使光合系统保持相对稳定的状态,降低了对菊花生长发育的影响。
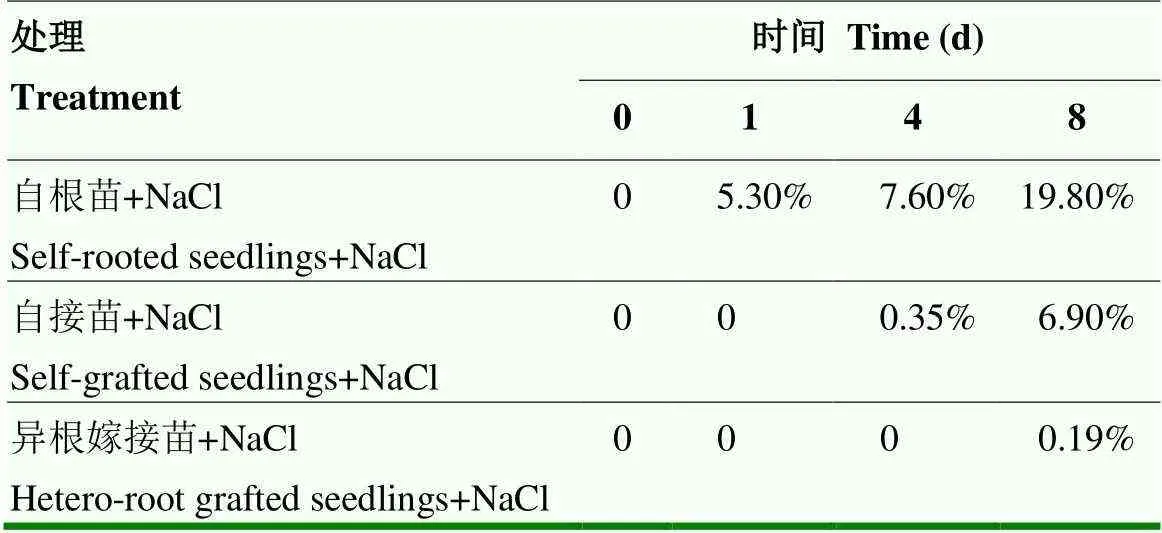
表1 单株叶面积受害比率

a-0、a-1、a-4、a-8表示自根苗在无胁迫第0、1、4、8天的形态;b-0、b-1、b-4、b-8表示自接苗在无NaCl胁迫第0、1、4、8天的形态;c-0、c-1、c-4、c-8表示异根嫁接苗在无NaCl胁迫第0、1、4、8天的形态;d-0、d-1、d-4、d-8表示自根苗在120 mmol∙L-1 NaCl胁迫第0、1、4、8天的形态;e-0、e-1、e-4、e-8表示自接苗在120 mmol∙L-1 NaCl胁迫第0、1、4、8天的形态;f-0、f-1、f-4、f-8表示异根嫁接苗在120 mmol∙L-1 NaCl胁迫第0、1、4、8天的形态
2.3 嫁接对菊花叶片相对电导率、MDA以及脯氨酸含量的影响
由图3可知,随着盐胁迫时间的延长,各处理的叶片相对电导率和MDA含量均逐渐升高。第8天时,盐胁迫下自根苗、自接苗和异根嫁接苗的相对电导率分别为对照的2.18、1.85、1.25倍,MDA含量分别为对照的1.69、1.62、1.08倍。表明盐胁迫下异根嫁接苗叶片的质膜透性和受害程度显著低于自根苗和自接苗。
如图4所示,随着胁迫时间的延长,各处理的脯氨酸含量呈逐渐上升的趋势,并在第8天达到最大值。从第4天开始,各处理之间表现出显著差异。到第8天时,盐胁迫下自根苗、自接苗和异根嫁接苗的脯氨酸含量分别为对照的14.08、15.0、6.24倍,自根苗含量最高,异根嫁接苗最低,自接苗居中。
不同小写字母表示同一时间不同处理间差异显著(P<0.05)。下同
2.4 嫁接对菊花抗氧化系统的影响
对照条件下,在不同的时间节点,自根苗、自接苗和异根嫁接苗的SOD活性存在一定波动,异根嫁接苗的SOD活性始终高于自根苗和自根嫁接苗。盐胁迫下,随着时间的延长,各组处理均表现出先下降再上升的趋势。第4天时,自根苗的SOD活性降到最低,仅为对照的59.74%,自接苗和异根嫁接苗在处理后的第1天降到最低,分别约为对照的89.40%、98.41%。异根嫁接苗的SOD活性降低幅度小,且活性始终高于自根苗和自接苗(表2)。由此可见,SOD可能在异根嫁接苗缓解盐胁迫的过程中发挥了重要作用。
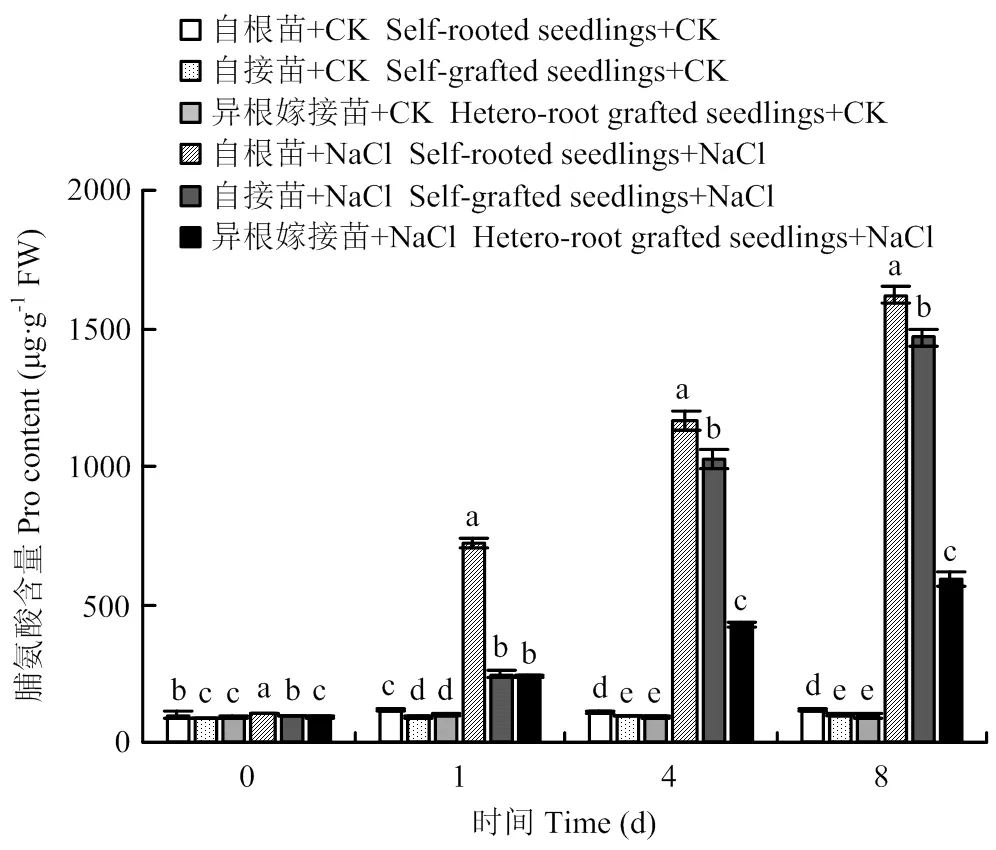
图4 嫁接对菊花‘钟山嫣红’在120 mmol·L-1 NaCl胁迫下脯氨酸含量的影响
对照条件下,自根苗、自接苗和异根嫁接苗的POD活性保持在相对稳定的状态,且各处理间基本无显著性差异。盐胁迫下,随着时间的延长,各处理的POD活性逐渐下降,第8天时,自根苗、自接苗和异根嫁接苗的POD活性分别为对照的88.63%、85.46%、97.81%,异根嫁接苗POD活性降低幅度较小,且活性显著高于自根苗和自接苗。在盐胁迫下,自根苗、自接苗和异根嫁接苗的CAT活性表现出先升高后降低的趋势。在胁迫的整个过程中,自接苗的CAT活性显著高于自根苗和异根嫁接苗(表2)。
2.5 嫁接对菊花各部位Na+、K+含量及Na+/K+比值的影响
2.5.1 对上部叶片的影响 随着NaCl胁迫时间的延长,自根苗、自接苗和异根嫁接苗上部叶片的Na+含量均呈逐渐上升的趋势。自根苗的Na+含量始终高于自接苗和异根嫁接苗,自接苗和异根嫁接苗之间无显著性差异。到第8天时,盐胁迫下自根苗、自接苗和异根嫁接苗上部叶片的Na+含量分别为对照的56.01、52.5和45.93倍(图5-A)。NaCl胁迫对自根苗、自接苗和异根嫁接苗上部叶片的K+含量产生了影响,其中,自根苗的K+含量显著下降,变化最为显著(图5-B)。Na+/K+比值的变化趋势与Na+一致,在处理第1、4和8天,自根苗的Na+/K+比值显著低于自接苗和异根嫁接苗,自接苗和异根嫁接之间无显著性差异(图5-C)。
2.5.2 对中部叶片的影响 如图6-A所示,随着NaCl胁迫时间的延长,自根苗、自接苗和异根嫁接苗中部叶片的Na+含量均呈逐渐上升的趋势。在盐胁迫的第1天和第4天,自根苗的Na+含量始终高于自接苗和异根嫁接苗,自接苗和异根嫁接苗之间不表现显著性差异。到第8天时,盐胁迫下各组间表现出显著差异,其中自根苗的Na+含量最高,为对照的39倍;自接苗次之,为对照的25倍;异根嫁接苗最低。
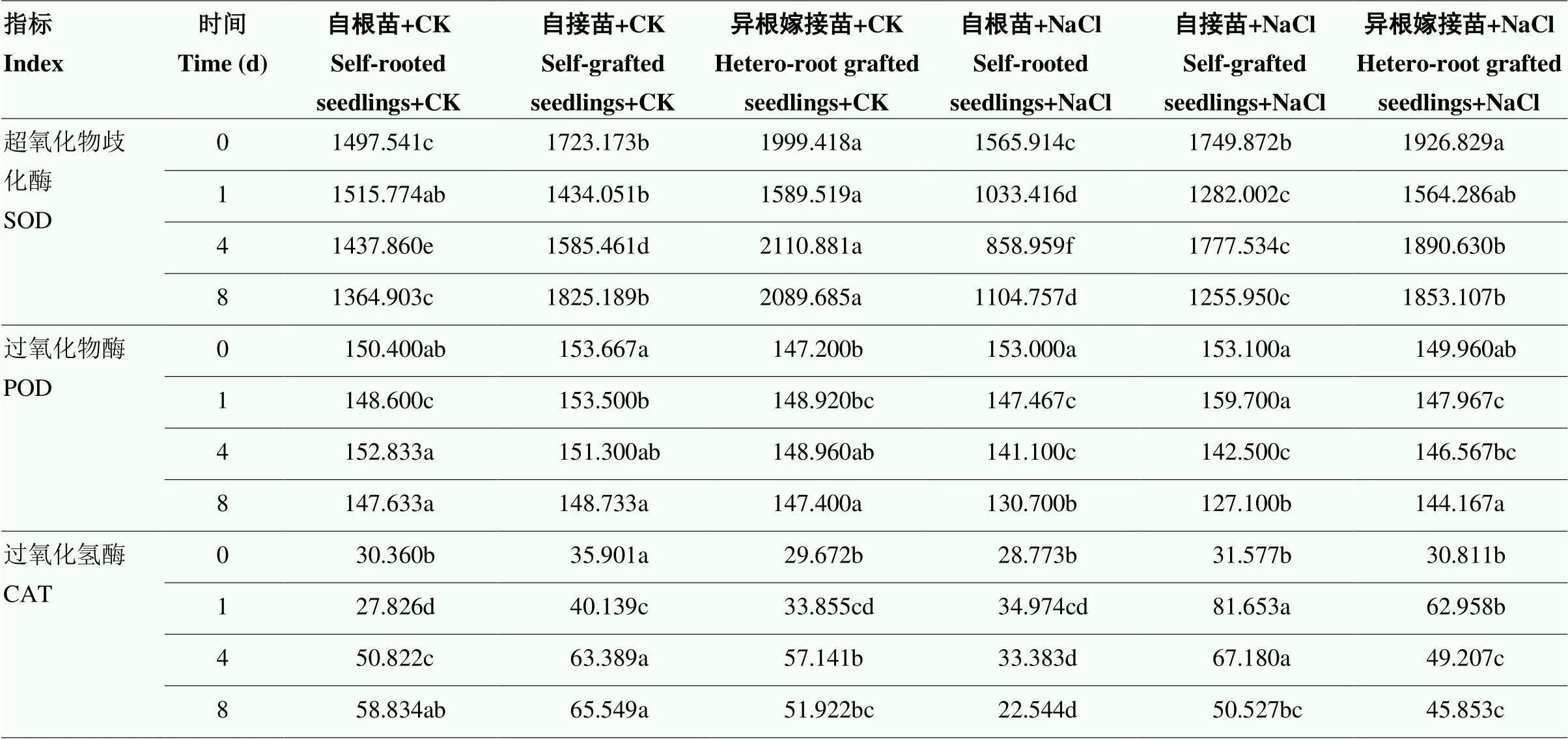
表2 嫁接对菊花‘钟山嫣红’在120 mmol·L-1 NaCl胁迫下叶片SOD、POD、CAT活性的影响
不同小写字母表示同一时间不同处理间差异显著(<0.05)。下同
Different lowercase letters indicate the difference between different treatments at the same time are significant (<0.05). The same as below
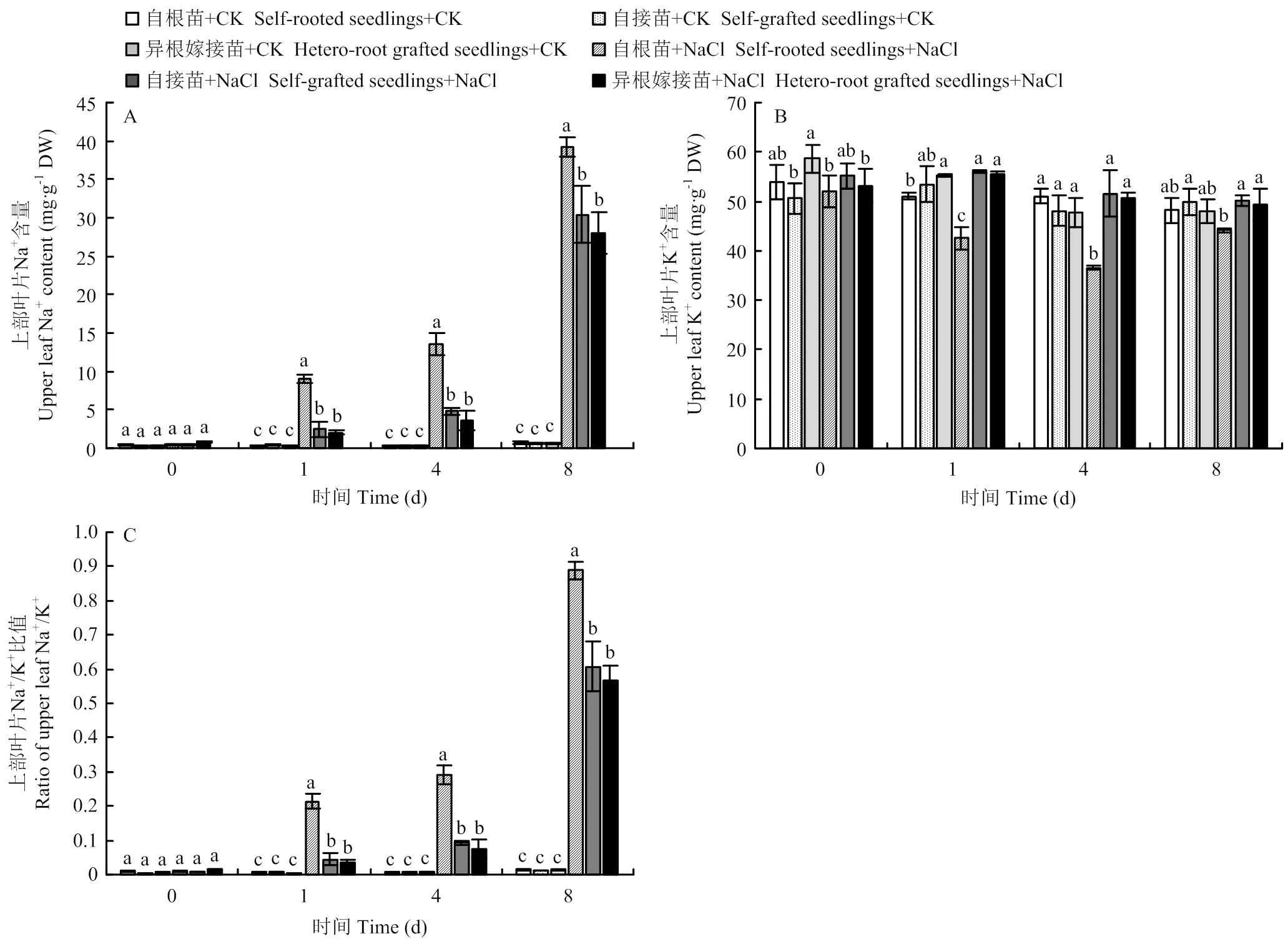
图5 嫁接对菊花‘钟山嫣红’在120 mmol·L-1 NaCl胁迫下的上部叶片Na+(A)、K+(B)含量及Na+/K+(C)的影响
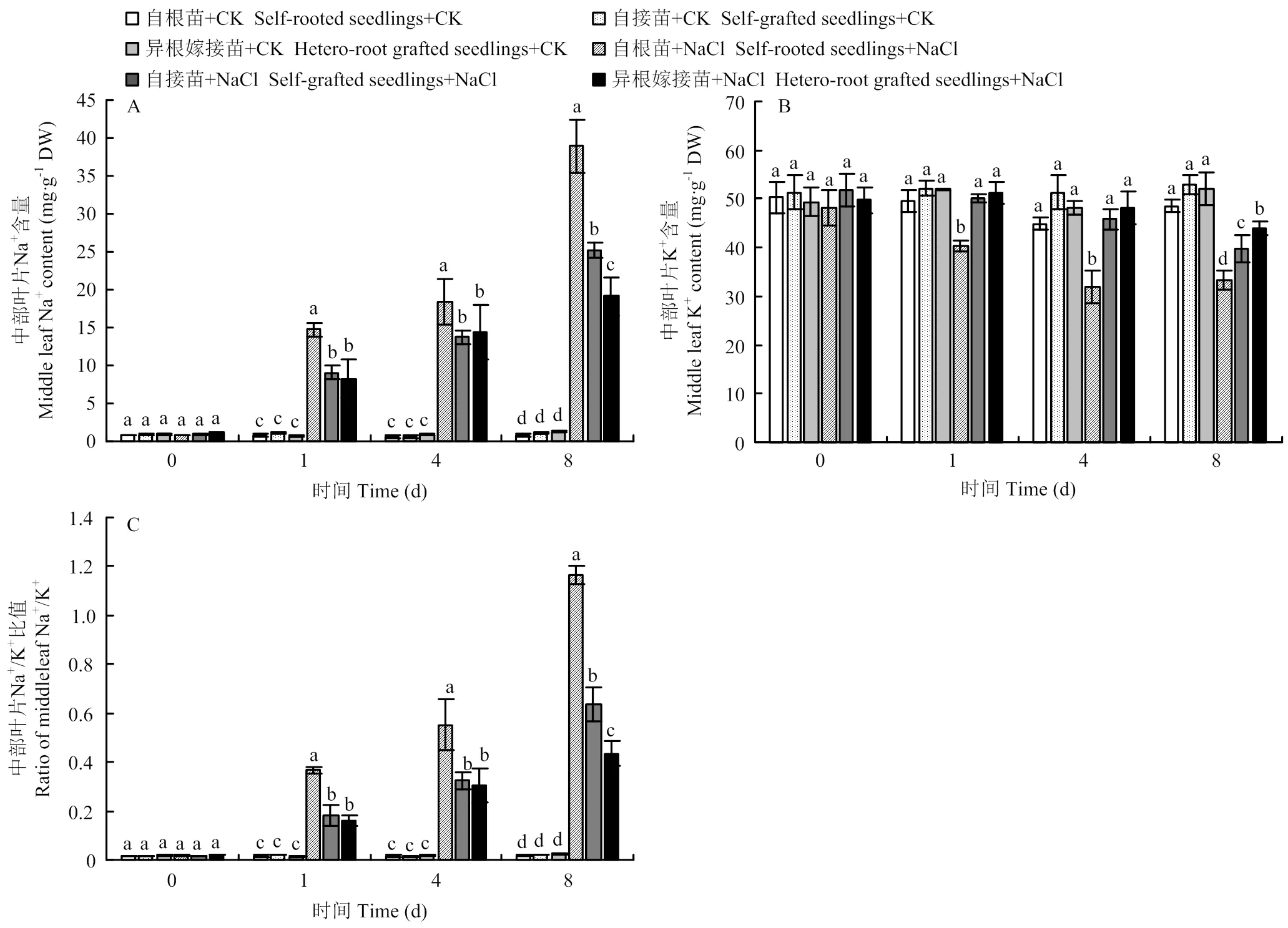
图6 嫁接对菊花‘钟山嫣红’在120 mmol·L-1 NaCl胁迫中部叶Na+(A)、K+(B)含量及Na+/K+(C)的影响
受NaCl胁迫的影响,随着时间延长,自根苗、自接苗和异根嫁接苗中部叶片的K+含量逐渐降低,在第8天时,自根苗、自接苗和异根嫁接苗中部叶片的K+含量分别为对照的68.74%、74.47%、84.60%(图6-B)。各处理的Na+/K+比值的变化与Na+趋势一致,均随胁迫时间的延长而逐渐升高,但是异根嫁接苗的Na+/K+比值显著低于自根苗和自接苗(图6-C)。结果表明,嫁接降低了菊花中部叶片Na+的积累,使Na+/K+比值维持在较低水平,缓解了对叶片造成的伤害。
2.5.3 对下部叶片的影响 随着NaCl胁迫时间的延长,自根苗、自接苗和异根嫁接苗下部叶片的Na+含量均呈逐渐上升的趋势。在盐胁迫的第1和第4天,自根苗的Na+含量始终高于自接苗和异根嫁接苗,自接苗和异根嫁接苗之间不表现显著性差异。到第8天时,盐胁迫下各组间表现出显著性差异,其中自根苗的Na+含量最高,为对照的45.61倍;自接苗次之,为对照的30.21倍;异根嫁接苗最低,仅为对照的25.56倍(图7-A)。
如图7-B所示,随着胁迫时间的延长,自根苗下部叶片的K+含量逐渐降低。自接苗和异根嫁接苗显著降低,自根苗、自接苗和异根嫁接苗中部叶片的K+含量分别为对照的31.50%、75.25%、84.58%。同样,各处理材料的Na+/K+比值在盐胁迫下显著提高,第8天时,自根苗、自接苗和异根嫁接苗的Na+/K+比值分别为2.45、1.12、0.75,异根嫁接苗的Na+/K+比值最低(图7-C)。结果表明,盐胁迫下菊花下部叶片聚集了大量的Na+,嫁接降低了菊花下部叶片Na+的积累,使Na+/K+比值显著低于自根苗和自接苗,缓解了Na+对叶片造成的伤害。
2.5.4 对嫁接接口上部茎的影响 盐胁迫下,自根苗、自接苗和异根嫁接苗接口上部茎的Na+含量均显著上升。处理第8天时,异根嫁接苗的Na+含量显著低于自根苗和自接苗(图8-A)。同时,受盐胁迫影响,自根苗、自接苗和异根嫁接苗接口上部茎的K+含量显著降低(图8-B)。第8天时,异根嫁接苗Na+/K+比值低于自根苗和自接苗,但是差异不显著(图8-C)。
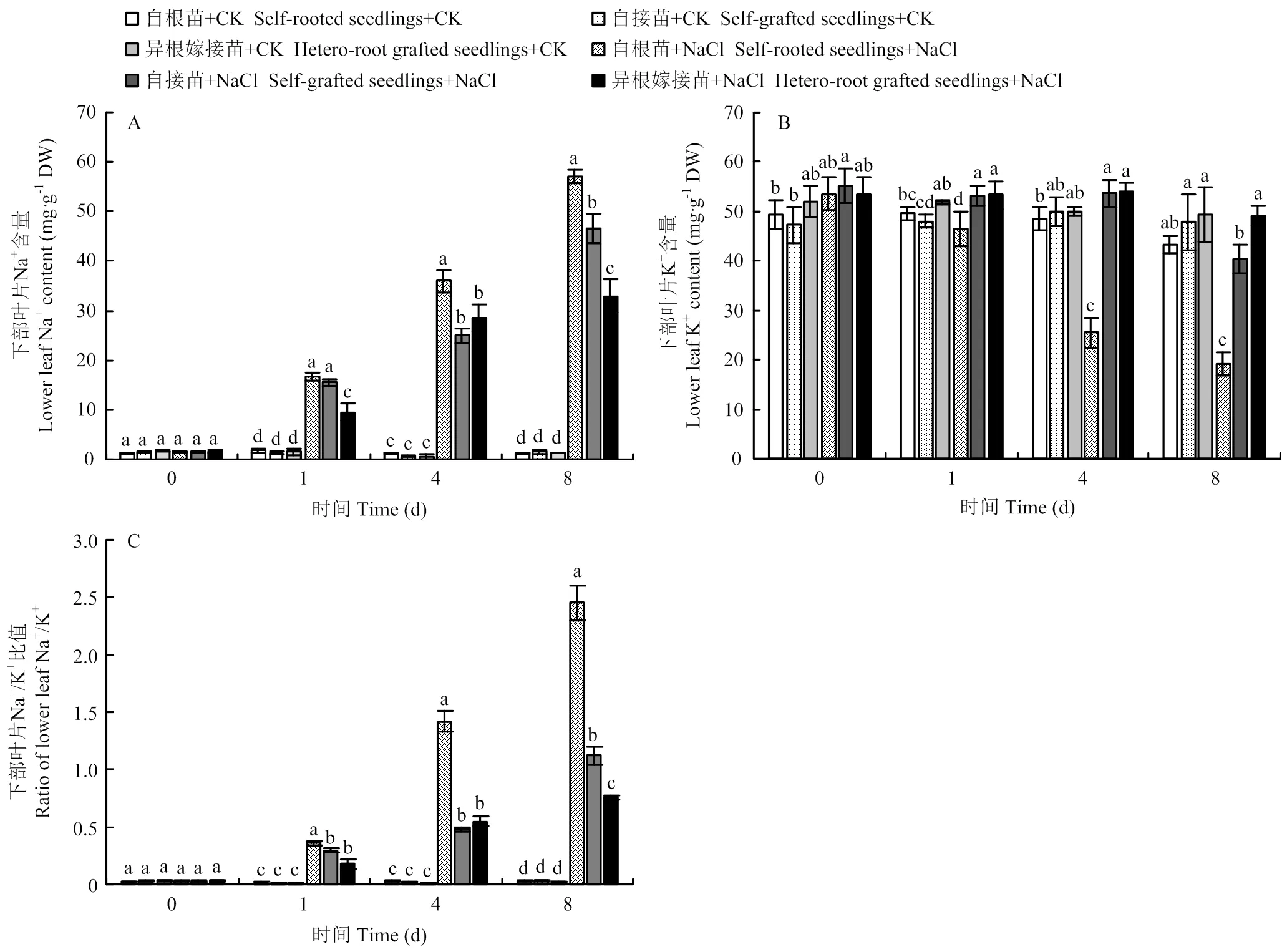
图7 嫁接对菊花‘钟山嫣红’在120 m mol·L-1 NaCl胁迫下的下部叶Na+(A)、K+(B)含量及Na+/K+(C)的影响
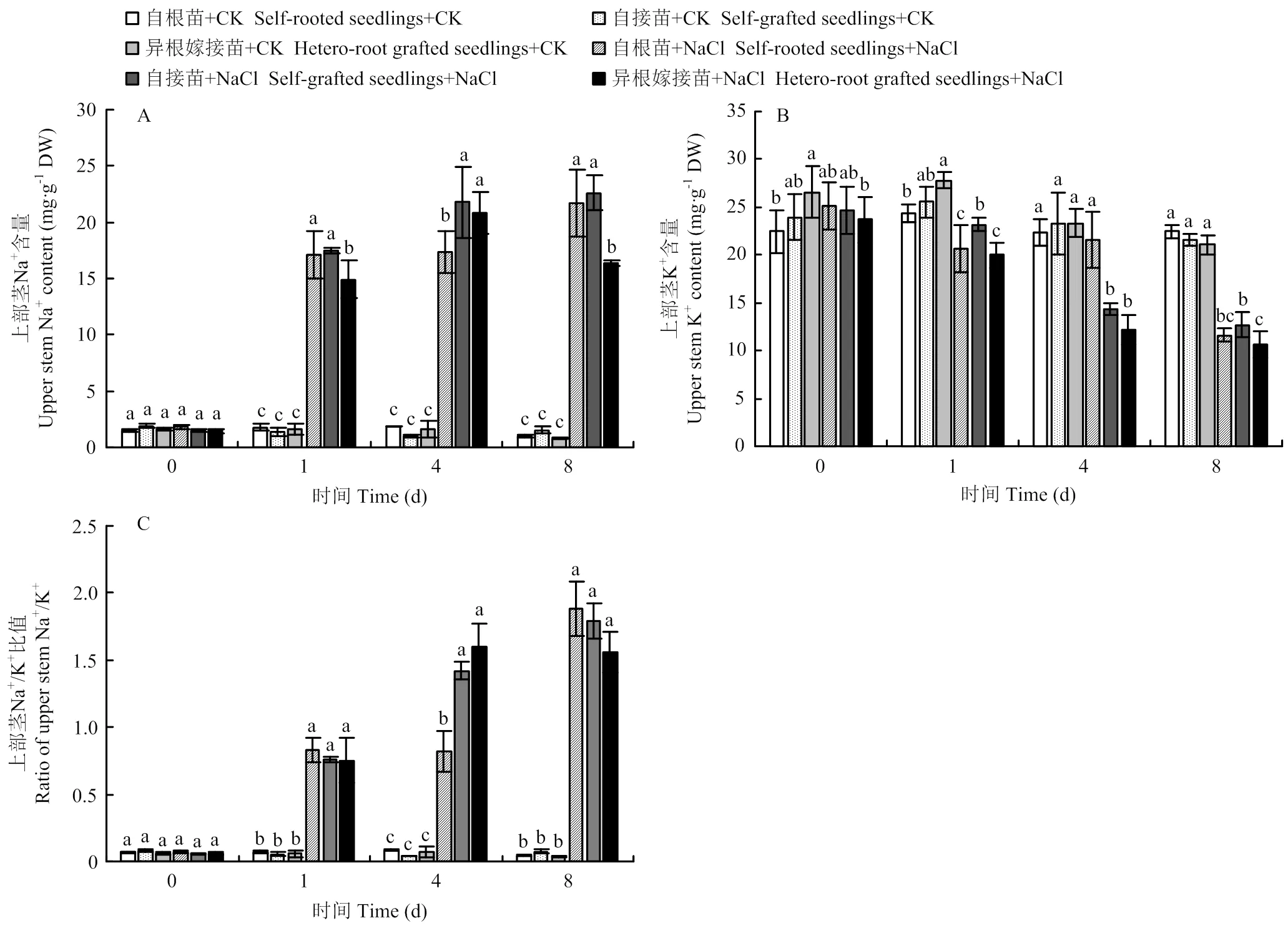
图8 嫁接对菊花‘钟山嫣红’在120 mmol·L-1NaCl胁迫下的上部茎Na+(A)、K+(B)含量及Na+/K+(C)的影响
Fig. 8 The effects of 120 mmol·L-1NaCl treatment on the upper stem Na+(A), K+(B) content and Na+/K+(C) of chrysanthemum Zhongshan Yanhong
2.5.5 对嫁接接口下部茎的影响 NaCl处理后,自根苗、自接苗和异根嫁接苗接口下部茎的Na+含量均显著性上升。从第4天开始,异根嫁接苗下部茎的Na+含量显著高于自根苗和自接苗,到第8天时,自根苗、自接苗和异根嫁接苗接口下部茎的Na+含量分别为对照的6.44、5.55、8.24倍(图9-A)。NaCl处理后,自根苗、自接苗和异根嫁接苗接口下部茎的K+含量均显著性降低,处理第8天时,自根苗、自接苗和异根嫁接苗的K+含量分别为对照的93.07%、79.30%、59.22%(图9-B)。在盐胁迫第4、8天时,异根嫁接苗的Na+/K+比值显著高于自根苗和自接苗,第8天时,异根嫁接苗的Na+/K+比值约为自根苗和自接苗的2倍(图9-C)。结果表明,与自根苗和自接苗相比,盐胁迫下异根嫁接苗嫁接接口下部茎中富集了更多的Na+,使向上运输的Na+含量减少,从而缓解盐胁迫对叶片产生的离子毒害。
3 讨论
3.1 嫁接与NaCl胁迫下菊花生理特性的关系
嫁接体通过砧木、接穗间的相互作用,可以改变植物体内原有的一系列生理、生化反应,对植株的生长、发育、抗性等诸多方面产生影响[29]。形态变化是植物受到逆境胁迫最直接的反映[30]。叶片是生物量构成器官之一,在胁迫下变化明显,而叶片干、鲜重与叶面积又存在正相关关系,故叶片受害面积的变化可在一定程度上反映整株植物的生物量变化[31]。本研究中,120 mmol·L-1NaCl处理下,异根嫁接苗的叶面积受害率显著低于自接苗,自接苗低于自根苗。这表明盐胁迫对砧木异根嫁接苗生物量的影响小于自根苗和自接苗,嫁接缓解了盐胁迫对植物生长造成的抑制,以及对叶片造成的伤害。
盐逆境会使植物的光合速率下降,叶绿素是表征光合利用率最重要的指标之一[32]。本研究中,异根嫁接苗的净光合速率、叶绿素(a+b)含量的降低幅度显著低于自根苗和自接苗。COLLA[33]和杨立飞等[34]的研究表明,盐胁迫下,嫁接黄瓜幼苗的净光合速率(Pn)和叶绿素含量下降幅度小于自根黄瓜,和本研究结果一致。表明嫁接缓解了离子对光合系统造成的伤害,降低了叶绿素的降解,使异根嫁接苗的光合性能高于自接苗和自根苗,从而降低了异根嫁接苗叶片的受害程度。

图9 嫁接对菊花‘钟山嫣红’在120 mmol·L-1 NaCl胁迫下的下部茎Na+(A)、K+(B)含量及Na+/K+(C)的影响
植物可以通过抗氧化酶系统清除氧自由基,阻止细胞氧化损伤,达到在逆境环境中生存的目的,其中,抗氧化酶主要有超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)[35]。此前有多项研究表明,盐胁迫下番茄[36]、辣椒[37]和黄瓜[38]嫁接苗的抗氧化酶活性均高于自根苗,表明嫁接对盐胁迫下植物的抗氧化系统起到了积极作用。本研究中,异根嫁接苗的SOD活性在对照条件和NaCl胁迫下均高于自接苗和自根苗,这表明砧穗互作赋予了异根嫁接苗更高的SOD活性,同样,异根嫁接苗的POD活性在盐胁迫下高于自根苗和自接苗,但是CAT活性低于自接苗。WANG[39]等在研究抗氧化系统对不同品种棉花耐盐性的差异影响时发现,不同材料在盐胁迫下会诱导一种或几种抗氧化酶,并不是所有的抗氧化酶都会参与到ROS的清除。因此,本研究中SOD和POD在异根嫁接苗适应盐胁迫的过程中发挥了重要作用。
在盐胁迫条件下,细胞质膜首先受到盐离子胁迫影响而产生胁变,导致质膜受伤。同时,盐分能增加细胞膜透性,加强脂质过氧化作用,最终导致膜系统的破坏[30]。相对电导率和MDA含量分别是衡量质膜透性和质膜受害程度的指标,它们的值越大,质膜受到的伤害也越大。本研究中,异根嫁接苗叶片的相对电导率和MDA含量增加幅度最低,自接苗居中,自根苗最高,表明异根嫁接苗叶片质膜受到的伤害小于自接苗,而自接苗小于自根苗。脯氨酸在盐害条件下的积累起到了胞质渗透压调节剂的作用,保护膜与酶的结构,缓解胁迫压力[40]。本研究各材料的受害程度与脯氨酸含量表现出正相关的关系,反映了材料在盐胁迫下的适应性反应。
同时,自根嫁接苗的受害程度轻于自根苗,自根苗‘钟山嫣红’本身为盐敏感品种,以其自身作为砧木嫁接形成的嫁接植株耐盐表现优于自根苗,与嫁接伤口形成引发的“交叉适应性”有关。有研究表明,植物在受重度机械损伤处理后,SOD、POD、PPO和PAL等保护酶活性均被诱导增加[41]。本试验中,自接苗的SOD、CAT活性均显著高于自根苗的活性,也支持了这一观点。
3.2 嫁接与NaCl胁迫下菊花各部位离子分布的关系
Munns等[42]提出,增强耐盐性有两种途径,一是降低渗透胁迫对植株长势的影响,二是通过降低有毒离子的浓度来维持植株长势和功能[43-44]。在盐胁迫下,Na+大量进入细胞,细胞内Na+增加,而K+外渗,使Na+/K+值增大,从而打破原有的离子平衡,当Na+/K+比值增大到阈值时植物即受害[30]。
本研究中,120 mmol·L-1NaCl胁迫下菊花各部位叶片的Na+含量差异显著,下部叶片的Na+含量、Na+/K+比值最高,中部和上部叶片的Na+含量接近。盐胁迫下,异根嫁接苗的接口下部茎(砧木茎)Na+离子含量、Na+/K+比值显著高于自根苗和自接苗,中部、下部叶片,以及接口上部茎的Na+含量、Na+/K+比值显著低于自接苗,而自接苗低于自根苗,K+含量高于自根苗和自接苗。这与黄蒿嫁接其他菊花品种的异根嫁接苗接穗各部分Na+含量低于菊花扦插苗的结果相同[2]。所以,黄蒿砧木对Na+的富集能力强于菊花茎,阻止了Na+向上的大量运输,使接穗部分的Na+/K+比值降低,这是黄蒿砧木嫁接提高菊花耐盐性的主要原因;嫁接会使接穗的导管面积、筛管面积变小,木质部生长减弱[45],推测嫁接伤口及砧穗愈合会在一定程度上影响离子的向上运输,使菊花自接苗接口以上部位叶片的Na+含量减少,其受害程度也低于自根苗。
阳艳娟等[46]的研究也发现,盐胁迫下嫁接西瓜苗将Na+更多地集中在根系和砧木茎,阻止了Na+向接穗地上部的大量运输,防止了离子毒害的发生,增强了嫁接西瓜植株的耐盐性。耐盐南瓜砧木嫁接限制了Na+从根部向地上部黄瓜接穗的长距离运输是嫁接苗耐盐性提高的原因。COBAN等[47]以耐盐砧木嫁接盐敏感番茄,发现耐盐砧木嫁接可以减少Na+向叶片的转运。HUANG等[48]以耐盐南瓜为砧木嫁接黄瓜,显著降低了接穗部分地上部Na+的含量,从而提高了黄瓜的耐盐性。进一步对根部进行X射线微区分析,结果表明耐盐砧木具有限制Na+进入接穗木质部的能力,避免由于过多的Na+在地上部分积累对植株造成伤害。嫁接作为一个特异的研究系统已被广泛应用于物质运输和信号的长距离传导机制等方面的研究[49]。砧木和接穗间物质的运输可能是引起嫁接植物性状改变的原因[50]。孙静宇[51]通过构建南瓜和黄瓜正反嫁接组合阐述了更加有说服力的砧穗互作关系,发现以耐盐南瓜为砧木的嫁接组合可有效限制Na+在地上部的积累,缓解地上部盐害程度,而以盐敏感黄瓜为砧木的嫁接组合,则不能限制Na+向地上部运输,表明耐盐南瓜砧木在嫁接黄瓜耐盐中的决定作用。进一步的研究证实南瓜的Na+特异转运蛋白基因通过限制Na+向根系木质部装载,减少了Na+向地上部运输,进而减少地上部Na+积累,是黄瓜接穗耐盐性增强的原因。此外,本试验中黄蒿砧木的Na+特异转运蛋白基因是否也在嫁接耐盐性提高中发挥了关键作用,有待进一步研究。
4 结论
相对于‘钟山嫣红’菊花的扦插苗,以黄蒿作为砧木、‘钟山嫣红’作为接穗进行嫁接后的菊花耐盐性有所提高。主要原因是异种砧木对Na+的有效截留,运输到‘钟山嫣红’茎段、中下部叶片的Na+减少;此外,嫁接切口损伤引发的“交叉适应性”导致了保护酶活性的升高,这些效应的共同作用减弱了盐胁迫对异根嫁接苗质膜造成的伤害,使叶片的光合速率维持在较高水平,从而在盐胁迫下保持了较好的生长状态。
[1] 郝洪波. 地被小菊的特点与园林应用. 南方农业: 园林花卉版, 2007, 1(6): 38-40.
HAO H B. Characteristics and ground application of ground cover chrysanthemum. South China Agriculture, 2007, 1(6): 38-40. (in Chinese)
[2] 房伟民. 嫁接对菊花抗逆性影响及切花菊栽培技术研究[D]. 南京: 南京农业大学, 2009.
FANG W M. Effect on abiotic stress tolerance of grafting in chrysanthemum and cultivated techniques for cutting chrysanthemum [D]. Nanjing: Nanjing Agricultural University, 2009. (in Chinese)
[3] Zhang J L, Shi H Z. Physiological and molecular mechanisms of plant salt tolerance. Photosynthesis Research, 2013, 115(1): 1-22.
[4] Munns R, Tester M. Mechanisms of salinity tolerance. Annual Review of Plant Biology, 2008, 59(1): 651-681.
[5] ZHU J K. Plant salt tolerance. Trends in Plant Science, 2001, 6(2): 66-71.
[6] KRONZUCHER H J, BRITTO D T. Sodium transport in plants: Acritical review. New Phytologist, 2011, 189(1): 54-81.
[7] SZABADOS L, SAVOURE A. Proline: A multifunctional amino acid. Trends in Plant Science, 2010, 15(2): 89-97.
[8] 朱士农, 郭世荣. 嫁接对盐胁迫下西瓜植株体内Na+和K+含量及其分布的影响. 园艺学报, 2009, 36(6): 814-820.
ZHU S N, GUO S R. Effects of grafting on K+, Na+contents and distribution of watermelon (Schrad) seedlings under NaCl stress. Acta Horiculture Sinica, 2009, 36(6): 814-820. (in Chinese)
[9] EETAN MARIA T, MARTINEZ-RODRIGUEZ M M, PEREZ- ALFOCEA F, FLOWERS T J, BOLARIN M C. Grafting raises the salt tolerance of tomato through limiting the transport of sodium and chloride to the shoot. Journal of Experimental Botany, 2005, 56(412):703-712.
[10] 雷波. 耐盐砧木通过调节Na+吸收和运转提高黄瓜耐盐性的机制研究[D]. 武汉: 华中农业大学, 2013.
LEI B. Mechanism of salt tolerant rootstock raise the salt tolerance of cucumber through regulating the uptake transportation of Na+[D]. Wuhan: Huazhong Agricultural University, 2013. (in Chinese)
[11] MARTINEZ-RODRIGUEZ M M, ESTA M T, MOYANO E, GARCIA-ABELLANT J O, FLORES F B, CAMPOS J F, AL- AZZAWI M J, FLOWERS T J, BOLARIN M C. The effectiveness of grafting to improve salt tolerance in tomato when an ‘excluder’ genotype is used as scion. Environmental & Experimental Botany, 2008, 63(1): 392-401.
[12] 杨秀玲. 黄瓜嫁接幼苗耐盐光合特性和WSC代谢生理调控研究[D]. 兰州: 甘肃农业大学, 2015.
YANG X L. Physiological regulation of salt tolerance on photosynthesis and WSC metabolism in grafted cucumber seedlings [D]. Lanzhou: Gansu Agricultural University, 2015. (in Chinese)
[13] PENELLA C, LANDI M, GUIDI L, NEBAUER S G, SAN BAUTISTA A, REMIRINI D, NALI C, LOPEZ-GALARZA S, CALATAYUD A. 盐胁迫下耐盐砧木通过保持光合能力和库强提高嫁接辣椒的产量. 刘越, 孔秋生, 译. 辣椒杂志, 2016, 14(2): 38-50.
PENELLA C, LANDI M, GUIDI L, NEBAUER S G, SAN BAUTISTA A, REMIRINI D, NALI C, LOPEZ-GALARZA S, CALATAYUD A. Salt-tolerant rootstocks increase the yield of grafted peppers by maintaining photosynthetic capacity and storage strength under salt stress. LIU Y, KONG Q S, Trans. Journal of China Capsicum,2016, 14(2): 38-50. (in Chinese)
[14] 高俊杰, 张琳, 秦爱国, 于贤昌. 氯化钠胁迫下嫁接黄瓜叶片SOD和CAT mRNA基因表达及其活性. 应用生态学报, 2008, 19(8): 1754-1758.
GAO J J, ZHANG L, QIN A G, YU X C. Relative expression of SOD and CAT mRNA and activities of SOD and CAT in grafted cucumber leaves under NaCl stress. Chinese Journal of Applied Ecology, 2008, 19(8): 1754-1758. (in Chinese)
[15] 施先锋. 南瓜砧木嫁接提高西瓜耐冷性的生理机制及蛋白质组学研究[D]. 武汉: 华中农业大学, 2019.
SHI X F. Physiological mechanism and proteomics research of improved cold tolerance of watermelon seedlings by grafting onto pumpkin rootstock [D]. Wuhan: Huazhong Agricultural University, 2019. (in Chinese)
[16] SHAHID M A, BALAL R M, KHAN N, SIMON-GRAO S, ALFOSEA-SIMON M, CAMARA-ZAPATA J M, MATTSON N S, GARCIA-SANCHEZ F. Rootstocks influence the salt tolerance oftrees by altering the antioxidant defense system, osmolyte concentration, and toxic ion accumulation. Scientia Horticulturae, 2019, 250: 1-11.
[17] 林有润. 中国蒿属志—中国蒿属植物的系统分类、分布和主要经济用途. 植物研究, 1988, 8(4): 1-61
LIN Y R. The Chinese Artemisia Linn. -The classification, distribution and application ofArtemisia LinnIn China. Bulletin of Botanical Research, 1988, 8(4): 1-61. (in Chinese)
[18] CHEN Y, SUN X Z, ZHENG C S, ZHANG S, YANG J H. Grafting ontoimproves drought tolerance in chrysanthemum by enhancing photosynthetic capacity. Horticultural Plant Journal, 2018, 4(3): 117-125.
[19] ZHANG X Y, SUN X Z, ZHANG S, YANG J H, LIU F F, FAN J. Comprehensive transcriptome analysis of grafting ontoW. to affect the aphid resistance of chrysanthemum (T.). BMC Genomics, 2019, 20(1): 776.
[20] 陈思思. 嫁接缓解菊花连作障碍机制初探[D]. 南京: 南京农业大学, 2012.
CHEN S S. Effects of grafting on the relieve of continuous cropping obstacles of[D]Nanjing: Nanjing Agricultural University, 2012.
[21] 管志勇, 陈素梅, 王艳艳, 陈发棣. 菊花近缘种属植物耐盐筛选浓度的确定及耐盐性比较. 生态学杂志, 2010, 29(3): 467-472.
GUAN Z Y, CHEN S M, WANG Y Y, CHEN F D. Screening of salt-tolerance concentration and comparison of salt-tolerance for chrysanthemum and its related taxa. Chinese Journal of Ecology, 2010, 29(3): 467-472. (in Chinese)
[22] 柏军华, 王克如, 初振东, 陈兵, 李少东. 叶面积测定方法的比较研究. 石河子大学学报(自然科学版), 2005, 23(2): 89-91.
BAI J H, WANG K R, CHU Z D, CHEN B, LI S D. Comparative study on the measure methods of the leaf area. Journal of Shihezi University, 2005, 23(2): 89-91. (in Chinese)
[23] 李志丹, 韩瑞宏, 廖桂兰, 张美华. 植物叶片中叶绿素提取方法的比较研究. 广东第二师范学院学报, 2011, 31(3): 80-83.
LI Z D, HAN R H, LIAO G L, ZHANG M H. A comparative study on the different extraction techniques about chlorophyll concentration of plant leaves. Journal of Guangdong University of Education, 2011, 31(3): 80-83. (in Chinese)
[24] SU L Y, DAI Z W, LI S H, XIN H P. A novel system for evaluating drough-cold tolerance of grapevines using chlorophyll fluorescence. BMC Plant Biology, 2015, 15(1): 82.
[25] 张殿忠, 汪沛洪, 赵会贤. 测定小麦叶片游离脯氨酸的方法. 植物生理学通讯, 1990(4): 62-65.
ZHANG D Z, WANG P H, ZHAO H X. Determination of the content of free proline in wheat leaves. Plant Physiology Communications, 1990(4): 62-65. (in Chinese)
[26] 李合生, 孙群, 赵世杰, 章文华. 植物生理实验原理与技术. 北京: 高等教育出版社, 2006: 169-170.
LI H S, SUN Q, ZHAO S J, ZHANG W H. Principles and Techniques of Plant Physiological Experiment. Beijing: Higher Education Press, 2006: 169-170. (in Chinese)
[27] 王学奎. 植物生理生化实验原理和技术. 北京: 科学出版社, 2006: 167-168, 172-173.
WANG X K. Principles and Techniques of Plant Physiological Experiment. Beijing: Science Press, 2006: 167-168, 172-173. (in Chinese)
[28] 郑书华, 蔡萍. 电感耦合等离子质谱法测定茶叶中的多种微量元素. 分析仪器, 2018, 220(5): 40-44.
ZHENG S H, CAI P. Determination of trace elements in tea by ICP-MS. Analytical Instrumentation, 2018, 220(5): 40-44. (in Chinese)
[29] 刘德兴, 荆鑫, 焦娟, 魏珉, 隋申利, 赵利华, 李艳玮, 赵娜, 巩彪, 史庆华. 嫁接对番茄产量、品质及耐盐性影响的综合评价. 园艺学报, 2017,44(6): 1094-1104.
LIU D X, JING X, JIAO J,WEI M, SUI S L, ZHAO L H, LI Y W, ZHAO N, GONG B, SHI Q H. Comprehensive evaluation of yield, quality and salt stress tolerance in grafting tomato. Acta Horiculture Sinica, 2017, 44(6): 1094-1104. (in Chinese)
[30] 李彦, 张英鹏, 孙明, 高弼模. 盐分胁迫对植物的影响及植物耐盐机理研究进展. 中国农学通报, 2008, 24(1): 258-263.
LI Y, ZHANG Y P, SUN M, GAO B M. Research advance in the effects of salt stress on plant and the mechanism of plant resistance. Chinese Agricultural Science Bulletin, 2008, 24(1): 258-263. (in Chinese)
[31] 管志勇, 陈发棣, 滕年军, 陈素梅, 刘浦生. 5种菊花近缘种属植物的耐盐性比较. 中国农业科学, 2010, 43(4): 787-794.
GUAN Z Y, CHEN F D, TENG N J, CHEN S M, LIU P S. Study on the NaCl tolerance in five plant species fromand its relatives. Scientia Agricultura Sinica, 2010, 43(4): 787-794. (in Chinese)
[32] 张金林, 李惠茹, 郭姝媛, 王锁民, 施华中, 韩庆庆, 包爱科, 马清. 高等植物适应盐逆境研究进展. 草业学报, 2015, 24(12): 220-236.
ZHANG J L, LI H R, GUO S Y, WANG S M, SHI H Z, HAN Q Q, BAO A K, MA Q. Research advances in higher plant adaptation to salt stress. Acta Prataculturae Sinica, 2015, 24(12): 220-236. (in Chinese)
[33] Colla G, Rouphael Y, Rea E, Cardarelli M.Grafting cucumber plants enhance tolerance to sodium chloride and sulfate salinization. Scientia Horticulturae, 2012, 135: 177-185.
[34] 杨立飞, 朱月林, 胡春梅, 刘正鲁, 张古文. NaCl胁迫对嫁接黄瓜膜脂过氧化、渗透调节物质含量及光合特性的影响. 西北植物学报, 2006, 26(6): 1195-1200.
YANG L F, ZHU Y L, HU C M, LIU Z L, ZHANG G W. Effects of NaCl stress on the contents of the substances regulating membrane lipid oxidation and osmosis and photosynthetic characteristics of grafted cucumber. Acta Botanica Boreali-Occidentalia Sinica, 2006, 26(6): 1195-1200. (in Chinese)
[35] 韩萌. 混合盐碱胁迫对7种禾种子萌发及生理特性的影响[D]. 哈尔滨: 哈尔滨师范大学, 2013.
HAN M. Effects of saline-alkaloid stress on the seed germination and physiological characteristics of seven grass seeds [D]. Harbin: Harbin Normal University, 2013. (in Chinese)
[36] 陈淑芳, 朱月林, 刘友良, 李式军. NaCl胁迫对番茄嫁接苗保护酶活性、渗透调节物质含量及光合特性的影响. 园艺学报, 2005, 32(4): 609-613.
CHEN S F, ZHU Y L, LIU Y L, LI S J. Effects of NaCl stress on activities of protective enzymes, contents of osmotic adjustment substances and photosynthetic characteristics in grafted tomato seedlings. Acta Horiculture Sinica, 2005, 32(4): 609-613. (in Chinese)
[37] LLOPEZ-SERRANO L, CANET-SANCHIS G, SELAK G V, PENELLA C, SAN BAUTISTA A, LOPEZ-CALARZA S, CALATAYUD A. Physiological characterization of a pepper hybrid rootstock designed to cope with salinity stress. Plant Physiology and Biochemistry, 2020, 148: 207-219.
[38] ZHEN A, BIE Z L, HUANG Y, LIU Z X, LI Q. Effects of scion and rootstock genotypes on the anti-oxidant defense systems of grafted cucumber seedlings under NaCl stress. Soil Science and Plant Nutrition, 2010, 56(2): 263-271.
[39] WANG N, QIAO W Q, LIU X H, SHI J B, XU Q H, ZHOU H, YAN G T, HUANG Q. Relative contribution of Na+/K+, homeostasis, photochemical efficiency and antioxidant defense system to differential salt tolerance in cotton (L.) cultivars. Plant Physiology and Biochemistry, 2017, 119: 121-131.
[40] ASHRAF M, FOOLAD M R. Roles of glycine betaine and proline in improving plant abiotic stress resistance. Environmental and Experimental Botany, 2005, 59(2): 206-216.
[41] 杨凡. 硅肥和虫害及机械损伤对油菜抗虫性的影响[D]. 呼和浩特: 内蒙古农业大学, 2019.
YANG F. Effects of silicon fertilizer, pests and mechanical damage on insect resistance of rape[D]. Hohot: Inner Mongolia Agricultural University, 2019. (in Chinese)
[42] MUNNS R, TESTER M. Mechanisms of salinity tolerance. Annual Review of Plant Biology, 2008, 59(1): 651-681.
[43] BALIBREA M E, DELL'AMICO J, BOLAR IN M C, PEREZ- ALFOCEA F. Carbon partitioning and sucrose metabolism in tomato plants growing under salinity. Physiologia Plantarum, 2000, 110(4): 503-511.
[44] YEO A, FLOWERS T. Plant Solute Transport. Blackwell Publishing Ltd., Oxford, UK, 2007.
[45] 李春燕, 杨廷桢, 王新平, 王淑婷, 王骞, 蔡华成, 杜学梅, 高敬东, 弓桂花. 苹果矮化中间砧对接穗品种枝条输导组织解剖结构的影响. 西北农业学报, 2019, 28(3): 404-411.
LI C Y, YANG T Z, WANG X P, WANG S T, WANG Q, CAI H C, DU X M, GAO J D, GONG G H. Effect of apple dwarf rootstock on anatomy structure of conducting tissue in branch of scion. Acta Agriculturae Boreali-occidentalis Sinica,2019, 28(3): 404-411. (in Chinese)
[46] 阳燕娟, 郭世荣, 于文进. 嫁接对盐胁迫下西瓜幼苗体内离子和内源激素含量与分布的影响. 西北植物学报, 2015, 35(3): 80-87.
YANG Y J, GUO S R, YU W J. Effect of rootstock-grafting on the contents and distributions of ions and endogenous hormones in watermelon seedlings under NaCl stress. Acta Botanica Boreali- Occidentalia Sinica, 2015, 35(3): 80-87. (in Chinese)
[47] COBAN A, AKHOUNDNEJAD Y, DERE S, DASGAN H Y. Impact of salt-tolerant rootstock on the enhancement of sensitive tomato plant responses to salinity. Hortscience, 2020, 55(1): 35-39.
[48] HUANG Y, BIE Z L, LIU P Y, NIU M L, ZHEN A, LIU Z X, LEI B, GU D G, LU C, WANG B T. Reciprocal grafting between cucumber and pumpkin demonstrates the roles of the rootstock in the determination of cucumber salt tolerance and sodium accumulation. Scientia Horticulturae, 2013, 149: 47-54.
[49] 王幼群. 植物嫁接系统及其在植物生命科学研究中的应用. 科学通报, 2011, 56(30): 2478-2485.
WANG Y Q. Plant grafting and its application in biological research. Chinese Science Bulletin, 2011, 56(30): 2478-2485. (in Chinese)
[50] 孙敬爽, 李少峰, 董辰希, 孙长忠. 嫁接植物体中RNA分子长距离传递研究进展. 林业科学, 2014, 50(11): 158-165.
SUN J S, LI S F, DONG C X, SUN C Z. Research progress and prospect of long distance transmission of RNA molecules in grafted plants. Scientia Silvae Sinicae, 2014, 50(11): 158-165. (in Chinese)
[51] 孙静宇. 南瓜提高黄瓜嫁接苗耐盐性的机理及相关microRNAs鉴定[D]. 武汉: 华中农业大学, 2019.
SUN J Y. The mechanism ofincreasing salt tolerance of grafted cucumber seedling and identification of related microRNAs [D]. Wuhan: Huazhong Agricultural University, 2019. (in Chinese)
Effects of Rootstock and Scion Interaction on Salt Tolerance of Grafted Chrysanthemum Seedlings
MENG Rui, LIU Ye, ZHAO Shuang, FANG WeiMin, JIANG JiaFu, CHEN SuMei, CHEN FaDi, GUAN ZhiYong
College of Horticulture, Nanjing Agricultural University/State Key Laboratory of Crop Genetics and Germplasm Enhancement/Key Laboratory of Landscaping, Ministry of Agriculture and Rural Affairs, Nanjing 210095
【】The objective of this study is to investigate the effects ofgrafted with chrysanthemum on the salt tolerance and its interaction between the rootstocks and scions. 【】The physiological indexes, including the content of Na+and K+in the leaves and stems of chrysanthemum cutting seedlings Zhongshan Yanhong (self-rooted seedlings), self-root grafted cutting seedlings (self-grafted seedlings) androotstock grafted cutting seedlings (hetero-root grafted seedlings), were measured under 120 mmol·L-1NaCl stress. 【】Under NaCl stress, the damage symptom rate of hetero-root grafted seedling leaves was lower than that of self-rooted and self-grafted seedlings. The relative content of conductivity, malondialdehyde, and proline of hetero-root grafted seedlings were lower than those of self-rooted and self-grafted seedlings, and the content of chlorophyll, superoxide dismutase (SOD), and peroxidase (POD) were higher than self-rooted and self-grafted seedlings. The content of Na+and Na+/K+ratios of the middle and lower leaves of the hetero-root grafted seedlings showed the lowest, followed by the self-grafted seedlings, and the highest index was recorded in the self-rooted seedlings. There was no significant difference in Na+content between the upper leaves of self-grafted seedlings and hetero-root grafted seedlings; the Na+content of the stems above the interface of hetero-root grafted seedlings was significantly lower than that of self-grafted and self-rooted seedlings, while there was no significant difference in the Na+content of the upper stems of self-grafted and self-rooted seedlings; the Na+concentration and Na+/K+ofstem segments below the interface were twice fold than that of the stem segments of chrysanthemum.【】The ion transported from self-grafted seedlings of chrysanthemum to the middle and lower leaves was significantly less than that of self-rooted seedlings. The results indicated that after grafting chrysanthemum withas a rootstock, the higher Na+enrichment capacity of rootstock reduced the accumulation of Na+in the upper part of the grafting interface, while hetero-root grafted seedlings showed stronger photosynthetic performance and antioxidant enzyme activity. Therefore, the improvement of salt tolerance of hetero-root grafted seedlings withas rootstock was the combined effect of rootstock healing leading to the reduction of ions transported upward to the leaves and the accumulation ofrootstock with more Na+on the rootstock.
grafting; chrysanthemum;; physiological index; Na+; K+; salt tolerance

10.3864/j.issn.0578-1752.2021.03.016
2020-05-14;
2020-08-02
国家重点研发计划(2019YFD1001500)、江苏省农业科技自主创新资金(CX(18)2020)
孟蕊,E-mail:2017104098@njau.edu.cn。通信作者管志勇,E-mail:guanzhy@njau.edu.cn
(责任编辑 赵伶俐)

