辛二酰苯胺异羟肟酸舒张大鼠离体胸主动脉作用和机制
谢 童,李发珍,张成瑞,范彦英,杨彩红
(山西医科大学基础医学院药理学教研室,山西 太原 030001)
近年来,组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACI)广泛用于临床治疗肿瘤,目前HDACI按化学结构主要分为四类,分别为短链脂肪酸类、苯胺类、异羟肟酸类和亲电酮类等[1]。根据药物的结构改造,合成的辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)成为首个获得批准上市的HDACI,通用名称为伏立诺他,临床上主要用于T细胞淋巴瘤的治疗[2-3]。在心血管方面,近年研究发现HDACI可以改善动脉粥样硬化、高血压和肺动脉高压、心肌梗死等心血管疾病的发生发展过程[4],但SAHA对血管的作用机制目前尚不明确,本文旨在探讨SAHA对大鼠离体胸主动脉的作用,研究内皮舒张因子一氧化氮(nitric oxide,NO)和前列环素(prostacyclin,PGI2)以及蛋白激酶C(protein kinase C,PKC)和Ca2+在SAHA舒张血管中的作用,以求丰富SAHA在血管方面的药理学资料,期望为心血管疾病的治疗找到新方法。
1 材料与方法
1.1 动物清洁级SD♂大鼠,体质量(300±25)g,大鼠饲养条件:温度(22±2) ℃,湿 度(45%-60%),光、暗每12 h循环1次,自由饮食与饮水。获自山西医科大学实验动物中心(许可证号SCXK(晋)2009-0001)。
1.2 试剂SAHA(批号0510B022)、氯化乙酰胆碱(acetylcholine chloride,ACh,批号323D011)、二甲基亚砜(dimethyl sulphoxide,DMSO,批号520C0314)和乙二醇双(2-氨基乙基醚)四乙酸[ethyleneglycol bis (2-aminoethylether) tetraacetic acid,EGTA,批号526E052]均购自北京索莱宝科技有限公司,吲哚美辛(indomethacin,Indo,批号056M4036V)、佛波酯(phorbol ester,PMA,批号MKBX7267V)和左旋硝基精氨酸甲酯(L-nitroarginiemethylester,L-NAME,批号WXBC4975V)均购自美国Sigma公司。十字孢碱(staurosporine,SP,批号21226)购自MedChemExpress公司,重酒石酸去甲肾上腺素(norepinephrine,NE,批号1806141)购自天津金耀氨基酸有限公司,苯肾上腺素(phenylephrine,PE,批号H1816053)购自上海晶纯生化科技股份有限公司。生理盐溶液成分(mmol·L-1):NaCl 144,KCl 5.8,CaCl22.5,MgCl21.2,葡萄糖11.1,HEPES 5。60 mmol·L-1KCl溶液成分(mmol·L-1):NaCl 89.6,KCl 60,CaCl22.5,MgCl21.2,葡萄糖11.1,HEPES 5。现配现用,使用前pH值调节为7.4,温度调为37 ℃。其余试剂均为国产分析纯。
1.3 仪器PowerLab 8/30信号分析系统购自澳大利亚埃德公司;HYJ-501S超级恒温水槽购自上海跃进医疗器械有限公司;CP124C电子天平购自奥豪斯仪器(常州)有限公司;SV-8离体组织器官灌流系统购自四川泰盟科技有限公司;雷磁pH计购自上海仪电科学仪器有限公司。
1.4 方法[5-8]
1.4.1大鼠离体胸主动脉环制备与内皮功能测定 断头处死300 g左右的SD♂大鼠,从心脏方向分离出整条胸主动脉,置于4 ℃ pH值为7.4的生理盐溶液中,快速分离血管周围结缔组织,均匀分成每段约3-4 mm长的血管环,用自制棉棒在血管环内壁轻轻摩擦3-4次即可制成去内皮胸主动脉环。用自制的三角形细钢丝挂钩轻轻穿过血管将其固定,然后再用自制的L形细钢丝再次轻轻穿过血管管腔,水平悬挂于充满5 mL 37 ℃ pH值为7.4的生理盐溶液的浴管中,上方连接张力转换器,下方固定于浴管底部,浴管内持续通入100% O2,调节血管前负荷为2 g,每15 min更换生理盐溶液1次,重新调节血管前负荷为2 g,经过4次共60 min后血管基础张力稳定在2 g左右,然后用5 mL 37 ℃ pH值为7.4的60 mmol·L-1KCl溶液替换浴管中的生理盐溶液,刺激血管收缩,每15 min更换1次KCl溶液,使血管收缩达到坪值,KCl收缩2次的幅度差值低于5 %说明血管活性良好。KCl收缩完后重新更换为新鲜的生理盐溶液,用1 μmol·L-1PE收缩血管,稳定后用10 μmol·L-1ACh舒张,以ACh舒张幅度比PE收缩幅度作为舒张率,如果舒张率高于0.75即可认定血管内皮完整(endothelium-intact,End+),如果舒张率低于0.05即可认定血管内皮完全去除(endothelium-denuded,End-)。待内皮功能检测完,更换生理盐溶液使血管恢复基础状态进行后续实验。
1.4.2SAHA影响基础状态大鼠离体胸主动脉张力的测定 采用内皮完整的大鼠胸主动脉环,实验组每隔10 min依次加入SAHA系列药物溶液,使其终浓度分别达到0.3、1、3、10和30 μmol·L-1,对照组加入等体积SAHA系列药物溶液配制溶剂DMSO,观察SAHA累积加药实验组与溶剂对照DMSO组血管基础张力的变化。
1.4.3SAHA影响KCl预收缩的End+与End-大鼠离体胸主动脉张力的测定 分别用60 mmol·L-1KCl预收缩End+与End-大鼠胸主动脉环,收缩稳定后,实验组每隔10 min分别向孵育End+与End-大鼠胸主动脉环的生理盐溶液中依次加入SAHA系列药物溶液,使其终浓度分别达到0.3、1、3、10和30 μmol·L-1,对照组每隔10 min分别向孵育End+与End-大鼠胸主动脉环的生理盐溶液中加入等体积SAHA系列药物溶液配制溶剂DMSO。以KCl预收缩血管达到的最大收缩幅度为1,分别计算End++SAHA组、End-+SAHA组、End++DMSO组和End-+DMSO组中SAHA与DMSO各个累积浓度下的舒张幅度在 KCl最大收缩幅度中所占比例。
1.4.4SAHA影响NE预收缩的End+与End-大鼠离体胸主动脉张力的测定 分别用1 μmol·L-1NE预收缩End+与End-大鼠胸主动脉环,收缩达坪值后,实验组每隔10 min分别向孵育End+与End-大鼠胸主动脉环的生理盐溶液中依次加入SAHA系列药物溶液,使其终浓度分别达到0.3、1、3、10和30 μmol·L-1,对照组每隔10 min分别向孵育End+与End-大鼠胸主动脉环的生理盐溶液中加入等体积SAHA系列药物溶液配制溶剂DMSO。以NE预收缩血管达到的最大收缩幅度为1,分别计算End++SAHA组、End-+SAHA组、End++DMSO组和End-+DMSO组中SAHA与DMSO各个累积浓度下的舒张幅度在 NE最大收缩幅度中所占比例。
1.4.5L-NAME和Indo影响SAHA舒张大鼠离体胸主动脉的测定 分别使用一氧化氮合酶(nitric oxide synthase,NOS)和环氧合酶(cyclooxygenase,COX)抑制剂L-NAME与Indo预处理内皮完整的大鼠胸主动脉环,实验组分别孵育0.1 mmol·L-1L-NAME和0.01 mmol·L-1Indo 30 min,SAHA对照组不孵育L-NAME和Indo,然后3组均用1 μmol·L-1NE预收缩血管,稳定后每隔10 min依次加入SAHA系列药物溶液使其分别达到0.3、1、3、10和30 μmol·L-1的终浓度,分别计算End++SAHA+L-NAME组、End++SAHA+Indo组和End++SAHA组中SAHA各个累积浓度下的舒张幅度在NE最大收缩幅度中所占比例。
1.4.6PMA和SP影响SAHA舒张大鼠离体胸主动脉的测定 分别使用PKC激动剂PMA和PKC抑制剂SP预处理内皮完整的大鼠胸主动脉环,实验组分别孵育0.1 μmol·L-1PMA和0.01 μmol·L-1SP 30 min,SAHA对照组不孵育PMA和SP,然后3组均用1 μmol·L-1NE预收缩血管,稳定后每隔10 min依次加入SAHA系列药物溶液使其分别达到0.3、1、3、10和30 μmol·L-1的终浓度,分别计算End++SAHA+PMA组、End++SAHA+SP组和End++SAHA组中SAHA各个累积浓度下的舒张幅度在NE最大收缩幅度中所占比例。
1.4.7测定SAHA对外钙内流和内钙释放诱导大鼠离体胸主动脉收缩的影响 采用内皮完整的大鼠胸主动脉环,基础状态稳定后,用含EGTA无Ca2+的生理盐溶液替换浴管内正常含Ca2+的生理盐溶液,以此来螯合血管的细胞外钙,20 min后重新更换为不含EGTA无Ca2+的生理盐溶液,稳定后用1 μmol·L-1NE预收缩血管,此时血管通过细胞释放的Ca2+而引起收缩,收缩稳定后加入CaCl2系列溶液,使其终浓度分别达到0.03、0.1、0.3、1和3 mmol·L-1,由于细胞外钙内流,血管收缩增强,当血管收缩达到坪值后,用含EGTA无Ca2+的生理盐溶液替换浴管内液体,以此来络合细胞外钙,20 min后再重新更换为不含EGTA无Ca2+的生理盐溶液,实验组分别孵育0.1、1和10 μmol·L-1SAHA 30 min,对照组孵育等体积SAHA系列药物溶液配制溶剂DMSO 30 min,然后各组加入1 μmol·L-1NE预收缩血管,收缩稳定后各组依次加入CaCl2系列溶液使其终浓度分别达到0.03、0.1、0.3、1和3 mmol·L-1,比较实验组孵育0.1、1和10 μmol·L-1SAHA和对照组孵育DMSO前后CaCl2和NE收缩幅度变化,以孵育之前CaCl2和NE的最大收缩幅度为1,分别计算孵育之后累积浓度CaCl2和NE的收缩率,观察SAHA对血管外Ca2+内流和细胞内Ca2+释放的影响。
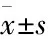
2 实验结果
2.1 SAHA对基础状态大鼠离体胸主动脉张力的作用如Fig 1所示,累积浓度SAHA(0.3、1、3、10和30 μmol·L-1)不改变基础状态大鼠离体胸主动脉环张力。
2.2 SAHA对KCl预收缩的End+与End-大鼠离体胸主动脉张力的作用SAHA可以舒张KCl预收缩的End+(Fig 2A)与End-(Fig 2B)胸主动脉,最大浓度SAHA对KCl预收缩的End+与End-胸主动脉的舒张率分别为(0.124±0.013)和(0.065±0.013),差异有统计学意义(P<0.01),对End+胸主动脉舒张率高于End-胸主动脉(Fig 2C)。
2.3 SAHA对NE预收缩的End+与End-大鼠离体胸主动脉张力的作用从Fig 3可以看出,SAHA可以浓度依赖性的舒张NE预收缩的End+(Fig 3A)和End-(Fig 3B)胸主动脉,最大舒张率分别为(0.656±0.06)和(0.320±0.014),对End+胸主动脉舒张率高于End-胸主动脉(Fig 3C),结果差异具有统计学意义(P<0.01)。

Fig 1 Effect of SAHA on basal tension of isolated thoracic aorta rings of rats n=6)
2.4 L-NAME和Indo对SAHA舒张大鼠离体胸主动脉的影响如Fig 4A所示,L-NAME (0.1 mmol·L-1)和Indo (0.01 mmol·L-1)预处理实验组与SAHA对照组相比,L-NAME和Indo预处理组SAHA各个累积浓度下对NE预收缩血管的舒张明显减小,End++SAHA+L-NAME组、End++SAHA+Indo组和End++SAHA组中SAHA的最大舒张率分别为(0.301±0.04)、(0.552±0.05)和(0.623±0.05),差异具有统计学意义(P<0.05),说明预孵L-NAME和Indo可以减弱NE预收缩下SAHA的血管舒张作用,揭示SAHA舒张血管可能与增加内皮舒张因子NO和PGI2生成有关。
2.5 PMA和SP对SAHA舒张大鼠离体胸主动脉的影响从Fig 5A可以看出,预孵PKC抑制剂SP(0.01 μmol·L-1)可以促进SAHA的血管舒张作用,End++SAHA+SP组与End++SAHA组最大舒张率分别为(0.797±0.06)和(0.650±0.03),差异有统计学意义(P<0.01)。而预孵PKC激动剂PMA(0.1 μmol·L-1)能抑制SAHA舒张血管,但是随着SAHA累积浓度的增大,PMA的抑制作用减弱,在SAHA浓度累积达到30 μmol·L-1时,无抑制作用。结果说明SAHA舒张血管作用可能部分与PKC有关。
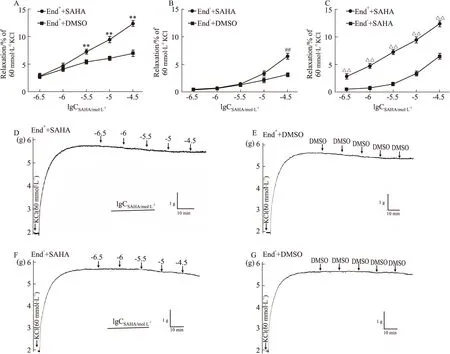
Fig 2 Effect of SAHA on End+ and End- isolated thoracic aorta rings of rats precontracted with KCl n=6)
2.6 SAHA对外钙内流和内钙释放诱导大鼠离体胸主动脉收缩的影响如Fig 6A所示,孵育1和10 μmol·L-1SAHA 均能显著抑制累积浓度CaCl2(0.03、0.1、0.3、1和3 mmol·L-1)在无钙生理盐溶液中引起的血管收缩,最大收缩率分别为(0.804 ± 0.04)和(0.600±0.04),与溶剂对照DMSO组收缩率(0.928 ± 0.05)比较,具有统计学差异(P<0.01)。而低浓度SAHA(0.1 μmol·L-1)在CaCl2累积浓度达到3 mmol·L-1时就不能发挥抑制作用。预孵0.1、1和10 μmol·L-1SAHA也能显著抑制无钙液中NE诱导的血管收缩(Fig 6B),收缩率分别为(0.275 ± 0.03)、(0.172 ± 0.029)和(0.108 ± 0.04),与溶剂对照DMSO组收缩率(0.734±0.07)比较,结果差异具有统计学意义(P<0.01)。提示一定浓度下SAHA舒张血管可能与抑制外钙内流和内钙释放有关。
3 讨论
由于心血管疾病严重影响患者的生活质量,抑制组蛋白去乙酰化酶渐成为心血管疾病领域研究热点。为了进一步丰富SAHA在血管方面的药理学资料,本文在离体条件下探究了SAHA对大鼠胸主动脉的作用,发现其能舒张血管,并初步研究了SAHA的舒张机制。
研究发现,血管内皮细胞能够分泌产生多种调节血管收缩与舒张功能的活性物质,其中内皮型一氧化氮合酶合成的NO和COX合成的PGI2是两种重要的血管内皮舒张因子[9]。NO和PGI2分别活化血管平滑肌细胞内的鸟苷酸环化酶和腺苷酸环化酶,使胞质中环鸟苷酸和环腺苷酸水平升高,胞内钙离子浓度降低,进而舒张血管[10]。实验结果表明SAHA对完整内皮血管的舒张要强于去内皮血管,具有内皮相关性,使用NOS和COX抑制剂L-NAME与Indo预孵血管后,发现SAHA的舒张作用明显减弱,表明SAHA舒张血管可能与增加内皮舒张因子NO和PGI2生成有关。
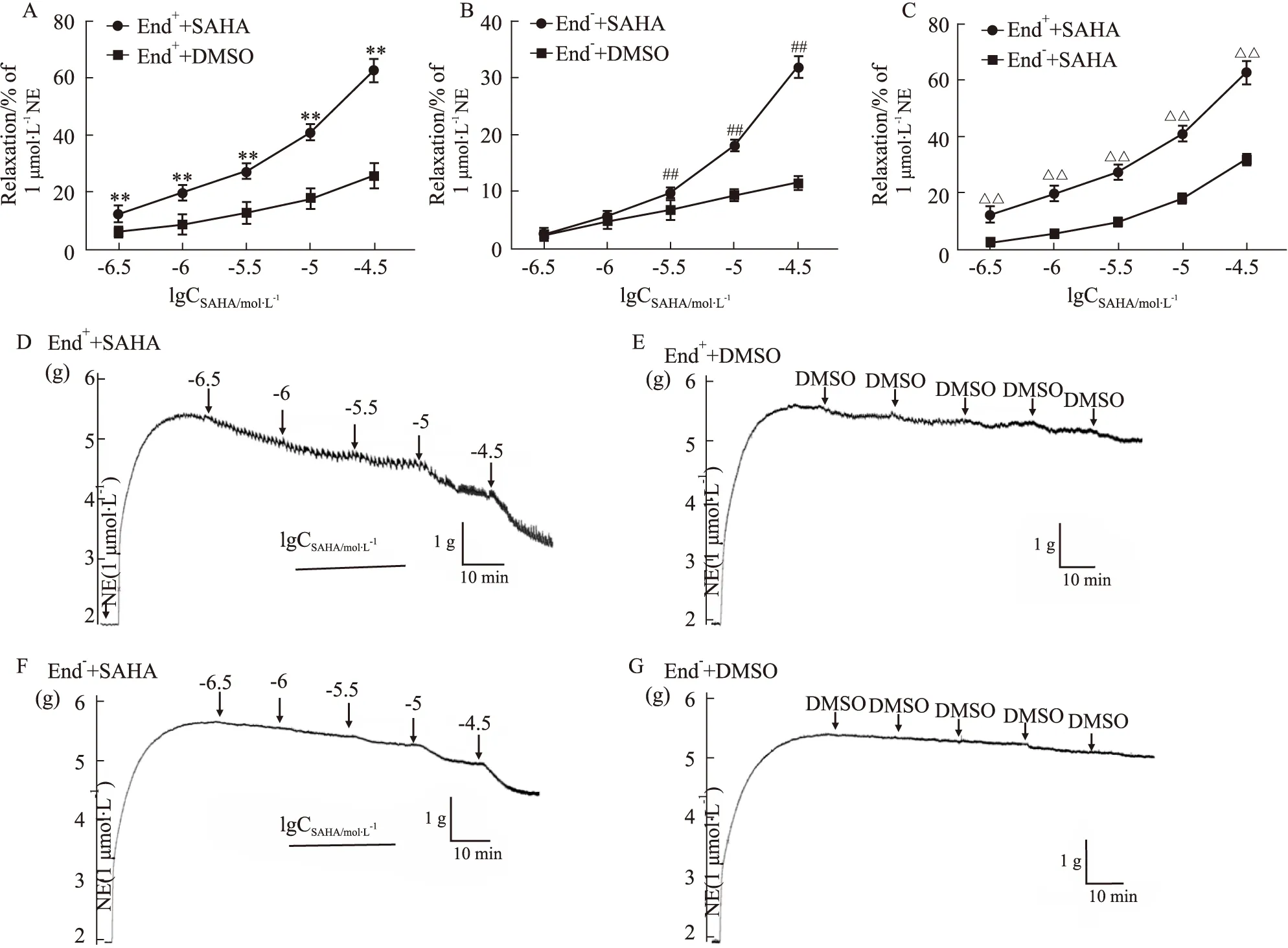
Fig 3 Effect of SAHA on End+ and End- isolated thoracic aorta rings of rats precontracted with NE n=6)
另外,PKC也通过多种途径参与血管收缩舒张的调节,一是抑制PKC可以增强内皮型一氧化氮合酶的活性,导致NO合成增加,从而引起血管发生舒张[11]。二是PKC能够通过多种机制抑制肌球蛋白轻链磷酸酯酶,增强肌球蛋白轻链(myosin light chain,MLC)磷酸化,促使平滑肌收缩[12]。还有研究发现,PKC可以通过增强细胞内钙离子的敏感性,使肌细胞膜去极化,促进钙离子通过电压依赖性钙通道进入细胞,从而增强平滑肌的收缩[13]。本文应用PKC激动剂PMA孵育血管后发现SAHA的血管舒张作用降低,而使用PKC抑制剂SP则能促进SAHA舒张血管,提示SAHA舒张血管与抑制PKC活性也有关。
在血管平滑肌的收缩与舒张过程中,钙离子的参与至关重要,细胞内钙离子结合钙调蛋白后活化肌球蛋白轻链激酶,使横桥中的MLC磷酸化,引起横桥肌丝滑行,从而诱发平滑肌收缩[14]。细胞内的钙离子水平升高主要有两个途径,一个是细胞外钙离子内流进入细胞,另外一个途径是细胞内钙库释放储存的钙离子。在本实验中预收缩剂KCl引起血管收缩就是由于细胞外高K+使平滑肌细胞膜去极化,从而活化细胞膜上电压依赖性钙通道,致钙离子内流进入细胞而收缩血管。预收缩剂NE是通过活化受体依赖性钙离子通道,诱发外钙内流而使血管发生收缩。在无钙生理盐溶液中加入累积浓度CaCl2引起血管收缩是通过增加细胞外钙离子水平,而促进钙离子内流引起血管收缩。实验结果表明,累积浓度SAHA能够舒张KCl和NE预收缩的大鼠离体胸主动脉,且抑制累积浓度CaCl2诱导的血管收缩,提示SAHA舒张血管可能与抑制外钙内流相关。在本实验中预收缩剂NE可以活化磷脂酶C,刺激三磷酸肌醇产生,而后者能促使肌浆网内钙离子释放[15]。NE在无钙生理盐溶液中收缩血管就是通过内钙释放增加钙离子浓度,实验结果表明随着预孵SAHA浓度的增加,无钙液中NE引起的收缩作用减弱,揭示SAHA舒张血管与抑制内钙释放也有关。
Fig 4 Effect of L-NAME and Indo on SAHA-mediated vasodilating effect on isolated thoracic aorta rings of rats precontracted with NE n=6)
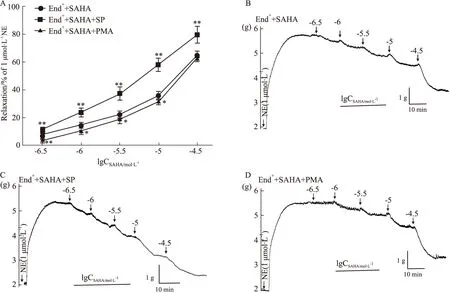
Fig 5 Effect of SP and PMA on SAHA-mediated vasodilating effect on isolated thoracic aorta rings of rats precontracted with NE n=6)

Fig 6 Effect of SAHA on vascular contraction induced by extracellular calcium influx and intracellular calcium release n=6)
综上所述,SAHA的血管舒张作用具有内皮相关性,可能与增加内皮舒张因子NO和PGI2生成有关,另外,其舒张血管还可能与抑制PKC活性,抑制细胞外钙离子内流和细胞内钙离子释放有关。本实验仅做了基础性的初步研究,关于SAHA舒张血管的具体机制还有待进一步的深入研究。
(致谢:特别感谢山西医科大学药理教研室各位老师和同学们的帮助。)

