高三尖杉酯碱激活ATM/p53通路抑制人肝癌细胞PLC5增殖
杜玉梅,唐加峰,黄世莹,张 滔,,卢睿瑾,何 爽,徐 航,,李 静,冉建华,陈地龙
(重庆医科大学1.公共卫生与管理学院;2.基础医学院干细胞与组织工程研究室,重庆 400016;3.重庆三峡医药高等专科学校,重庆 404120;4.重庆医科大学基础医学院神经科学研究中心,重庆 400016)
肝细胞肝癌(hepatocellular carcinoma,HCC)是临床上最常见的恶性肿瘤之一,具有恶性程度高、死亡率高、预后差等特点[1]。近年来,肝细胞肝癌已成为全球第六大常见癌症和第四大癌症相关死亡原因,每年新增病例约84.1万例,死亡约78.2万例[2]。因此,肝癌被认为是近年来发病率上升最快、死亡率最高的肿瘤之一。肝癌患者的治疗首选是手术切除,但是由于部分患者在诊断时已经处于中晚期,所以不符合手术切除的适应症[3]。因此,寻找治疗肝癌的有效办法仍迫在眉睫。
高三尖杉酯碱(homoharringtonine,HHT)是一种从不同三尖杉属植物中提取的植物生物碱,美国FDA已经批准将高三尖杉酯碱用于治疗慢性粒细胞白血病[4]。近年来已有研究表明,HHT对胰腺癌[5]、结直肠癌[6]、乳腺癌[7]、黑色素瘤[8]等均有一定的抑制作用,但对肝癌的研究甚少,因此,本研究旨在探讨HHT对肝癌细胞增殖的影响及可能的机制。
1 材料与方法
1.1 细胞株人肝癌细胞PLC5由重庆医科大学干细胞与组织工程研究室提供。
1.2 药物与试剂高三尖杉酯碱注射液(homoharringtonine injection,1 g·L-1)购自杭州民生药业有限公司,高糖DMEM细胞培养液购自Hyclone公司,胎牛血清购自Lonsera公司(S711-001S),Cell Counting Kit-8(CCK-8)购自上海东仁化学科技有限公司(CK04),青霉素-链霉素(C0222)、胰酶消化液(C0201)、EdU细胞增殖检测试剂盒(C0071S)、RIPA裂解液(强)(P0013B)、蛋白酶磷酸酶抑制剂混合物(P1048)、BCA蛋白浓度测定试剂盒(P0010S)均购自碧云天生物技术有限公司,PAGE凝胶快速制备试剂盒(PG113)、双色预染蛋白Marker(WJ103)和无蛋白快速封闭液(PS108)均购自雅酶生物,一抗抗体GAPDH、p21、CDK2、CyclinA、p53、ATM均购自Bimake公司,二抗抗体均购自CST公司。
1.3 主要仪器恒温孵箱(Thermo),低温高速离心机(平凡仪器,TGL-185),凝胶成像系统、M450酶标测定仪、SDS-PAGE电泳仪、电转仪(美国Bio-Rad公司),倒置显微镜、倒置荧光显微镜(德国Leica公司)。
1.4 细胞培养复苏PLC5细胞,接种于含有10%胎牛血清和1%青霉素-链霉素溶液的高糖DMEM中,置于37 ℃、5%二氧化碳的孵箱中培养,每24-48 h传代1次。
1.5 CCK-8法检测细胞增殖能力取对数生长期的PLC5细胞,将细胞浓度调整为2×107个·L-1,接种于96孔板中,每孔100 μL。该实验分3组,每组5个复孔。空白对照组:不含细胞和HHT,仅含DMEM完全培养基;对照组:含细胞、DMEM完全培养基,但不含HHT;实验组:含细胞、DMEM完全培养基和HHT(终浓度为5、10、20、40、80 μg·L-1)。分别培养24、48、72 h后,每孔中加入10 μL CCK-8工作液,继续37 ℃孵育2 h,在450 nm处检测其吸光度值(A)。计算24、48、72 h细胞生长抑制率,抑制率/% =(A对照组-A实验组)/(A对照组-A空白对照组)×100%。实验重复3次。
1.6 EdU检测细胞增殖能力取对数生长期的PLC5细胞,将细胞浓度调整为2×107个·L-1,接种于24孔板,每孔500 μL。将该实验分2组,对照组:接种细胞但不加药处理;实验组:接种细胞并加药处理,药物浓度为12 μg·L-1。将24孔板置于37 ℃、5% CO2的孵箱中培养24 h后,加入EdU(20 μmol·L-1)继续37 ℃孵育2 h,4%多聚甲醛固定20 min,洗涤3次,通透液孵育15 min,洗涤3次,加入配制好的Click反应液100 μL,避光30 min,洗涤3次,DAPI染核3 min。于荧光显微镜下拍照,蓝色为细胞核,绿色为EdU阳性细胞,即新增殖的细胞,每组拍5个视野。实验结果用ImageJ软件进行计数,绿色荧光数比蓝色荧光数求得PLC5细胞中新增殖细胞百分比。实验重复3次。
1.7 流式细胞仪检测细胞周期取对数生长期的PLC5细胞,将细胞浓度调整为2×107个·L-1,接种于60 mm培养皿中,每皿3 mL。将该实验分2组,对照组:接种细胞但不加药处理;实验组:接种细胞并加药处理,药物浓度为12 μg·L-1。培养24 h后,弃上清,PBS洗2次,胰酶消化,离心收集细胞,用PBS重悬细胞,并缓慢加入预冷的70%乙醇固定过夜。次日,离心洗去乙醇,加入500 μL PI试剂,室温避光孵育30 min,流式细胞仪检测细胞周期。实验重复3次。
1.8 免疫印迹法(Western blot)检测相关蛋白的表达将该实验分4组,对照组:接种细胞但不加药处理;实验组:接种细胞并加药处理,药物浓度分别为3、6、12 μg·L-1。处理24 h后收集细胞,提取细胞总蛋白,用BCA蛋白浓度测定试剂盒检测总蛋白浓度,加入蛋白质缓冲液高温变性。将蛋白进行SDS-PAGE电泳,电转移至硝酸纤维素膜上,使用无蛋白快速封闭液室温封闭20 min,加入一抗(GAPDH、p21、CDK2、CyclinA、p53、ATM稀释比例为1 ∶:1 000)置于4 ℃冰箱孵育过夜。用TBST液洗膜3次,加入与之对应的二抗(稀释比例为1 ∶10 000)室温孵育1 h,TBST液洗膜3次,使用ECL系统检测蛋白表达量。实验重复3次。
2 结果
2.1 CCK-8检测HHT对人肝癌细胞PLC5增殖的影响使用不同浓度HHT作用于人肝癌细胞PLC5 24、48、72 h后,采用CCK-8法检测HHT对PLC5增殖的影响,结果如Fig 1所示,随着HHT浓度的升高,其对PLC5细胞的抑制率逐渐增加,差异有统计学意义(P<0.01),表明HHT能明显抑制人肝癌细胞PLC5的增殖,且呈现浓度和时间依赖性。通过计算得24 h的IC50为12.27 μg·L-1,48 h的IC50为6.15 μg·L-1,72 h的IC50为2 μg·L-1。因此选择最大浓度为12 μg·L-1的HHT处理24 h作为后续实验的条件。
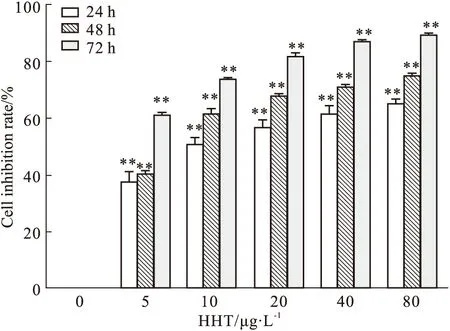
Fig 1 Effect of HHT on proliferation of PLC5 cells by CCK-8 n=3)
2.2 光镜下观察细胞形态HHT处理人肝癌细胞PLC5 24 h后,在倒置显微镜下观察细胞状态,如Fig 2所示,对照组细胞形态规则,呈鹅卵石状整齐排列,生长旺盛,贴壁生长良好,仅少许细胞脱落,胞质清澈,细胞核大,隐约可见核仁;而HHT处理后的细胞增殖能力明显降低,细胞形态发生改变,细胞发生皱缩,边缘不齐,胞质内可见大量颗粒,细胞贴壁能力下降,脱落增多,部分细胞呈悬浮生长。

Fig 2 Cell morphology under light microscope(×20)
2.3 EdU检测HHT对人肝癌细胞PLC5增殖的影响HHT处理人肝癌细胞PLC5 24 h后,使用碧云天的EdU试剂盒对PLC5进行染色,荧光显微镜下拍照。如Fig 3所示,在对照组和实验组蓝色荧光数量差不多的情况下,对照组的绿色荧光数量较多,而HHT处理后绿色荧光明显少于对照组,差异有统计学意义(P<0.01),提示HHT能抑制人肝癌细胞PLC5的增殖。
2.4 流式细胞术检测HHT对人肝癌细胞PLC5周期的影响HHT处理人肝癌细胞PLC5 24 h后,用流式细胞仪检测其对PLC5周期的影响。结果如Fig 4所示,与对照组相比,经HHT处理后G0/G1期细胞数量减少,S期细胞数量增加,G2/M期细胞数量减少,差异有统计学意义(P<0.01)。提示HHT将PLC5细胞阻滞在S期。
2.5 Western blot检测HHT对人肝癌细胞PLC5周期相关蛋白的影响用不同浓度的HHT(0、3、6、12 μg·L-1)作用于PLC5细胞24 h后,Western blot结果如Fig 5所示,经HHT处理后的PLC5细胞中 CDK2、cyclinA蛋白表达明显降低,而p21蛋白表达显著升高,差异有统计学意义(P<0.01)。提示HHT促使PLC5细胞周期阻滞在S期。
2.6 Western blot检测ATM/P53通路相关蛋白用不同浓度的HHT(0、3、6、12 μg·L-1)作用于PLC5细胞24 h后,Western blot结果如Fig 6所示,经HHT处理后的PLC5细胞中 ATM和p53蛋白表达明显升高,差异有统计学意义(P<0.01)。提示HHT诱导PLC5细胞发生DNA损伤,激活ATM/p53信号通路。

Fig 3 Effect of HHT on proliferation of PLC5 cells by EdU assay n=3)
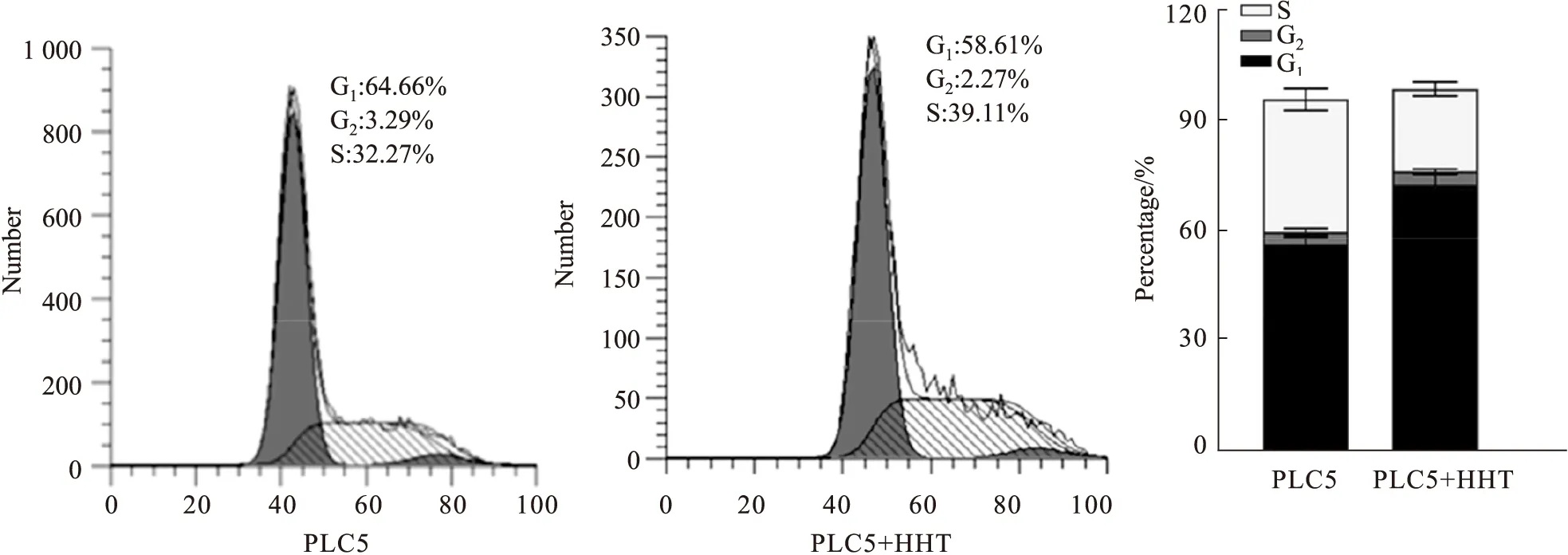
Fig 4 Effect of HHT on cell cycle distribution of PLC5 cells by FCM n=3)

Fig 5 Effect of HHT on expression of CDK2, CyclinA, p21 protein in PLC5 cells n=3)
3 讨论
肝细胞肝癌(HCC)是全球第六大常见恶性肿瘤,是与癌症相关的第四大死亡原因,也是最常见的原发性肝脏恶性肿瘤,占所有病例的75%-80%[9]。肝癌患者的传统治疗方法是手术切除和原位肝移植,但是,在最近一项病例研究发现,只有不到10%的患者符合手术切除的标准[10]。并且原位肝移植对患者造成的多种副作用使患者难以承受。因此,寻找适合绝大多数患者治疗的方式变得格外重要。
近年来,中草药抗肿瘤的作用逐渐被研究人员关注,目前已有多个抗肿瘤天然小分子药物被批准上市。高三尖杉酯碱是一种来源于三尖杉属植物 (cephalotaxus) 中的有效抗癌成分,已被证明具有较强的抗肿瘤活性[11]。其作用机制主要是抑制蛋白质表达,诱导细胞凋亡和分化,从而抑制肿瘤细胞增殖。有研究表明,HHT可通过激活胰腺癌细胞MEK1/ERK1/2信号通路,诱导胰腺癌细胞凋亡[5]。HHT还可以通过阻断mTOR信号通路抑制HT29人结直肠癌细胞增殖并诱导其凋亡[12]。然而,HHT在肝细胞肝癌中的作用少有报道。本文旨在研究HHT作用于肝细胞肝癌的机制。
本研究通过CCK-8实验和EdU实验检测了HHT对PLC5细胞增殖的影响,结果表明HHT对PLC5细胞的增殖有显著的抑制作用,并呈现浓度和时间依赖性。显微镜下观察发现HHT处理后的PLC5细胞数量明显减少,细胞形态发生了改变,细胞皱缩,边缘不齐,胞质内可见大量颗粒,细胞贴壁能力下降,脱落增多,部分细胞呈悬浮生长。进一步通过流式细胞术检测HHT对PLC5细胞周期的影响,结果表明HHT可诱导PLC5细胞阻滞在S期。

Fig 6 Effect of HHT on expression of ATM, p53 protein
细胞周期异常是恶性肿瘤的特性之一,可导致肿瘤无限制地增殖。在细胞分裂增殖的过程中,周期蛋白Cyclins和周期蛋白依赖性激酶CDK起着重要的调控作用[13],其中cyclinA与CDK2结合在促进细胞由S期进入G2期特别是在DNA合成过程中起到了非常重要的作用。p21作为一种肿瘤抑制因子,在肿瘤细胞中处于低表达状态,当受到药物刺激后,其表达量会升高。当DNA受损时,p21能够与CyclinA/CDK2复合物结合从而抑制其活性,使细胞周期阻滞在S期。而S期阻滞在大多数癌症发病机制中发挥了重要的作用,在S期阻滞过程中,一些相关的信号通路被激活,从而引发细胞的增殖抑制。本研究中,Western blot 结果显示,被HHT处理后的PLC5细胞内,p21表达水平的升高,而周期相关蛋白cyclinA以及CDK2的表达水平则降低,这可能与HHT将PLC5细胞阻滞在S期有关。
肿瘤抑制因子p53是一种短暂的核转录因子,在DNA损伤、氧化应激、癌基因激活、营养饥饿和缺氧等多种细胞应激反应中稳定并激活[14],p53的升高与肿瘤的发生、发展、转移等密切相关[15]。共济失调毛细血管扩张突变基因(ataxia telangiectasia-mutated gene,ATM)是一类广泛存在于各种生物中,并广泛表达的大型磷酸化蛋白激酶家族[16],ATM通过调控相关信号通路、维持细胞氧化还原稳态、促进细胞代谢和协同调节增殖相关信号通路活性以调控细胞正常增殖[17]。有研究表明,在DNA损伤条件下,ATM的激活会导致p53的激活,驱动细胞的衰老和凋亡,而p53的激活也使得细胞周期检查点p21的表达升高,从而抑制细胞周期[18]。在本实验中,用不同浓度HHT处理肝癌细胞PLC5,实验组与对照组相比,p53和ATM蛋白水平均升高。
综上所述,HHT对肝癌细胞PLC5有明显的抗肿瘤活性,其作用机制可能是诱导PLC5细胞发生DNA损伤,激活DNA损伤修复信号通路,阻滞细胞于S期,从而抑制细胞增殖。本研究为HHT 抗肝细胞肝癌的深入研究及临床应用提供了理论依据。

