复合酶法制备紫花芸豆抗氧化肽
李雪,左锋,王长远,2
1.黑龙江八一农垦大学食品学院,黑龙江 大庆163319;2.黑龙江省农产品加工与质量安全重点实验室,黑龙江大庆163319
紫花芸豆营养丰富,含有蛋白质、脂肪、膳食纤维、各种维生素等成分[1],还因含有皂苷、尿毒酶和多种球蛋白等独特成分,具有较高的药用价值,因此受到医学界的重视[2]。紫花芸豆中蛋白含量丰富,且具有较好的功能性,是一种优质蛋白。但大分子蛋白因结构及抗原性强等原因不易被机体直接吸收,使得芸豆蛋白在保健和疾病治疗领域的应用受到限制[3]。多肽是涉及机体内各种细胞功能的活性物质[4],相对分子质量小,易于人体吸收。研究发现,植物蛋白多肽链中的肽类物质具有较强抗氧化活性,近年已成为研究热点[5-8]。目前,植物蛋白中对大豆抗氧化肽的研究较多。CHEN 等[9]、徐力等[10]、荣建华[11]均从大豆蛋白中得到了具有抗氧化活性的多肽;程云辉等[12]从麦胚蛋白、王双玉等[13]从玉米醇溶蛋白中也获得了抗氧化活性肽。紫花芸豆作为药食同源的一种植物,其蛋白肽也将是一种较好的抗氧化肽生产的来源。酶法生产生物活性肽因其具有生产条件温和、安全性高、价廉且可得到特定的活性肽等优点,是目前生产活性肽的主要方法。蛋白质多肽链内部可能普遍存在功能区,含有许多生物活性肽,其在母体蛋白质序列内不具生物活性,但通过体内或体外蛋白酶水解释放出来后即可在体内发挥特定的生理功能[14-15]。多数食物源蛋白质水解得到的肽均能表现出一定的抗氧化性[16]。
本研究以紫花芸豆为原料,建立复合酶体系,对紫花芸豆蛋白进行水解,通过响应面分析对水解工艺进行优化,并对获得的芸豆蛋白肽进行抗氧化特性分析,为芸豆蛋白的精深加工提供新途径,也为紫花芸豆抗氧化肽的生产及工业化应用提供参考。
1 材料与方法
1.1 紫花芸豆 产自黑龙江,由黑龙江省大庆市国家杂粮工程技术研究中心提供。
1.2 主要试剂及仪器 碱性蛋白酶(100 u / mg)购自北京索莱宝生物科技有限公司;中性蛋白酶(100 u/mg)购自上海源叶生物科技有限公司;胃蛋白酶(3 000 u / g)、风味蛋白酶(30 000 u / g)、胰蛋白酶(74 000 u/g)购自德国赛国生物科技有限公司;盐酸、氢氧化钠均为分析纯,购自国药集团化学试剂有限公司;DPPH、硫酸亚铁购自阿拉丁试剂有限公司;PHS.2C型精密pH 计购自美国METTLERTOLEDO 公司。
1.3 紫花芸豆蛋白的提取 参照文献[17]方法进行提取。将紫花芸豆手工去皮后粉碎过80 目筛,石油醚脱脂5 h,制得脱皮脱脂的芸豆粉。取芸豆粉与蒸馏水按1 ∶10(W / V)比例混合,用1 mol / L NaOH调pH 至9.0,50 ℃搅拌提取50 min;1 789 ×g离心20 min,收集上清液置烧杯中,沉淀按固液比1 ∶8(W / V)混合,重复上述操作。将2 次收集的上清液混合,用1 mol/L HCl 调pH 至4.6,沉淀1 h,1 789×g离心20 min,弃上清液,沉淀用蒸馏水复溶,1 mol / L NaOH 调pH 至7.0,蛋白液喷雾干燥后,即获得紫花芸豆蛋白,于-20 ℃保存备用。
1.4 紫花芸豆蛋白水解物的制备 采用pH-stat法[18]。称取一定量的芸豆蛋白粉配成一定浓度的蛋白质溶液,90 ℃下预处理10 min;调溶液pH 至各蛋白酶所需值,加入适量蛋白酶,并置恒温水浴锅中不断搅拌,用0.2 mol/L NaOH 调溶液pH 维持不变后,进行灭酶处理,收集上清液,即为芸豆蛋白水解物。记录反应过程中消耗NaOH 溶液的体积。按下式计算蛋白水解度。
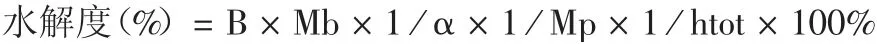
式中B 为消耗NaOH 的体积(mL);Mb 为NaOH浓度(0.2 mol / L);Mp 为加入蛋白的质量(g);碱性蛋白酶1 / α 为1;htot 为每克蛋白质中肽键的毫摩尔数,对于芸豆蛋白质来说,htot = 7.72。
1.5 蛋白酶的选择 选取碱性蛋白酶、中性蛋白酶、风味蛋白酶、胰蛋白酶和胃蛋白酶共5 种进行最适蛋白酶筛选。底物浓度均为5%,在各自最适条件下水解芸豆蛋白2 h。以水解度为指标,在各个酶最适条件下筛选出芸豆蛋白水解度最高、效果最好的两种蛋白酶,作为复合酶的组合。
1.6 单因素试验设计 确定复合酶组合后,以酶解的反应温度、pH、酶比例(碱性蛋白酶∶中性蛋白酶)、反应时间和酶添加量为影响因素,分析以上因素对紫花芸豆蛋白水解度的影响,其中酶添加量部分,因选取的两种蛋白酶的酶活力单位不同,因此选取总酶活力值作为指标,通过计算可得出每种酶的添加量,从而进行试验。基础试验条件为pH 10,酶比例1 ∶1,温度55 ℃,酶解时间2 h,酶添加量6 000 u / mL。研究单个因素时,仅该因素条件发生变化,其他条件均为基础试验条件。单因素试验水平见表1。
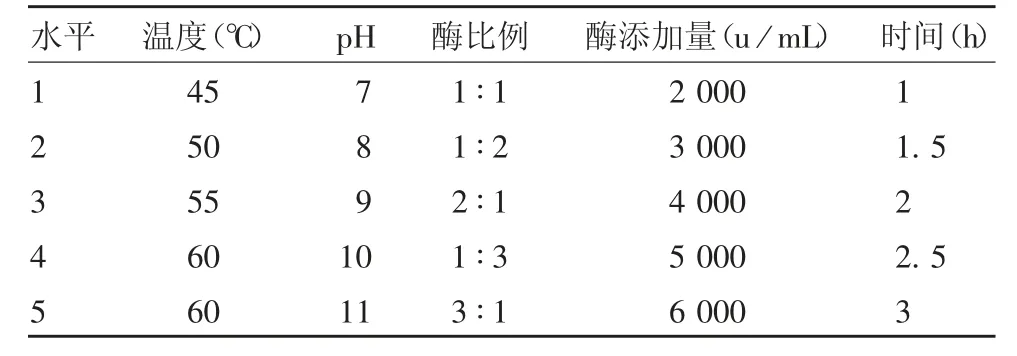
表1 单因素试验水平表Tab.1 Levels in single factor test
1.7 响应面分析试验 在单因素试验的基础上,根据Box-Behnken 的原理[19],选取温度(A)、pH(B)、酶比例(C)和酶添加量(D)4 个影响显著的因素作为自变量,水解度(Y)为响应值,设计类型为4 因素3 水平的响应面试验,共29 组试验,其中5 组为中心零点试验,24 组为析试验。零点为区域的中心值,析因点为自变量取值在A、B、C、D 所构成的三维顶点。将因素的上下水平编码为1、-1,应用Design-Expert 8.0.6.1 软件计算出实际水平[20-21]。因素水平见表2,Box-Behnken 试验方案见表3。响应曲面坡度的陡峭程度与平缓程度表明处理条件变化对响应值即接枝度影响的大小,如响应曲面坡度相对陡峭,表示处理条件变化对接枝度的影响较大;如响应曲面坡度相对平缓,表示处理条件变化对接枝度的影响较小[22]。

表2 响应面因素水平编码表Tab.2 Factors and levels in response surface optimization
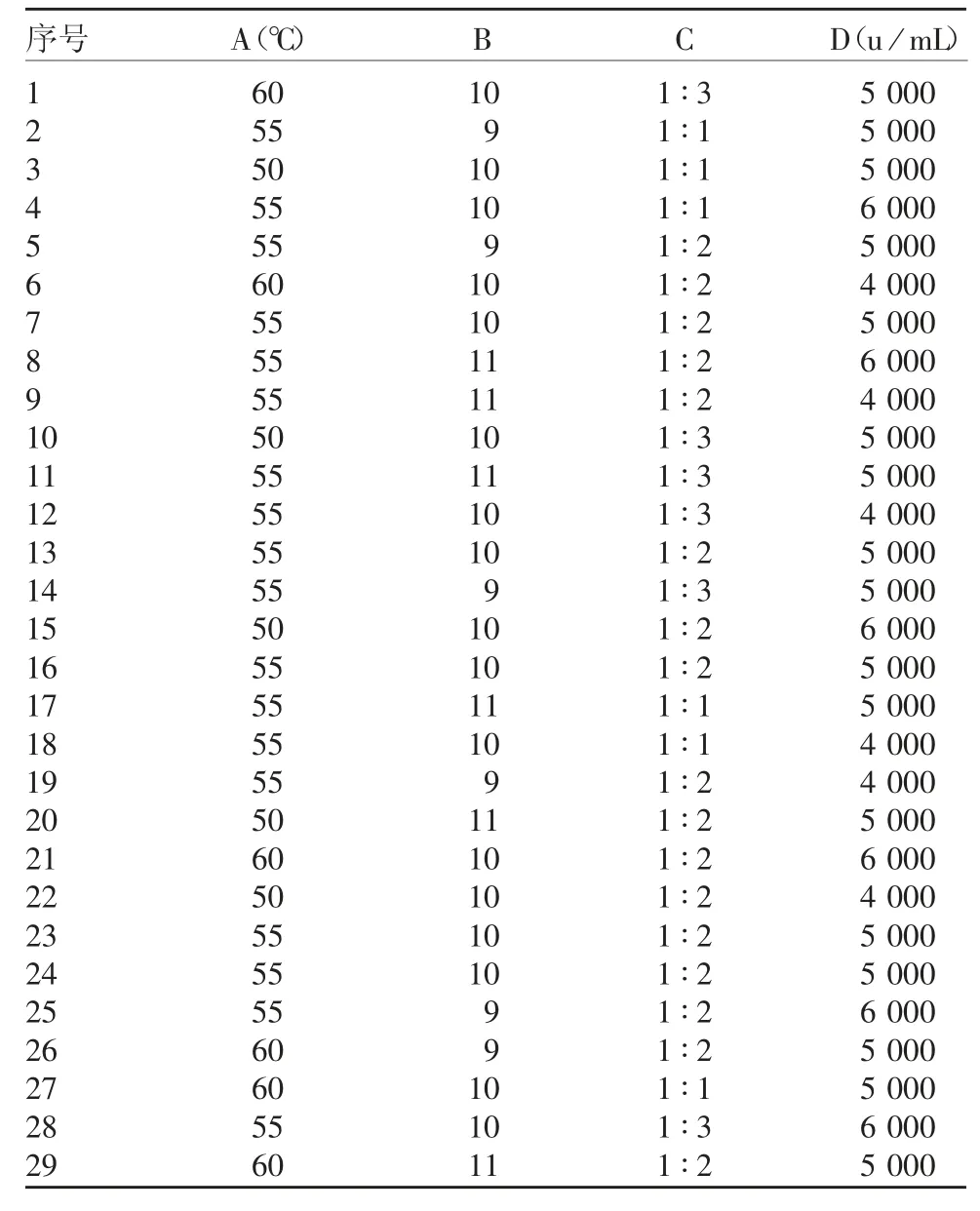
表3 Box-Behnken 试验方案Tab.3 Protocol of Box-Behnken test
1.8 芸豆蛋白肽抗氧化能力的检测 以羟自由基清除能力和DPPH 清除能力作为指标,以紫花芸豆蛋白水解度作为参照,探讨紫花芸豆蛋白肽的抗氧化性。
1.8.1 羟自由基清除能力 在不同水解时间各取2 mL芸豆蛋白水解上清液,分别依次加入6 mmol / L 硫酸亚铁4 mL,6 mmol 过氧化氢2 mL,混匀,静置10 min后,加入6 mmol / L 水杨酸2 mL,混匀静置30 min后,于510 nm 波长处检测吸光度值,空白对照组以蒸馏水代替芸豆蛋白水解液。按下式计算羟自由基清除能力。
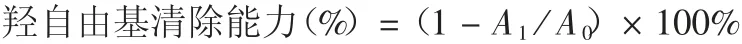
式中,A1为510 nm 波长下水解液的吸光度值,A0为510 nm 波长下对照的吸光度值。
1.8.2 DPPH 抗氧化能力 将样品液100 μL(用双蒸水溶解)与100 μL 0.1 mmol / L DPPH 溶液(用无水乙醇配置)混合均匀,室温避光反应30 min;在517 nm 波长处检测样品吸光度A1,用等体积无水乙醇代替DPPH 溶液作为空白对照组,吸光度值记作A0,其他条件与实验组相同,检测吸光度A2。按下式计算DPPH 自由基清除率。
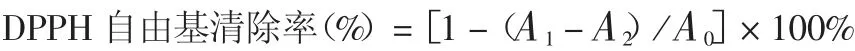
2 结 果
2.1 最适蛋白酶的筛选 结果显示,碱性蛋白酶和中性蛋白酶对紫花芸豆蛋白的水解程度最好,水解度分别为29%和34%,而风味蛋白酶、胰蛋白酶和胃蛋白酶的水解度则不高,因此,选择碱性蛋白酶和中性蛋白酶进行复合酶的组合,见图1。
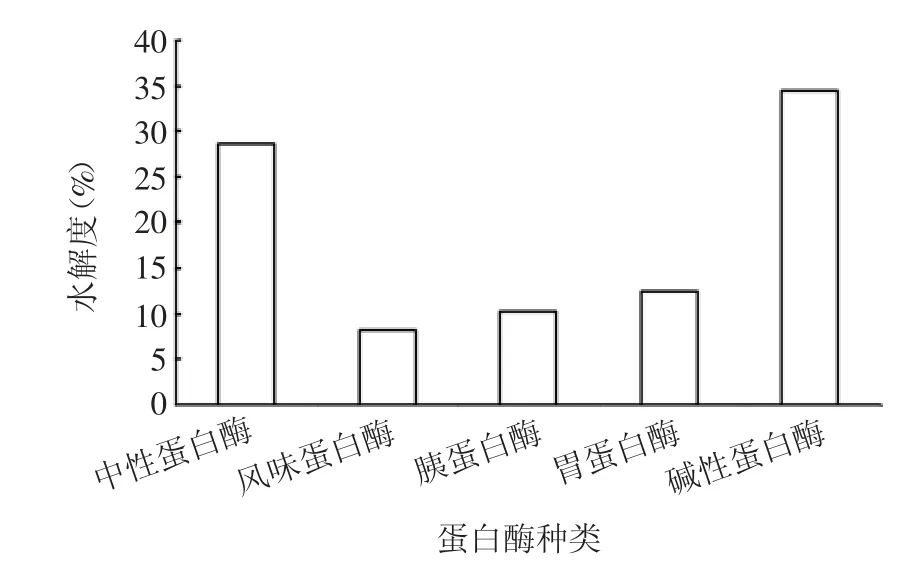
图1 5 种蛋白酶芸豆蛋白水解度对比图Fig.1 Hydrolysis degrees of five kinds of kidney bean protein
2.2 单因素试验
2.2.1 温度对紫花芸豆蛋白水解度的影响 结果显示,随着温度的升高,芸豆蛋白的水解度呈先上升后下降的趋势,当温度为55 ℃时,水解度达最大值,为32.75%,见图2。
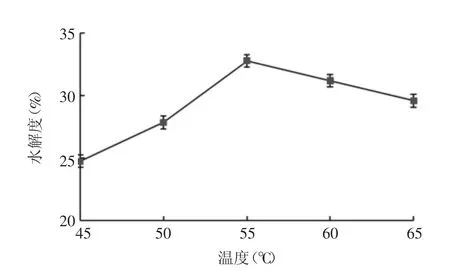
图2 温度对芸豆蛋白水解度的影响Fig.2 Effect of temperature on hydrolysis degree of kidney bean protein
2.2.2 pH 对紫花芸豆蛋白水解度的影响 结果显示,随着pH 的升高,芸豆蛋白水解度呈先上升后下降的趋势,当pH 为10 时,水解度达最大值,即复合酶水解最适pH 为10,见图3。
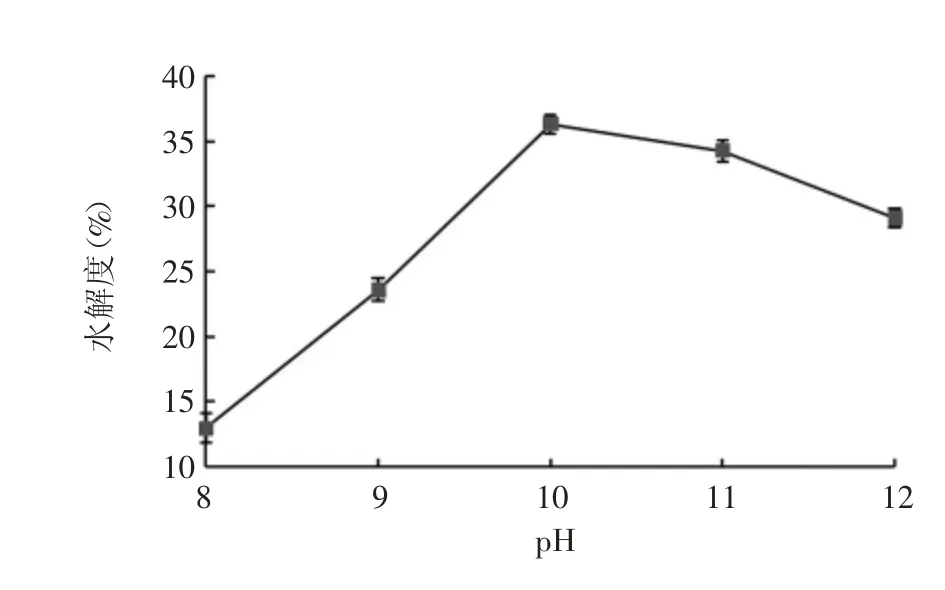
图3 pH 对芸豆蛋白水解度的影响Fig.3 Effect of pH on hydrolysis degree of kidney bean protein
2.2.3 酶比例对紫花芸豆蛋白水解度的影响 结果显示,随着中性蛋白酶比例的增加,芸豆蛋白水解度呈上升趋势,当中性蛋白酶用量一定时,随着碱性蛋白酶用量的增加,芸豆蛋白水解度呈下降趋势,当酶比例为1 ∶3 时,芸豆蛋白水解度最高,为蛋白酶最适复合配比,见图4。
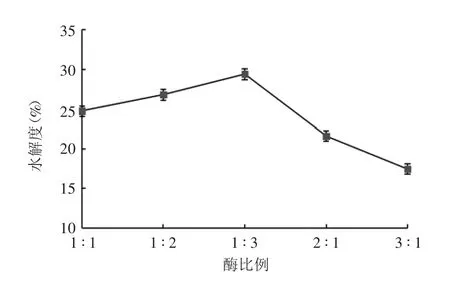
图4 酶比例对芸豆蛋白水解度的影响Fig.4 Effect of enzyme ratio on hydrolysis degree of kidney bean protein
2.2.4 酶添加量对紫花芸豆蛋白水解度的影响结果显示,酶活在2 000 ~5 000 u / mL 时,随着酶活力的增加,水解度呈上升趋势,当酶活力在5 000 ~6 000 u / mL 时,水解度呈下降趋势,因此最适酶添加量为5 000 u / mL,见图5。
2.2.5 时间对紫花芸豆蛋白水解度的影响 结果显示,随着酶解时间的增加,芸豆蛋白水解度呈上升趋势,在2.5 ~3 h 之间上升趋势趋于平稳,酶解3 h 时水解效果最佳,但考虑到实际因素,选择酶解2.5 h 为最适时间,见图6。
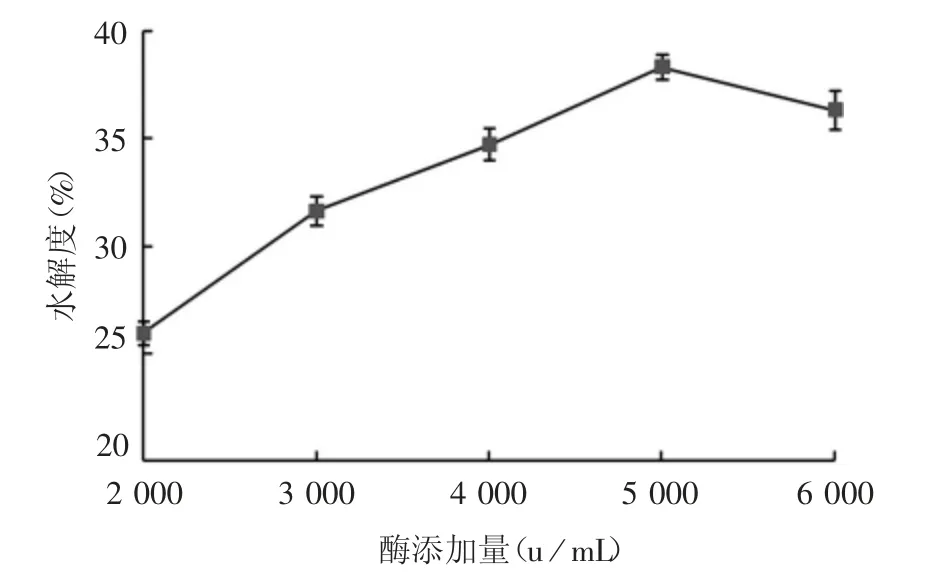
图5 酶添加量对芸豆蛋白水解度的影响Fig.5 Effect of enzyme addition on hydrolysis degree of kidney bean protein

图6 时间对芸豆蛋白水解度的影响Fig.6 Effect of time on hydrolysis degree of kidney bean protein
2.3 Box-Behnken 试验
2.3.1 Box-Behnken 试验结果 通过模型预测得到最适紫花芸豆蛋白复合酶酶解条件为:温度56.29 ℃,酶添加比例1 ∶2,酶添加量5 800 u / mL,pH 10.94,此时的水解度预测值为43.54%。见表4。
2.3.2 回归方程及显著性检验 以水解度(Y)为响应值,经回归拟合后,A、B、C 和D 对应响应Y 的二元多项回归方程为:Y = 26.52 + 2.63 A + 7.68 B +2.45 C+0.43 D+3.33 AB-0.77 AC-0.84 AD +1.16 BC+2.36 BD+0.8 CD+1.62 A2+ 1.07 B2-1.83 C2+ 1.63 D2,根据方差分析结果,剔除不显著项,得到优化后的响应面方程为:Y=26.52+2.63 A+7.68 B + 2.45 C + 0.43 D + 3.33 AB + 2.36 BD -1.83 C2+ 1.63 D2。回归模型系数见表5,回归方程模型F检验显著,失拟项不显著,表明其他因素对试验结果干扰较小,模型能较好地反映数据,因此,用此模型优化反应温度、pH、酶比例、酶添加量及酶解时间对紫花芸豆蛋白水解度的影响是可行的。因素AB的P= 0.001 15 <0.05,BD 的P= 0.012 0 <0.05,表明在3 个因素中,A 与B、B 与D 两者之间有显著的交互作用。
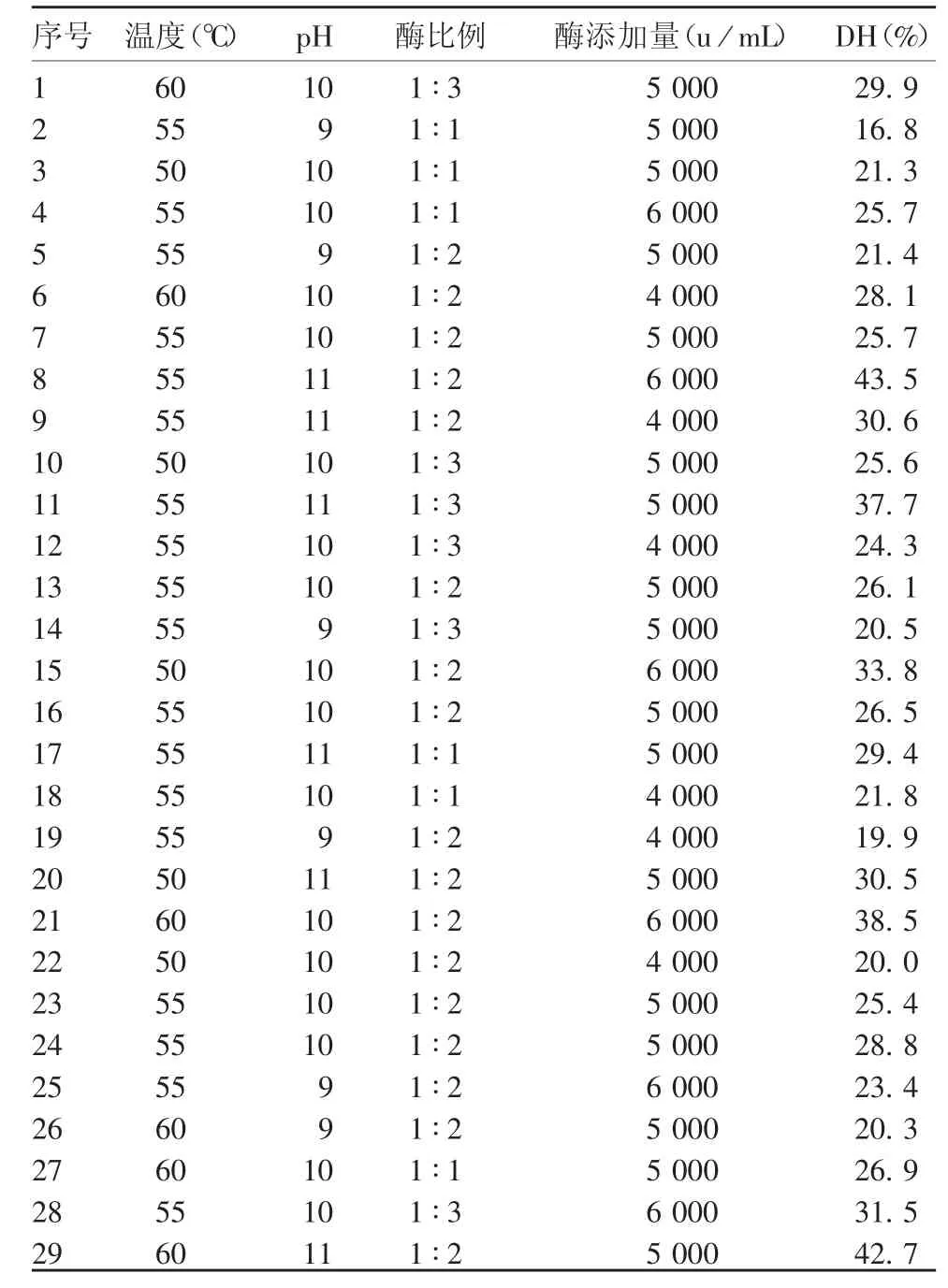
表4 Box-Behnken 试验结果Tab.4 Result of Box-Behnken test
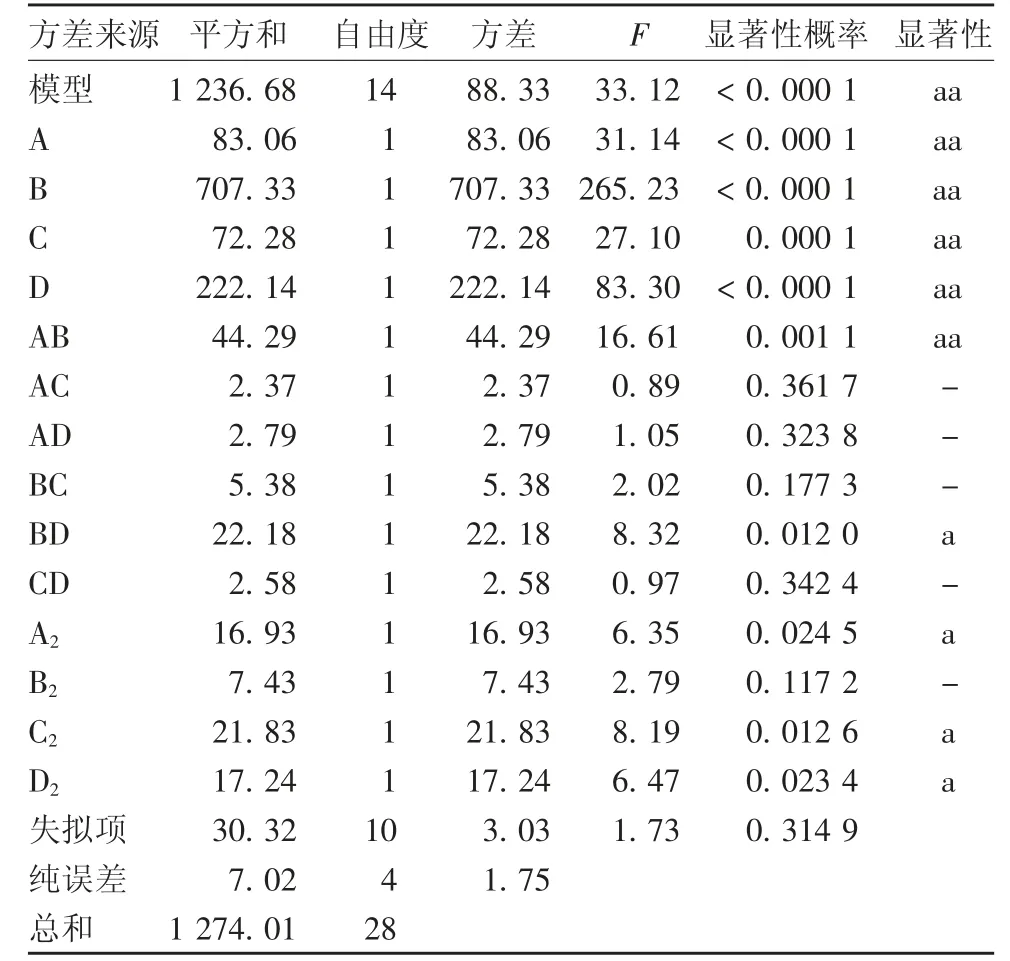
表5 回归模型系数检验Tab.5 Regression model coefficient test
2.3.3 响应面分析及优化 在不同的pH 条件下,温度对芸豆蛋白水解度的影响变化趋势基本相同,随着pH 增大,芸豆蛋白水解度呈上升趋势。在一定pH条件下,蛋白水解度随温度变化不显著。温度的等高线比酶添加量的等高线密集,表明温度比pH 对芸豆蛋白水解度的影响要大。见图7。
在不同的pH 条件下,酶添加量对芸豆蛋白水解度的影响变化趋势基本相同,随着pH 增大,芸豆蛋白水解度呈上升趋势。在一定pH 条件下,芸豆蛋白水解度随酶添加量的变化不显著。pH 的等高线比酶添加量的等高线密集,表明pH 比酶添加量对芸豆蛋白水解度的影响要大。见图8。

图 7 温度-pH 对芸豆蛋白水解度的影响Fig.7 Effect of temperature-pH on hydrolysis degree of kidney bean protein
2.3.4 最适复合酶酶解工艺参数 由2.3.1 项结果可知,模型预测的最适紫花芸豆蛋白复合酶酶解条件为:温度56.29 ℃,酶添加比例1 ∶2,酶添加量5 800 u / mL,pH 10.94,水解度预测值为43.54%。综合实际应用,考虑pH 对芸豆蛋白结构及理化性质的影响和酶用量等因素,最终确定最适紫花芸豆蛋白复合酶酶解条件为:温度55 ℃、酶添加比例1 ∶2、酶添加量5 000 u / mL 和pH 10,根据上述条件进行验证,得到水解度的实际值为42.2%,二者接近。且复合酶酶解紫花芸豆蛋白肽的水解度要高于5 种蛋白酶单独酶解紫花芸豆蛋白肽的水解度。
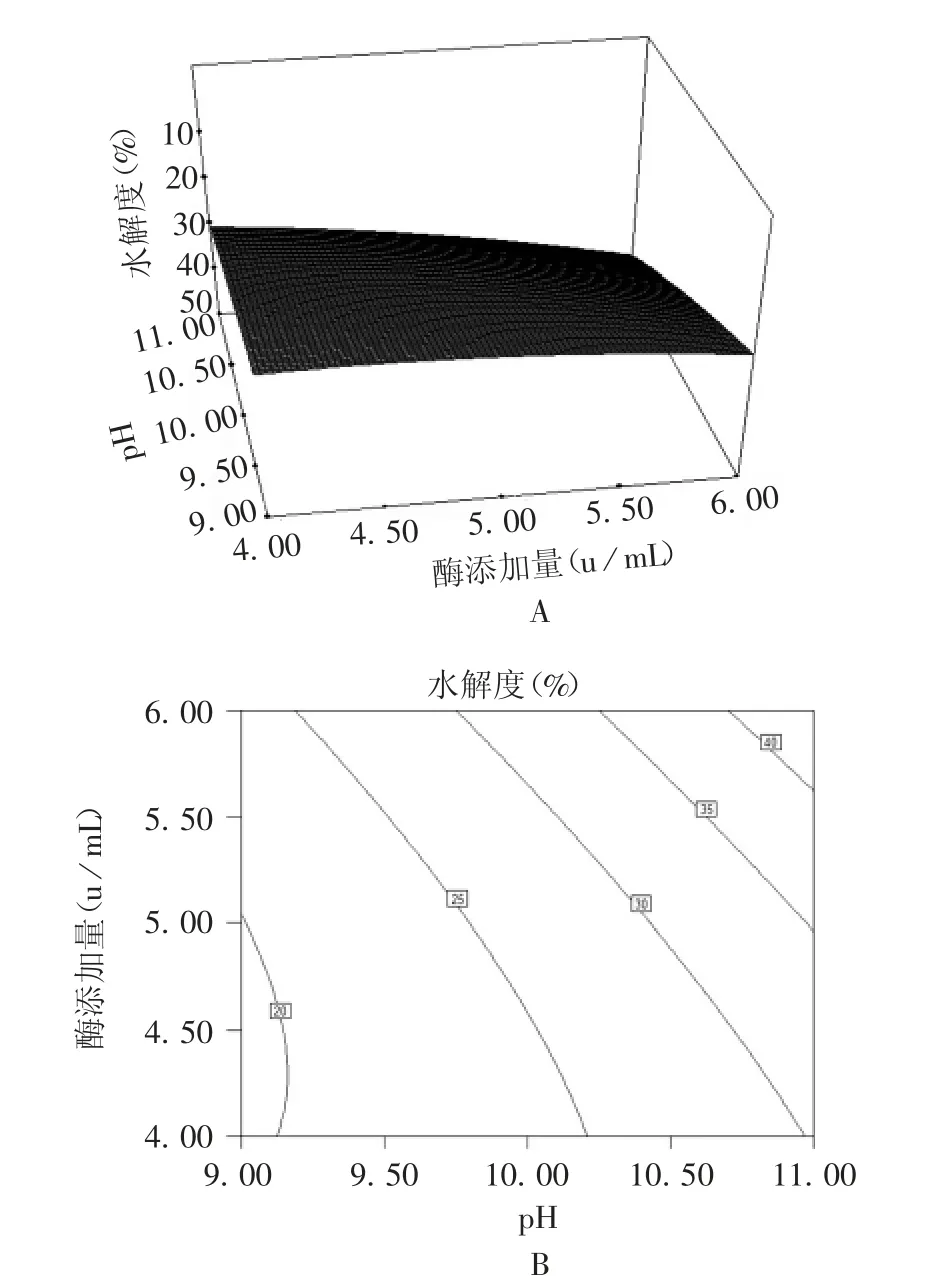
图8 pH-酶添加量对芸豆蛋白水解度的影响Fig.8 Effect of pH-enzyme addition on hydrolysis degree of kidney bean protein
2.4 芸豆蛋白肽抗氧化性 结果显示,随着时间的延长,紫花芸豆蛋白的水解度、DPPH 清除率和羟自由基的清除率均呈上升趋势。水解度在0 ~0.5 h 内迅速提高,0.5 h 后提高幅度变缓,在酶解时间为3 h时,达最高值,水解度为42.7%。综合两种自由基清除能力,当酶解时间为3 h 时,为制备紫花芸豆抗氧化肽的最适水解时间。见图9。
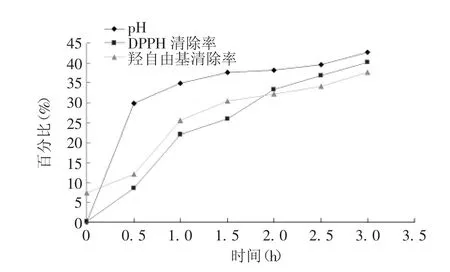
图9 紫花芸豆蛋白肽水解度与抗氧化性关系Fig.9 Relationship between hydrolysis degree and antioxidant activity of kidney bean protein peptide
3 讨 论
有研究认为,水解植物蛋白时使用碱性蛋白酶较为合适[23],碱性蛋白酶对酶解羧端疏水性氨基酸有较强的专一性。NICHOLAS 等[24]研究发现,碱性蛋白酶Alcalase 可裂解酪蛋白中G1u、Met、Leu、Tyr、Lys 和Gln 的羧端肽键;而中性蛋白酶AS1.398 仅仅水解羧基端为Tyr、Phe、Trp 等的芳香族疏水性氨基酸的肽键。酶的专一性决定了某种蛋白酶可能仅对某些肽键或带有某种基团的氨基酸所形成的肽键作用,不同蛋白酶对底物蛋白水解所得的酶解物的种类和生物活性是不同的,因此,采用复合酶对紫花芸豆蛋白进行水解,将得到更多不同相对分子质量的肽链,而酶种类的不同也是制备高活性抗氧化肽的重要因素之一。选择两种酶进行复合,在水解紫花芸豆蛋白时则可以同时作用2 个酶的切割位点,即可水解出更多不同的肽链。
实验中温度范围为45 ~65 ℃,温度升高后,芸豆蛋白的水解度呈先上升后下降趋势,上升趋势是因为适当的温度可提高酶的活性,同时也可使蛋白质结构变得疏松,从而暴露出更多的酶作用点,在一定时间内与酶接触增多。下降是因为当温度超过一定值后,酶会发生变性,从而失去活性,导致水解不能继续进行。
pH 范围为8 ~12,芸豆蛋白水解度随pH 增大,呈先上升后下降趋势。这是因为酶是一种特殊的蛋白质分子,环境pH 会影响酶分子的构象以及酶分子和底物的解离状态,其催化能力也会随pH 的变化而变化,从而影响酶的活性和酶促反应速度,pH过高或过低对酶的反应均不利。当pH 为10 时,水解度达最大值,即复合酶水解最适pH 为10。
蛋白酶比例研究中,中性蛋白酶比例增加,芸豆蛋白水解度呈上升趋势,碱性蛋白酶用量增加,芸豆蛋白水解度呈下降趋势。碱性蛋白酶对酶解羧端疏水性氨基酸有较强的专一性,而中性蛋白酶可水解一些羧端芳香族疏水性氨基酸的肽键,两种酶各有专长,具体水解效果与底物密切相关。
酶添加量研究中,酶活范围为2 000 ~6 000 u/mL,随着酶活力的增加,水解度呈先上升后下降趋势,这是因为过量的酶不仅会增加成本,还可能会抑制与底物蛋白的反应,从而降低了水解度。
随着酶解时间的延长,芸豆蛋白的水解度呈上升趋势,最后趋于平稳,这是因为随着酶解时间的延长,底物芸豆蛋白的浓度不断减少,蛋白质上肽键的数量也在减少,同时酶的活性也在下降。
水解时间延长,紫花芸豆蛋白的水解度、DPPH清除率和羟自由基清除率均呈上升趋势。呈现这种趋势的原因可能为酶解初期底物和酶均很充足,而随着水解时间的延长,底物和酶的浓度不断降低。DPPH 清除率和羟自由基清除率为先缓慢上升,再快速上升,再缓慢上升的趋势。当水解时间为3 h时,DPPH 清除率和羟自由基清除率均达到最大值,可能是因为随着水解时间的延长,水解度增大,肽的相对分子质量减小,具有抗氧化活性的肽就越多,从而使得DPPH 清除率和羟自由基清除率不断增大,这与RAMESH 等[25]的研究相一致,羟自由基和DPPH清除率最大值分别为37.5%和40.1%,表明紫花芸豆蛋白肽具有较强的抗氧化性,可作为一种天然的抗氧化剂进行深入研究并应用。目前紫花芸豆蛋白抗氧化肽的研究不多,马萍等[26]采用双酶分段水解法对紫花芸豆蛋白水解,并进行了双酶分段水解的工艺优化,最终紫花芸豆蛋白的水解度达58.8%,酶解时间为7.5 h。本研究采用复合酶法进行紫花芸豆蛋白肽的水解研究,最终水解度为42.2%,酶解时间为3 h,虽然水解度较双酶分段水解度低,但酶解时间较双酶分段水解减少一半以上,而水解度却可达双酶分段水解的72%左右,考虑到操作和仪器的使用消耗等因素,复合酶水解紫花芸豆蛋白的方法比较简单且高效。
本研究采用复合酶法制备芸豆蛋白抗氧化肽,复合酶的组合为中性蛋白酶和碱性蛋白酶,通过单因素和响应面试验对复合酶水解工艺进行优化,获得最适水解条件为:温度55 ℃、pH 10、酶添加比例为1 ∶2、酶添加量5 mL,在此条件下,测得紫花芸豆蛋白水解度为42.2%。对水解后的紫花芸豆蛋白肽进行抗氧化性测定,羟基和和DPPH 清除率分别达37.5%和40.1%,证明紫花芸豆肽具有较好的抗氧化性,即为紫花芸豆抗氧化肽。本研究为紫花芸豆抗氧化肽的制备提供参考,也为紫花芸豆蛋白肽在天然抗氧化剂的开发方面提供技术支持。

