miR-205通过靶向调控Wnt-5a抑制乳头状甲状腺癌的细胞增殖
刘亚琪,郑承红,2*
(1.湖北中医药大学,湖北 武汉 430065;2.武汉市中医医院 内分泌科,湖北 武汉 430000)
乳头状甲状腺癌(papillary thyroid carcinoma,PTC)是甲状腺癌最常见的病理类型,占甲状腺恶性肿瘤的90%以上[1]。PTC患者早期仍有少数发生侵犯周围组织、淋巴结转移甚至远处转移,或术后复发转移[2]。因此,复发和转移仍然是PTC治疗失败和死亡的主要原因[2]。关键基因的异常激活和功能障碍可导致PTC的进展[3]。因此,研究PTC的分子标志物对改善其治疗策略和预后具有重要作用。
MicroRNAs(miRNAs)是一类高度保守的非编码RNA,通过导致mRNA降解或抑制蛋白质翻译在转录后水平上负调控基因表达[4]。miRNAs与PTC的增殖、血管生成、耐药性和预后有关[5]。研究表明miR-205在多种癌组织中表达下调,并通过抑制肿瘤增殖、侵袭和转移发挥抑癌作用[6]。Wnt通路含有多种分泌性糖蛋白,它们控制着包括细胞增殖、分化和迁移等重要代谢过程[7]。本研究拟探讨miR-205 是否可以通过靶向无翼样MMTV结合点家族蛋白5a(wingless-type MMTV integration site family member 5a,Wnt-5a)抑制PTC的发生及对其机制进行探讨。
1 材料与方法
1.1 材料
1.1.1 患者和临床样本:60例在武汉市中医医院普外科接受治疗的PTC患者入选本研究。手术中收集癌组织标本和相应的癌旁组织标本,并记录患者年龄、性别、肿瘤范围-淋巴结转移-远处转移(TMN)分期、是否多灶性、是否淋巴结转移等情况,所有患者均在武汉市中医医院病理科确诊为PTC,术前无患者接受放射治疗和化学药物治疗。术后将癌组织标本和癌旁组织标本迅速冷冻在液氮中。在本研究中,将距癌组织5 cm以上的正常甲状腺组织切除后,在30 min内收集的作为癌旁组织标本。该研究得到武汉市中医医院伦理委员会的批准(伦理编号:20160015),所有参与者均已签署知情同意书。
1.1.2 材料与试剂:PTC细胞系K1以及BCPAP和人正常甲状腺滤泡上皮细胞系NTHY-OR-3-1(威海海弘顺生物科技有限公司);K1和BCPAP细胞系为PTC癌细胞系列,NTHY-OR-3-1细胞为正常细胞系。CCK-8试剂盒 (Sigma-Aldrich 公司);RPMI-1640 Hyclone培养基(Hyclone 公司);PCR 相关试剂、引物、检测试剂盒和核蛋白提取试剂盒(Invitrogen公司);荧光素酶试剂盒、荧光素酶载体和荧光素酶(Promega 公司);miR-205过表达产物、抑制物和miR-NC(广州锐博生物科技有限公司)。
1.1.3 实验动物:SPF级6周龄裸鼠20只,4~6周,体质量为18~22 g[南方医科大学实验动物实验中心,合格证号:SCXK(粤)2016-0041]。级屏障条件下进行饲养与实验。饲养裸鼠用饲料为经钴60源辐射灭菌条件下处理过的大小鼠专用颗粒饲料。
1.2 方法
1.2.1 细胞的分组及处理:1)所有细胞均在含有10% FBS RPMI-1640 Hyclone培养基中培养,细胞孵育条件为5% CO2、37 ℃。2)细胞的干预和增殖实验:取对数增殖期BCPAP细胞用于后续转染实验:50 nmol/L miR-205 mimic 组,50 nmol/L miR-205抑制剂组,50 nmol/L miR-205 mimic对照组和50 nmol/L miR-205抑制剂对照组。将50 nmol/L miR-205 mimic组和50 nmol/L miR-205 mimic对照组组作为1组进行对照;将50 nmol/L miR-205 mimic 组 和50 nmol/L miR-205 mimic对照组作为1组进行对照(即将miR-205 mimic 与miR-205抑制剂分别与各自的NC进行对照)。
1.2.2 实时荧光定量PCR(RT-qPCR)检测miR-205和Wnt-5a mRNA的相对表达:RNA提取和PCR反应按常规步骤进行,miR-205和Wnt-5a mRNA的相对表达量分别以GAPDH和U6作为内参对照。反应条件:95 ℃ 2 min;95 ℃ 10 s,55 ℃ 1 min,72 ℃ 1 min,进行40个循环。具体引物如下:miR-205上游引物:5′-GATCCTTCATTCCACCGG -3′,下游引物:5′-GTGCAGGGTCCGAGGT-3′;Wnt-5a-上游引物:5′-ACCACATGCAGTACATCGGAG-3′,下游:5′-GAGGTGTTATCCACAGTGCTG-3′;GAPDH-上游:5′-GAAGGTGAAGGTCGGAGTC-3′,下游:5′-GAAGATGGTGATGGGATTTC-3′;U6-上游:5′-CTC GCTTCGGCAGCACATATACT-3′,下游:5′-ACGCTT CACGAATTTGCGTGTC-3′。使用2-△△Ct方法检测 miR-205和Wnt-5a的相对表达水平。
1.2.3 CCK-8法检测细胞增殖:将 3×104个BCPAP细胞铺板在96孔板中并孵育0、24、48 和72 h。然后将细胞放置在带5% CO2、37 ℃的保温箱。之后,取10 μL CCK-8试剂添加到每个孔中。2 h后使用酶标仪在450 nm的波长下进行检测。
1.2.4 异种移植肿瘤形成的试验:将带有miR-205质粒或阴性对照的4×106个BCPAP细胞注射到裸鼠的左上侧。每4 d观察1次肿瘤体积。4周后,麻醉处死小鼠,并将肿瘤用于进一步研究。
1.2.5 双荧光素酶报告基因的检测:将野生的或突变的Wnt-5a的3′-UTR插入pmirGLO荧光素酶载体,用于荧光素酶报告基因测定,将带有Wnt-5a的3′-UTR 和 miR-205 mimic的载体转染到BCPAP细胞中,使用双重荧光素酶测定系统检测荧光素酶活性。
1.3 统计学分析
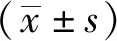
2 结果
2.1 miR-205和Wnt-5a在PTC组织和细胞系中的表达
癌组织中的miR-205表达明显低于癌旁组织(P<0.05),而Wnt-5a表达明显高于癌旁组织(P<0.01)(表1)。PTC组织中miR-205表达与Wnt-5a呈显著负相关性(r=-0.355,P<0.01)。miR-205的异常表达还与PTC患者的预后相关,高表达的 miR-205在PTC患者中具有更长的总生存期(P<0.05)。与NTHY-OR-3-1相比,PTC细胞系(K1和BCPAP)中miR-205的表达水平显着降低(图1A),而Wnt-5a表达显著增高(图1B)。

表1 miR-205和Wnt-5a在PTC组织和癌旁组织表达Table 1 Comparison of miR-205 and Wnt-5a expres- sion between PTC tissue and adjacent tissue
2.2 miR-205表达与PTC患者临床预后的相关性
miR-205低表达,而相对miR-205高表达淋巴结转移出现概率更高(P<0.01),并且 TNM 分期更为严重(P<0.01)(表2)。

表2 miR-205 表达与PTC患者临床病理特征之间的关系Table 2 Relationship between miR-205 expression and clinicopathological characteristics of PTC patients
2.3 miR-205过表达对PTC细胞增殖的影响
miR-205表达通过其模拟物增强,并通过其抑制剂降低(图1C)。miR-205 过表达抑制了BCPAP的增殖(图1D)(P<0.01)。相反,miR-205 的下调促进了 BCPAP 细胞增殖(图1E)(P<0.05)。
2.4 miR-205过表达对裸鼠成瘤的影响
将miR-205转染质粒或miR-NC注入BCPAP细胞到裸鼠中。具有miR-205质粒的裸鼠中PTC的肿瘤体积小于miR-NC(图2A)。此外,具有miR-205质粒的裸鼠中PTC肿瘤的生长速率低于miR-NC(P<0.01)(图2B)。

A.expression of miR-205 in human normal follicular epithelial cell line NTHY-OR-3-1,PTC cell lines K1 and BCPAP;*P<0.05,**P<0.01 compared with NTHY-OR-3-1;B.expression of Wnt-5a in human normal follicular epithelial cell line NTHY-OR-3-1,PTC cell lines K1 and BCPAP;**P<0.01 compared with NTHY-OR-3-1;C.effect of miR-205 mimic and miR-205 inhibitor on miR-205 expresion;D.effect of miR-205 mimic on BCPAP cell proliferation;**P<0.01 compared with NC;E.effect of miR-205 inhibitor on BCPAP cell proliferation;**P<0.05 compared with NC图1 miR-205和Wnt-5a在人正常甲状腺滤泡上皮细胞系NTHY-OR-3-1和PTC细胞系K1和BCPAP中的表达以及miR-205对BCPAP增殖的影响
2.5 Wnt-5a与miR-205的相互作用关系
TargetScan(http://www.TargetScan.org/vert_71/)和mi-Randa(http://www.microrna.org/ microrna/ getGeneForm.do)网站预测发现Wnt-5a为miR-205的靶基因(图3A)。miR-205 mimic降低了野生型Wnt-5a 的萤光素酶活性,但miR-205 mimc 未降低Mut-Wnt-5a 荧光素酶活性(图3B)。
3 讨论
miRNA在PTC中表达异常并通过抑制它们的靶点促进了PTC的发展和转移,并可能可以作为一种分子生物标志物用于预测疾病预后和治疗靶标[8]。譬如miR-431的下调促进了PTC细胞侵袭和淋巴结转移[9]。miR-101靶向MCL和c-met可促进TRAIL诱导的PTC线粒体凋亡[10],而miR-150可通过下调MUC4抑制PTC细胞增殖[11]。
Wnt-5a通常激活以下两种信号传导途径:Wnt/β-catenin通道和Wnt/Ca2+通道,且异常的Wnt信号传导已经成为某些癌的发病机制[12]。最近研究发现Wnt-5a在PTC中的表达显著增加,且Wnt-5a在PTC患者中的表达与肿瘤淋巴结转移和TNM分期有关[13]。
虽然Wnt-5a和miR-205都与PTC的发生和发展密切相关,但其在PTC中的交互作用尚不明确。本研究首先对PTC组织和细胞进行初步检测,证实了miR-205在PTC组织和细胞中的表达水平显著低于正常组甲状腺组织和细胞。然后,miR-205过表达可以抑制PTC细胞的增殖。最后本研究证实Wnt-5a是miR-205的直接靶标基因。这些研究结果为今后PTC治疗提供了新的临床治疗靶点。

A.general condition of tumor formation by injection of miR-205 and miR-NC;B.comparison of tumor weight by injection of miR-205 and miR-NC;*P<0.01 compared with miR-NC group图2 miR-205过表达对裸鼠成瘤的影响Fig 2 Effect of miR-205 over-expression on tumorigenesis in nude

A.predicted binding site of miR-205 with 3′-UTR of Wnt-5a;B.miR-205 mimic reduced the relative luciferase activity of Wnt-5a wild type,but such effect was not seen in Wnt-5a mutant;*P<0.05 compared with NC group图3 miR-205通过靶向结合Wnt-5a 3′-UTR端抑制Wnt-5a表达Fig 3 miR-205 inhibited Wnt-5a expression by targeting it’s 3′-UTR

