大鼠脑缺血-再灌注后G蛋白偶联受体84的表达升高
赵翀翀,郭文婷,蔡宏斌,王 欢
(兰州大学第二医院 神经内科,甘肃 兰州 730030)
缺血性卒中(ischemic stroke)的基本生理病理学特征是炎性反应、氧化应激和兴奋性毒性诱发的神经元死亡[1],但是其导致神经元死亡的机制还远未清楚。G蛋白偶联受体84(G protein-coupled receptor 84,GPR84)是G蛋白偶联受体家族的重要成员,主要分布于免疫系统细胞[2-3]。据报道,脂多糖或肿瘤坏死因子可以促进神经胶质细胞中GPR84的表达[4]。在实验性神经病理性疼痛,GPR84通过诱导巨噬细胞中毒性因子的分泌来发挥促炎受体的作用[5]。同时,基因微阵列结果显示:小鼠脑缺血-再灌注(ischemia-reperfusion,I/R)后GPR84基因的表达升高[6]。这提示:GPR84可能在缺血性脑损伤中发挥着重要作用。因此,本研究拟进一步探讨I/R后GPR84蛋白的表达变化,并初步阐释其功能,为揭示缺血性卒中后脑损伤的病理机制提供新的理论基础。
1 材料与方法
1.1 材料
1.1.1 动物:雄性SPF级SD大鼠30只(300 g左右)和出生1 d的SD大鼠[兰州大学实验动物中心,SCXK(甘)2018-0002]。
1.1.2 试剂:水合氯醛(国药集团化学试剂有限公司);RIPA裂解液和DAPI染色液(Boster公司);兔抗GPR84抗体(Santa Cruz公司);小鼠抗NeuN和Iba1单克隆抗体(Abcam公司);小鼠抗GFAP和GAPDH单克隆抗体(Proteintech公司);TUNEL试剂盒(上海翊圣生物公司);GPR84干扰片段(上海吉玛制药技术有限公司);RFectPM原代细胞小核酸转染试剂(常州百代生物公司)。
1.2 方法
1.2.1 大鼠的分组及处理:构建大鼠大脑中动脉阻断(middle cerebral artery occlusion,MCAO)模型[7],将大鼠分为假手术组(sham)和脑缺血2 h后再灌注12 h组(I/R 12 h)、24 h组(I/R 24 h)、48 h组(I/R 48 h)、72 h组(I/R 72 h)。
1.2.2 原代大鼠皮层神经元的分离及分组:取出生1 d的大鼠,消毒后处死,在无菌条件下分离并剪碎皮质组织。然后,在37 ℃条件下,利用0.125%胰蛋白酶将组织消化30 min,通过含10% FBS的 DMEM/F12 终止消化;随后,在1 000 r/min离心5 min,重悬,接种到培养皿中。培养4 h后,用含有2% B27的神经元基础培养基替换含10% FBS的 DMEM/F12培养基。48 h后,加入阿糖胞嘧啶以抑制非神经细胞。然后,每3 d更换半量的培养基。
GPR84干扰片段序列信息见表1。将细胞接种于6孔板,第2天采用RFectPM原代细胞小核酸转染试剂进行NC和GPR84 siRNA转染。将神经元分为对照组(control)、氧糖剥夺1 h复氧复糖24 h组(oxygen-glucose deprivation-reperfusion,OGD/R 1 h)、神经元转染干扰对照后氧糖剥夺1 h复氧复糖24 h组(NC+OGD/R 1 h)和神经元转染GPR84 siRNA后氧糖剥夺1 h复氧复糖24 h组(GPR84 siRNA +OGD/R 1 h),并按如下方法进行氧糖剥夺复氧复糖:将神经元接种到6孔板中,并添加glucose-free D-Hanks溶液,然后放入缺氧舱中,在5% CO2、94% N2和1% O2条件下低氧处理1 h或2 h。随后更换成神经元基础培养基,并置于常氧条件下继续培养24 h[8-9]。

表1 siRNA序列信息Table 1 Sequence of siRNA
1.2.3 Western blot检测脑组织和神经元细胞中GPR84蛋白的表达:利用含有蛋白酶抑制剂的RIPA裂解液将收集到的脑组织和神经元细胞进行裂解;并在15 000 r/min 离心约15 min,收集上清。通过Bradford比色法测定各样品蛋白的浓度;各样品吸取100 μg蛋白样品,通过2×上样缓冲液调整至等体积,随后于沸水中处理3 min将各样本蛋白变性。变性完成后进行SDS-PAGE和硝酸纤维素转膜,在室温利用脱脂奶粉(5%)封闭1 h。封闭完成后进行一抗孵育,在4 ℃过夜,TBST洗膜3次,随后在37℃进行二抗孵育,时间1 h,TBST洗膜3次,最后通过ECL化学发光发进行显影,用Quantity one 软件进行目的条带的吸光度值分析,以GAPDH作为内参对GPR84蛋白进行相对表达处理。
1.2.4 免疫荧光检测脑组织中GPR84蛋白的定位:大鼠在脑缺血-再灌注72 h后利用水合氯醛(3.5%)进行麻醉,通过PBS和4%的多聚甲醛进行灌注,灌注完毕后迅速将脑子取出,并于4%的多聚甲醛中过夜固定;然后,进行脑组织的石蜡包埋、切片和常规脱蜡。随后,将切片置于3% H2O2中室温处理10 min以灭活内源性酶,将切片浸入枸橼酸修复液中,通过微波炉进行抗原的热修复。将切片上滴加BSA在37 ℃孵育30 min以封闭非特异性背景,加入一抗(GPR84:1∶100,NeuN:1∶300,GFAP:1∶400,Iba1:1∶200),并于4 ℃孵育过夜,孵育完成后利用TBST洗3次,滴加驴抗兔/小鼠二抗(1∶500),在37 ℃孵育1 h,TBST洗3次,细胞核通过DAPI染色液进行染色,在37 ℃下作用15 min,最后通过荧光显微镜进行观察。
1.2.5 TUNEL(TdT-mediated dUTP nick end labeling)实验检测神经元的凋亡:将转染72 h后的神经元细胞进行OGD/R处理。OGD/R处理完成后,吸去培养基,并用PBS洗3次,利用多聚甲醛(4%)固定20 min,然后用PBS浸洗2次,通过PBS(含0.2% Triton X-100)处理细胞3 min,随后PBS浸洗,最后滴加TUNEL染色液,在37 ℃避光孵育1 h,将载玻片置于PBS孵育5 min,重复一次,再利用0.1% Triton X-100的PBS洗3次,每次5 min,最后滴加含有抗荧光淬灭的封片液封片,荧光显微镜下观察。
1.3 统计学分析
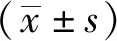
2 结果
2.1 脑缺血-再灌注对大鼠脑组织中GPR84蛋白表达的影响
与Sham组相比,I/R后脑组织中GPR84蛋白的表达显著提高(P<0.01)(图1)。
2.2 GPR84在脑缺血-再灌注大鼠脑皮层组织中的表达及定位
GPR84主要定位于神经元和小胶质细胞,星形胶质细胞几乎不表达,并且神经元中GPR84的表达在脑缺血-再灌注后明显提高(图2)。

图2 GPR84在I/R大鼠脑皮层组织中的表达及定位Fig 2 Expression and localization of GPR84 after cerebral I/R in rats(×400)
2.3 OGD/R对大鼠神经元中GPR84基因和蛋白表达的影响
与对照组相比,OGD/R 1 h和OGD/R 2 h两组大鼠神经元细胞中GPR84蛋白的表达均明显提高(P<0.01)(图3)。
2.4 GPR84干扰改善OGD/R诱导的神经元凋亡
与NC+OGD/R 1 h组相比,GPR84 siRNA+OGD/R 1 h组神经元细胞中的GPR84蛋白表达明显降低(P<0.01)(图4)。与对照组相比,OGD/R 1 h组神经元凋亡率明显提高(P<0.01)(图5);而与NC+OGD/R 1 h组相比,GPR84 siRNA+OGD/R 1 h组神经元凋亡率明显降低(P<0.01)(图5)。

A.Western blot assay detected the effect of cerebral I/R on the expression of GPR84 in rat neurons;B.statistical analysis results of A;*P<0.01 compared with sham group图1 MCAO I/R对大鼠脑组织中GPR84表达的影响Fig 1 Effect of cerebral MCAO I/R on the expression of n=6)
3 讨论
缺血性卒中导致的神经元不可逆死亡是造成患者行为学和神经功能障碍甚至死亡的重要原因[10]。这暗示抑制神经元死亡相关信号通路对于改善缺血性脑损伤的治疗具有重要意义。
GPR84是G蛋白偶联受体家族的重要成员,主要分布于免疫系统细胞(中性粒细胞、T细胞、巨噬细胞和神经胶质细胞),发挥促炎受体的作用[2-3]。研究表明神经炎性反应在缺血性脑损伤和再灌注损伤引发的神经元凋亡中发挥重要作用[11]。基因微阵列结果表明:脑缺血-再灌注可以诱导小鼠脑组织中GPR84基因的表达[6]。本研究也发现GPR84蛋白表达在大鼠I/R模型中明显升高。因此,GPR84可能在脑缺血-再灌注损伤中发挥重要作用。同时,本研究发现GPR84主要定位于神经元和小胶质细胞,星形胶质细胞几乎不表达,并且在I/R后神经元中GPR84的表达明显提高。这与前期文献报道GPR84主要表达于免疫系统细胞不同,而不同的病理状态可能是造成GPR84的不同细胞定位和表达模式的重要原因。

A.Western blot assay detected the effect of OGD/R on the expression of GPR84 in rat neurons;B.statistical analysis results of A;*P<0.01 compared with control group图3 OGD/R对大鼠神经元细胞中GPR84表达的影响Fig 3 Effect of OGD/R on the expression of GPR84 in rat neurons n=3)
鉴于神经元中GPR84的表达在I/R后明显提高,可以推测其在I/R诱导的神经元损伤中可能发挥重要作用。体外实验结果表明:原代大鼠神经元经氧糖剥夺1 h或2 h再灌注24 h后均可以明显诱导GPR84的表达,从而进一步证明了脑缺血-再灌注后神经元细胞中GPR84的表达是升高的。随后,本研究采用基因干扰技术抑制OGD/R诱导的GPR84表达,而GPR84下调可以明显抑制OGD/R诱导的神经元凋亡。但是,GPR84在调节OGD/R诱导的神经元凋亡中的作用机制还不清楚,还需要深入研究。有证据表明:GPR84在反流性食管炎中表达上调,抗炎处理后表达下调[12]。这表明GPR84与炎性存在密切联系。在实验性神经病理性疼痛中,GPR84通过诱导巨噬细胞中毒性因子(TNF-α、IL-6和IL-1β)的分泌来发挥促炎受体的作用[5]。TNF-α、IL-6和IL-1β已被证明在缺血性脑损伤中发挥重要作用[13]。这提示GPR84可能通过调节炎性因子的表达来影响神经元的凋亡。
综述所述,本研究表明GPR84蛋白在大鼠脑缺血-再灌注后的表达明显上调,而上调的GPR84蛋白主要分布于神经元中,抑制GPR84可以改善大鼠脑缺血-再灌注后神经元的凋亡,这为临床脑缺血性损伤的治疗提供了潜在的新靶点。

A.TUNEL assay detected the effect of GPR84 knockdown on the apoptosis of rat neurons induced by OGD/R;B.statistical analysis results of A;*P<0.01 compared with control group;#P<0.01 compared with NC+OGD/R 1 hour group图5 GPR84敲减抑制OGD/R诱导的神经元凋亡Fig 5 GPR84 knockdown reduced neural apoptosis caused by OGD/R n=3)

