苦荞抗氧化肽AFYRW稳定性研究
孙浩,左婕,雷霆雯,王筑婷,莫晓川,张礼林,许庆忠,李红梅
(贵州医科大学基础医学院生物化学与分子生物学教研室,贵州 贵阳 550025)
食源性天然抗氧化肽具有较强的抗氧化活性和较高的安全性,因此制备食源性抗氧化肽逐渐受到人们的重视[1]。已有研究者从发酵乳、鸢乌贼、大豆、乳清、玉米、鸡蛋和鱼等多种食材中制备得到抗氧化肽[2-6]。这些研究主要集中在抗氧化肽的酶解工艺、分离纯化、功能鉴定等方面,而生产加工及储存条件对其活性的影响研究较少。多肽作为蛋白质的降解产物,与蛋白质有类似的性质,其活性易受环境因素的影响,例如pH值、高温、重金属盐、有机溶剂、超声波、高压等。肽类物质在生产加工、储存过程中,可能会因氧化、脱氨基、水解或环化等作用而发生降解,导致其生物活性下降甚至完全丧失,这将严重影响到肽类产品的开发应用[7-8]。所以,研究肽类物质在不同环境中的稳定性显得尤为重要。
苦荞作为一种重要的农作物,因其风味独特,营养价值高,具有很好的保健食疗作用,被誉为“长寿食品”,已经得到广泛应用。苦荞的蛋白质含量为13.4%,富含赖氨酸、苯丙氨酸等多种必需氨基酸,是一种营养均衡的蛋白质,可以很好地为人体所利用。有研究发现苦荞蛋白具有降低胆固醇、降血脂、抗衰老、抑制乳腺癌的发生、抑制胆结石等作用[9-12]。前期通过碱性蛋白酶酶解苦荞清蛋白得到苦荞清蛋白酶解液,然后通过超滤分离、阴离子交换色谱、反向高效液相色谱成功分离出苦荞活性肽组分,经测序其氨基酸序列为Ala-Phe-Tyr-Arg-Trp(AFYRW),分子量大小为741.8 Da,并发现其在体外有良好的抗氧化活性[13],其清除羟自由基和DPPH自由基的IC50分别为0.65 mmol/L和0.64 mmol/L,同时还具有显著的脂质过氧化活性和还原性。这些结果表明AFYRW可能具有作为食品添加剂或功能性食品的潜在用途。然而,多肽必须抵抗胃肠道蛋白酶的降解,并通过肠道屏障完整的吸收,才能在人体系统发挥生理作用[14]。作为食品添加剂,还应考虑温度和加工条件对多肽的稳定性的影响。因此,本文研究了pH值、高温、冻融、金属离子以及模拟胃肠消化对苦荞抗氧化肽AFYRW抗氧化活性的影响,为其后期开发为食品添加剂、功能性食品等提供参考依据。
1 材料与方法
1.1 主要材料与试剂
苦荞抗氧化肽AFYRW(纯度≥98%):上海淘普生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):上海思域化工科技有限公司;胃蛋白酶(3 000 U/mg):大连美仑生物科技有限公司;胰蛋白酶(250 U/mg)、Triton X-100:北京索莱宝科技有限公司;羟自由基测试试剂盒:南京建成生物工程研究所;无水乙醇、盐酸(分析纯):国药集团化学试剂有限公司;氢氧化钠(分析纯):重庆茂业化工试剂有限公司。
1.2 仪器与设备
PE28 pH计:梅特勒-托利多仪器(上海)有限公司;Epoch2全波长酶标仪:美国Bio-Tek公司;DF-II数显集热式磁力搅拌器:金坛市杰瑞尔电器有限公司;UV-2600紫外可见分光光度计:尤尼柯(上海)仪器有限公司;CP214电子天平:奥豪斯仪器(上海)有限公司;SHHW21恒温水浴箱:天津市泰斯特仪器有限公司。
1.3 方法
1.3.1·OH清除率的计算
采用南京建成生物公司的羟自由基测试试剂盒测定样品的·OH清除率,严格按照羟自由基测试试剂盒说明书要求进行试验,并按照下面的公式计算羟自由基清除率。
羟自由基清除率/%=(Aa-Ab)/Aa×100
式中:Aa为空白吸光度;Ab为样品吸光度。
1.3.2 DPPH自由基清除率的计算
根据LIU等[15]描述的方法测定DPPH自由基清除率,并稍作修改。用95%乙醇溶液制备0.1 mmol/L的DPPH溶液。将100 μL样品和100 μL DPPH溶液在96孔板中混合。将混合物在黑暗中静置30 min。通过全波长酶标仪在波长为517 nm的条件下测量吸光度。使用乙醇做空白。DPPH自由基清除率通过以下公式计算。
DPPH 自由基清除率/%=[1-(Aa-Ab)/Ac]×100
式中:Aa为样品加DPPH溶液的吸光度值;Ab为样品加无水乙醇的吸光度值;Ac为无水乙醇加DPPH溶液的吸光度值。
1.3.3 pH值对苦荞抗氧化肽AFYRW抗氧化活性的影响
配制浓度为1 mg/mL的苦荞抗氧化肽AFYRW溶液,用1 mol/L氢氧化钠和盐酸调整溶液pH值分别为3.0、5.0、7.0、9.0、11.0,室温(25 ℃)振荡反应 2 h,结束后直接测定·OH清除率和DPPH自由基清除率。
1.3.4 温度对苦荞抗氧化肽AFYRW抗氧化活性的影响
配制浓度为1 mg/mL的苦荞抗氧化肽AFYRW溶液,分别在 37、65、98 ℃水浴中保温 0.1、0.5、1.0、1.5、2.0 h,测定·OH清除率和DPPH自由基清除率。
1.3.5 反复冻融对苦荞抗氧化肽AFYRW抗氧化活性的影响
配制浓度为1 mg/mL的苦荞抗氧化肽AFYRW溶液,将其放置-80 ℃冰箱反复冻融 0、1、2、4、6、8、10次,测定·OH清除率和DPPH自由基清除率。
1.3.6 金属离子对苦荞抗氧化肽AFYRW抗氧化活性的影响
配制浓度为2 mg/mL的苦荞抗氧化肽AFYRW溶液,向其添加等体积的 K+、Mg2+、Na+、Ca2+金属离子溶液,使每种金属离子浓度分别为0、0.05、0.10、0.20 mol/L,室温(25℃)放置2 h,测定·OH清除率和DPPH自由基清除率。
1.3.7 体外模拟胃肠道消化对苦荞抗氧化肽AFYRW抗氧化活性的影响
根据ZHU等[16]的方法并稍加改动,配制浓度为1 mg/mL的苦荞抗氧化肽AFYRW溶液,用1 mol/L的盐酸调节pH值至2.0,向其加入4%(质量分数)的胃蛋白酶,37℃水浴2 h,反应完成后,沸水浴10 min,6 000 r/min离心10 min,上清液为胃蛋白酶消化产物;取上清液用0.9 mol/L碳酸氢钠调节pH 5.3,再用1 mol/L氢氧化钠调节pH值至8.0,向其加入4%(质量分数)的胰蛋白酶,沸水浴10 min,6 000 r/min离心10 min,得到的上清液为胃蛋白酶、胰蛋白酶消化样品;取1mg/mL的苦荞抗氧化肽AFYRW溶液,用1mol/L氢氧化钠调节pH 8.0,向其加入4%(质量分数)的胰蛋白酶,沸水浴10 min,6 000 r/min离心10 min,得到的上清液为胰蛋白酶消化样品。将上述样品的pH值调至7.0,测定上清液的·OH清除率和DPPH自由基清除率。
1.3.8 苦荞抗氧化肽AFYRW溶血活性的测定
根据SOUZA等[17]的方法测定苦荞抗氧化肽AFYRW的溶血活性,取新鲜分离的人红细胞,用pH 7.4,0.01 mol/L磷酸盐缓冲液洗涤,然后在150 g,4℃离心10 min,重复3次,得到洗涤红细胞,用磷酸盐缓冲液配制浓度为4%(体积分数)的红细胞悬液;将100 μL 浓度为 0、10、50、100、200、300、400、500 μg/mL的苦荞抗氧化肽AFYRW加入到含有100 μL 4%的红细胞悬液的96孔板中,37℃共同孵育1 h,225 g,4℃离心10 min,取100 μL上清液,用酶标仪测定其在450nm的吸光度值。0.01mol/L磷酸盐缓冲溶液为阴性对照,0.1%的Triton X-100为阳性对照。重复3次。并按照下面的公式计算溶血率。
红细胞溶血率/%=(Aa-Ab)/(Ac-Ab)×100
式中:Aa为样品吸光度值;Ab为0.01 mol/L磷酸盐缓冲溶液的吸光度值;Ac为0.1%的Triton X-100的吸光度值。
1.4 统计分析
每组试验重复3次,试验结果以均值±标准差表示。使用SPSS 25.0软件进行方差分析,显著性水平为P<0.05。
2 结果与分析
2.1 pH值对苦荞抗氧化肽AFYRW抗氧化活性的影响
pH值对苦荞抗氧化肽AFYRW的抗氧化活性的影响如图1所示。
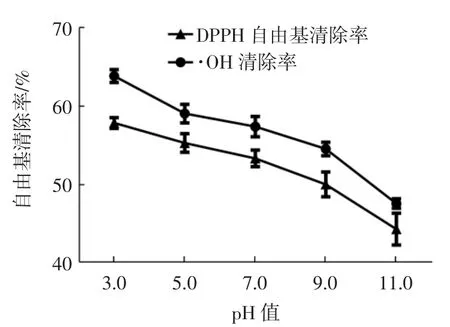
图1 pH值对苦荞抗氧化肽AFYRW抗氧化活性的影响Fig.1 Effect of pH on antioxidant activity of antioxidant peptide AFYRW from tartary buckwheat
由图1可以看出,pH值为3时,苦荞抗氧化肽AFYRW对·OH清除率和DPPH自由基清除率最强,分别为63.81%和57.80%,随着pH值的上升,苦荞抗氧化肽AFYRW的抗氧化活性显著下降(P<0.05),在pH值为11时,抗氧化活性最低,但也保持着较高的水平,这时·OH清除率和DPPH自由基清除率分别为47.52%和44.24%。与pH值为3时比较,pH值为11时对·OH清除率和DPPH自由基清除率分别下降了16.29%(P<0.05)和 13.56%(P<0.05)。这可能是随着 pH值增大,多肽易发生消旋作用,造成一些L型氨基酸变成D型氨基酸,进而引起极性和空间位阻等结构性质变化,降低生物活性[18]。因此,在加工利用过程中,应避免在强碱性环境下使用苦荞抗氧化肽AFYRW。
2.2 温度对苦荞抗氧化肽AFYRW抗氧化活性的影响
温度对苦荞抗氧化肽AFYRW的抗氧化活性的影响如图2、图3所示。
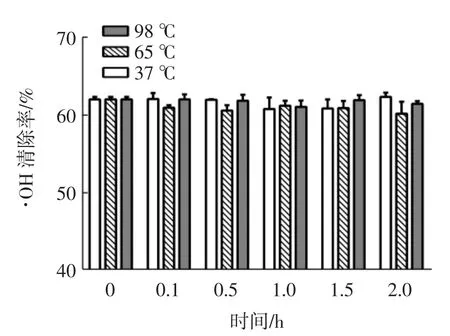
图2 温度对苦荞抗氧化肽AFYRW的·OH清除率的影响Fig.2 Effect of temperature on·OH scavenging rate of antioxidant peptide AFYRW from tartary buckwheat
由图 2、图 3可以看出,在 37、65、98℃时,苦荞抗氧化肽AFYRW的抗氧化活性保持在比较稳定的状态(P>0.05)。这可能是因为分子量较小的肽不具备热敏感的三级和四级结构[19],苦荞抗氧化肽AFYRW是只有5个氨基酸的小肽,过高温度处理,时间过长,可能并不会改变苦荞抗氧化肽AFYRW的结构,也没有影响其抗氧化活性,这与WONG等[20]研究黄貂鱼水解液抗氧化肽的结果相一致。这表明苦荞抗氧化肽AFYRW在生产加工中是耐高温的。
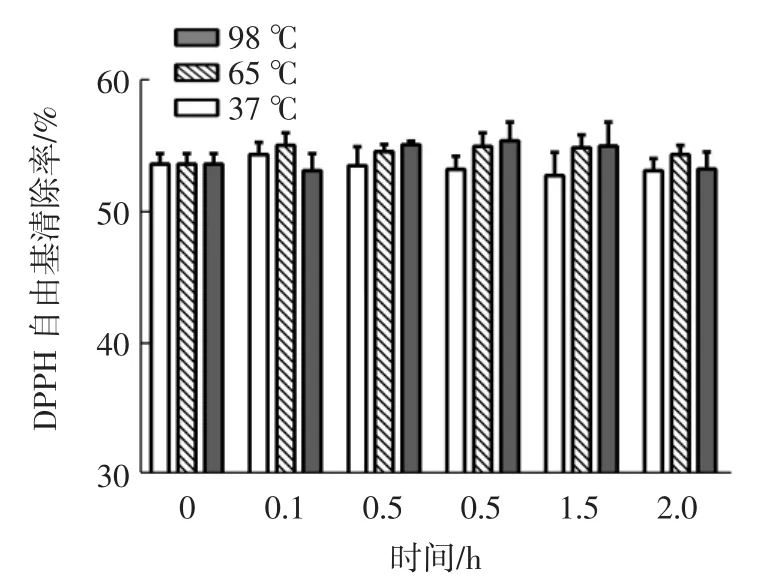
图3 温度对苦荞抗氧化肽AFYRW的DPPH自由基清除率的影响Fig.3 Effect of temperature on DPPH radical scavenging activity of antioxidant peptide AFYRW from tartary buckwheat
2.3 反复冻融对苦荞抗氧化肽AFYRW抗氧化活性的影响
反复冻融对苦荞活性肽AFYRW的抗氧化活性影响如图4所示。
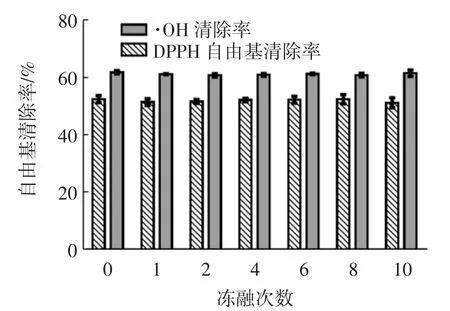
图4 冻融对苦荞抗氧化肽AFYRW的抗氧化活性的影响Fig.4 Effect of freezing and thawing on antioxidant activity of antioxidant peptide AFYRW from tartary buckwheat
从图4中可以看出,即使反复冻融10次,苦荞抗氧化肽AFYRW的抗氧化活性还保持在比较稳定的状态(P>0.05),说明反复冻融并不会影响苦荞抗氧化肽AFYRW的抗氧化活性,这也表明苦荞抗氧化肽AFYRW在生产加工过程中是可以冻融、耐低温的。
2.4 金属离子对苦荞抗氧化肽AFYRW抗氧化活性的影响
金属离子对苦荞抗氧化肽AFYRW的抗氧化活性如图5、图6所示。
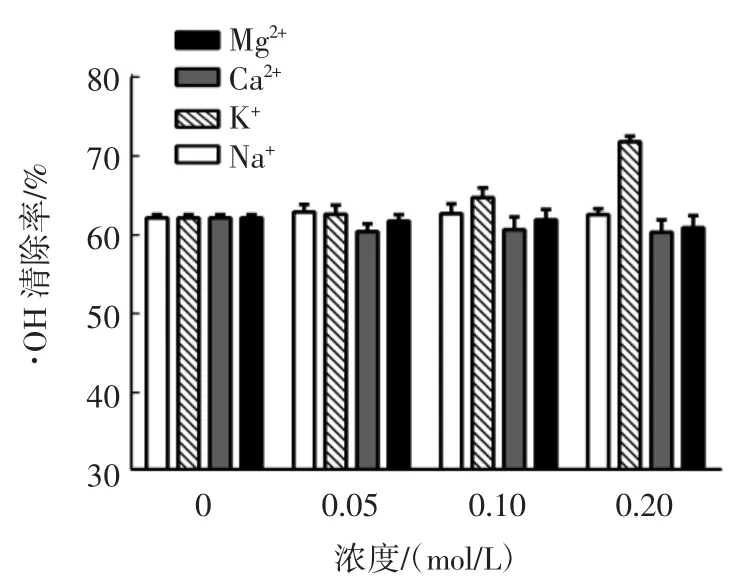
图5 金属离子对苦荞抗氧化肽AFYRW的·OH清除率的影响Fig.5 Effect of metal ions on·OH clearance of antioxidant peptide AFYRW from tartary buckwheat
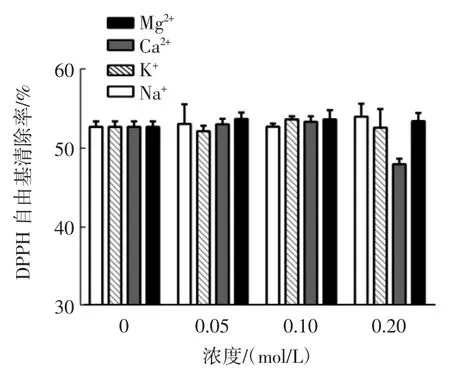
图6 金属离子对苦荞抗氧化肽AFYRW的DPPH自由基清除率的影响Fig.6 Effect of metal ions on DPPH radical scavenging activity of antioxidant peptide AFYRW from tartary buckwheat
由图 5 和图 6 可以看出,Mg2+、Na+在 0~0.20 mol/L时,对苦荞抗氧化肽AFYRW的抗氧化活性影响不显著(P>0.05);K+可以提高苦荞抗氧化肽AFYRW的·OH清除率,浓度为0.20 mol/L时,·OH清除率相比未添加K+时可以提高9.67%(P<0.05),K+对苦荞活性肽AFYRW的DPPH自由基清除率的影响不显著(P>0.05);Ca2+在 0~0.10mol/L 时,对苦荞抗氧化肽 AFYRW的DPPH自由基清除率的影响不显著(P>0.05),Ca2+在0.20 mol/L时,抑制了苦荞抗氧化肽AFYRW的DPPH自由基清除率,比未添加Ca2+低4.4%左右(P<0.05);Ca2+对苦荞抗氧化肽的·OH清除率没有显著影响(P>0.05)。结果表明,苦荞抗氧化肽AFYRW在加工储存过程中,可以与含有Mg2+、Na+、K+的原辅料一起加工,但应该尽量避免与Ca2+接触。
2.5 体外模拟胃肠道消化对苦荞抗氧化肽AFYRW抗氧化活性的影响
模拟胃肠道消化对苦荞抗氧化肽的抗氧化活性影响如图7所示。

图7 模拟胃肠消化对苦荞抗氧化肽AFYRW的抗氧化活性的影响Fig.7 Effect of simulated gastrointestinal digestion on antioxidant activity of antioxidant peptide AFYRW in tartary buckwheat
经过2 h模拟胃液消化后,与消化前相比,·OH清除率和DPPH自由基清除率分别下降了12.03%(P<0.05)、16.86%(P<0.05);经过 2 h 模拟肠液消化后,与消化前相比,·OH清除率和DPPH自由基清除率分别下降了 9.02%(P<0.05)、11.63%(P<0.05);先经过胃液消化2 h后,再经肠液消化2 h,与消化前相比,·OH清除率和DPPH自由基清除率分别下降了14.71%(P<0.05)、19.96%(P<0.05)。通常,胃蛋白酶会水解食源性蛋白质生成分子量超过10 kDa的肽混合物,后者会被胰蛋白酶进一步水解为小肽。CHITTCHANG等[21]发现分子量大于3 kDa的肽在胃消化过程中比分子量小于3 kDa的肽更容易被降解。然而,CING MARS等[22]发现低分子量的活性肽优先比高分子量肽水解。研究结果表明,除了分子量外,肽的其它特性,如酸碱性、疏水性和碳氮末端氨基酸组成也对肽的胃肠消化稳定性有影响[23]。因此,苦荞抗氧化肽AFYRW的胃肠消化稳定性还需要进一步研究和分析。
2.6 苦荞抗氧化肽AFYRW溶血活性
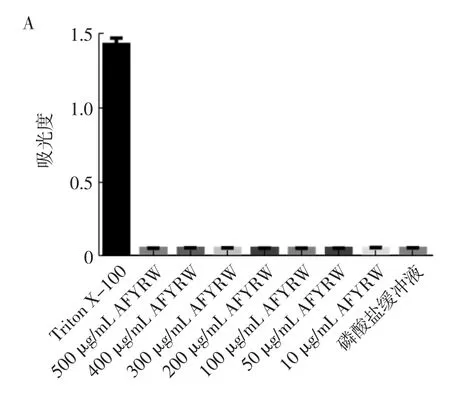
苦荞抗氧化肽AFYRW对红细胞的溶血作用如图8所示。
由图8可以看出,苦荞抗氧化肽AFYRW的浓度达到500 μg/mL时,其吸光度与0.01 mol/L磷酸盐缓冲液吸光度无差异(P>0.05),溶血率为0,说明苦荞抗氧化肽AFYRW对红细胞无溶血作用,这一结果也与YANG等[24]研究的抗菌肽AMP-17对红细胞的作用相一致。因此,苦荞抗氧化肽AFYRW对人的红细胞是安全的。
3 结论
以苦荞抗氧化肽AFYRW为对象,研究了不同因素和体外模拟胃肠消化对其抗氧化活性的影响,以及抗氧化肽AFYRW对红细胞的溶血作用。结果表明:苦荞抗氧化肽AFYRW具有较好的热稳定性;反复冻融、Na+、Mg2+对抗氧化肽AFYRW抗氧化活性无显著变化;Ca2+会降低抗氧化肽AFYRW的DPPH自由基清除率,K+会提高抗氧化肽AFYRW的·OH清除率;随着pH值升高,抗氧化肽AFYRW的·OH和DPPH自由基清除率下降,不利于苦荞抗氧化肽AFYRW活性的保持。不同因素对苦荞抗氧化肽AFYRW活性影响不同,因此,在苦荞抗氧化肽AFYRW的生产加工中,采用合理优化的条件有利于避免其活性的下降。苦荞抗氧化肽AFYRW对红细胞无溶血作用,说明苦荞抗氧化肽AFYRW无毒性作用。但模拟胃肠消化后发现苦荞抗氧化肽AFYRW的抗氧化活性下降,说明胃肠消化道酶可能会降解肽或改变其结构,因此在整个胃肠消化过程中可能需要使用一些策略来提高其生物利用度,在这方面,还需要进一步研究,以评价肽作为功能性食品的生物活性和生物利用度,以及可能对人体产生的生理影响。

