蜂胶提取物对诺如病毒的体外抑制作用研究
唐梦旋,陈莉莉,廖宁波,,*,陈 江,程东庆,吴国平
(1.江西农业大学 食品科学与工程学院,江西 南昌 330000;2.浙江省疾病预防控制中心,浙江 杭州 310051;3.浙江中医药大学 医学技术学院,浙江 杭州 310053)
人源诺如病毒(human norovirus,HuNoV)是全世界非细菌性肠胃炎的主要病因。HuNoV主要通过粪口途径感染,而鲜切的绿色蔬菜、草莓和西红柿等农产品及其果汁制品是最常见的、与诺如病毒(norovirus,NoV)暴发有关的食品类别[1-2]。鲜榨果(蔬)汁是指以新鲜水果或蔬菜为原料的现榨现饮,即不经任何的杀菌处理,供人们直接饮用的非定型包装饮料。目前,HuNoV的灭活主要依靠加热、辐射、次氯酸钠和二氧化钛处理等传统的物理和化学方法,但是这些方法都会对食品的生物活性成分产生破坏,最终降低食品的营养和感官价值[3]。据报道,含有类黄酮、多糖和多酚的植物提取物,如石榴提取物、葡萄籽提取物和蔓越莓提取物,可以降低饮料中诺如病毒的感染性[4]。一些天然化合物适合用作安全、健康的抗病毒添加剂。蜂胶是蜜蜂从各种植物中收集的树脂材料,并与蜡和其他物质混合,是一种天然的植物产物,也是常用的食品添加剂成分[5]。蜂胶主要由黄酮类、酚类、芳香酸类、酯类等多种化合物组成,在我国及一些东南亚国家,蜂胶常被添加到果蔬汁中以调节口感。据报道,蜂胶及其部分活性物质可以抑制脊髓灰质炎病毒(PV)、甲型和乙型流感病毒、呼肠孤病毒(RV)和艾滋病病毒(HIV)[6]。尽管已有许多关于蜂胶药理活性的报道,但蜂胶对HuNoV的作用及其机制尚不清楚,关于其在果蔬汁中抗诺如病毒的应用也鲜有报道。目前国际上已有许多关于HuNoV体外培养的探索,并取得了一系列的成果,但HuNoV体外培养体系还不完全稳定,无法被广泛运用;因此,对于抗诺如病毒药物效果的研究仍然需要通过可培养的HuNoV替代物来完成[7]。选取小鼠诺如病毒(murine norovirus-1,MNV-1)和噬菌体MS2作为HuNoV的替代物。MNV-1是一种可培育的诺如病毒,目前被认为是最合适的HuNoV替代物;而MS2在常规实验中培养简便、经济,感染性实验比其他替代方法更易进行。
本研究拟探讨蜂胶水提物(propolis water extract,PWE)和醇提物(propolis ethanol extract,PEE)对诺如病毒替代物MNV-1和MS2的抑制作用。通过浓度相关性和时间相关性实验对蜂胶提取物的抗病毒功效进行分析;为了进一步了解PEE抑制病毒的机制,在MNV-1感染过程中的不同时间点,将PEE作用于MNV-1及其缩主细胞——小鼠单核巨噬细胞(RAW264.7细胞),测定病毒的复制和吸附情况,并利用透射电镜技术观察病毒颗粒的破损情况,进一步验证蜂胶提取物的抗病毒机制;对蜂胶提取物作为天然添加剂在鲜榨果蔬汁中的抗病毒应用进行初步评价。
1 材料与方法
1.1 材料与试剂
蜂胶,浙江江山福赐德蜂业科技开发有限公司;噬菌体MS2 (ATCC 15597-B1)、大肠杆菌(ATCC 15597)、MNV-1、小鼠单核巨噬细胞(RAW264.7细胞),美国典型培养物保藏中心;没食子酸、D-葡萄糖、芦丁,均为分析纯试剂,上海索莱宝生物科技有限公司;苯甲酸、咖啡酸、对香豆酸、柚皮素、α-儿茶素、表儿茶素、乔松素、白杨素、高良姜素、蜂胶黄酮(pinobanksin-3-O-acetate,PB3A,质量分数≥99%,属于二氢黄酮),均为色谱纯试剂,云南西力股份有限公司。
1.2 仪器与设备
3383L70型Thomas-Willey研磨机,广州德润仪器科技有限公司;6000型二极管阵列检测器(DAD),北京京科瑞达科技有限公司;JEOL-1400型电子显微镜,日本电子株式会社;601型超声波冲样机,美国Gatan公司;JY96-IIN型超声波细胞破碎仪、722S型分光光度计,上海向帆仪器有限公司;LGJ-10N型冷冻干燥机,上海锦玟仪器设备有限公司;BSC-1600IB2型生物安全柜,苏州安泰空气技术有限公司;1384-M型细胞培养箱,美国Thermo公司。
1.3 实验方法
1.3.1PEE和PWE的制备
将生蜂胶样品在-20 ℃冷冻6 h,研磨成均匀的粉末(粒度≤80目)。
PEE的制备:将50 g蜂胶粉溶于150 mL体积分数为96%乙醇中,25 kHz下超声处理45 min,在室温下过滤后得到PEE。
PWE的制备:将50 g生蜂胶在研磨机中粉碎,在80 ℃ 150 mL水中提取12 h,25 kHz下超声处理45 min,室温下冷却过滤后得到PWE[8]。
将粗提取的PEE和PWE溶液以14 000g离心15 min,减压浓缩上清液后获得干燥提取物。用体积分数为5%的二甲基亚砜(DMSO)溶解PEE,用去离子水溶解PWE,配制质量浓度为1 000 μg/mL的PEE和1 000 μg/mL PWE用于后续实验,并分别以体积分数为5%的DMSO溶液和不含蜂胶的去离子水作为对照。
1.3.2PEE和PWE的化学成分鉴定
采用Folin-Ciocalteu比色法计算提取物中的总酚类化合物含量[9];采用phenol-sulfuric acid法检测可溶性多糖含量[10];采用比色法测定总黄酮的含量[11];采用高效液相色谱(HPLC)分析提取物中酚类物质,通过保留时间和紫外光谱的比较,鉴定蜂胶提取物中的10种酚类化合物,并用标准品曲线进行定量 (以mg/g为单位)[12]。
1.3.3蜂胶提取物的抗病毒作用实验
在浓度相关性研究中[3-4,13],用过滤器(孔径为0.22 μm)将质量浓度为1 000 μg/mL的PEE和PWE除菌,并进一步无菌稀释至100、250、500 μg/mL。将等体积的PEE和PWE溶液分别与等体积的MNV-1或MS2混合,使病毒浓度达到4、8 lgPFU/mL,并在室温下培养30 min。在时间相关性研究中,将质量浓度为500 μg/mL的PEE和PWE溶液分别与等体积的MNV-1或MS2混合,分别培养0、10、20、30、40、50、60 min,并将MNV-1和MS2分别与体积分数为5% DMSO和去离子水混合,作为未经处理的对照。培养后,用含有体积分数为10%热灭活胎牛血清(FBS)的细胞培养基(DEME)处理每种混合物,以停止反应。实验重复3次。
1.3.4MNV-1和MS2的感染性评估
使用空斑实验评估蜂胶提取物处理过的两种病毒的感染性。MNV-1和MS2的培养方法参照Cheng等[13]报道。MNV-1在37 ℃下培养5 h后计数斑块,MS2在37 ℃下培养过夜后计数斑块。通过从未处理的对照组滴度中减去用PEE或PWE处理的样品的滴度来确定病毒滴度的变化。
1.3.5PEE抑制MNV-1病毒的作用机制研究
在MNV-1感染RAW264.7细胞的不同时间点,通过添加PEE来测定病毒在侵染细胞过程中的复制和吸附的实验(time-of-addition experiments),可以初步探索PEE的抗病毒机制。实验过程包括前处理[细胞前处理(pre-RAW264.7)和病毒前处理(pre-MNV-1)]、共同处理(Co-treatment)和后处理(post-treatment)。为了评价天然提取物对病毒吸附的抑制作用,通常采用前处理和共同处理两个步骤;为了评价天然提取物对病毒复制的抑制作用,通常采用后处理来进行[14]。
用PEE对RAW264.7细胞进行前处理:采用六孔板培养RAW264.7细胞,向RAW264.7细胞培养液[含体积分数为10%的FBS和1% 双抗(PS)的DMEM]中加入PEE,使其终质量浓度为500 μg/mL。将PEE与细胞培养液的反应体系于37 ℃的 CO2培养箱中培养40 min,完全吸除含PEE的细胞培养液后,每孔中再次加入1 mL含体积分数为10%FBS和1% PS的DMEM 细胞培养液,并向细胞培养液中加入100 μL的MNV-1接种液(病毒终浓度8 lgPFU/mL)。在37 ℃的CO2培养箱中让MNV-1吸附细胞1 h后,去除含MNV-1接种物的细胞培养基,每孔中重新加入1 mL DMEM(含1.5% 琼脂糖、5% FBS 和0.5% PS)培养基。将六孔培养板在37 ℃,体积分数为5%的CO2中培养2 d(42~48 h)后,细胞用结晶紫染色,计算空斑数,并观察细胞病变效应和空斑形成。对照组采用灭菌蒸馏水。
用PEE对MNV-1进行前处理:将等体积的PEE与 MNV-1混合,室温培养40 min后,用含体积分数为10% FBS的DMEM细胞培养液稀释中和PEE与病毒的反应体系(体系中PEE的终质量浓度500 μg/mL,MNV-1终浓度8 lgPFU/mL)。将PEE与病毒的反应体系稀释液(含体积分数为10% FBS的 DMEM细胞培养液)接种到RAW264.7细胞单层上,在37 ℃温度下接种1 h,去除含PEE和MNV-1接种物的细胞培养基。其后步骤按RAW264.7细胞前处理方法进行。
用PEE对MNV-1和RAW264.7进行共同处理:用MNV-1和PEE同时加入宿主RAW264.7细胞培养液(含10%FBS和1% PS的DMEM)中。体系中PEE的终质量浓度为500 μg/mL,MNV-1终浓度为8 lgPFU/mL,在37 ℃下混合1 h,去除含PEE和MNV-1接种物的细胞培养基。其后步骤按RAW264.7细胞前处理方法进行。
用PEE对MNV-1和RAW264.7进行后处理:先用MNV-1(终浓度为8 lgPFU/mL)感染宿主RAW264.7细胞1 h,再加入PEE(终质量浓度为500 μg/mL)在37 ℃处理40 min,去除含PEE和MNV-1接种物的细胞培养基。其后步骤按RAW264.7细胞前处理方法进行。
1.3.6透射电子显微镜成像分析
将3 μL经PEE和PWE处理的MS2和MNV-1悬浮液用水稀释10倍,置于辉光放电碳涂层电磁栅极上,并用3 μL体积分数为3%的醋酸铀酰水溶液染色1 min。待染色的网格干燥后进行透射电子显微镜检测,以40 000倍的放大倍率拍摄图像。
1.3.7PEE在果蔬汁中的抗病毒实验
从浙江省杭州市的一家超市获得4种果蔬汁(番茄汁,pH值为4.0;生菜汁,pH值为4.1;葡萄汁,pH值为3.3和橙汁,pH值为3.5)。将初始滴度为7 lgPFU/mL的MNV-1和MS2接种于果蔬汁中,与PEE(250 μg/mL)等体积混合,并在室温下处理30 min。细胞毒性对照组仅包括不添加PEE的果汁。
1.4 数据分析
所有数据均以平均值±标准差表示,采用非配对t检验比较两组数据的平均值。对于两组以上数据的多重比较,采用单因素方差分析和Fisher最小显著性差异检验方法。P<0.05时,表示数据间差异显著。
2 结果与分析
2.1 PEE和PWE的化学成分分析
蜂胶中PEE、PWE的提取率和化学成分分析结果见表1。由表1可知:PEE和PWE提取率分别为19.87%和13.11%;PEE中总酚质量分数为(151.54±9.74)μg/mg,总黄酮质量分数为(70.05±2.56)μg/mg;PWE中可溶性多糖含量为338.43±7.32 μg/mg,其总酚、总黄酮含量低于PEE。这一组成也证实了总酚是PEE的主要成分,可溶性多糖是PWE的主要成分。蜂胶提取物中酚类化合物的HPLC分析结果见表2。表2表明:在PEE的多酚类化合物中,主要化合物为高良姜素(galangin)、蜂胶黄酮(pinobanksin-3-O-acetate)、乔松素(pinocembrin)和白杨素(chrysin);PWE的总酚、总黄酮含量低于PEE。有研究表明,一些含酚的天然成分,特别是抗黏附酚可以抑制包括细菌、病毒和原生动物在内的微生物毒素或肠道病原体的黏附[15]。2010年,Schnitzler等[16]研究了蜂胶化合物对游离单纯疱疹病毒1型(herpes simplex virus-1,HSV-1)斑块形成的影响,发现与未处理的对照组相比,高良姜素和白杨素分别使游离HSV-1斑块的形成减少了68.0%和56.4%。
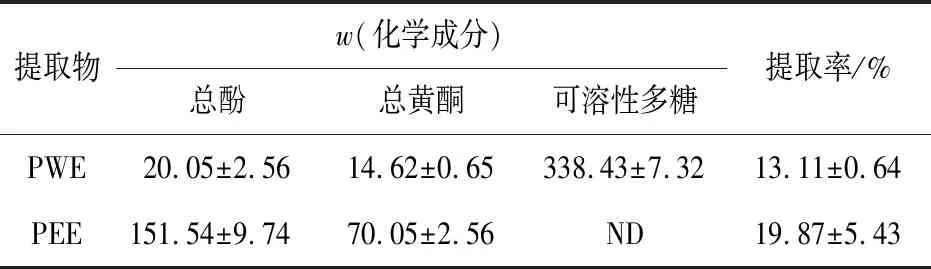
表1 蜂胶提取物的提取率及其主要化学成分Tab.1 Extraction rate and main chemical components of propolis extract μg /mg
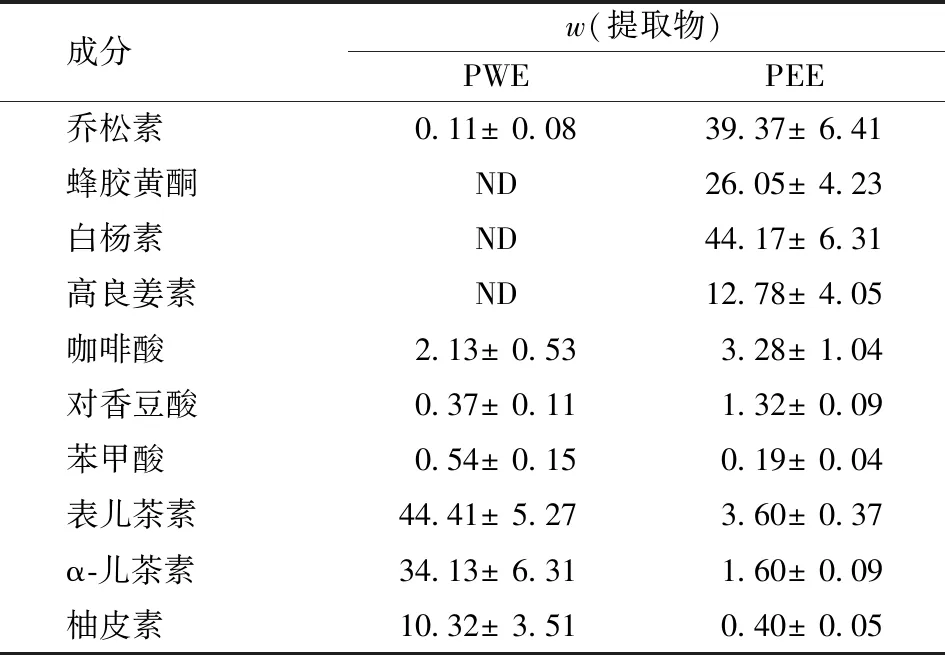
表2 蜂胶提取物中酚类化合物的HPLC分析结果Tab.2 Results of analysis of phenolic compounds in propolis extract by HPLC mg/g
不同浓度的蜂胶提取物(PEE和PWE)对宿主细胞RAW 264.7存活的影响,实验结果见图1。图1表明,当高浓度PEE或PWE添加到宿主细胞系时,发现其对RAW 264.7细胞具有细胞毒性。当PEE或PWE质量浓度小于等于500 μg/mL时,未观察到其细胞毒性作用。因此,在接下来的抗病毒实验中,空斑实验所用PEE和PWE的质量浓度(≤500 μg/mL),不会影响使用宿主细胞确定抗病毒效果的能力。

*表示PWE与PEE相比差异显著(P<0.05)。图1 不同浓度的蜂胶提取物对宿主细胞RAW264.7存活率的影响Fig.1 Effects of different concentrations of propolis extract on survival rate of RAW264.7 cells
2.2 蜂胶提取物的抗病毒作用分析
2.2.1浓度相关性分析
研究了蜂胶提取物(PEE和PWE)对诺如病毒替代物(MNV-1和MS2)的抑制作用,实验结果见图2。当MNV-1和MS2起始浓度为低滴度(4 lgPFU/mL)时,低滴度的PEE(100 μg/mL)作用使MNV-1和MS2的滴度分别下降了2.09 lgPFU/mL和2.66 lgPFU/mL,表现出显著的病毒抑制效果,但随着后续PEE浓度的增加,病毒的减少效果并不显著,而是一直保持着一个较低的水平,直到无法检测;PWE仅在高浓度500 μg/mL时表现出显著的病毒抑制效果。
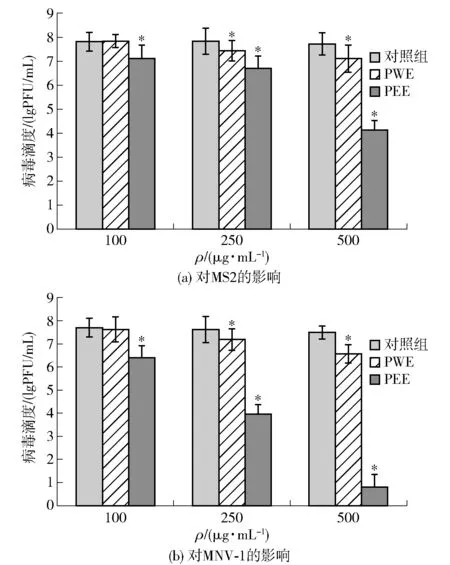
*表示PWE或PEE与对照组相比差异显著(P<0.05)。图2 不同浓度的蜂胶提取物对MS2和MNV-1病毒滴度的影响Fig.2 Effects of different concentrations of propolis extracts on virus titer of MS2 and MNV-1
当MNV-1和MS2起始浓度为高滴度(18 lgPFU/mL)时,图2(a)显示,当用100 μg/mL PEE处理MS2时,病毒滴度下降了0.77 lgPFU/mL;当PEE质量浓度增加到500 μg/mL时,病毒滴度下降了3.75 lgPFU/mL。图2(b)表明:PEE对MNV-1的抑制作用更显著,当用100 μg/mL PEE处理MNV-1时,MNV-1病毒滴度下降了1.32 lgPFU/mL;用500 μg/mL PEE处理MNV-1时,MNV-1病毒滴度下降了6.93 lgPFU/mL。
使用PWE处理病毒时,同样观察到PWE的抗病毒活性。由图2可见,质量浓度为100、250、500 μg/mL的PWE可有效降低MNV-1和MS2的病毒滴度,且呈浓度相关性。然而,在实验中使用3种浓度的PWE处理病毒后,发现MS2滴度的下降均小于1 lgPFU/mL,说明与PEE抑制病毒的效果相比,PEE比PWE更有效。
与此研究结果类似,Kwon等[17]的研究表明,蜂胶提取物kaempferol (KF)和p-coumaric acid (p-CA)可能阻止或减少病毒进入细胞,以保护细胞免受病毒破坏;Urushisaki等[18]发现了蜂胶提取物与MDCK细胞表面之间存在强烈的相互作用;Büfalo等[19]研究了70%乙醇提取PEE对HEp-2细胞系中脊髓灰质炎病毒1型(PV1)的体外抗病毒活性。
2.2.2时间相关性分析
图3为蜂胶提取物与病毒抑制作用的时间相关性实验结果。图3显示,质量浓度为250 μg/mL的蜂胶提取物与MNV-1和MS2培养0、10、20、40、60 min,病毒滴度与培养时间相关。在对照组中,磷酸盐缓冲液(PBS)中MNV-1和MS2的滴度在60 min内无变化,而实验组中,在质量浓度为250 μg/mL PEE作用下,病毒量随时间延长而明显下降。病毒与PEE混合后10 min,MNV-1和MS2的滴度分别下降1.56、1.02 lgPFU/mL;在接下来的30 min内,MNV-1的滴度继续下降2.62 lgPFU/mL,MS2的滴度继续下降2.28 lgPFU/mL;在剩余的20 min培养时间内,MNV-1和MS2的病毒滴度仅略有下降。PWE的抗病毒作用则弱于PEE,经质量浓度为250 μg/mL PWE处理60 min后,MNV-1和MS2的总滴度分别减少1.56 lgPFU/mL和1.34 lgPFU/mL。因此,PEE在降低MNV-1和MS2滴度方面比PWE更有效。

*表示PWE或PEE与对照组相比差异显著(P<0.05)。图3 PEE或PWE处理后MNV-1和MS2病毒滴度随培养时间的变化Fig.3 Changes of virus titers of MNV-1 and MS2 with different incubation time after exposure to PEE or PWE
2.3 PEE的抗病毒机制分析
2.3.1PEE对病毒吸附与复制作用的影响
在MNV-1感染RAW264.7细胞之前,或者同时与PEE作用,抗病毒效果显著则说明PEE可能发挥与宿主细胞(受体)结合或直接与病毒颗粒结合的作用,阻断病毒颗粒与宿主细胞的附着或结合,阻止病毒进入宿主细胞;在MNV-1感染RAW264.7细胞之后加入PEE,抗病毒效果显著则说明PEE抑制了病毒在宿主细胞中的复制[20-21]。使用PEE的抗病毒实验是在没有细胞毒性的浓度下进行的,即用质量浓度为250 μg/mL和500 μg/mL的PEE处理后,RAW264.7细胞的存活率大于85%。PEE对MNV-1病毒吸附和复制的影响,实验结果见图4。图4显示:用质量浓度为500 μg/mL PEE对RAW264.7细胞进行前处理,与对照组相比,MNV-1滴度相差3.87 lgPFU/mL;用质量浓度为500 μg/ml PEE对MNV-1进行前处理,病毒滴度较对照组降低5.18 lgPFU/mL。与对照组相比,质量浓度为500 μg/mL PEE共同处理组MNV-1滴度降低了1.74 lgPFU/mL;病毒感染后用质量浓度为500 μg/mL PEE处理,MNV-1的滴度比对照组降低0.37 lgPFU/mL。本研究表明:用PEE对病毒进行前处理表现出更强的抗病毒活性,推测PEE对病毒感染的作用机制可能是PEE与宿主细胞(受体)结合,或直接与病毒颗粒结合,阻断病毒与宿主细胞的黏附或结合,阻止病毒进入宿主细胞。
2.3.2TEM分析结果
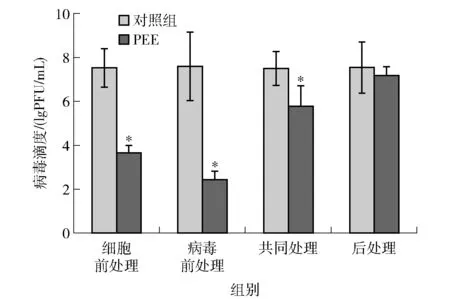
*表示PEE与对照组相比差异显著(P<0.05)。图4 PEE对MNV-1病毒吸附和复制的影响Fig.4 Influence of PEE on MNV-1 absorption and replication
为了进一步确定PEE的作用方式,在用PBS(不含PEE)和质量浓度为500 μg/mL的PEE处理病毒前后,通过TEM观察低滴度MNV-1的形态,实验结果见图5。图5(a)显示,处理前,MNV-1病毒颗粒呈球形,约为30~35 nm。用不含PEE 的PBS处理后,MNV-1病毒颗粒的形态和大小与未处理对照组无差异。由图5(b)可知:经质量浓度为500 μg/mL PEE处理后,MNV-1病毒颗粒的形态和大小增大到直径80~100 nm,表明颗粒变性、增大,部分颗粒破碎;MS2经处理后同样发现颗粒增大和碎片增多的现象。由于MNV-1的电镜图片与MS2相比更具有代表性,因此未附上MS2的扫描电镜图。本研究结果与Coelho等[22]用类黄酮化合物(C-糖基黄酮)处理的HSV和Gilling等[23]用牛至油(Oregano oil)处理的MNV-1的形态变化相似。这些结果表明,PEE可能是用使病毒衣壳蛋白变性的方式抑制病毒。
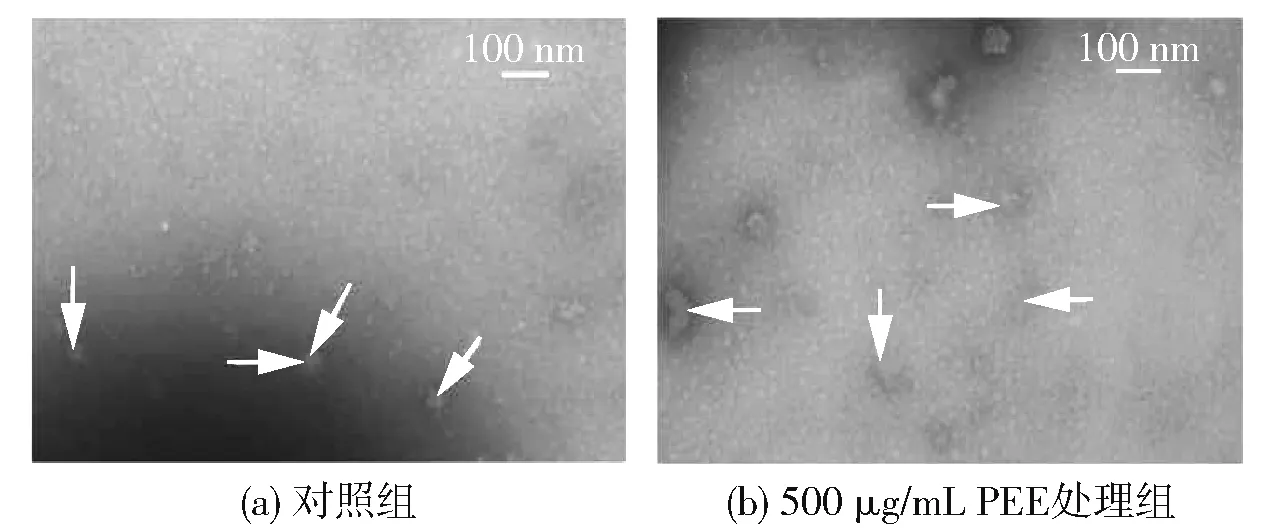
图5 不存在或存在PEE时MNV-1的成像分析结果Fig.5 Imaging analysis of MNV-1 in absence or presence of PEE
2.4 PEE在果蔬汁中的抗病毒活性分析

*表示各实验组与未添加PEE的对照组相比差异显著(P<0.05)。图6 PEE在鲜榨果蔬汁中的抗病毒活性Fig.6 Antiviral activity of PEE in fresh vegetable and fruit juices
部分绿色蔬菜以及浆果类农产品易被病毒附着,因此在鲜榨蔬菜汁和果汁中存在很高的交叉污染风险。虽然一些天然化合物本身可以作为调味添加剂加入果蔬汁中提升口感,但对于其在果汁体系中抑制病毒效果的报道却很少。单一果汁实验表明,除了葡萄汁对病毒的存活有一定的影响,其他鲜榨生菜汁、橙汁和番茄汁本身的成分对病毒的存活率影响不大。当加入PEE后,发现PEE对果蔬汁中MS2和MNV-1具有显著抑制作用,病毒存活率显著降低。图6为质量浓度250 μg/mL的PEE在4种果蔬汁中的抗病毒活性。图6显示,用质量浓度为250 μg/mL的PEE处理30 min后,蔬菜汁和果汁中的MS2和MNV-1滴度都有所下降。与未添加PEE的对照组相比,MS2在生菜汁、番茄汁、葡萄汁和橙汁中的存活率分别下降了39%、27%、19%和30%;而对于MNV-1,用250 μg/mL PEE处理后,生菜汁、番茄汁、葡萄汁和橙汁中病毒存活率分别降低了59%、36%、20%和36%。由图6可知,PEE对MS2和MNV-1具有一定的抑制效果,且相较于MS2,PEE对MNV-1的抑制作用更显著。与此研究结果一致,Randazzo等[24]发现,经过绿茶提取物处理的生菜和菠菜中的MNV和甲型肝炎病毒(HAV),滴度降低了1.5 lgPFU/mL以上;同样,Su等[25]发现,在用1 mg/mL葡萄籽提取物处理1 min后,生菜和胡椒中的MNV和HAV滴度减少量分别为1.23 lgPFU/mL和1.29 lgPFU/mL。由于蜂胶可以较低成本获得,且蜂胶作为抑制诺如病毒的天然添加剂时所需添加的剂量并不多,因此,蜂胶提取物的成本能够控制在一个合理范围内,具有经济可行性。PEE在鲜榨果(蔬)汁中的抑制病毒活性应用,将有可能为其在果蔬汁鲜榨过程中挑选合适的添加剂提供更多的选择。
3 结 论
本研究发现,质量浓度为100、250、500 μg/mL的蜂胶提取物可有效降低MNV-1和MS2的病毒滴度,并呈浓度和时间相关性,证明蜂胶提取物PEE和PWE具有一定的抗病毒作用,且PEE能够比PWE更有效地抑制病毒MNV-1和MS2。time-of-addtion experiments及TEM成像分析表明,PEE可能是以破坏病毒衣壳蛋白的方式抑制病毒。通过对PEE的化学成分分析,推测酚类成分可能是PEE的主要活性成分。PEE也可用作农产品的天然添加剂,经过30 min PEE处理后,蔬菜汁和果汁的MNV-1和MS2滴度显著降低。PEE可望作为一种天然的抗病毒添加剂应用于鲜切的蔬菜和果汁中。

