双水相萃取韭籽粕多糖的工艺优化及其抗氧化活性研究
尹国友,孙 婕,2,*,澹 博,王一萍,吴静娴,周文雅
(1.河南城建学院 生命科学与工程学院,河南 平顶山 467036;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
韭菜籽是韭菜干燥成熟的种子,性温、味微甜,具有温补肝肾、壮阳固精等功效[1]。韭菜籽中包含核苷酸类、生物碱类、不饱和脂肪酸、多糖和多肽等多种有效化学成分[2]。其中,多糖作为主要的有效成分之一,具有改善免疫功能、抗氧化、调节生殖系统、抗疲劳等药理作用[2-3]。目前常用水提醇沉、超声辅助热水浸提和双水相萃取等方法提取多糖。
双水相萃取技术作为一种新型的绿色分离、富集技术,具有简单、省时、高效等特点,已被应用于生物活性物质的分离纯化以及天然产物的提取等领域[4-5]。双水相体系主要包括聚合物- 聚合物双水相体系、聚合物- 盐双水相体系、离子液体- 盐双水相体系和小分子有机溶剂- 盐双水相体系。聚合物- 盐双水相体系,如聚乙二醇(PEG)-硫酸铵双水相体系用盐代替聚合物- 聚合物双水相体系中的一种聚合物作为成相物质,在降低体系黏度和生产成本的同时,还具备聚合物生物相容性好的优点,可在工业规模化生产中进行应用,但少见在韭籽粕多糖中有应用。因此,本研究选择PEG-硫酸铵双水相体系提取韭籽粕多糖,采用响应面分析法优化工艺参数[6],并对提取的多糖进行抗氧化评价,以期为下一步韭籽粕多糖的分离纯化、结构鉴定和构效研究提供理论数据。
1 材料与方法
1.1 材料与试剂
韭籽粕(含油率<1%),本课题组采用超临界二氧化碳萃取法得到。PEG1000、PEG2000、PEG4000、PEG6000,国药集团化学试剂有限公司;PEG8000,天津市大茂化学试剂厂;硫酸铵、苯酚、浓硫酸(纯度96%~98%)等,洛阳市化学试剂厂。
1.2 仪器与设备
ME204E型电子天平,梅特勒- 托利多仪器有限公司;101- 1SA型电热恒温鼓风干燥箱,金坛市盛蓝仪器制造有限公司;JW- 1042型低速离心机,安徽嘉文仪器装备有限公司;KQ5200DE型超声波清洗器,昆山市超声仪器有限公司;UV- 1100型紫外可见分光光度计,上海美普达仪器有限公司。
1.3 实验方法
1.3.1多糖含量测定
采用苯酚- 硫酸法测定多糖含量,制作标准曲线[7]。
1.3.2PEG-硫酸铵双水相相图绘制
分别精准称取0.5 g PEG1000、PEG2000、PEG4000和PEG6000于锥形瓶中,加入1 mL双蒸水,配制成质量分数为50%的PEG溶液,记录PEG溶液的质量。向滴定管中加入质量分数为50%的硫酸铵溶液缓慢滴定PEG并振荡,当锥形瓶中开始出现浑浊时停止滴定,记录滴加盐溶液的质量。再向混合物中加水,直至溶液再次变得澄清,记录滴加的水的质量。继续滴加硫酸铵溶液,直至再次出现浑浊,重复上述操作步骤数次,记录每次质量。硫酸铵和PEG质量分数计算见式(1)、式(2);以浑浊时硫酸铵在系统中的质量分数为横坐标,PEG的质量分数为纵坐标绘图,即可得到双节线[8]。
w(PEG)=m1/(m1+m2+m3)×100%;
(1)
w(硫酸铵)=m2/(m1+m2+m3)×100%。
(2)
式(1)、式(2)中,m1,PEG在系统中的总质量,g;m2,盐溶液在系统中的总质量,g;m3,水在系统中的总量,g。
1.3.3韭籽粕多糖提取
称取10 g韭籽粕加入150 mL去离子水,设定温度60 ℃、功率80 W,提取2 h,冷却后分装于离心管中,4 000 r/min离心20 min,取上清液,置于冰箱中保存。从烧杯中准确移取1.00 mL溶液稀释25倍,取1 mL稀释液于试管中,然后依次在试管中加入1.0 mL蒸馏水、1.00 mL 质量分数5%苯酚溶液,摇匀后迅速加入5.00 mL浓硫酸,再次摇匀待其冷却至室温,以蒸馏水为空白组,测定吸光度。
1.3.4双水相萃取
准确量取多糖溶液20 mL,称取一定质量的PEG,溶解后称取不同质量的硫酸铵,充分混合,在室温条件下静置30 min。上、下相溶液各取1 mL,加蒸馏水稀释至10 mL,再取1 mL稀释液于试管中,依次加入1 mL蒸馏水、1.0 mL 5%苯酚溶液、5.0 mL浓硫酸,摇匀,室温静置冷却。以蒸馏水为空白对照,测定490 nm处吸光度,根据葡萄糖标准曲线计算多糖在上、下相中的含量。根据式(3)至式(5)计算双水相体系的分配系数和多糖的萃取率。
K=ρa/ρb;
(3)
R=Va/Vb;
(4)
Y=1/(1+RK) 。
(5)
式(3)~式(5)中,K,多糖在PEG-硫酸铵两相中的分配系数;R,上下相体积之比;Y,多糖在下相中的萃取率,%;ρa,上相中的多糖质量浓度,mg/mL;ρb,下相中的多糖质量浓度,mg/mL;Va,上相体积,mL;Vb,下相体积,mL。
1.3.5单因素实验设计
选取PEG相对分子质量(1 000、2 000、4 000、6 000、8 000)、PEG质量分数(10%、15%、20%、25%、30%)、硫酸铵质量分数(15%、20%、25%、30%、35%)和萃取时间(20、30、40、50、60 min)4个因素进行实验,考察单一因素改变对韭籽粕多糖萃取率的影响,平行重复5次,结果取平均值。
1.3.6响应面试验设计
依据单因素实验结果,使用Design Expert 8.0.6软件进行结果分析。选定PEG的相对分子质量、PEG质量分数、硫酸铵质量分数作为响应面的3个因素变量[9],以韭籽粕多糖萃取率为响应值,设计响应面试验,并对结果进行回归分析和优化,各因素与水平见表1。
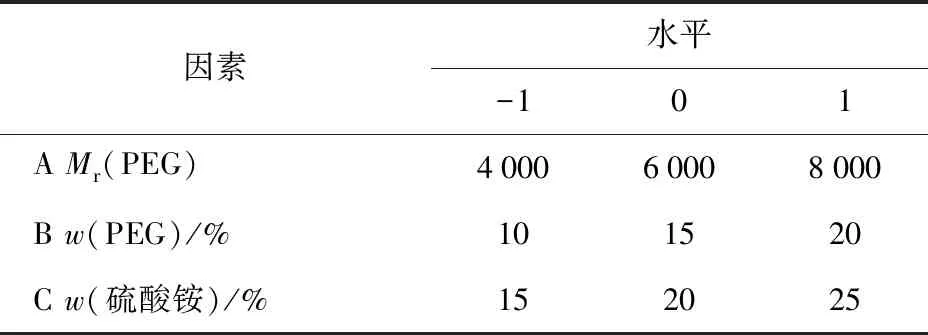
表1 响应面分析法的因素与水平Tab.1 Factors and levels of response surface methodology
1.3.7韭籽粕多糖抗氧化活性测定
1.3.7.1 DPPH·清除能力测定
参照Sellal等[10]方法并稍有改动。使用无水乙醇配置质量浓度为0.5、1.0、1.5、2.0、2.5、3.0 mg/mL的样品溶液,并配置相同质量浓度的维生素C溶液为对照。取1.0 mL浓度为0.2 mmoL/L的DPPH溶液和1.0 mL样品溶液,混匀后于室温暗反应30 min,无水乙醇为参比,测定517 nm处的吸光度A;测定1.0 mL无水乙醇与1.0 mL样品溶液的吸光度A0及1.0 mL DPPH溶液与1.0 mL无水乙醇的吸光度A1。重复实验3次,按式(6)计算DPPH·清除率。

(6)
1.3.7.2 ·OH清除能力测定
参考孙婕等[11]方法,反应体系中加9 mmol/L FeSO42.0 mL、9 mmol/L水杨酸- 乙醇2.0 mL,不同质量浓度样品溶液各3.0 mL,然后加8.8 mmol/L H2O22.0 mL,37 ℃反应1 h,以蒸馏水为空白对照,在510 nm测定各质量浓度样品的吸光度。·OH清除率计算见式(7)。

(7)
式(6)中,A0为空白对照液的吸光度,A1为加入待测样品后的吸光度,A2为不加显色剂H2O2的待测样品溶液吸光度。
1.3.7.3 总还原能力测定
参照李珊等[12]的方法,使用无水乙醇配制质量浓度为0.5、1.0、1.5、2.0、2.5、3.0 mg/mL的多糖溶液,并配制同样质量浓度的2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)溶液作为对照。在2.0 mL pH值6.6、浓度为0.2 mol/L的磷酸盐缓冲溶液中分别加入样品溶液2.0 mL和质量分数为1%的铁氰化钾溶液2.0 mL,混匀后在50 ℃恒温20 min,冷却后加入2.0 mL质量分数为10%的三氯乙酸溶液,然后以3 000 r/min离心10 min,取上清液2.0 mL,加2.0 mL双蒸水、0.4 mL体积分数0.1% FeCl3溶液,混匀后静置10 min,在700 nm处测定吸光度,吸光度与还原能力之间呈正相关[13]。
1.4 数据处理
实验数据统计及绘图均采用Excel 2007软件,所有实验重复5次。
2 结果与分析
2.1 葡萄糖标准曲线的绘制
葡萄糖标准曲线见图1。
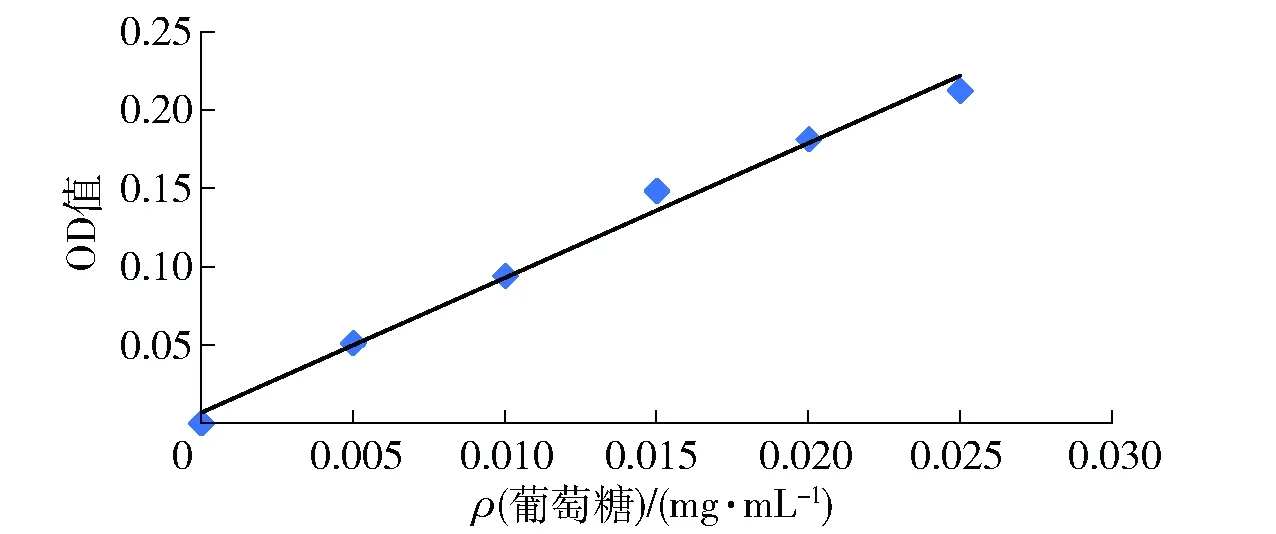
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
通过苯酚- 硫酸法显色反应实验,确定葡萄糖质量浓度和吸光度之间的线性关系,y=8.594 3x+0.006 9,R2=0.990 8。
2.2 双水相相图分析
不同分子质量PEG相图见图2。由图2可知,当成相物质的浓度在双节线以下时,不会出现上下相分离的现象,所以要选择系线上方的点作为萃取体系。当(NH4)2SO4质量分数为30%时,PEG1000的质量分数需达到61.57%才能形成双相,PEG2000的质量分数需达到45.89%,PEG4000的质量分数需达到29.46%,PEG6000的质量分数则需达到15.31%,这与王飞等研究一致[14]。由此可知,随着聚乙二醇相对分子质量的增大,相分离的动力增强,形成双水相体系所需的成相物质浓度减小[15]。PEG相对分子质量增大,其疏水性增强,形成双水相的临界浓度降低[16]。当PEG相对分子质量增大时,系统的黏度也增大,不易发生渗透作用。造成分子间碰撞次数的减少,相相分离的阻力增大,分相时间延长。
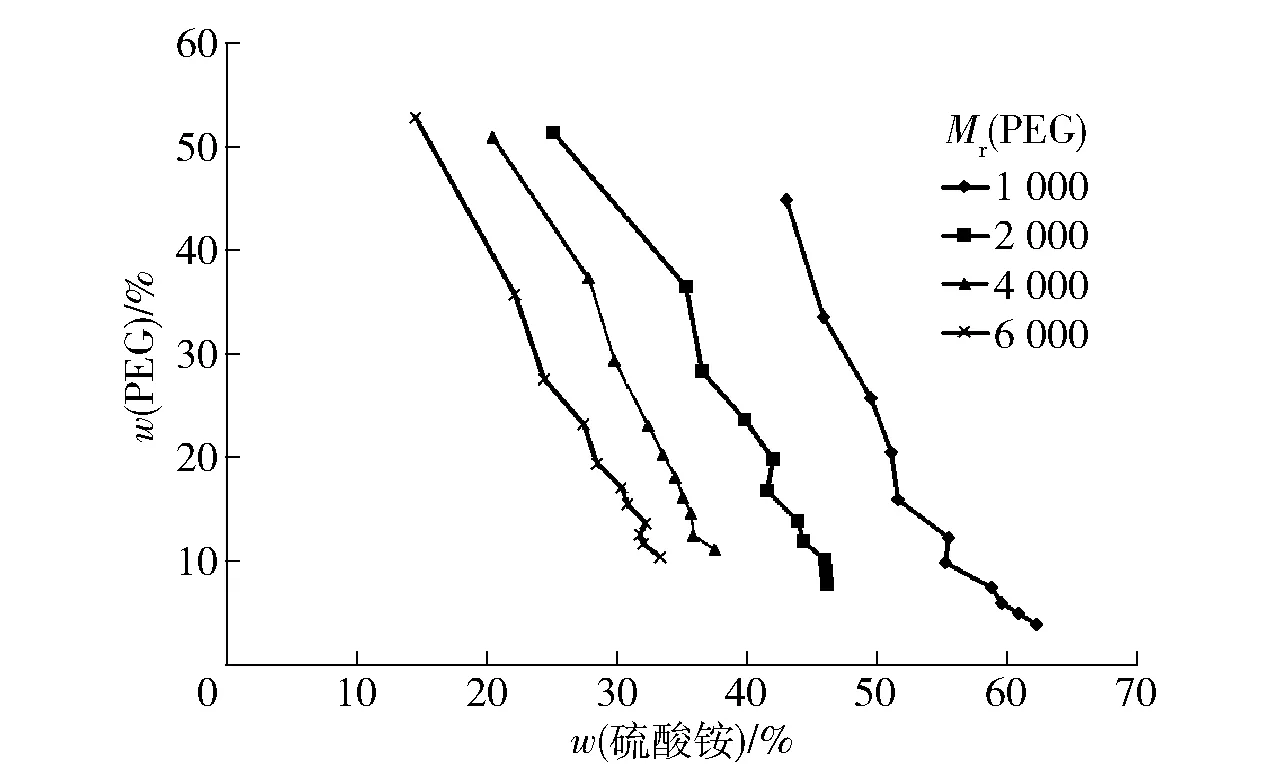
图2 不同相对分子质量PEG相图Fig.2 Phase diagram of PEG with different relative molecular weights
2.3 单因素实验分析
2.3.1PEG相对分子质量对韭籽粕多糖萃取率的影响
不同相对分子质量PEG对韭籽粕多糖萃取率的影响如图3。PEG-硫酸铵萃取系统中,硫酸铵一般在下相,PEG主要在上相,下相主要存在静电作用,上相主要表现为疏水作用,韭籽粕多糖主要分布于下相。在硫酸铵和PEG的质量分数一定的情况下,当PEG相对分子质量增大时,上相体积逐渐变小,下相体积逐渐变大,总体变化不大,这和徐海军等[17]的研究结果一致。由图3可知,多糖的分配系数和萃取率随着PEG相对分子质量的增大变化较明显,分配系数呈现先减小后增大的趋势;萃取率呈现先增大后减小的趋势,在PEG相对分子质量为6 000时最大,因为PEG相对分子质量越大,黏度增加,成相物质分子的空间阻碍作用增大[18]。因此,PEG相对分子质量为6 000时最有利于多糖在下相的富集,此时萃取率为84.37%。

图3 多糖萃取率与PEG相对分子质量的关系Fig.3 Relationship between polysaccharide extraction rate and relative molecular weight of PEG
2.3.2PEG质量分数对韭籽粕多糖萃取率的影响
PEG质量分数对韭籽粕多糖萃取率的影响见图4。当硫酸铵添加量一定时,上下相比随着PEG质量分数的变大而增大,分配系数逐渐减小,多糖萃取率先增大后减小,这与徐海军等[17]的研究结果一致。由图4可知,在PEG质量分数为15.00%时,多糖萃取率最大为84.34%。继续增加PEG含量会导致溶液黏度增大,影响两相的相比且给工业生产带来不利影响;由于相比的增加,韭籽粕多糖萃取率开始降低,所以较佳的PEG质量分数为15.00%。
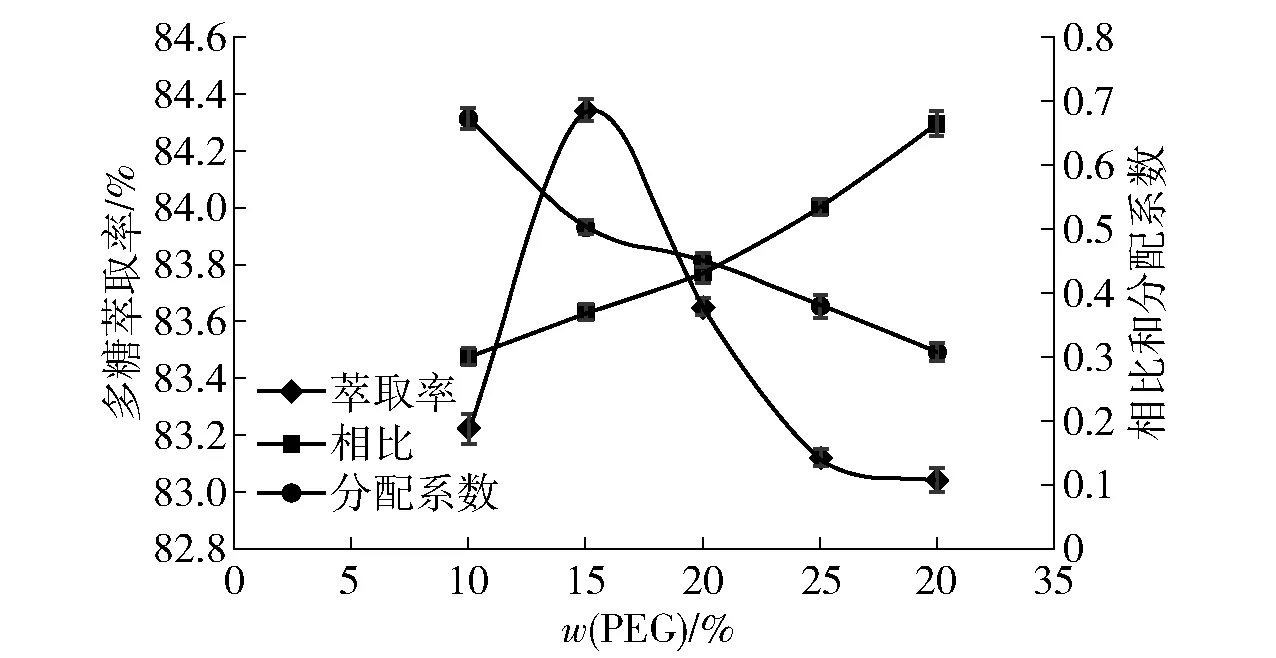
图4 多糖萃取率与PEG质量分数的关系Fig.4 Relationship between polysaccharide extraction rate and mass fraction of PEG
2.3.3硫酸铵质量分数对韭籽粕多糖萃取率的影响
硫酸铵质量分数对韭籽粕多糖萃取率的影响如图5。当PEG的添加量一定时,随着下相硫酸铵质量分数的增加,下相的吸水能力增强,下相体积呈增大趋势,所以相比逐渐减小。体系中多糖的分配系数先降后增。由图5可知,多糖萃取率先增大后减小,当硫酸铵质量分数达到20.00%时,多糖萃取率达到最大值80.60%。吴学昊等[19]发现当双水相系统中硫酸铵的含量过大时,会造成硫酸铵饱和析出,不易溶解,影响PEG的回收。

图5 多糖萃取率与硫酸铵质量分数的关系Fig.5 Relationship between polysaccharide extraction rate and mass fraction of ammonium sulfate
2.3.4萃取时间对韭籽粕多糖萃取率的影响
萃取时间对韭籽粕多糖萃取率的影响如图6。当硫酸铵和PEG的质量分数都固定时,随着时间的增加,上下相比逐渐减小但总体变化不明显。由图6可知,多糖萃取率在20~30 min的增加并不明显,20 min时间较短,多糖不能完全分配好。但随后在30~60 min内,多糖萃取率却下降明显。当时间为30 min时,多糖的萃取率相对较大,可达到84.03%。在工业上应用时需要减少时间和财力的浪费,因此,萃取时间不作为响应面优化试验的考察因素。
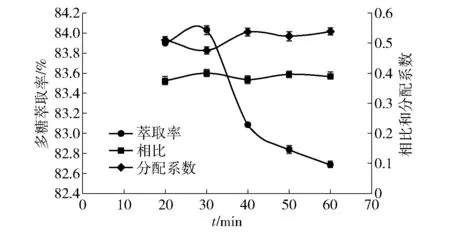
图6 多糖萃取率与萃取时间的关系Fig.6 Relationship between polysaccharide extraction rate and extraction time
2.4 响应面试验分析
2.4.1响应面试验结果
根据单因素实验,设定响应面的3个因素变量为PEG相对分子质量、PEG质量分数、硫酸铵质量分数,韭籽粕多糖萃取率为响应值,利用软件进行响应面设计,优化提取工艺,以获取最佳的提取率。响应面设计及结果如表2。
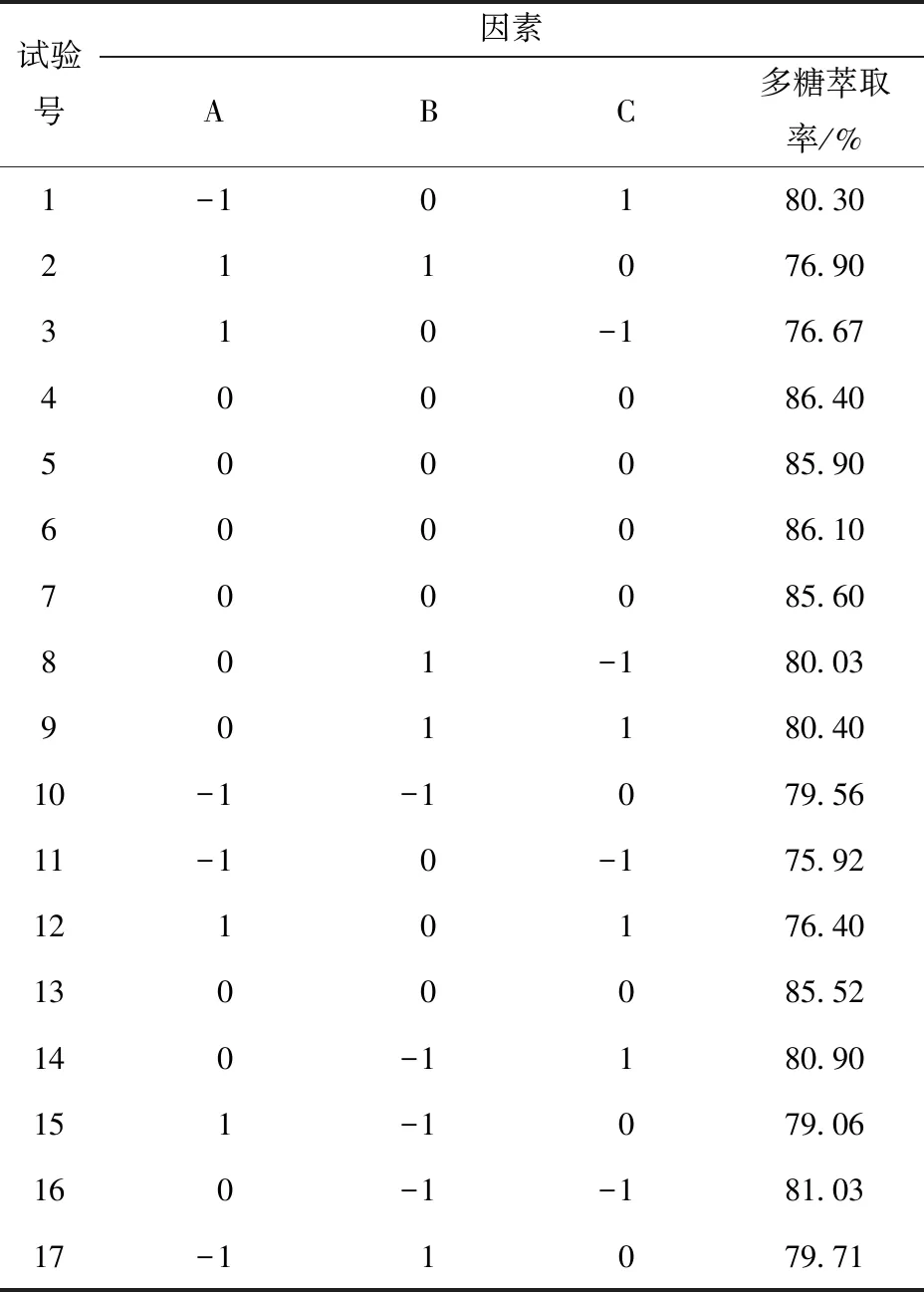
表2 响应面设计及结果Tab.2 Design and results of response surface
2.4.2回归模型分析
对响应面的结果进行多元回归拟合,得到双水相体系下相的韭籽粕多糖萃取率与PEG相对分子质量、PEG质量分数、硫酸铵质量分数的多元回归方程为:
Y=5.90-0.81A-0.44B+0.54C-0.58AB-
1.16AC+0.13BC-5.18A2-1.91B2-3.40C2
多元二次模型的方差分析见表3。

表3 响应面二次模型方差分析Tab.3 Variance analysis of response surface quadratic model

根据回归方程的方差分析可知,该模型的一次项A的P值为0.006 1小于0.01,B的P值为0.073 3大于0.05,C的P值为0.035 0小于0.05,表明PEG相对分子质量对韭籽粕多糖萃取率影响极显著,PEG的质量分数对韭籽粕多糖萃取率影响不显著,硫酸铵的质量分数对韭籽粕多糖萃取率影响显著,影响因素主次顺序依次为PEG相对分子质量、硫酸铵质量分数、PEG质量分数。交互项AB、BC的P值都大于0.05,对多糖的萃取率影响不显著;AC的P值为0.005 6小于0.01,对多糖萃取率的影响极显著。二次项A2、B2、C2的P值均小于0.01,表明三者对韭籽粕多糖萃取率的影响均极显著。研究表明,韭籽粕多糖萃取率受多种因素影响,且不是简单的线性关系。
2.4.3交互作用分析
各因素对多糖萃取率的交互作用见图7。根据等高线及响应面分析可以直观地反映出各因素对响应值的影响。观察图7等高线的形状和3D图的颜色、倾斜度,可知AB、BC不显著,AC极显著。
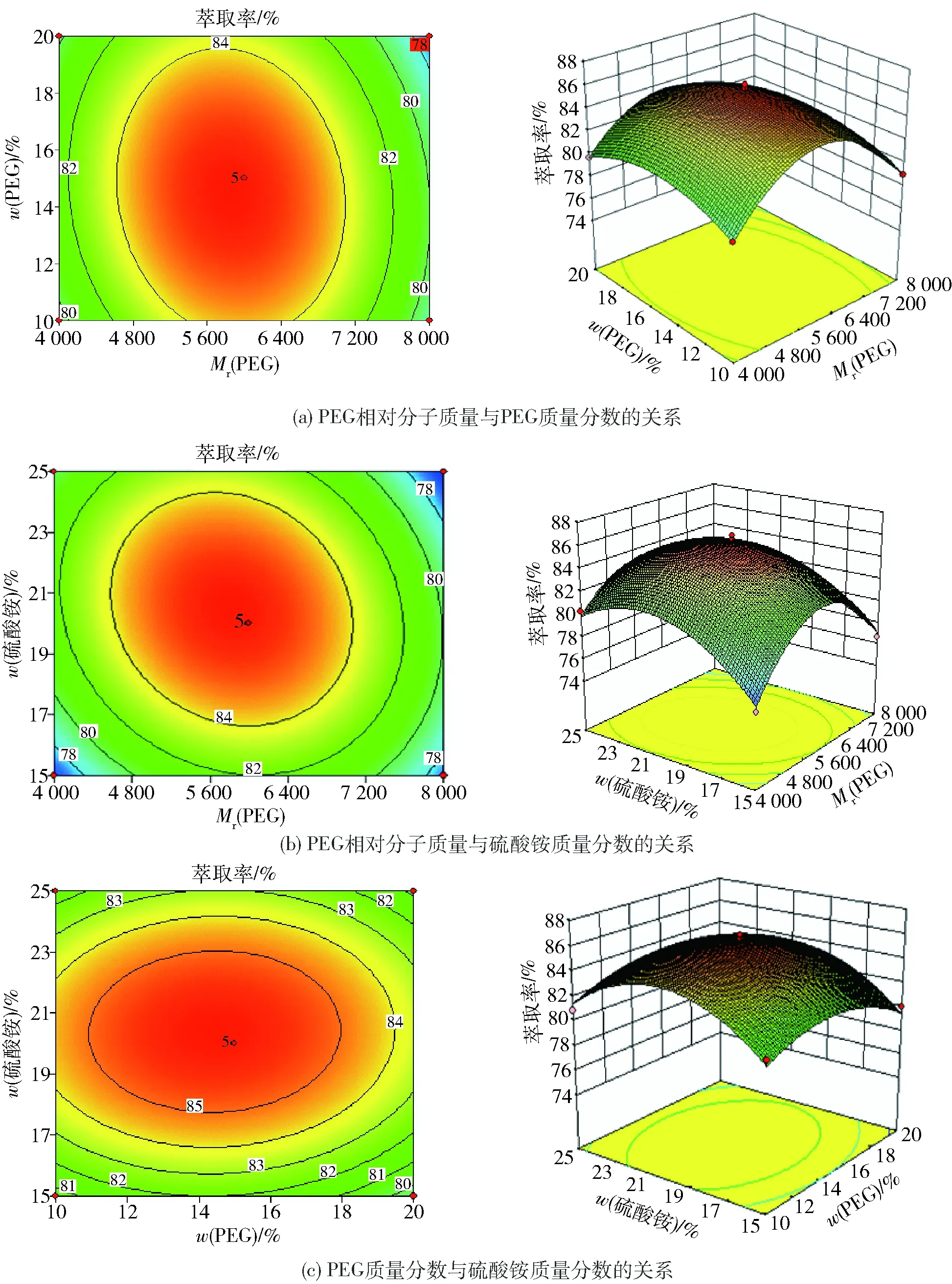
图7 各因素对韭籽粕多糖萃取率的交互作用Fig.7 Interaction of factors on extraction rate of polysaccharides from leek seed meal
2.4.4验证实验
根据Design Expert软件分析3个因素较优实验点为PEG相对分子质量6 000,硫酸铵质量分数20.46%,PEG质量分数14.50%,在此条件下多糖萃取率的预测值为85.98%。为验证模型预测的准确性,优化条件下进行验证实验,3次验证实验的平均萃取率为85.39%,与理论值相差0.59%(相对误差<5.00%),说明该方程与实际情况拟合很好,通过响应面法优化得到的工艺条件可靠。
2.5 韭籽粕多糖抗氧化活性分析
2.5.1DPPH·清除能力分析
韭籽粕多糖对DPPH·的清除能力用清除率表示,清除率越高则韭籽粕多糖对自由基的清除能力越好,见图8。由图8可知,维生素C、BHT和韭籽粕多糖对DPPH·均有清除能力,且均随样品质量浓度的增大而略微增大。当韭籽粕多糖质量浓度达到3.00 mg/mL时,DPPH·清除率最大,达53.22%。
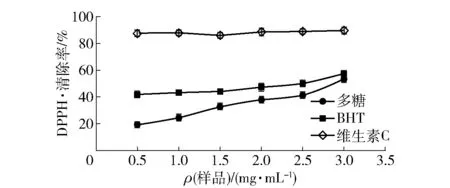
图8 韭籽粕多糖对DPPH·的清除能力Fig.8 Scavenging capacity of polysaccharide from leek seed meal to DPPH free radicals
2.5.2·OH清除能力分析

图9 韭籽粕多糖对·OH的清除能力Fig.9 Scavenging capacity of polysaccharide from leek seed meal to hydroxyl radical
2.5.3总还原能力分析
抗氧化剂能使铁氰化钾的三价铁还原成二价铁(亚铁氰化钾),二价铁(亚铁氰化钾)进一步和三氯化铁反应生成在700 nm处有最大吸光度的普鲁士蓝(Fe4[Fe(CN)6]3),因此测定700 nm处的吸收峰可以间接反映抗氧化剂的还原能力大小,吸光度越大,还原能力越强。韭籽粕多糖的总还原能力见图10。随着维生素C、BHT和多糖质量浓度的增加,三者在700 nm处的吸光度也在增加,即三者的总还原能力在增加。说明维生素C、BHT和韭籽粕多糖均能抑制自由基转移电子,从而终止自由基链反应。而维生素C、BHT与多糖相比,维生素C和BHT表现出较强的还原能力。

图10 韭籽粕多糖的总还原能力Fig.10 Total reducing capacity of polysaccharide from leek seed meal
3 结 论
双水相萃取提取韭籽粕多糖的单因素实验结果表明,PEG相对分子质量6 000、PEG质量分数15.00%、硫酸铵质量分数20.00%,分别有较高的多糖萃取率。进而运用Design Expert 8.06软件进行响应面设计分析。由多元二次回归方程相关系数的显著性大小可知,各因素对萃取率的影响由大到小依次为PEG相对分子质量、硫酸铵质量分数、PEG质量分数。根据软件得到的优化条件为PEG相对分子质量6000、PEG质量分数14.50%,硫酸铵质量分数20.46%,在此条件下韭籽粕多糖萃取率为85.39%。
韭籽粕多糖对DPPH·和·OH均有一定的清除效果;总还原力的测定中,随着多糖质量浓度的增大,抗氧化能力也在增加,可初步判断采用双水相萃取得到的韭籽粕多糖具有良好的抗氧化活性。

