卵叶海桑花粉活力测定方法的比较研究
任飞艳, 陈 显, 王士泉
(热带岛屿生态学教育部重点实验室,海南省热带动植物生态学重点实验室,海南师范大学生命科学学院, 海口 571158)
卵叶海桑(SonneratiaovataBacker)隶属于海桑科海桑属,生长于热带、亚热带海岸潮间带,主要分布于泰国、越南、马来西亚、印度尼西亚以及巴布亚新几内亚等地[1-3]。我国仅天然分布于海南省文昌市清澜港自然保护区,分布范围狭窄,天然更新困难,被列为濒危物种[2,4]。目前国内外对卵叶海桑的研究较少,主要集中在化学成分[5-7]、遗传多样性[8-9]、染色体核型[10-11]、育苗技术[12]、形态解剖[13-16]等方面。卵叶海桑具有抗风、耐贫瘠、耐盐碱等特点,是理想的海防林树种。
卵叶海桑生长地在人为因素和自然因素的共同作用下,生态系统日渐脆弱,抵御外界干扰的能力降低,自然更新相对困难,个体数量也在不断减少。前期调查表明,在卵叶海桑林下无幼苗生长。卵叶海桑通过种子繁殖,但在自然条件下,种子发芽率极低,影响了其自然更新。研究表明,拟海桑的花粉败育率为95.62%,海南海桑为54.43%,这会影响开花时期的有效传粉和授粉过程,导致结实率低和种子量少[17]。本文以卵叶海桑花粉为实验材料,利用TTC染色法、MTT染色法、亚历山大染色法、I2-KI染色法、红墨水染色法和离体萌发法,测定卵叶海桑的花粉活力,确定卵叶海桑花粉活力快速有效的测定方法,为下一步探讨卵叶海桑濒危的原因,进行传粉、繁育系统研究和杂交育种提供理论依据。
1 材料与方法
1.1 材 料
卵叶海桑是常绿乔木,高4~8 m。花序顶生,花1~3朵,无花瓣,萼管表面具明显的小瘤状突起,花萼片内面红色。2019年3—6月,在海南省文昌市清澜港自然保护区,选取初花期未散粉的花朵,待花药裂开,花粉自然散出后,采用6种不同的方法测定花粉活力。
1.2 方 法
1.2.1TTC染色法[18]
用镊子取花粉散落到试管里,滴1~2滴0.5%的TTC染液,搅拌均匀后,置于37 ℃恒温箱中,避光染色2~3 h。将玻片置于显微镜下观察并统计有活力和无活力的花粉数。具有活力的花粉被染色后呈红色,发育不良活力弱的花粉无法着色。
1.2.2MTT染色法[19]
用镊子将花粉置于载玻片上,滴1~2滴5%的MTT染液染色(MTT有致癌性,使用过程应佩戴手套),置于25 ℃恒温箱中,避光染色1~2 h。然后将玻片置于显微镜下观察并统计有活力和无活力的花粉数。凡是具有活力的花粉被染色后呈蓝紫色,发育不良生活力弱的花粉呈黄褐色。
1.2.3亚历山大染色法[20]
用镊子将花粉置于载玻片上,滴1~2滴亚历山大染液染色,盖上盖玻片,室温染色,将玻片置于显微镜下观察并统计有活力和无活力的花粉数。凡是具有活力的花粉,原生质呈红色,花粉壁呈绿色;原生质和花粉壁均呈绿色则为发育不良或无活力。
1.2.4I2-KI染色法[21]
区总馆要充分发挥示范引导作用,围绕基本文化服务功能,精心设置服务项目,提高全区各类图书馆、公共阅读空间的利用率。各分馆、基层馆外服务点,作为强力支撑,以标准化建设为抓手,实现服务供给全覆盖,社会参与覆盖,志愿者服务推进,科技文化传播,接轨一流标准的目标。
用镊子将花粉置于载玻片上,加1~2滴I2-KI染液,盖上盖玻片,室温染色,将玻片置于显微镜下观察并统计有活力和无活力的花粉数。凡具有生活力的花粉粒被染色后呈蓝黑色(其中含有积累的淀粉),发育不良或无活力的花粉粒呈黄褐色。
1.2.5红墨水染色法[22]
用镊子将花粉置于载玻片上,加1~2滴红墨水染液,盖上盖玻片,室温染色,将玻片置于显微镜下观察并统计有活力和无活力的花粉数。凡是具有活力的花粉呈无色,发育不良活力弱的花粉呈红色。
1.2.6离体萌发法[23-24]
用镊子将花粉置于双凹载玻片上,加1~2滴蔗糖-硼酸培养液(10%蔗糖,10 mg·L-1硼酸,0.5%琼脂),将载玻片置于培养皿内,盖上盖玻片,置于25 ℃恒温箱中,培养后将玻片置于显微镜下观察,统计有生活力和无生活力的花粉数。
1.3 数据统计与分析
每株设3次重复,每次取10余个视野观察。每个个体统计的花粉数都在500粒以上。采用Excel 2007软件和SPSS 19.0分析软件对相关数据进行统计比较分析。在USB数码显微镜下放大40×或10×拍照保存并处理图像。
2 结果与分析
2.1 TTC染色法测定花粉活力
TTC是一种无色的氧化还原染料,氧化状态下是无色的。具有活力的花粉呼吸作用强烈,脱氢酶能将无色的TTC还原为红色的TTF。没有活力的花粉不具有上述功能。有活力的花粉被染成红色,而无活力的花粉不能着红色(图1 A)。TTC染色法多次实验未果,花粉活力均为0,表明TTC染色法不适合用来测定卵叶海桑的花粉活力(表1)。
2.2 MTT染色法测定花粉活力
MTT是一种能接受氢原子的染料,外源性的MTT还原生成难溶性并沉淀的蓝紫色结晶物质,而死细胞没有此功能。MTT染色法根据花粉粒中脱氢酶的活性确定花粉生活力,凡被染成蓝紫色的为活力较强的花粉,呈黄褐色为发育不良的花粉,无色为无活力的花粉(图1 B)。MTT染色法测定的卵叶海桑花粉活力为88.00%~90.40%,平均为89.30%(表1)。
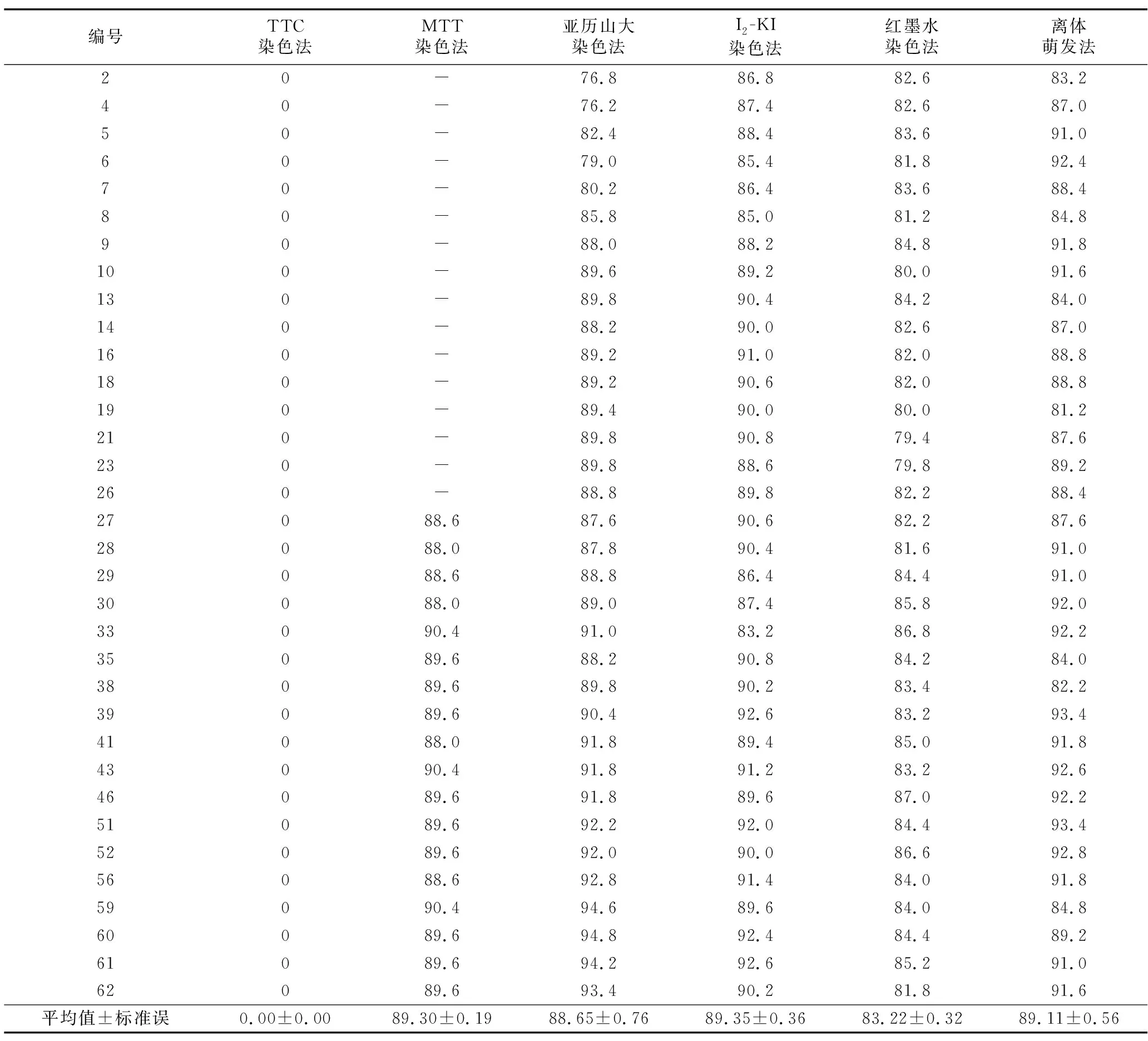
表1 不同方法测定的花粉活力Table 1 Pollen viability measured by different methods
2.3 亚历山大染色法测定花粉活力
2.4 I2-KI染色法测定花粉活力
利用I2-KI溶液对花粉粒进行染色,淀粉遇碘后变成蓝色,花粉粒中淀粉含量直接影响花粉的着色程度,并成为判断花粉活力高低的依据。有活力的花粉淀粉含量高,被染成蓝色,而无活力的花粉淀粉含量少,呈黄褐色(图1 D)。 I2-KI染色法测定的结果为83.20%~92.60%,平均为89.35%(表1)。
2.5 红墨水染色法测定花粉活力
利用红墨水对花粉粒进行染色,有活力的花粉其细胞膜具有选择透性,无活力的花粉具有完全渗透性,因此未被染色的花粉粒是具有生活力的,呈红色的为发育不良活力弱的花粉(图1 E)。红墨水染色法测定的结果为79.40%~87.00%,平均为83.22%(表1)。
2.6 离体萌发法测定花粉活力
卵叶海桑的花粉粒为椭圆形,未萌发时呈黄色,在25 ℃避光培养30 min后,有活力的花粉粒开始出现透明突起,随后在2~3 h期间逐渐伸长形成花粉管(图1 F)。以花粉管的长度大于花粉粒直径作为萌发标准,统计其萌发状况,计算出花粉活力。离体萌发法测得的萌发率为81.20%~93.40%, 平均值89.11%(表1)。
2.7 不同测定方法花粉活力的比较
红墨水染色法的结果低于离体萌发法,二者在5%水平上差异显著(p<0.05),在1%水平上差异极显著(p<0.01)。MTT染色法和I2-KI染色法的结果略高于离体萌发法,亚历山大染色法的结果略低于离体萌发法,三者与离体萌发法的结果在5%水平和1%水平上差异均不显著(表2)。

表2 5种方法测定的卵叶海桑花粉活力比较Table 2 Comparison of pollen viability of S. ovata measured by 5 methods
而TTC染色法的花粉活力均为0,多次实验未果,故在此不进行比较分析。
3 讨论与结论
本实验结果表明,利用离体萌发法测得的花粉活力较高。对于培养温度、营养成分、pH值要求较高,花费时间长,不太适合快速准确地测定花粉活力,但可将该方法作为标准,确定哪种方法更适合卵叶海桑花粉活力的测定。
TTC染色法已广泛用于许多植物花粉活力的测定,但其对花粉要求较高,当花粉中脱氢辅酶含量较低时,就难以准确地测定花粉活力[25]。本实验中,TTC染色法对卵叶海桑花粉的染色效果不佳,可能与材料选择有关,花粉均呈淡红色,颜色深浅差异不明显,很难区分其是否被染色,TTC无法成功染色的原因有待进一步研究。MTT染色法操作要求较高,实验过程复杂,且需要在避光环境下进行操作,所以MTT不适合快速准确测定花粉活力。红墨水染色法的优点是简便,时间也较短,适于野外测定,但随时间的延长多数花粉逐渐失去选择透性,如不及时统计可能会降低实验结果的准确性。亚历山大染色法染色效果较好,在室温下放置一段时间就可以观察结果且易辨别,适用于野外条件下花粉活力的快速测定,结果也比较接近离体萌发法。I2-KI染色法主要是依据花粉粒内的淀粉判断花粉活力,决定性因素是淀粉含量的高低,主要适用于玉米、小麦等淀粉含量比较高的农作物花粉活力测定[26]。从本实验的测定结果看,I2-KI染色法所测得的花粉活力最高,接近于离体萌发法的结果。I2-KI染色法是一种经济、快速测定花粉活力的方法,适合野外条件下花粉活力的检测。
综上所述,I2-KI染色法和亚历山大染色法都可以快速、准确地检测出卵叶海桑的花粉是否有活力以及活力的高低,是判断花粉活力的简便准确方法,可为传粉、繁育系统研究和杂交育种提供科学依据。

