水稻去泛素化酶OsUCH-L5基因的克隆及表达分析
陈立杰, 方远鹏, 杜巧丽, 陈 俊, 蒋君梅, 陈美晴, 李向阳, 谢 鑫
(1.贵州大学资产经营办公室, 贵阳 550025;2.贵州大学农学院农业微生物特色重点实验室, 贵阳 550025;3.贵州大学绿色农药与农业生物工程教育部重点实验室, 贵阳 550025)
水稻(Oryzasativa)是世界五大粮食作物之一,主要分为籼稻和粳稻或糯稻,是中国及部分国家的主粮。随着水稻基因组组装的完成,对水稻基因水平研究已成为热点[1],其中蛋白翻译后修饰过程也成为研究的焦点之一[2-4]。
泛素化是一类小分子蛋白,在酶(泛素激活酶[5]、结合酶[6]及连接酶[7])的调控下,能对靶标蛋白进行特异性修饰[8],同时泛素化在蛋白质功能体现[9]及降解[10-11]过程中具重要作用;泛素化还间接参与细胞凋亡[12]、植物免疫反应[13]、营养运输[14]、水分抗性[15]、损伤修复[16]等各种生命活动。而去泛素化酶(Deubiquitinases,DUBs)则可以逆转泛素化过程,辅助调节生命活动;其主要包括UBP/USP(泛素特异性蛋白酶)家族﹑UCH(泛素C末端水解酶)家族﹑OTU(卵巢肿瘤蛋白酶)家族、MJD(MachadoJoseph域)家族和JAMM(JAB 1/MPN/MOV 34蛋白酶)家族[17]。研究报道去泛素化酶在抗病响应[18]、细胞增殖[19]、植物转录调控[20]等多个方面起着重要的调节作用。
泛素C端水解酶(ubiquitin carrboxy terminal hydrolases,UCHs)在蛋白质的降解过程中具有反向调控作用,可促进泛素的再循环。研究报道,UCHs可通过去泛素化的作用对细胞周期产生影响,并且在代谢调控、转录调控以及DNA修复等过程中具有关键作用[20]。UCH- L 5(UCH 37)被作为DUBs中泛素C末端水解酶(UCH)家族的半胱氨酸蛋白酶,主要由蛋白酶体和INO 80染色质复合体组成[21]。据报道,在癌细胞中对UCH-L5基因进行过表达或进行基因敲除,可使小鼠在胚胎期致死[22-23];同时该基因可能参与调节生物体的寿命[24]。而在植物拟南芥中,AtUCH4突变体能产生较野生型更耐强盐、脱落酸(ABA, abscisic acid)的抗性[20];AtUCH4同时更能抵抗低温逆境,并与AtPTP1基因形成负相关的基因对[25]。拟南芥中过量表达AtUCH1基因时,对生长素信号通路具有一定促进作用(如促使生长素不敏感型突变体恢复正常[26])。此外,去泛素化酶UCH-L 3与K 27链接类型二泛素(K 27 diub)互作可促进DNA的损伤修复[27-28]。
近年来关于植物UCH家族的研究主要集中在UCH-L 3和UCH 4,对UCH-L 5在植物中的研究报道较少,本研究对水稻OsUCH-L5基因的序列特征以及表达模式进行探究,以期为OsUCH-L5的泛素化模型研究提供基础。
1 材料与方法
1.1 材料与试剂
1.1.1材 料
水稻材料日本晴(OryzaSativaL. spp.japonica)品种保存于贵州大学植物病理教研室。
1.1.2试 剂
本实验中所用的反转录试剂盒购于普洛麦格(北京)生物技术有限公司,SYBR荧光染料购自北京康润诚业生物科技有限公司。所用的激素,盐胁迫和其它胁迫处理剂均购自北京酷来搏科技有限公司。
1.2 生物信息学分析
利用MEGA 7.0软件,以邻接法(Neighbor-Joining,NJ)(bootstrap=1000)方式构建无根进化树,并于EvolView美化。采用HMMER(https://www.ebi.ac.uk/Tools/hmmer/)联合SMART获得OsUCH-L 5蛋白的保守域;使用EXPASy软件完成OsUCH-L 5蛋白的理化性质测定与亲水性分析;OsUCH-L 5蛋白的二级结构和亚细胞定位在PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)和Softberry(http://www.softberry.com)分别进行预测。并基于SWISS-MIDEL网站直接预测SWISS-MODEL及PyMOL单模型构建蛋白质三级结构。
1.3 OsUCH-L5基因克隆与重组载体的构建
1.3.1总RNA的提取与cDNA的反转录
取水稻日本晴三叶期植株,利用RNA提取试剂盒、逆转录试剂盒分别完成水稻RNA的提取及反转录,所获cDNA于-80 ℃超低温冰箱冻存。
1.3.2OsUCH-L5基因的克隆
根据NCBI数据库中水稻染色体注释信息直接获得了水稻OsUCH-L5(NCBI编号:LOC 4331185),依据提供的CDS序列及已获的cDNA模板,设计引物(表1)并扩增OsUCH-L5基因,扩增产物连接到中间载体pEASY上。
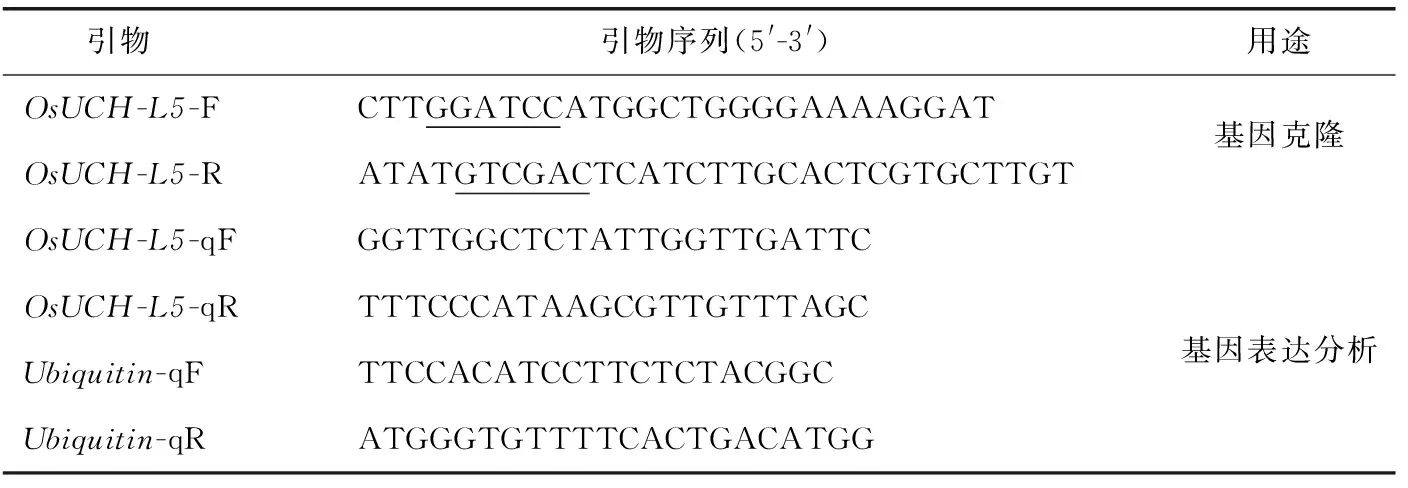
表1 引物序列Table 1 Primer sequences
1.4 UCH-L5基因的表达情况分析
1.4.1UCH-L5基因的非生物逆境表达特征
取水稻种子灭菌消毒后,种植于灭菌营养土中,待水稻长到三叶期时,取水稻根、茎、叶组织,提取RNA用并反转录cDNA后,用特异性引物(表1)进行RT-qPCR(quantitative Real-time PCR,RT-qPCR)检测。处理组的材料选取长势一致的植株,通过4 ℃低温和40 ℃高温处理,并利用脱落酸(ABA,200 μmol·L-1)、D-甘露醇(D-mannitol,1 mmol·L-1)、氯化钠(NaCl,250 mmol·L-1)、油菜素内酯(BR,200 μmol·L-1)分别进行干旱、盐胁迫及激素处理。最后分别在0 h、0.5 h、1 h、3 h、6 h、9 h、12 h和24 h取样,设置3个生物学重复,每个重复处理5株苗,并将样本-80 ℃超低温保存备用。
1.4.2数据整理与分析
RT-qPCR结果以2-ΔΔCt方法进行分析,并利用SPSS软件进行显著性分析。
2 结果与分析
2.1 水稻去泛素化酶编码基因OsUCH-L5的克隆
用OsUCH-L5-F/OsUCH-L5-R引物(表1)进行扩增经水稻总RNA逆转录获得的cDNA,得到目的基因大小为837 bp,其编码278个氨基酸。经测序以及1%琼脂糖凝胶电泳检测后,发现条带大小与数据库预测大小一致(图1)。
2.2 OsUCH-L 5蛋白的序列分析
2.2.1OsUCH-L 5蛋白的理化性质预测及亚细胞定位
利用ProtComp软件对OsUCH-L 5蛋白进行亚细胞定位,预测该蛋白定位于细胞核,符合该类亚家族的特点。Prot-param软件预测OsUCH-L 5蛋白理化性质结果显示,其相对分子质量31.644 08 kD,等电点为5.66,氨基酸共278个,且谷氨酸(Glu)含量最多,达到10.4%。负电荷及正电荷残基分别为43个和39个,脂肪指数为82.16,不稳定指数为48.88,该蛋白较不稳定,具强亲水性(表2)。

表2 OsUCH-L 5蛋白的基本理化性质Table 2 Basic physical and chemical parameters of OsUCH-L 5 protein
2.2.2OsUCH-L 5蛋白的序列分析
根据MEGA 7以邻接法完成系统进化树的构建,并结合SMART及HMMER对其结构进行预测,SMART结果显示,OsUCH-L 5蛋白2-153及163-220处具一个Peptidase_C 12结构域和一个卷曲区域。且所有的UCH-L 5蛋白均具备一个Ⅰ亚族结构的Peptidase_C 12保守域及一段UCH_C的UCH家族识别保守域。水稻OsUCH-L 5和二穗短柄草(Brachypodiumdistachyon)BdUCH-L 5亲缘关系最近,且同科内蛋白在系统进化树上聚合为一支(图2)。
2.2.3水稻OsUCH-L 5蛋白结构及亲水性分析
利用ProtScale网站获得OsUCH-L 5蛋白(图3 A)亲水性情况,结果表明,其亲水性上下限为1.756和-3.000,疏水区主要在20~40 aa、105~115 aa、124~130 aa、162~168 aa、205~219 aa、242~250 aa,显示OsUCH-L 5蛋白具有强亲水性。通过SWISS-MODEL预测蛋白质三级结构,显示OsUCH-L 5蛋白主要由螺旋和无规则卷曲构成(图3 B)。
2.3 OsUCH-L5基因表达分析
2.3.1OsUCH-L5基因的组织表达分析
以水稻Ubiquitin为内参基因,分析OsUCH-L5在不同组织的表达模式。qRT-PCR结果表明,水稻OsUCH-L5基因在根、茎、叶不同组织均有表达,在根中的表达量最高,即根>叶>茎(图4 A)。
2.3.2OsUCH-L5基因在NaCl及模拟干旱胁迫下的应答分析
为阐明干旱和盐分胁迫中OsUCH-L5基因的作用,通过RT-qPCR检测NaCl、ABA、D-mannitol处理下OsUCH-L5基因的表达情况。结果显示,在盐处理下,OsUCH-L5基因表达在极短时间内显著降低,但在处理6 h之后,OsUCH-L5基因表达量显著上升,并在12 h达到最大值(图4 B)。利用ABA和D-mannitol模拟干旱胁迫,结果显示,OsUCH-L5基因在ABA处理6 h时基因表达量显著增加至峰值,之后显著下降(图4 C)。而在D-mannitol处理下,OsUCH-L5基因在0.5 h显著上升达到最大值,之后又出现下调(图4 D)。
2.3.3OsUCH-L5基因在BR下的应答分析
为探究BR对OsUCH-L5基因表达影响,采用RT-qPCR进行定量分析。结果显示,OsUCH-L5基因表达量呈现先升后降模式,于3 h达到峰值。在6 h后OsUCH-L5基因表达量与对照相同(图5 A)。
2.3.4OsUCH-L5基因温度胁迫分析
为探索OsUCH-L5基因是否受到温度胁迫的影响,分别在4 ℃低温和40 ℃高温胁迫处理后,对其进行表达分析。结果显示,OsUCH-L5基因在低温及高温处理下,均在0.5 h时基因表达量显著降低,但在连续低温(图5 B)及高温(图5 C)处理下,分别在3 h和1 h时,基因表达量显著增加至峰值,随后又逐渐降低。说明OsUCH-L5基因能迅速响应温度胁迫信号(图5 C)。
3 讨 论
泛素化调节被作为生物体内必不可少的可逆性调节途径,在生物体生长发育过程中具有重要意义,其可逆过程主要由泛素化酶的修饰[29]及去泛素化酶[30]的修饰完成。去泛素化酶同时还参与生物器官发育[26,31]、细胞分化[32]等过程,其广泛参与到对动物肿瘤[33]、植物免疫抗性[34-37]以及病原物的致病性等方面[38-39]。
UCH家族作为去泛素化酶重要的一员,其翻译产物能协调多种蛋白质共同完成对生物或非生物应激的反应,刘石娟[25]的研究表明,AtUCH4/AtPTP1基因的表达与盐胁迫相关,具有正调控作用。张静进一步对AtUCH4基因在各种非生物逆境下的反应进行研究,更进一步明确了AtUCH4基因在组织表达的选择性以及受到ABA的正调控[20]。
本研究中OsUCH-L5基因的表达具有组织特异性,在根中表达量最高,而在叶和茎中表达较弱;这与拟南芥中AtUCH4基因在根中选择性表达具有相似性[25]。张静[20]的研究表明,AtUCH4基因的表达受到盐胁迫以及ABA的诱导表达。这与本研究中OsUCH-L5基因表达结果一致,在模拟干旱(ABA,D-manntiol)和盐胁迫(NaCl)处理下,OsUCH-L5基因表达量也上调表达。
油菜素内酯是植物重要的生长调节剂和药害解除剂,可促进植物对多种逆境反应进行适应[40]。本研究发现OsUCH-L5基因在油菜素内酯的处理下,OsUCH-L5基因受到诱导表达,这一结果与ABA或NaCl处理结果相似,因此,推测OsUCH-L5基因参与多种胁迫信号反应;同时在4 ℃或40 ℃胁迫处理下,OsUCH-L5均受到诱导表达,均在3 h时表达水平最高;刘石娟等[25]的研究提出,UCH基因可能与温度响应有关,主要受到温度的负调控,这与本研究中水稻OsUCH-L5基因受温度诱导表达不同,可能是由于温度持续胁迫时间不同所导致的。
4 结 论
本研究克隆了水稻OsUCH-L5基因,全长837 bp,编码278个氨基酸。生物信息学预测结果表明,该蛋白具有Peptidase_C 12和UCH_C结构域,相对分子质量为31.64 kDa,等电点为5.66,与二穗短柄草BdUCH-L 5亲缘关系最近。OsUCH-L5基因具组织特异性,在根部表达最佳;此外,OsUCH-L5基因分别参与对盐、干旱、激素以及温度胁迫的反应。该研究为进一步研究水稻OsUCH-L5基因功能提供基础。

