多管发酵法测定水体中粪大肠菌群的方法验证及质量控制
邓泽 鲁朝旭 袁姁 王馥云 余世东


摘 要:粪大肠菌群作为指示水体粪便污染的菌群,在环境监测中是很重要的项目。本文通过对空白实验、阴阳性对照、精密度、准确度等试验,对新方法进行了实验室验证,并对不确定度、注意事项和优缺点等方面进行了探讨,为多管发酵法测粪大肠菌群的准确性提供一定参考和技术保障,希望能够更好地服务于环境监测工作。
关键词:粪大肠菌群;多管发酵法;不确定度;方法验证
中图分类号:X832
粪大肠菌群在微生物项目中是总大肠菌群中的一部分,主要用来表明水质受粪便污染的程度。粪大肠菌群是一类能使乳糖发酵、产酸产气的需氧及兼性厌氧的革兰氏阴性无芽孢杆菌,在44.5℃培养24~48h能发酵乳糖产酸产气。水体粪大肠菌群含量的高低与周边经济发展、企业影响、人口等因素密切相关,水体超标会影响整个流域生态环境,对人体健康极为不利。通过对粪大肠菌群的监测,可了解水体受生活污水污染的状况。目前,WHO、ISO以及世界上绝大多数国家都以粪大肠菌作为水质粪便污染指标菌。粪大肠菌群适用于河流、湖泊等地表水、企业污水及医院废水的监测,是综合评价城镇污水尤其是生活污水污染的一个必不可少的重要指标[1-3]。
国际上测粪大肠菌群的实验方法主要有,多管发酵法、酶底物法、纸片法、滤膜法等,近几年来,我国在粪大肠菌群的监测方面取得了很大进步,粪大肠菌群的相关环境标准也在不断的更新。我国刚刚也出台和变更了多管发酵法的新标准,酶底物法、多管发酵法等[1-2]。我国多用多管发酵法进行检测。
1 方法
1.1 监测方法[2]
根据水样的污染程度,选择样品的接种量。将样品加入在含乳糖蛋白胨培养基的试管中(根据样品浓度采取不同的培养试管或者三角烧瓶),在37±0.5℃培养箱里进行初发酵实验,培养24小时。对于产酸产气的试管进行复发酵验证实验,轻微振荡试管,用接种环接种到装有EC培养基的试管中,在44.5±0.5℃下进行复发酵培养24小时,最后得出产气的细菌为粪大肠菌群。
1.2 执行标准[3]
1.3 仪器和设备
(1)恒温培养箱:37±0.5℃、44.5℃±0.5℃。
(2)高压蒸汽灭菌器:121℃、101.3kPa。
(3)采样瓶:500mL、250mL。
(4)移液管:1±0.01mL、10±0.1mL。
(5)试管:20mL、10mL
(6)接种环:直径3mm。
1.4 试剂
EC培养基、单倍乳糖蛋白胨培养基、3倍乳糖蛋白胨培养基。
2 采样
通过对南充市顺庆区3条河流进行采样。用水样采集器采集表层水,每件样品量为500mL,装入已经灭菌处理的采样瓶中,采集6个平行样,并4℃以下冷藏保存。采样瓶需用牛皮纸包扎灭菌[4]。
3 分析与讨论
3.1 空白实验
每次试验均用无菌生理盐水按照步骤进行空白测定,培养后无任何颜色变化,测定结果均符合实验要求。
3.2 阴阳性对照
将粪大肠菌群的标准菌株制成一定浓度的菌悬液,分别取相应水量的菌悬液按接种的要求接种于试管中,然后按实验要求培养,阳性菌株(大肠埃希氏菌)呈阳性反应,阴性菌株(产气肠杆菌)呈阴性反应,该测定结果符合实验要求。
3.3 精密度检验
对三种浓度的水样进行了6次重复测定,并计算其相对偏差、相对标准偏差,检验该方法的精密度。从测定的结果得出,样品1的测定均值为34.50MPN/L,样品1取对数为154MPN/L,相对标准偏差为2.47%;样品2的测定均值为7616.67MPN/L,样品2取对数为3.88MPN/L,相对标准偏差为5.22%;样品3的测定均值为12666.67MPN/L,样品3取对数为4.1MPN/L,相对标准偏差为0.93%。以上样品的精密度结果均符合验证要求具体测定结果见表2。
3.4 准确度分析
根据多管发酵法有证标准物质/标准样品测试数据,有证标准物质所测标样平均值为23MPN100m/L,有证标准物质真值为21±7MPN/100mL,可接受范围为6-121MPN/100mL,相对误差REi为1.0%。根据《水质粪大肠菌群的测定多管发酵法》(HJ347.2-2018)方法要求,准确度实验验证符合方法要求。
综上所述,采用多管发酵法检测水中的粪大肠菌群,对样品进行空白对照、阴阳性对照、以及对精密度和准确度进行验证,结果都在质控范围内。实验室按照以上要求可获得准确的数据,满足其方法要求。
4 不确定度分析
影响粪大肠菌群MPN值计算结果不确定度的因素有很多,例如:培养基称量配制过程的误差、取样稀释过程引起的误差、样品保存条件、购买培养基质量的好坏、培养时间长短、培养温度的控制等[5-7]。
5 注意事项
(1)样品采集时,可加入适量硫代硫酸钠消除活性氯的干扰;如果确定水样重金属离子含量高的,可加入乙二胺四乙酸二钠溶液消除干扰;采集样品时,坚持细菌样优先原则,尽可能直接采样,也可使用灭菌过的专用采样装置采样。
(2)样品保存时,需要在10℃以下冷藏,6h内完成测定。建议在采集细菌样时,车上安装车载冰箱或者其他冷藏设备,实时监测样品温度。
(3)样品测试时,在样品浓度比较低,易出现阳性结果不明显的发酵管,实验员应将所有有可能的试管都进行复发酵;初发酵24小时后未发现产气,可以适当地延长培养时间[6];培养基分装灭菌时,排尽发酵管内倒管中的气泡,否则会出现假阳性结果;吸取不同浓度的稀释液时,必须规范操作,及时更换移液管。
(4)定期使用有证标准样品进行质量控制,使用有证标准菌株进行阴阳性对照试验,用无菌水做全程序空白和实验室空白测定。
(5)培养箱温度的均匀性和稳定性对多管发酵法的影响比较大,有条件最好放置精确的自动记录温度仪实时监控培养箱温度[8]。
6 优缺点
目前出台的粪大肠菌群的标准很多,各有优缺点。多管发酵法有着原理简单、技术难度容易、实验准确度高、價格便宜、利于推广的优点,但操作步骤比较烦琐、需要确认实验、实验周期相对比较长,检测时间需要48~72小时,消耗大量人力、物力,不适于大批量样品的分析[9]。
参考文献:
[1]国家环境保护总局水和废水监测分析方法编委会.水和废水监测分析方法[M].第四版.北京:中国环境科学出版社,2003.
[2]国家生态环境部.水质粪大肠菌群的测定多管发酵法(HJ347.2-2018)[S].北京:中国标准出版社,2018.
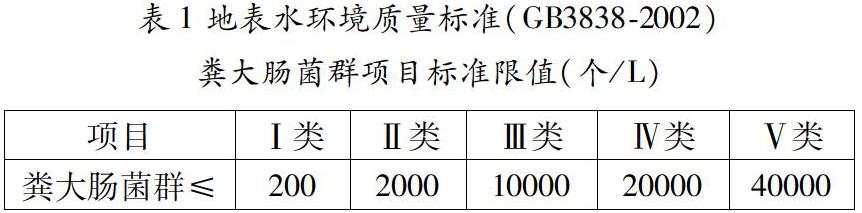
[3]国家环境保护总局.地表水环境质量标准(GB3838-2002)[M].中华人民共和国环境保护标准GB3838-2002.
[4]陈巧,李晋,李晓曼,袁姁.地表水采样的质量控制措施探讨[J].科技创新与应用,2020,(25):119-123.
[5]何敏,张亚娟,周艳红,等.水中粪大肠菌群检测方法的对比[J].净水技术,2018(09):27-30.
[6]鲁朝旭,袁姁,陈巧,李晓曼,梁时军.粪大肠菌群监测分析中存在的问题探讨[J].绿色科技,2019,(14):178-181.
[7]张贵刚,黄博珠.粪大肠菌群多管发酵法不确定度的评定[J].资源节约与环保,2018(8):37,48.
[8]黎尧,张绍斌.多管发酵法测定水质粪大肠菌群的探讨[J].环境与发展,2019(5):116.
[9]赵长征.浅谈水中粪大肠菌群检测方法及其研究进展[J].华东科技(综合),2019(8):0479-0480.
作者简介:邓泽(1988— ),男,汉族,四川南充人,助理工程师,主要从事环境监测分析与评价工作。
*通讯作者:袁姁(1995— ),女,汉族,重庆开州人,助理工程师,主要从事环境监测分析与评价工作。

