水培条件下氮、CO2耦合对紫青菜叶片SPAD值、氮含量、温度及湿度的影响
李世龙 陈丹艳 张燕 刘娅 黄舒蕾 吴思远 杨智 姜晓蕊 马敬泽 刘延飞 沈岩 颜立宇

摘 要:為探讨水培条件下氮素营养(N)与二氧化碳(CO2)气体耦合对紫青菜叶片叶绿素荧光值(SPAD值)、氮含量(YN)、温度(YT)、湿度(YRH)的影响,以南京本地紫青菜为试验材料,设置了C0N0、C0N2、C0N4、C1N0、C1N2、C1N4等6个氮气耦合处理,其中水培液氮浓度设置为水培液稀释液中不添加外源氮(N0)、添加0.2 g·L-1外源氮(N2)、添加0.4 g·L-1外源氮(N4),每种氮素浓度下设置不施加CO2增长剂(C0)和施加CO2增长剂(C1)处理,研究了移栽后叶片SPAD值、YN、YT、YRH的变化情况。结果表明:施加CO2能够显著提高紫青菜叶片SPAD值(P<0.05),紫青菜移栽后,在11月16日之前C1N4处理下叶片SPAD值均较高,之后以C1N2处理下其值最大。在11月11日之前提高水培液N含量有助于增加叶片YN,但之后不利于叶片YN含量增加,以C1N0、C1N2处理下叶片YN较高。水培液N和CO2均能够显著降低叶片YT(P<0.05),且N和CO2耦合处理显著作用于叶片YRH(P<0.05),以高浓度N能够提高叶片YRH,11月11日后以增加CO2作用效果更明显。值得注意的是,同时间叶片各指标间具有显著相关性(P<0.05)。Pearson分析表明紫青菜生长前期YT增加直接降低了叶片SPAD值、YN、YRH,后期YT上升开始有利于SPAD值、YN、YRH提高。YN、YRH与叶绿素SPAD值呈极显著的正相关(P<0.01)。综上所述,合理的水培液氮素、CO2耦合能够增加水培紫青菜叶片叶绿素、氮含量,本结果可为水培紫青菜精准氮、CO2管理提供一定理论基础。
关键词:氮浓度;二氧化碳;紫青菜;叶绿素;花青素
中图分类号:S 634 文献标志码:A 文章编号:0253-2301(2021)11-0014-09
DOI: 10.13651/j.cnki.fjnykj.2021.11.003
Effects of the Coupling of Nitrogen and CO2 on Leaf SPAD, Nitrogen Content,Temperature and Humidity of Purple Pak-choi Under Hydroponic Conditions
LI Shi-long1, CHEN Dan-yan1*, ZHANG Yan2, LIU Ya2, HUANG Shu-lei1, WU Si-yuan1,
YANG Zhi1, JIANG Xiao-rui1, MA Jing-ze1, LIU Yan-fei1, SHEN Yan1, YAN Li-yu1
(1. College of Horticulture and Landscape Architecture, Jinling Institute of Technology, Nanjing, Jiangsu 210038,
China; 2. School of Software Engineering, Jinling Institute of Technology, Nanjing, Jiangsu 211169, China)
Abstract: In order to investigate the effects of the coupling of nitrogen nutrition (N) and carbon dioxide (CO2) on the leaf chlorophyll fluorescence value (SPAD) of purple pak-choi, nitrogen content (YN), temperature (YT) and humidity (YRH) under hydroponic conditions, six nitrogen coupling treatments including C0N0, C0N2, C0N4, C1N0, C1N2 and C1N4, were set with Nanjing local purple pak-choi as the experimental material, among which the nitrogen concentration in the hydroponic solution was set to be without exogenous nitrogen (N0), 0.2 g·L-1 exogenous nitrogen (N2) and 0.4 g·L-1 exogenous nitrogen (N4) in the diluent of hydroponic solution. Then, the changes of SPAD, YN, YT and YRH in leaves after transplanting were studied under the treatments of no CO2 growth agent (C0) and CO2 growth agent (C1) at each nitrogen concentration. The results showed that the application of CO2 could significantly improve the leaf SPAD of purple pak-choi (P<0.05). After transplanting, the leaf SPAD of purple pak-choi under C1N4 treatment was higher before November 16, and then it was the highest under C1N2 treatment. Increasing the N content in the hydroponic solution before November 11 was helpful to increase the YN content in leaves, but it was not conducive to the increase of YN content in leaves after November 11. The YN content in leaves was higher under the treatments of C1N0 and C1N2. Both N and CO2 could significantly reduce the YT of leaves (P<0.05). In addition, the coupling treatment of N and CO2 significantly affected the YRH of leaves (P<0.05), and high concentration of N could increase the YRH of leaves, and the effect was more obvious when increasing CO2 after November 11. It should be noted that there was significant correlation among various indexes of leaves at the same time (P<0.05). The Pearson analysis showed that the increase of YT at the early growth stage directly reduced the leaf SPAD, YN and YRH of purple pak-choi, and the increase of YT at the later growth stage was beneficial to the increase of SPAD, YN and YRH. YN and YRH were positively correlated with chlorophyll SPAD (P<0.01). In conclusion, the reasonable coupling of nitrogen and CO2 in hydroponic solution could increase the contents of chlorophyll and nitrogen in the leaves of hydroponic purple pak-choi, and the results could provide theoretical basis for the accurate management of nitrogen and CO2 in the hydroponic purple pak-choi.
Key words: Nitrogen concentration; Carbon dioxide; Purple pak-choi; Chlorophyll; Anthocyanins
有效利用环境因素能实现温室蔬菜优质高产,促进我国设施农业可持续发展[1-2]。水培液氮素(N)和空气二氧化碳(CO2)是温室蔬菜最重要的生长环境因子。KILINC等[3]研究发现,水培液元素含量和性质决定了作物生长及品质。多数研究表明不同营养液N浓度对叶菜生长、产质量等都有不同程度的影响[4-8]。随着生菜生长,营养液N对其干物质累积量及植株N吸收影响显著,但高浓度N仍然有利于N吸收[9-11]。刘燕婕等[12]、KACJAN等[13]认为水培小白菜和生菜在水培液N浓度为8 mmol·L-1的营养液中生长最好,但MAHLANGU等[14]认为水培液N浓度在8.57 mmol·L-1时生菜冠部鲜重最大。刘爱荣等[15]发现在NH4NO3 600 mg L-1氮水平下,紫青菜的鲜质量和干质量均最高、营养均衡、抗氧化能力强。张春兰等[16]发现水培液中硝态氮处理叶菜生长情况优于铵态氮、尿素处理。由于设施温室严重缺乏CO2,甚至接近或达到CO2补偿点[17-19]。空气CO2浓度升高能提高作物净光合速率,減少植物叶片气孔导度,改善叶片水分关系,刺激植物生长[20-21]。张树生等[22]研究发现大棚增施CO2促进了生菜、青菜、油麦菜等叶菜叶片厚度,提高其光合作用,最终使产量增加。所以在封闭设施生产条件下,CO2施肥已经成为提高蔬菜的光合作用、产量和品质的理想途径[23-26]。但植物生长的增加取决于共同限制因子的性质,任何增加的碳供应将加剧营养限制[20]。COLEMAN等[27]发现植物对大气中CO2浓度升高的反应通常是体内组织氮浓度降低。在不施氮条件下增施CO2能促进黄瓜茎叶干物质向果实分配[28]。但在施氮条件下富集CO2会降低氮素的吸收而损害植物的生长[29]。
设施蔬菜中的紫色蔬菜因含有很高的花青素,抗氧化能力比普通绿色蔬菜强,能够预防高血压、减缓肝功能障碍等[30],设施紫色叶菜在市场上销量及价格逐渐上涨。CHEN等[31]发现,有机紫色叶菜售价可达100~120元·kg-1,而一般的绿色叶菜仅售4~10元·kg-1。现阶段关于紫青菜的理化性质[32]和提取工艺[33]、产质量[34]及其紫色基因定位[35]、花色苷组成分析[36]等已有相关研究,然而设施紫叶菜生长的多数研究还停留在单因素调控研究中,对营养液N与空气CO2对水培紫色叶菜的耦合效应研究几乎未见报道。前期研究发现增加空气CO2浓度,降低水培液N含量,明显有利于紫叶菜的生长、提高叶片SPAD值及养分吸收,但对花青素的影响应进一步研究[31]。本试验通过设置水培条件下氮、CO2互作处理,研究其对紫青菜叶片叶绿素SPAD值、氮含量(YN)、温度(YT)、湿度(YRH)的耦合影响。以南京本地紫青菜为试验材料,设置了C0N0、C0N2、C0N4、C1N0、C1N2、C1N4等6个氮气耦合处理,其中水培液氮浓度设置为水培液稀释液中不添加外源氮(N0)、添加0.2 g·L-1外源氮(N2)、添加0.4 g·L-1外源氮(N4),每种氮素浓度下设置不施加CO2增长剂(C0)和施加CO2增长剂(C1)处理,研究移栽后紫青菜叶片SPAD值、YN、YT、YRH的变化情况,以期为水培条件下紫青菜精准氮、CO2管理提供一定理论基础。
1 材料与方法
1.1 试验地概况
试验场地为南京市金陵科技学院园艺园林学院园艺站连栋温室(N 32.1234°,E 118.8111°),搭建两个大小一致的室内塑料棚,尺寸为脊高2.0 m,檐高1.6 m,长度4 m,宽度2 m。四周及底部全覆盖塑料薄膜,仅一侧在必要时可打开,其余时间全部密封。
1.2 试验材料及方法
采用管道水培方法种植紫青菜,紫青菜品种为南京当地紫油菜品种。设置3种氮素浓度处理,分别为水培液稀释液不添加氮素(N0)、添加0.2 g·L-1氮素(N1)、添加0.4 g·L-1氮素(N2)。每种氮素处理下设置两种CO2处理,分别为不添加CO2增长剂(C0)、添加CO2增长剂(C1),CO2增长剂来自市售吊挂式(品牌:曲州国盛)。共设置6个处理为C0N0、C0N2、C0N4、C1N0、C1N2、C1N4,每个处理重复4次。其中水培液原液为市场采购,含N 381.24 g·L-1、P2O5 140.3 g·L-1、K2O 558.44 g·L-1、MgO 160.24 g·L-1、CaO 434.7
g·L-1、S 128.7 g·L-1、Fe 6.40 g·L-1、B 0.98 g·L-1、Mn 1.34 g·L-1、Zn 0.09 g·L-1、Cu 0.04 g·L-1、Mo 0.014 g·L-1,与水按照1∶3稀释后使用。外源添加氮素为自制速效尿素(42%N)。根据生长情况每7~10 d更换1次水培液,早上8:00定时循环,下午14:00停止循环。利用氯化铵稀释液进行调节水培液pH范围为7.9~8.3,盐度995~1253 mg·L-1,温度为19~24℃即可。C1处理为移栽后1周内不添加CO2,通过通风保持CO2浓度在400~600 μL·L-1。缓苗1周后,添加适量CO2增长剂保持浓度在1000~1300 μL·L-1范围。株高大于15 cm时,保持CO2浓度为800~1000 μL·L-1。株高为(20±0.3)cm时不再添加外源CO2,保持CO2浓度为400~600 μL·L-1。于2020年9月28日土培育苗,10月28日移栽至水培管道。移栽时选取生长一致的高度约为8 cm的紫青菜苗,清洗根,用定植棉固定移栽至管道种植孔。
1.3 测定项目与方法
根据株高增长速率分别在2020年11月9日、11月10日、11月11日、11月16日、11月17日利用叶绿素仪(TYS4N, 金科利达,中国)的光谱检测其叶片叶绿素SPAD值、氮含量(YN)、温度(YT)和湿度(YRH)。每个重复处理下紫青菜选取3片叶子测定取平均值,每个处理为4个重复的平均值。
1.4 数据分析
试验数据采用Excel 2010处理,利用SPSS Statistics 17.0 进行单因素方差分析(One Way ANOVA),其中Duncan′s 多重比较显著性差异水平为P<0.05。不同指标间相关性利用Pearson相关分析,在0.05显著和0.01极显著水平上进行(N)、二氧化碳(CO2)及N×CO2互作效应方差分析。
2 结果与分析
2.1 水培条件下氮、CO2耦合对紫青菜叶绿素荧光值的影响
由表1可知,在11月9日、11月10日、11月16日C1处理下紫青菜叶片SPAD值均大于C0。无论是否施用CO2增长剂,在11月9日、11月10日随着氮素浓度增加,叶绿素SPAD值呈先降低后上升趋势。11月11日、11月16日、11月17日在C0情况下,随着水培液中氮素增加,SPAD值逐渐降低;在C1情况下11月11日隨着氮素浓度提高,SPAD值先降低后再增加,11月16日、11月17日均表现出SPAD值随着氮素浓度先增加后降低。在11月9日,C1N4处理下紫青菜叶片叶绿素SPAD值(33.15)最高,与C1N0差异不显著,与其他处理差异显著(P<0.05)。C0N2处理下最低,为24.37。11月10日,C1N4处理下紫青菜叶片叶绿素SPAD值最高,为32.03,与其余处理差异显著(P<0.05),C0N2处理下最低,为26.75(P<0.05)。11月11日以C1N0处理下SPAD值最高,为34.23,与C1N4无显著差异,与其他处理差异显著(P<0.05),C0N4处理下最低,为21.60(P<0.05)。11月16日C1N2处理下SPAD值最高,为35.20,显著高于C0的所有处理(P<0.05),C0N4处理下最低(P<0.05)。11月17日C1N0(34.40)与C1N2(33.48)处理下SPAD值均显著高于C0N4(29.53)和C1N4(27.63),与其他处理差异均不显著。
方差分析表明,氮素在11月9日、11月10日、11月11日、11月16日极显著影响紫青菜叶片叶绿素SPAD值(P<0.01),在11月17日对SPAD值无显著影响。CO2在11月9日、11月16日显著影响SPAD值(P<0.05),在11月11日、11月17日极显著影响SPAD值(P<0.01),在11月10日无显著影响。对于N、CO2互作效应来说,仅在11月11日对叶片SPAD值产生极显著影响(P<0.01),其余时间无显著影响(P>0.05)。
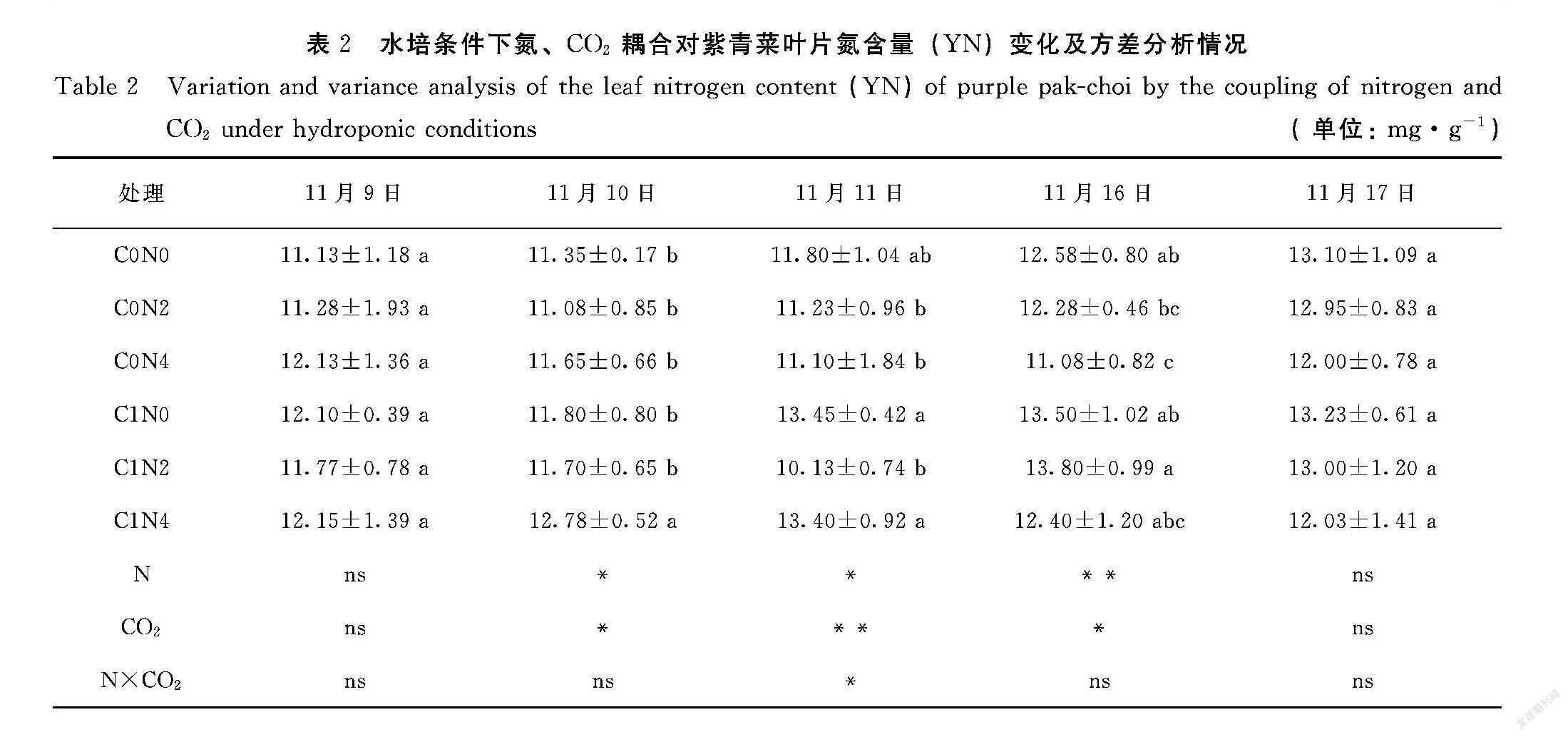
2.2 水培条件下氮、CO2耦合对紫青菜叶片氮含量的影响
由表2可知,除11月11日,其余每日相同N浓度下C1处理氮含量均大于C0处理。在11月9日,所有处理紫青菜叶片YN差异不显著(P>0.05),以C1N4、C0N4、C1N0处理下YN最大,分别为12.15、12.13、12.10 mg·g-1,其余处理处于11.10~12.00 mg·g-1,以C0N0处理下最小为11.13 mg·g-1。在11月10日,C1N4处理下叶片YN值最高,为12.78 mg·g-1,显著大于其他处理(P<0.05),C0N2处理下最小,为11.08 mg·g-1。在11月11日,在N0和N4处理下叶片YN均表现为施用CO2增长剂处理下其值较大,而C1N2处理叶片YN小于C0N2处理。C1N0(13.45 mg·g-1)、C1N4(13.40 mg·g-1)和C0N0(11.80 mg·g-1)处理下叶片YN差异不显著(P>0.05),前两者均显著大于其他处理(P<0.05)。在11月16日,C0处理下随着水培液氮素浓度增加,紫青菜叶片YN减少,C0N0和C0N4处理下YN差异显著(P<0.05);在C1处理下紫青菜叶片YN在处理间无显著差异(P>0.05),随着水培液氮素浓度增加,先增加后降低。C1N2和C1N0处理下叶片YN最高,分别为13.80、13.50 mg·g-1,C0N4处理下最低,为11.10 mg·g-1。在11月17日,测定发现无论在哪种CO2处理下随着水培液氮素增加,叶片YN降低;所有处理下叶片YN差异不显著(P>0.05),按照含量大小依次为C1N0(13.23 mg·g-1)、C0N0(13.10 mg·g-1)、C1N2(13.00 mg·g-1)、C0N2(12.95 mg·g-1)、C1N4(12.03 mg·g-1)、C0N4(12.00 mg·g-1)。
方差分析表明,氮素仅在11月10日、11月11日对紫青菜叶片YN有显著影响(P<0.05),在16日呈现极显著影响(P<0.01)。CO2在仅在11月10日、11月16日对叶片YN有显著影响(P<0.05),在11月11日呈现极显著影响(P<0.01)。另外,仅在11月11日呈现显著的N和CO2交互作用(P<0.05)。
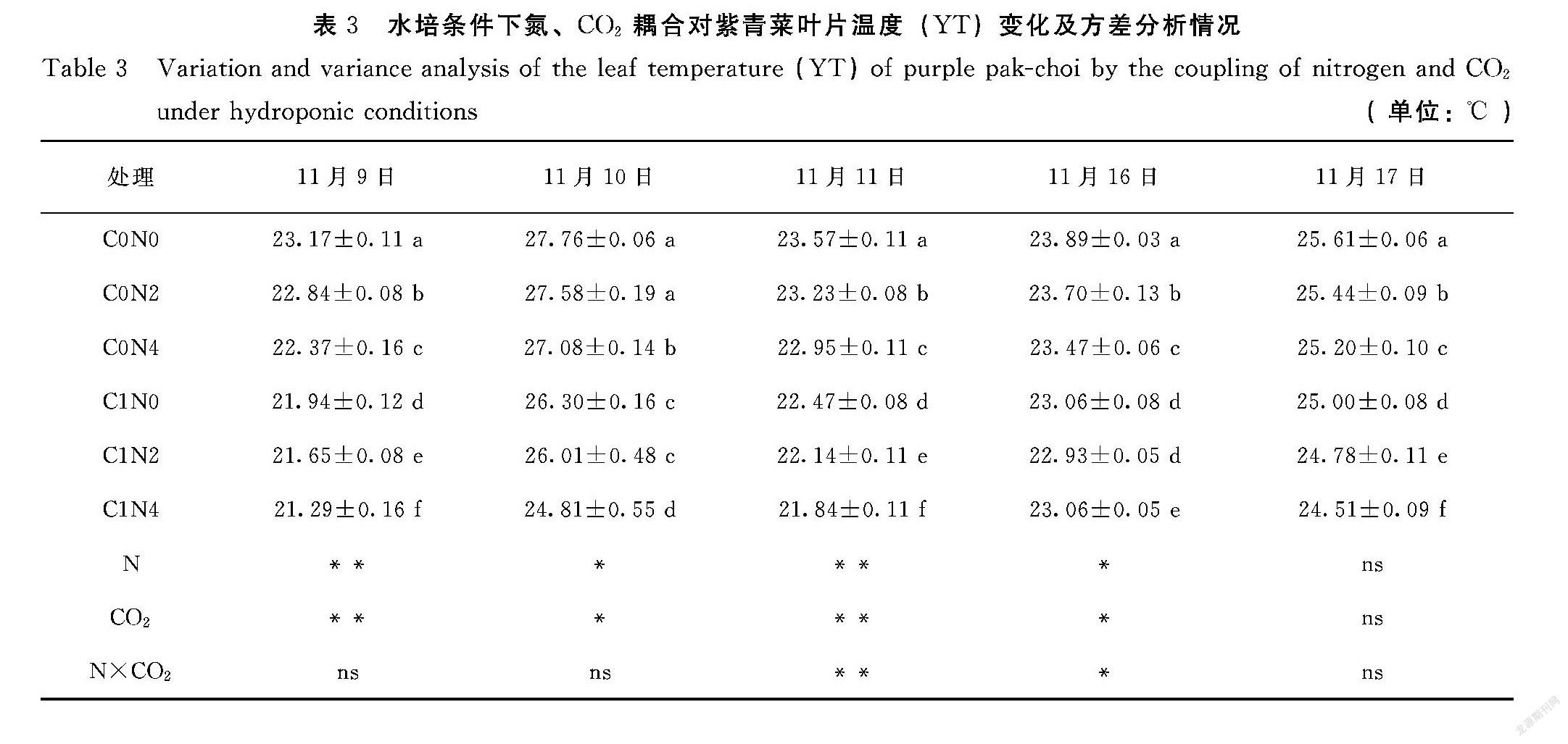
2.3 水培条件下氮、CO2耦合对紫青菜叶片温度的影响
由表3可知,无论是否添加CO2增长剂,随着水培液氮素浓度提高紫青菜叶片YT逐渐降低的趋势。相同氮素浓度水培液生长的紫青菜叶片YT在C0处理下其值高于施用C1。除11月10日,其余测定日期均以C0N0处理下叶片YT最大,显著高于其他处理(P<0.05)。11月11日C0N0、C0N2处理下叶片YT无显著差异(P>0.05),均显著高于其他处理(P<0.05)。
方差分析结果表明,在紫青菜生长过程中N和CO2均对叶片YT影响明显。在11月11日水培液N和CO2对叶片YT的耦合效应表现为极显著影响(P<0.01),在11月16日表现为显著的耦合影响(P<0.05)。
2.4 水培条件下氮、CO2耦合对紫青菜叶片湿度的影响
由表4可知,不同氮、CO2耦合处理对紫青菜叶片YRH影响随着时间的变化规律不一样。在11月9日,C0处理下,随着水培液氮素增加,叶片YRH先降低后增加;在C1处理下,随着水培液氮素增加,叶片YRH逐渐降低;C0N4处理下叶片YRH最大,为50.53%,仅显著高于C0N2处理(P<0.05),与其他处理间差异不显著(P>0.05)。在11月10日,无论是C0还是C1处理下,均表现出随着水培液氮素增加叶片YRH先降低后增加的趋势;其中C1N4处理下叶片YRH最大,为51.10%,显著高于其他处理(P<0.05)。在11月11日,C0处理下表现出随着水培液氮素增加叶片YRH先降低的趋势,在C1处理下,随着水培液氮素增加叶片YRH呈现先降低后增加;C1N0(53.80%)、C1N4(53.59%)处理下叶片YRH差异不显著(P>0.05),均显著高于其他处理(P<0.05)。11月16日叶片YRH在不同处理间变化规律与11月11日一致,以C1N0(54.00%)、C1N4(52.00%)处理下叶片YRH最大,均与C0N4、C1N2呈现显著性差异(P<0.05)。11月17日所有处理下叶片YRH无显著差异(P>0.05),无论哪种CO2处理下均表现出随着氮素浓度上升叶片YRH减少;相同氮素浓度下以C0处理下叶片YRH较大,所有处理下叶片YRH从大到小顺序为C1N0、C0N0、C1N2、C0N2、C1N4、C0N4。
方差分析表明(表4),N 和CO2分别在11月10日、11月16日显著影响紫青菜叶片YRH(P<0.05),在11月11日极显著影响叶片YRH(P<0.01)。N和CO2在11月11日对叶片YRH表现出极显著耦合作用(P<0.01),在11月16日表现出显著耦合影响(P<0.05)。
2.5 水培条件下氮、CO2耦合与紫青菜叶片各指标间Pearson相关性分析
由表5可知,紫青菜叶绿素SPAD值在11月9日(r=-0.688)、11月10日(r=-0.567)均与YT呈极显著的负相关(P<0.01),11月16日两者呈显著的负相关(r=-0.451,P<0.05)。值得注意的是,两者在生长后期(11月17日)呈较弱的正相关(r=0.360)。叶绿素SPAD值在11月9日分别与YRH(r=0.479)、YN(r=0.488)呈显著正相关(P<0.05)。在其余测定时期均分别与YRH、YN呈极显著正相关(P<0.01)。值得注意的是SPAD值与YN在11月10 日的相关系数极显著达到0.999(P<0.01),在11月11日SPAD值与YRH相关系数极显著达到0.976(P<0.01)。YT仅在11月10 日分别与YRH(r=-0.584)、YN(r=-0.570)呈极显著负相关(P<0.01)。值得注意的是在11月17 日YT分别与YRH、YN呈较弱的正相关。YRH在11月9日(r=0.669)、11月10日(r=0.940)、11月11日(r=0.802)、11月17日(r=0.929)均与氮YN呈极显著正相关(P<0.01),在11月16日呈显著正相关(r=0.503,P<0.05)。
3 结论与讨论
水培液氮素浓度和环境中CO2对设施叶菜影响最大。朱建雯等[37]研究发现10 mmol·L-1氮素浓度能提高水培小白菜产量,降低其硝酸盐。而适合用于水培韭菜生长及产质量的营养液氮素浓度为8~12 mmol·L-1[6]。随着供氮水平的增加,紫青菜叶绿素含量呈上升趋势,但是高于一定氮素水平鲜质量和干质量也不高,且植株体内易积累硝酸盐,根际积累硝酸铵,引起根际水体的硝酸盐污染[34]。王春乙等[38]发现随着CO2浓度增加,大白菜净光合速率增大,蒸腾系数减小,叶气温差增大,叶温升高。虽然青菜对CO2有强烈的富集作用,通过叶片光合作用吸收CO2会向其他部位组织输送并形成累积[39]。但是CO2对紫青菜的影响研究还很少,进一步的水培液氮素浓度和CO2对紫青菜的耦合效应研究还未见报道。
本研究以紫青菜为试验材料,初步研究了不同水培液氮素浓度与外源CO2施加对紫青菜叶片叶绿素SPAD值、氮含量(YN)、温度(YT)、湿度(YRH)的影响。研究结果表明水培液氮素与CO2耦合显著影响紫青菜叶片叶绿素SPAD值、YN、YT、YRH(P<0.05),各指标间相关性显著(P<0.05)或极显著(P<0.01)。CO2施肥能够显著提高紫青菜SPAD值(P<0.05),且在移栽后约13 d,N与CO2耦合效应呈现极显著性(P<0.01)。紫青菜移栽后在11月16日之前,以C1N4互作处理下叶片SPAD值最高,但随后C1N2互作处理下叶片SPAD值最高。这可能是由于氮素增加导致叶片早衰及细胞膜透性增加,对叶绿体超微结构造成伤害使SPAD值降低[40]。在C0条件下提高水培液中N含量仅有助于紫青菜移栽后在11月11日之前叶片YN增加。这可能是因为该阶段叶片还比较小较薄、生物量低,氮素提高促进其养分吸收。随后叶片变大生物量增加,叶片YN累积量相对变小。C1N4互作处理紫青菜移栽后在11月11日之前有利于提高其葉片YN,随后不添加任何外源N处理有利于提高叶片YN。所以合理的CO2施用与水培液N浓度互作有利于提高某生长时间的紫青菜叶片YN。CO2施用和添加外源N的水培液均能够显著降低叶片YT,这可能是因为增加CO2和N提高了紫青菜叶片YRH,水分蒸发量加大,带走了热量使温度降低。水培液氮、CO2耦合处理显著作用于紫青菜叶片YRH(P<0.05),移栽后在11月11日之前以N4能够提高叶片YRH,随后增加CO2作用效果明显。紫青菜生长过程中,叶片YT能够直接影响叶片SPAD值、YRH、YN,从而影响叶片光合作用。11月17日叶片YT上升有利于SPAD值、YRH、YN提高,其原因可能是随着植株长大,植株吸水及养分增多,且光合作用增强。整个生长过程发现叶片YT、YRH与YN提高能够增加叶片SPAD值。
由于葉片氮含量、叶绿素、温度、湿度是作物生长的重要营养和生理参数,本研究结果初步能够反映紫青菜生命体征,指导紫青菜施肥和灌溉,可为叶菜在不同时期生长所需的精准氮、CO2管理提供一定理论基础。
参考文献:
[1]YANG N W, ZANG L S, WANG S, et al.Biological pest management by predators and parasitoids in the greenhouse vegetables in China[J].Biological Control, 2014, 68(1): 92-102.
[2]王巧莉, 王震.我国设施蔬菜产业发展存在的问题及发展重点[J].江西农业, 2018 (8):61.
[3]KILINC S S, ERTAN E, SEFEROGLU S.Effects of different nutrient solution formulations on morphological and biochemical characteristics of nursery fig trees grown in substrate culture[J].Entia Horticulturae, 2007, 113(1):20-27.
[4]别之龙, 徐加林, 杨小峰.营养液浓度对水培生菜生长和硝酸盐积累的影响[J].农业工程学报, 2005 (S2):109-112.
[5]王瑞, 胡笑涛, 王文娥, 等.菠菜水培不同营养液浓度的产量、品质、元素利用效率主成分分析研究[J].华北农学报, 2016 (S1):206-212.
[6]杜红艳,于平彬,季延海,等.不同氮素浓度对水培韭菜生长发育与品质的影响[J].中国蔬菜,2015,1(5):45-48.
[7]孙兴祥, 王健, 周毅,等.不同氮素水平对菠菜生长和品质的影响[J].南京农业大学学报, 2005 (3):126-128.
[8]赵凤艳, 魏自民, 陈翠玲.氮肥用量对蔬菜产量和品质的影响[J].农业系统科学与综合研究, 2001 (1):44-45.
[9]贺志文.水培生菜吸氮模型构建与营养液氮素调控研究[D].晋中:山西农业大学, 2018.
[10]王强, 姜丽娜, 符建荣, 等.氮素形态,用量及施用时期对小青菜产量和硝酸盐含量的影响[J].植物营养与肥料学报, 2008, 14(1):126-131.
[11]苏苑君, 王文娥, 胡笑涛, 等.氮对水培生菜营养液元素动态变化及产量与品质的影响[J].华北农学报, 2016 (3):198-204.
[12]刘燕婕.氮浓度对水培小白菜和生菜生长,光合及叶片光谱反射率的影响[D].银川:宁夏大学, 2016.
[13]KACJAN MARI 'C N, OSVALD J.The influence of different concentration of nitrogen in nutrient solution on plant growth and nitrate accumulation in aeroponically grown lettuce (Lactuca sativa L.)[J].Agrochimica, 2002, 46(1-2):56-65.
[14]MAHLANGU R, MABOKO M M, SIVAKUMAR D, et al.Lettuce (Lactuca sativa L) growth, yield and quality response to nitrogen fertilization in a non-circulating hydroponic system[J].Journal of Plant Nutrition, 2016, 39(12): 1-15.
[15]刘爱荣,张远兵,黄守程, 等.根际不同供氮水平对紫青菜生长和营养品质的影响.热带亚热带植物学报, 2016, 24(1): 56-62.
[16]张春兰, 高祖明, 张耀栋, 等.氮素形态和NO3-~N 与 NH4+~N配比对菠菜生长和品质的影响[J].南京农业大学学报, 1990, 13(3):70-74.
[17]喻景权, 周杰.“十二五”我国设施蔬菜生产和科技进展及其展望[J].中国蔬菜, 2016 (9):18-30.
[18]汪永钦,刘荣花.日光温室蔬菜栽培中人工增施CO2技术[J].应用气象学报, 1997, 8(4):460-468.
[19]RING H P, HAUSCHILD C, HEINER A, et al.Model-based control of CO2 concentration in greenhouses at ambient levels increases cucumber yield[J].Agricultural & Forest Meteorology, 2007, 143(3-4): 208-216.
[20]KIRSCHBAUM M U.Does enhanced photosynthesis enhance growth? Lessons learned from CO2 enrichment studies[J].Plant Physiology, 2011, 155(1), 117-124.
[21]MATEOS-NARANJO E, REDONDO-GOMEZ S, AN-DRADES-MORENO L, et al.Growth and photosynthetic responses of the cordgrass Spartina maritima to CO2 enrichment and salinity[J].Chemosphere, 2010, 81(6): 725-731.
[22]张树生, 梅淑芳, 赵华, 等.有机废弃物发酵加富大棚CO2对叶菜类蔬菜生长的影响[J].广东微量元素科学, 2011, 18(8):27-32.
[23]MORTENSEN L M.Review: CO2 enrichment in greenhouses.Crop responses[J].Scientia Horticulturae, 1987, 33(1-2): 1-25.
[24]NEDERHOFF E M.Effects of CO2 concentration on photosynthesis, transpiration and production of greenhouse fruit vegetable crops[J].Wageningen Agricultural University,1994:1-11.
[25]JIN C W, DU S T, WANG Y, et al.Carbon dioxide enrichment by composting in greenhouses and its effect on vegetable production[J].Journal of Plant Nutrition and Soil Science, 2009, 172(3): 418-424.
[26]高文瑞, 徐剛, 王虹, 等.CO2施肥对设施蔬菜影响的研究进展[J].江苏农业科学,2009(6): 213.
[27]COLEMAN J S, MCCONNAUGHAYK D M, BAZ-ZAZF A.Elevated CO2 and plant nitrogen-use: is reduced tissue nitrogen concentration size-dependent?[J].Oecologia, 1993, 93(2): 195-200.
[28]董金龙, 李汛, 段增强, 等.CO2施肥对设施黄瓜生长和土壤氮素转化的影响[J].江苏农业科学, 2016, 44(2): 207-212.
[29]TAYLOR B N, STRAND A E, COOPER E R, et al.Root length, biomass, tissue chemistry and mycorrhizal colonization following 14 years of CO2 enrichment and 6 years of N fertilization in a warm temperate forest[J].Tree Physiol, 2014, 34(9): 955-965.
[30]刘庞源, 张宝海, 何伟明, 等.紫色蔬菜资源的收集与优异种质的筛选[J].中国蔬菜, 2010(23):51-52.
[31]CHEN D Y, HU J, LI P Z, et al.Effects of carbon dioxide and nitrogen coupling on growth, anthocyanin and nutrients absorption of hydroponicpurplelettuce[J].Fresenius Environmental Bulletin, 2021, 30(3): 3005-3011.
[32]李长新.紫色小白菜花青素理化性质研究[D].杨凌:西北农林科技大学, 2011.
[33]杨碧云, 叶丽萍, 林琳琳,等.响应面法优化超声辅助提取紫色小白菜花青苷的工艺研究[J].热带亚热带植物学报, 2014(4):373-382.
[34]刘爱荣, 张远兵, 黄守程, 等.根际不同供氮水平对紫青菜生长和营养品质的影响[J].热带亚热带植物学报, 2016 (1) : 56-62.
[35]刘瑾, 汪维红, 张德双, 等.控制白菜叶片紫色的pur基因初步定位[J].华北农学报, 2013(1):49-53.
[36]徐学玲, 赵岫云, 王丹, 等.HPLC-ESI-MS分析紫色小白菜中花色苷组成分析[J].食品工业科技, 2014, 35(11):278-281.
[37]朱建雯, 袁丽红, 冯翠梅.不同氮水平对水培小白菜生长及其体内硝酸盐含量的影响[J].安徽农业科学, 2008, 36(1):16-17,73.
[38]王春乙, 郭建平, 王修兰, 等.CO2浓度增加对C3、C4作物生理特性影响的实验研究[J].作物学报, 2000, 26(6):813-817.
[39]史建君, 林明明.青菜对CO2的吸收和积累动态[J].环境科学, 2007, 28(8):1806-1809.
[40]任丽花, 余华, 罗土炎,等.不同供氮水平对叶菜型甘薯生理指标及叶绿体结构的影响[J].福建农业学报, 2011, 26(3):360-364.
(责任编辑:柯文辉)

