油菜根内生菌分离、鉴定及其植物益生作用筛选
张沁怡 杨美雪 张婷 程林洁 黎烨 张羽杉 李景虹 蓝灿华 田宝玉 李欣


摘 要:从油菜中分离鉴定根内生细菌菌株,检测评估其促生、抑菌潜力和机制,为开发具有植物促生和病害防控的微生物肥料提供依据。以油菜为研究对象,通过分离纯化和16S rRNA基因扩增分离和鉴定油菜根内生细菌,并进一步通过平板法、酶活法以及抑菌试验等分析分离其木制纤维素降解能力、促生作用以及抑菌活性等益生特性及其机理。结果表明:根据细菌菌落形态、颜色和大小,挑取纯化得到14株油菜根内生细菌菌株。经16S rRNA基因测序和鉴定分析,分别为假单胞菌、肠杆菌、芽孢杆菌、葡萄球菌和莱略特菌。在分离纯化的14株内生菌株中,除菌株Y-7、Y-8外都具有明显的木聚糖酶活性,除菌株Y-1、Y-7、Y-8、Y-9、Y-10外都具有纤维素分解能力,进一步对14株内生菌株的植物益生作用进行初步筛选和评价,得到产铁载体菌株Y-2、Y-4、Y-6、Y-10、Y-11、Y-13、Y-14,具有稳定固氮能力的固氮菌株Y-1、Y-2、Y-10、Y-13、Y-14。在拮抗内生菌筛选中,得到拮抗大肠杆菌菌株Y-1、Y-6、Y-7、Y-8、Y-12,拮抗金黃色葡萄球菌菌株Y-3、Y-4,拮抗枯草芽孢杆菌菌株Y-1以及拮抗黑曲霉菌株Y-3、Y-4、Y-6、Y-9、Y-10、Y-14。大多数分离的油菜根内生菌具有一定的木质纤维素降解能力。分离的油菜根内生菌具有广泛而多样性的植物益生特性,如促生长和抑菌活性,这些益生特性可能与其具有的产铁载体、产IAA以及固氮能力有关。结果表明油菜根内生菌可以作为筛选和开发具有植物促生和病害防控作用的微生物菌剂的重要来源。
关键词:油菜根内生菌;16S rRNA基因;分子鉴定;植物益生作用
中图分类号:S 476.1 文献标志码:A 文章编号:0253-2301(2021)11-0033-11
DOI: 10.13651/j.cnki.fjnykj.2021.11.006
Isolation and Identification of Endophytic Bacteria from the Roots of Brassica Napusand the Screening for the Probiotic Effects of Plants
ZHANG Qin-Yi, YANG Mei-Xue, ZHANG Ting, CHENG Lin-Jie, LI Ye, ZHANG Yu-shan,LI Jing-hong, LAN Can-hua, TIAN Bao-Yu, LI Xin*
(Fujian Key Laboratory in Universities of Cellular Stress Response and Metabolic Regulation/College
of Life Science, Fujian Normal University, Fuzhou, Fujian 350108, China)
Abstract: The endophytic bacterial strains were isolated and identified from the roots of Brassica napus, and their growth promotion and antibacterial potential and mechanism were detected and evaluated, thus to provide the basis for the development of microbial fertilizers with the abilities of plant growth promotion and disease prevention. By taking Brassica napus as the research object, the endophytic bacteria in the roots of Brassica napus were isolated and identified by the isolation and purification and 16S rRNA gene amplification. The probiotic characteristics of lignocellulose, such as the degradation ability, growth-promoting effect and antibacterial activity, and its mechanism were further analyzed by using the plate method, enzyme activity method and antibacterial test. The results showed that 14 strains of endophytic bacteria were selected and purified from the roots of Brassica napus according to the morphology, color and size of bacterial colonies. By 16S rRNA gene sequencing and identification & analysis, they were Pseudomonas, Escherichia coli, Bacillus, Staphylococcus and Lelliottia. Among the 14 isolated and purified endophytic strains, all the strains except Y-7 and Y-8 had significant xylanase activity, and all the strains except Y-1, Y-7, Y-8, Y-9 and Y-10 had the cellulose decomposition ability. The preliminary screening and evaluation on the plant probiotic effects of the 14 endophytic strains were further carried out, and the iron carrier-producing strains including strain Y-2, Y-4, Y-6, Y-10, Y-11, Y-13 and Y-14 were obtained, and the azotobacters including strain Y-1, Y-2, Y-10, Y-13 and Y-14 with stable nitrogen fixation ability were also obtained. In the screening of antagonistic endophytic bacteria, the strains Y-1, Y-6, Y-7, Y-8 and Y-12 against Escherichia coli, the strains Y-3 and Y-4 against Staphylococcus aureus, the strain Y-1 against Bacillus subtilis and the strains Y-3, Y-4, Y-6, Y-9, Y-10 and Y-14 against Aspergillus niger were obtained. Most of the endophytic bacteria isolated from the roots of Brassica napus had certain ability of lignocellulose degradation. The endophytic bacteria isolated from the roots of Brassica napus exhibited a wide range of probiotic properties such as growth promotion and bacteriostatic activity, which might be related to their abilities to produce iron carriers & IAA and the nitrogen fixation ability. The results showed that the endophytic bacteria from the roots of Brassica napus could be used as the important source for screening and developing the microbial agents with the abilities of plant growth promotion and disease prevention and control.
Key words: Endophytic bacteria from the roots of Brassica napus; 16S rRNA gene; Molecular identification; Probiotic effects of plants
油菜Brassica napus L.是世界上食用植物油和植物蛋白的主要来源之一,广泛种植于中国、加拿大、印度及欧盟等各地,在国际农产品贸易中占有极为重要的地位[1]。在化石资源储量有限以及全球能源需求日益增加的状况下,油菜作为新替代型可再生能源,是缓解我国石油储备与供应矛盾的一个重要替代方案[2-3]。油菜在生長发育过程中,容易受到根肿病、菌核病、白锈病、茎腐病、黑胫病等病虫害、病菌引起的生物胁迫以及环境变化引起的非生物胁迫影响,使得产量下降,质量不佳[4-6]。由于缺乏有效的抗性品种,加上我国土地资源有限,复种指数高,以及多种高毒高残留化学农药的使用受到限制等原因,发展具有高效、环境友好和人畜安全的油菜病害生物防治策略迫在眉睫。植物内生菌是指其生活史的一定阶段或全部阶段定殖于植物器官、组织内部以及细胞间隙,但并不会引起明显的外在感染症状的一类微生物,主要包括内生真菌、内生细菌和内生放线菌[7-11]。作为一类非常重要的微生物资源,植物内生菌具有独特的生理和代谢机制,可产生多种活性物质,帮助植物抵御病原微生物的侵害,如抗旱、抗霜冻、抗病虫害及对病原体拮抗等,并可以通过产生吲哚乙酸、赤霉素以及细胞分裂素等植物激素来直接促进宿主植物的生长、促进宿主植物中有效活性成分的产生等。郎多勇等[12]对宁夏产甘草根茎叶中内生菌分离纯化得到内生细菌100株,经鉴定和进一步研究表明对多种病原菌具有拮抗效果。王红珠等[13]以生长于丽水市某村重金属污染区的植物为材料,分离筛选出链球菌菌株GZ01,经鉴定其能够通过分泌IAA、产铁载体、溶磷以及合成ACC脱氨酶等功能来促进宿主植物生长。这些具有植物益生特性的内生细菌,是目前商品化生防制剂或微生物肥料的主要来源,已在农业实践中得到了广泛应用[14-19]。研究表明,油菜根内含有丰富的内生菌菌群,在促进油菜种子的萌发以及后期生长发育中发挥重要的作用。同时油菜的根系分泌物也可增强土壤微生物和土壤生化活性作用,并能溶解和利用土壤中的难溶性磷,提高土壤的有效磷水平[20-21]。油菜不仅是十字花科的主要代表性植物,也是一种重要的蔬菜和油料经济作物。对油菜根内生细菌菌株的分离及益生特性的筛选不仅丰富了十字花科植物和油料经济作物的益生菌资源,而且将为发展高效、环境友好和人畜安全的生防制剂或微生物肥料奠定材料和理论基础。本研究从油菜根中分离鉴定内生细菌菌株,并检测其植物益生作用,以筛选具有植物益生作用的菌株,系统评估油菜植物益生菌资源及其潜力。
1 材料与方法
1.1 试验材料
油菜采集于福建省福州市闽侯油菜种植地。
1.2 试验方法
1.2.1 油菜根内生菌的分离、纯化和分子鉴定 采集的油菜植物去掉根部浮土,自来水冲洗干净,并用无菌水冲洗3次。将预处理的根置于无菌培养皿中,75%酒精消毒2 min后,用无菌水清洗3次。将预处理的油菜根充分研磨静置后得菌悬液,菌悬液梯度稀释后涂布于TSA固体培养基上,每个处理重复3次,28℃培养24~36 h。当平板长出菌落时,根据菌落形态、颜色及大小的差异挑取单克隆进行多次纯化。纯化后菌株于摇床28℃振荡培养18~24 h。取适量纯菌液与已灭菌的20%甘油混合于-20℃保藏,剩余部分用于试验。
按Ezup柱式细菌基因组DNA试剂盒说明提取油菜根内生菌基因组DNA。以提取的基因组DNA为模板,采用细菌通用引物(27f:5′AGAGTTTGATCCTGGCTCAG-3′;1492r:5′-AAGGAGGTGATCCAGCCGCA-3′)进行PCR扩增[22]。扩增产物用SanPrep柱式PCR产物纯化试剂盒纯化回收后,送至上海生工测序。获得的序列用SeqMan查看并进行序列拼接,利用EzBioCloud数据库分析并确定其分类地位,最后在Mega 7.0中用Neighbor-Joining法构建系统发育树。
1.2.2 油菜根内生菌木质纤维素和木聚糖降解能力测定 纤维素酶和木聚糖酶活性测定:分别取4 mL于TSA培养基中活化的菌悬液,离心弃上清收集菌体接种于CMC培养基,28℃培养48 h后,革兰氏碘液染色3~5 min。分别取10 μL纤维素酶液(10 mg·mL-1)滴加于打孔的CMC平板上,10 μL木聚糖酶液(10 mg·mL-1)滴加于打孔的木聚糖平板作为阳性对照。无菌水作阴性对照。
1.2.3 油菜根内生菌促生及产IAA活性的测定 产IAA内生菌对植物种子发芽的影响:分别吸取8 μL于TSA培养基活化的菌悬液接种于装有2 mL含L色氨酸的King氏培养基(酵母浸粉0.5 g、胰蛋白胨0.5 g、酪蛋白氨基酸0.5 g、葡萄糖0.5 g、可溶性淀粉0.5 g、丙酮酸钠0.3 g、K2HPO4 0.3 g、 MgSO4·7H2O 0.05 g、 L色氨酸0.5 g,蒸馏水定容至1000 mL,pH为7.2±0.2,121℃灭菌)和不含L色氨酸的King氏培养基(酵母浸粉0.5 g、胰蛋白胨0.5 g、酪蛋白氨基酸0.5 g、葡萄糖0.5 g、可溶性淀粉0.5 g、丙酮酸钠0.3 g、K2HPO4 0.3 g、MgSO4·7H2O 0.05 g,蒸馏水定容至1000 mL,pH为7.2±0.2,121℃灭菌)的试管中,28℃培养5 d,离心后保留上清液待用。小麦种子用5%次氯酸钠消毒30 s,无菌水冲洗1次,充分吸干水分。将处理后的5~7颗种子放入铺有湿润滤纸的无菌培养皿中,并滴加100 μL上述过程获得的内生菌菌株上清液,28℃黑暗保湿催芽48 h,而后于28℃光照温箱中继续培养8~10 d,定期观察滤纸湿润程度并滴加适量的无菌水,分别统计测定不同菌液培养下种子的发芽率、芽长度、植物根的长度(根尖到根部)和植物叶的长度(叶尖到叶根部)。
产IAA内生菌的比色筛选:将200 μL于TSA培养基活化的菌悬液接种于装有5 mL含L色氨酸的King氏培养基和不含L色氨酸的King氏培养基的试管中,28℃培养5 d,离心后收集上清液,分别将等量的上清液和Salkowski比色液混合,室温避光静置15 min后观察,颜色变红者为能够分泌IAA的阳性菌株。
1.2.4 油菜根内生菌抑菌活性的测定 细菌和真菌平板制备:分别将靶标细菌大肠杆菌、芽孢杆菌和金黄色葡萄球菌挑取少许接种于含2 mL TSB液体培养基的试管中,30℃培养12~18 h后,取0.1 mL菌悬液分别在TSA固体培养基上涂布,晾干,用枪头在TSA固体培养基距离中心位置相同的4个点进行打孔备用。真菌黑曲霉接种到PDA培养基上进行活化,28℃培养3 d后收集孢子用0.9%生理盐水制备真菌孢子悬液。取0.1 mL孢子悬液分别在PDA固体培养基上涂布,28℃培养过夜,用枪头在距离中心位置相同的4个点进行打孔备用。
抑菌活性检测:挑取内生菌单菌落接种于含2 mL TSA培养基的试管中,30℃培养12~18 h后,取0.5 mL菌悬液10000 r·min-1离心5 min,保留上清液。取100 μL待测的培养上清液分别加至已经制备好的细菌和真菌平板的孔内,每个平板接入4种内生细菌,28℃培养24~48 h,检查孔周边是否产生抑菌圈,记录其抑菌圈的大小及菌株编号。对测试菌株和初筛中产生抑菌圈的菌株进行活化后,按初筛的步骤进行复筛,每个菌株3个平行,分别以无菌水和TSB培养基作为阴性对照。
1.2.5 油菜根内生菌固氮和产载體能力的测定 内生固氮菌筛选:将内生菌菌株分别接种于TSA固体培养基,28℃活化培养1~2 d后,挑取单菌落接种在无氮培养基上[22],28℃培养至第3 d和第7 d后观察其生长情况。挑取可在该无氮培养基中生长的菌株进行继代培养,连续传代3次后仍能在无氮培养基中生长的菌株为具有固氮能力的内生细菌。将筛选出的内生菌重新接种在无氮培养基上,挑取单克隆进行转接,每3~7 d转接1次,连续转接5次以上,观察待测菌株的生长状况,生长状况良好则认为其具有较稳定的固氮能力。
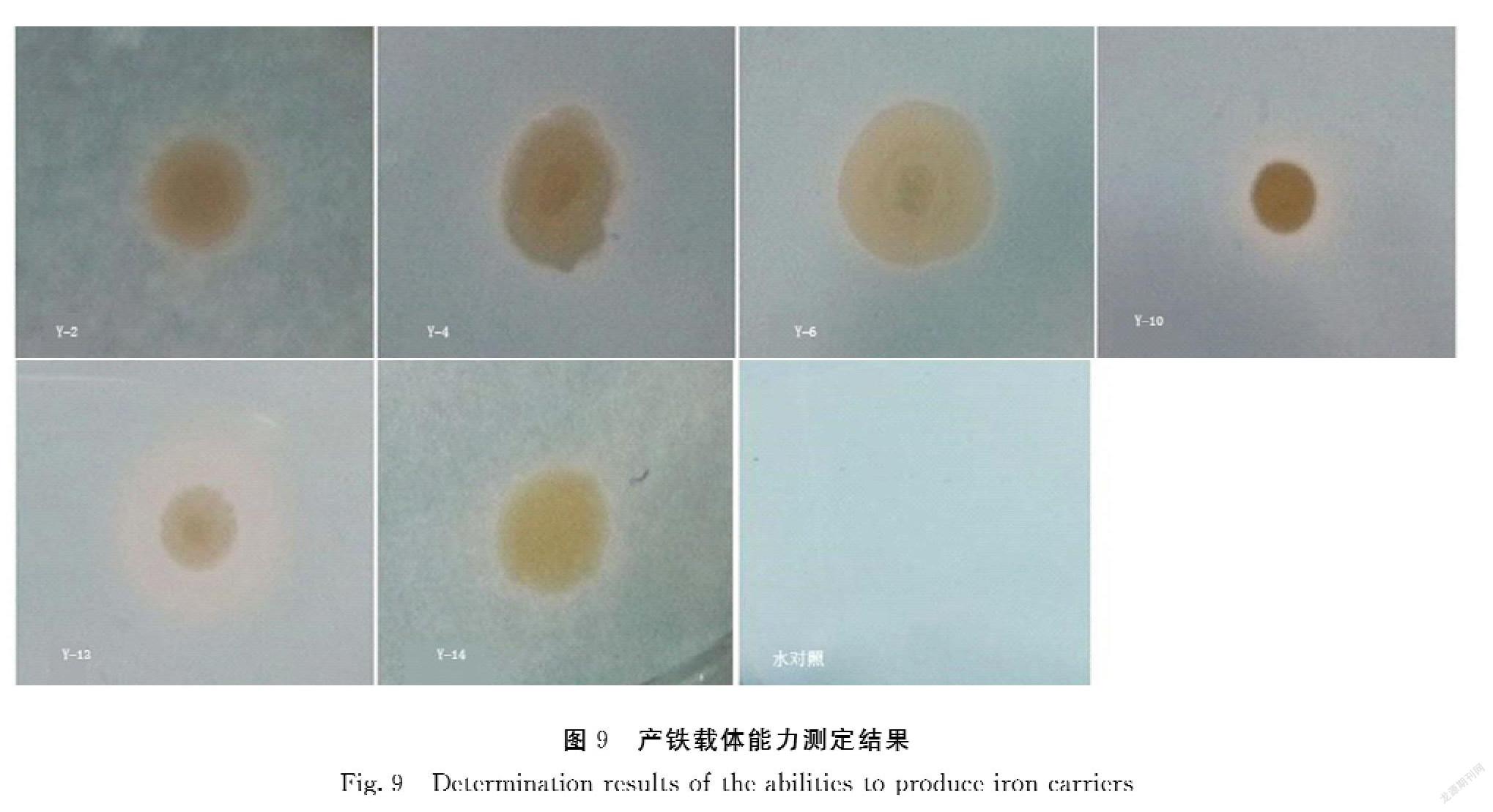
产铁载体菌筛选:取4 mL于TSB培养基中活化的菌悬液,离心后弃上清保留菌体。用枪头吸取菌体点于CAS检测平板[23](每个菌3个平行),30℃培养12 h,以无菌水作为对照。菌体周围由亮蓝色变为橙色即具有铁载体分泌圈,随后进行复筛。
2 结果与分析
2.1 油菜根内生菌的分离纯化与分子鉴定
根据平板上菌落的形态、大小及颜色差异,挑取单克隆并在新的平板划线,最终得到纯化的油菜根内生菌菌株14株。扩增分离筛选得到的细菌菌株的16S rRNA基因,测序后序列上传通过EzBioCloud数据库进行分子鉴定,其结果如表1所示。
从表1可知,分离得到的14株菌株分别属于假单胞菌属Pseudomonas、大肠杆菌属Enterobacter、芽孢杆菌属Bacillus、葡萄球菌属Staphylococcus以及莱略特菌属Lelliottia。其中,大肠杆菌属Enterobacter在油菜根分离得到的菌株中所占比例最高,为42.86%,其次为假单胞菌属Pseudomonas,所占比例为35.71%。利用Mega 5.0对测序的16S rRNA基因序列构建系统发育树,系统发育分析结果与分子鉴定结果基本一致(图1),菌株Y-2、Y-3、Y-4、Y-13、Y-14均为假单胞菌属Pseudomonas,相似性较高,且菌株
Y-2、Y-3、Y-4、Y-14在同一分支上,亲缘关系更为接近。菌株Y-1、Y-5、Y-6、Y-7、Y-8、Y-12都为肠杆菌属Enterobacter,亲缘关系很近,菌株Y-11为莱略特菌属Lelliottia。其他的如Y-10为葡萄球菌属Staphylococcus,菌株Y-9为芽孢杆菌属Bacillus,各自单独聚为一支。
2.2 油菜根内生菌木质纤维素和木聚糖降解能力测定
以分离筛选得到的14株油菜根内生菌菌株为材料,进一步筛选能够分解纤维素和木聚糖的菌株。结果表明,Y-2、Y-3、Y-4、Y-5、Y-6、Y-11、Y-12、Y-13、Y-14等9株菌株能分解纤维素,具有纤维素酶活性,且Y-2、Y-12、Y-13、Y-14等4株菌株的纤维素酶活性相对较高(图2、图3)。Y-1、Y-2、Y-3、Y-4、Y-5、Y-6、Y-9、Y-10、Y-11、Y-12、Y-13、Y-14等12株菌株能分解木聚糖,具有木聚糖酶活性,且Y-2、Y-4、Y-9、Y-10、Y-12、Y-13、Y-14等7株菌株的木聚糖酶活性相对较高(图4、图5)。
2.3 油菜根内生菌促生及产IAA活性的测定
以小麦种子为材料,分别检测14株油菜根内生菌菌株的促生长活性。结果表明,在添加色氨酸的培养基中培养后,有些菌株可以促进根的生长,如菌株Y-8、Y-12;在不添加色氨酸的培养基中培养后,有些菌株可以促进根的生长,比如菌株Y-1、Y-4、Y-5、Y-7、Y-10、Y-12、Y-13等;有些菌株则可以促进茎的生长,如菌株Y-5。就发芽率而言,添加色氨酸培养基培养的油菜发芽率整体上比不添加色氨酸培养基培养的油菜发芽率低(表2)。
在添加色氨酸的King氏培养基中培养后,假单胞菌属Y-3及肠杆菌属Y-7、Y-8共3株菌株培养上清液显红色,说明3株油菜根内生菌可以通过色氨酸途径利用色氨酸合成分泌IAA(表3、图6)。其中,肠杆菌属菌株Y-8产IAA的能力相对较强。然而,在没有添加色氨酸的King培养基中培养后,检测的14株油菜根内生菌培养上清液均没有显色,说明根内生菌在没有色氨酸存在的情况下不分泌生长素IAA。
2.4 油菜根内生菌抑菌活性测定
以分离筛选得到的14株油菜根内生菌株为材料,进一步筛选内生拮抗菌株并测定其抑菌活性。结果表明,菌株Y-1、Y-6、Y-7、Y-8、Y-12可以拮抗大肠杆菌,且Y-7拮抗大肠杆菌的能力相对较强,5株菌株均为肠杆菌属Enterobacter;菌株Y-1能拮抗枯草芽孢杆菌;菌株Y-3、Y-4能拮抗金黄色葡萄球菌,2株菌株均为假单胞菌属Pseudomonas;
Y-3、Y-4、Y-6、Y-9、Y-10、Y-14可拮抗黑曲霉,且菌株Y-3、Y-6拮抗黑曲霉的能力相对较强,其中Y-9为芽孢杆菌属Bacillus,Y-10为葡萄球菌属Staphylococcus,Y-14为假单胞菌属Pseudomonas。
2.5 油菜根内生菌固氮和产载体能力测定
以分离筛选得到的14株油菜根内生菌株为材料,进一步测定其内生固氮菌和产铁载体的能力。菌株Y-1、Y-2、Y-6、Y-10、Y-13、Y-14有一定的固氮能力,且菌株Y-1、Y-2、Y-10、Y-13、Y-14固氮能力较为稳定(图7、图8)。菌株Y-2、Y-4、Y-6、Y-10、Y-11、Y-13、Y-14等7株菌都可以产生铁载体分泌圈,且菌株Y-12和Y-16产铁载体的能力较强(图9)。
总体来说,从油菜根中分离得到的14株根内生菌具有一定的产铁载体、固氮、纤维素酶和木聚糖酶活性以及抑菌能力,且这些有益的植物特性对植物生长发育具有一定的促进作用(表3)。
3 结论与讨论
植物体内广泛分布着内生细菌、内生放线菌和内生真菌,不仅分布广泛、种类繁多,同时具多样性的功能特性,如促植物生長、生物固氮、增加宿主植物抗病害能力等,具有巨大的利用潜能[24]。目前关于植物益生菌的筛选及其应用方面的报道大多集中在模式作物拟南芥、农作物和蔬菜等,包括促生菌、抗植物病害菌、固氮菌、产铁载体菌等功能菌的分离筛选及鉴定[25]。本研究以重要油料经济作物油菜为试验材料,从油菜根中分离纯化获得14株油菜根内生菌,经鉴定14株菌株分别隶属于假单胞菌属、肠杆菌属、芽孢杆菌属、葡萄球菌属以及莱略特菌属。对分离纯化的14株内生菌株的筛选及其功能机制的初步研究表明,14株内生菌具有丰富而多样的植物益生作用,包括促生、拮抗病害菌、固氮、产铁载体等。对油菜植物根内生菌益生特性及其作用机制的初步研究,不仅丰富了现有的益生菌资源,也为功能性内生细菌的开发和利用奠定材料和理论基础。试验结果表明油菜根内生菌可以作为筛选和开发具有植物促生和病害防控作用的微生物菌剂的重要来源。
本研究筛选得到9株具有分解纤维素能力的菌株并筛选得到12株具有分解木聚糖能力的菌株,分别占所测试菌株64.3%和85.7%,表明大多数分离的油菜根内生菌具有一定的木质纤维素降解能力。该结果与前人关于植物内生菌来源的研究基本一致,有研究认为是通过降解植物细胞纤维素,破坏细胞壁,进入植物体内而成为内生菌[23,26]。纤维素酶和木聚糖酶在油菜内生菌种的广泛存在也从侧面说明具有分解木质纤维素的能力是内生菌的一个重要特征,同时也应作为评价内生菌在植物根组织内定殖的一个重要指标。植物内生细菌主要通过两种机制促进植物生长,一方面是内生细菌可以通过直接产生吲哚乙酸(IAA)或其他植物激素来促进植物生长,一方面内生菌通过生物固氮、促进植物对矿物质氮、磷等营养元素的吸收利用和对有害病原生物的防控等间接机制促进植物生长[27]。对油菜内生菌的筛选表明,内生菌菌株对测试的小麦根和芽的生长具有一定的促进作用。进一步对内生菌的促生机制进行了初步研究,结果表明,所有的内生菌菌株在不含色氨酸的培养基中均不能产生IAA,但含在色氨酸存在的情况下,3株内生细菌菌株Y-3、Y-7、Y-8具有分泌吲哚乙酸(IAA)的能力,表明油菜内生菌可以通过色氨酸途径合成吲哚乙酸(IAA)。然而,3株产IAA的菌株处理小麦之后芽长没有显著大于对照组,可能是产生了抑制作用。同时一些没有分泌IAA的供试菌株也显示了明显的植物促生作用,表明内生菌株可通过其他途径促生植物的生长,比如生物固氮为植物提供营养,或者抑制植物病害等,比如在试验中至少有5株内生菌表明了具有稳定的固氮能力。
本研究还发现油菜根内生菌具有种类多样性,同时具有多样性的益生特性,比如1株菌株可能具有多种功能,对于宿主植物,1株菌株发挥的作用可能是一种,也可能是多种,表明油菜内生菌在植物促生和病害防控中具有很大的开发和应用潜力。然而,要将内生菌株应用于农业和病害防治,不仅需要将内生菌株产生的高效稳定的益生功能特性,同时也要保证益生菌在植物内稳定定殖,比如分离的内生菌具有多种的抑菌活性表明了植物内生菌之间复杂的相互作用,这些因素会影响内生菌功能作用的发挥。进一步通过采用大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌及黑曲霉4种测试菌株,筛选得到多株拮抗内生细菌,也表明了分离的油菜内生菌表现出了对多种待测细菌和真菌菌株有明显的抑制作用。有研究表明,微生物在限铁的条件下,能够产生一种对Fe3+具有较高螯合特性的低分子量化合物,即铁载体,可以向寄主植物提供可利用的铁元素,并有效的抑制致病真菌对铁的需求,所以植物内生细菌能够通过产生铁载体抑制植物病害[28]。本研究筛选获得7株内生细菌能够分泌产生铁载体,但其分泌能力只有隶属于假单胞菌属的Y-13菌株及隶属于葡萄球菌属的Y-10菌株较强,其余菌株均不明显,筛选所得菌株是否具有植物促生作用以及生防作用还需待进一步的研究。
参考文献:
[1]殷艳,尹亮,张学昆,等.我国油菜产业高质量发展现状和对策[J] .中国农业科技导报, 2021,23(8):1-7.
[2]娄洪祥,姬建利,蒯婕,等.种植密度对油菜正反交组合产量与倒伏相关性状的影响[J].作物学报,2021,49(9):1724-1740.
[3]陆志峰,任涛,鲁剑巍.我国冬油菜种植区土壤有效镁状况与油菜施镁效果[J].华中农业大学学报,2021,40(2):17-23.
[4]皇甫海燕,史志丹,郝丽芬,等.油菜黑胫病菌T-DNA插入致病力减弱突变体的筛选及侧翼序列分析[J].华北农学报,2021,36(1):197-202.
[5]马勤,雷瑞峰,迪力热巴·阿不都肉苏力,等.环境胁迫下内生菌与宿主代谢相互作用研究进展[J].生物技术通报,2021,37(3):153-161.
[6]SCHMIDT C S,MRNKA L,LOVECKA P,et al.Bacterial and fungal endophyte communities in healthy and diseased oilseed rape and their potential for biocontrol of Sclerotinia and Phoma disease[J].Scientific reports,2021,11(1):3810.
[7]蒋圆婷,刘杨,陈德力,等.半红树植物黄槿内生菌及其代谢产物的研究进展[J].天然产物研究与开发,2021,33(2):331-41.
[8]马红梅,王璐璐,段双全.西藏2种乌头属药用植物茎内内生菌的分离与鉴定[J].安徽农学通报,2020,26(23):26-27,75.
[9]王楠,苏誉,刘文杰,等.植物内生菌中抗耐药微生物活性成分的研究进展[J].生物技术通报,2021,37(8):1-12.
[10]张国荣,翟丽霞,王燕萍,等.药用植物内生菌次级代谢产物药理作用研究进展[J].中国药房,2021,32(7):880-884.
[11]HARRISON J G,BELTRAN L P,BUERKLE C A,et al.A suite of rare microbes interacts with a dominant, heritable,fungal endophyte to influence plant trait expression[J].The ISME journal,2021,15(9):2763-2778.
[12]郎多勇,张文晋,解植彩,等.宁夏产甘草内生细菌分离纯化、拮抗植物病原菌菌株的筛选及鉴定[J].时珍国医国药,2017,28(9):2226-2228.
[13]王红珠,吴华芬,吕高卿,等.耐铅植物内生菌的筛选及其促生机制研究[J].浙江农业科学, 2021,62(4):823-827.
[14]丁绍武,张鹏,刘梦铭.植物内生菌对植物生长的影响研究进展[J].现代农业科技,2020(11):132-134.
[15]刘江苇,刘颖,徐婷,等.水稻内生菌研究进展及展望[J].生命科学研究,2021,25(3):232-239.
[16]王盈桐,李学威,陆云彪,等.苦菜、茵陈内生真菌的分离鉴定与生物活性[J].江苏农业科学,2020,48(20):265-270.
[17]张淑婷,周利华,赵文卓.植物内生细菌对植物健康的作用[J].植物医生,2020,33(1):6-11.
[18]DI F,SOWMYALAKSHMI S,SMITH D L.Plant endophytes promote growth and alleviate salt stress in Arabidopsis thaliana[J].Scientific reports,2020,10(1):1-18.
[19]MUNAKATA Y,GAVIRA C,GENESTIER J,et al.Composition and functional comparison of vetiver root endophytic microbiota originating from different geographic locations that show antagonistic activity towards Fusarium graminearum[J].Microbiological Research,2021,243:126650.
[20]付永强,袁新琳,李佼,等.早春顶凌播种绿肥油菜适宜播种量研究[J].新疆农业科技,2021(1):15-16.
[21]周泉,张小短,马淑敏,等.间作绿肥对油菜根际土壤碳氮及根际微生物的影响[J].生态学报,2017,37(23):7965-7971.
[22]金玲月,路晶晶,冯燕辉,等.患根结线虫病番茄根内生固氮菌的筛选、鉴定和系统发育分析[J].福建农业科技,2020(12):46-51.
[23]TIAN B Y,ZHANG C J,YE Y,et al.Beneficial traits of bacterial endophytes belonging to the core communities of the tomato root microbiome[J].Agriculture,Ecosystems & Environment,2017,247:149-156.
[24]徐亚军.植物内生菌资源多样性研究进展[J].广东农业科学,2011,38(24):149-152.
[25]朱永官,彭静静,韦中,等.土壤微生物组与土壤健康[J].中国科学(生命科学版),2021,51(1):1-11.
[26]TIAN B Y,CAO Y,ZHANG K Q.Metagenomic insights into communities,functions of endophytes,and their associates with infection by root-knot nematode,Meloidogyne incognita,in tomato roots[J].Scientific reports,2015,5:17087.
[27]黎烨,熊娟,张婷,等.番茄根内生细菌的促生及其优势种群的筛选和分析[J].福建农业科技,2019(11):17-24.
[28]MA R Q,CAO Y,CHENG Z Q,et al.Identification and genomic analysis of antifungal property of a tomato root endophyte Pseudomonas sp.p21[J].Antonie van Leeuwenhoek,2017,110(3):387-397.
(責任编辑:林玲娜)

