小滴玻璃化法脱除蝴蝶兰种苗建兰花叶病毒的研究
王仁睿 汤玲莉 苏仕林 刘成才 李 杰
(西南科技大学生命科学与工程学院,绵阳 621010)
蝴蝶兰(Phalaenopsis aphrodite)为兰科(Orchi⁃daceae)蝴蝶兰属(Phalaenopsis)多年生草本植物,花形奇特、花色艳丽、花期长久,具有极高的观赏价值,在观赏花卉中占有极为重要的地位,被誉为“兰中皇后”,深受消费者青睐,继而形成了蝴蝶兰产业[1~2]。我国蝴蝶兰产业从20 世纪80 年代初开始兴起,经过近几年的发展,我国由以前的蝴蝶兰输入国逐渐转变为生产输出大国,从最北新疆、内蒙古到最南端的海南岛都有蝴蝶兰生产基地[3]。但我国蝴蝶兰品质和蝴蝶兰生产强国相比仍有较大的差距,造成该现象最主要的原因是蝴蝶兰种苗普遍感染病毒,品质不佳[4~5]。
目前已报道感染蝴蝶兰病毒有25 种,其中建兰花叶病毒(Cymbidium mosaic virus,CymMV)是侵染蝴蝶兰最主要病毒之一,国际上已认识到这种病毒的危害,多数国家现已推行了种苗植物检疫证书制度,对进口蝴蝶兰严格规定不能携带此类病毒[6]。植物感染CymMV 后,叶片和花瓣出现褪绿条纹或坏死斑点,抑制植物生长[7]。植株一旦感染病毒无法根治,长期的无性繁殖导致病毒不断积累,蝴蝶兰感染CymMV 病毒的情况十分普遍。栽培无毒苗是目前生产上防治病毒的有效方法,生产无毒苗是实现无毒化栽培的核心技术[8]。
目前国内外对CymMV 病毒的脱除主要有茎尖培养[9~10]、化学药剂法[11~12]、化学药剂结合茎尖培养法[4,13]和热处理结合茎尖培养法[4,14],其中以化学药剂结合茎尖培养最常用。此外,还有纳米技术应用于CymMV 的脱除研究,用以降低病毒浓度,并增强植物对CymMV 的抗性[15]。以上几种主要的脱毒方法存在三方面的问题:①分生组织过小易褐化,据研究表明,蝴蝶兰的茎尖小于1 mm以下时褐化率和死亡率均为100%[10,14];②化学药剂对植物具有毒害作用[10,16];③化学药剂易引起种苗变异[17]。由此可见,对蝴蝶兰建立高效、安全的新型脱毒技术对于实际生产和科研研究均具有重要的意义。
超低温脱毒是在超低温保存技术上延伸出来、目前发展迅猛的一种新型脱毒技术[18~19],指将感染病原体(病毒、植原体、细菌)的材料经液氮短暂处理后脱除病原体。迄今为止,超低温脱毒技术已在15 种植物上有所应用,成功脱除了25 种病毒、2 种植原体、1 种类病毒和1 种细菌[20]。与传统脱毒方法相比,超低温脱毒技术具有不需要剥取过小的茎尖[18~19]、对植物不产生毒害、再生植株遗传稳定[21]等优势。超低温脱毒技术尚未应用于蝴蝶兰脱毒,建立该技术体系有望解决蝴蝶兰脱毒存在的以上问题。
本研究拟以感染CymMV 的蝴蝶兰品种“满天红”为试验材料,分别从蔗糖预培养浓度、预培养时间和PVS2 处理时间三个关键因素进行筛选,PVS2 是指不含生长激素的MS(Murashige and Skoog medium)液体培养基+30%甘油(w/v)+15%乙二醇+15%DMSO(dimethyl sulfoxide)+0.4 mol·L-1蔗糖,pH为5.8[22],超低温茎尖诱导类原球茎,再诱导成苗,再生植株经过RT-PCR 方法进行病毒检测,验证CymMV 的脱毒情况,脱毒苗进行增殖和生根,建立蝴蝶兰茎尖小滴玻璃化超低温脱毒体系,为兰科植物脱除CymMV 的后续研究提供了技术指导。
1 材料与方法
1.1 材料
实验材料选用本实验室收集的蝴蝶兰品种“满天红”,建立组培体系。蝴蝶兰增殖培养基为BM+BA 3.0 mg·L-1+NAA 0.2 mg·L-1+蔗糖30 g·L-1+琼脂7 g·L-1,pH值为6.0。BM成分为花宝1号(Hy⁃ponex No.1,氮、磷、钾含量分7∶6∶9)3 g·L-1+Fe.Na.EDTA 10 ml·L-1+有机物(肌醇20 000 mg·L-1+烟酸100 mg·L-1+盐酸吡哆醇100 mg·L-1+盐酸硫胺素20 mg·L-1+甘氨酸400 mg·L-1,配成100 倍母液)10 ml·L-1+蛋白胨1.5 g·L-1。培养温度为26±2℃,光照强度45µmol·m-2·s-1,光照周期14 h·d-1。
1.2 病毒检测
将超低温脱毒前、超低温脱毒后的再生植株(6 个月)各取8 株,3 次重复,经过RT-PCR 分子检测,确定病毒情况。称取0.1 g植物叶片,在研钵中添加液氮进行研磨,采用RNA试剂盒(天根生化科技有限公司)按照试剂盒说明书提取植物总RNA,采用紫外吸收法检测RNA 质量。以合格的RNA为模板,用Takara 反转录试剂盒反转录合成cD⁃NA,进行质量检查后将符合条件的cDNA 作为模板,离心管 中依次添加10×PCR buffer 2.0 µL、dNTPs(2.5 mmol·L-1)1.6 µL、cDNA 模 版1 µL、rTaq DNA 聚合酶0.2 µL,病毒正反引物(CymMVF: GTCGACCGCTTACTACGCAAAAGTGGTGTG、CymMV-R: CTGCAGCGACGGCATCGAAGAAGT⁃CAAAG)[23]各1.0µL,ddH2O 水补足至20µL,瞬时离心混匀。反应体系为:48℃保温45 min,94℃变性30 s,从60℃开始,每个循环递减0.5℃,退火30 s,72℃延伸2 min,进行10 个循环,94℃变性30 s,55℃退火30 s,72℃延伸2 min,21 个循环,72℃再延伸7 min。
1.3 蝴蝶兰茎尖小滴玻璃化超低温脱毒体系的关键因素筛选
1.3.1 不同浓度的蔗糖预培养
以确定感染CymMV 病毒的组培苗(6周苗龄)为对象,在体视显微镜下用无菌手术刀切取5~6 mm 大小的茎尖(见图1a),在BM+0.3、0.6、0.8、1.0 mol·L-1蔗糖的培养基上暗培养1 d。室温条件下用加载液(BM+2 mol·L-1甘油+0.4 mol·L-1蔗糖)处理茎尖20 min。在0℃条件下用PVS2 玻璃化溶液浸泡茎尖60 min,用移液枪吸取0℃的PVS2 溶液,在铝箔条(2×0.8 cm)上形成一个个小滴(大小约为2.5 µL)(见图1b),将茎尖逐个放入小滴中,用镊子夹住铝箔条,投入液氮,再将冷冻管投入液氮,待液氮充满冷冻管后,将铝箔条转至冷冻管,液氮保存1 h。夹起铝箔条,放入卸载液(BM+1.2 mol·L-1蔗糖)室温卸载20 min。处理完的茎尖放置在无菌的滤纸上吸干卸载液,转入再生培养基BM+GA32.0 mg·L-1+蔗糖30 g·L-1+琼脂7 g·L-1,暗培养3 d,转入类原球茎培养基BM+BA 5.0 mg·L-1+NAA 0.7 mg·L-1+活性炭2 g·L-1+蔗糖30 g·L-1+琼脂7 g·L-1[24]进行诱导,正常光照培养。
在海南建省办经济特区之前,刚硕士毕业的程立生便登上海南岛,任华南热带农业大学教师、系主任助理、教务处副处长、处长、研究生处处长。程立生还担任过3年乐东县科技副县长。
1.3.2 不同天数的蔗糖预培养
剥取的茎尖在BM+0.6 mol·L-1蔗糖的培养基上暗培养1、2、3、4 d。再经过加载、PVS2 处理、形成小滴、冷冻、卸载、再生培养,步骤同上。
1.3.3 PVS2处理时间
剥取的茎尖在BM+0.6 mol·L-1蔗糖的培养基上暗培养1 d。经过加载后,在0℃条件下用PVS2玻璃化溶液浸泡茎尖30、60、90、120、150 min,再形成小滴、冷冻、卸载、再生培养,步骤同上。
1.4 类原球茎的成苗
将诱导的类原球茎切成小块(>3 mm),转移到BM+BA 3.0 mg·L-1+NAA 0.5 mg·L-1+蔗糖30 g·L-1+琼脂7 g·L-1的培养基[24]进行生长,1 个月后类原球茎即可变绿成苗。
1.5 再生植株的增殖和生根
将再生植株逐一分成单棵,培养6个月后随机选取8 株,重复3 次,经病毒检测,将RT-PCR 阴性结果的植株转移到BM+BA 3.0 mg·L-1+NAA 0.2 mg·L-1+蔗糖30 g·L-1+琼脂7 g·L-1的培养基上进行增殖,6 周后,将增殖的植株转到1/2BM+BA 2.0 mg·L-1+NAA 0.5 mg·L-1+蔗糖30 g·L-1+琼脂7 g·L-1的培养基[14]诱导生根。
1.6 实验设计与数据分析
采用单因素实验筛选蝴蝶兰茎尖小滴玻璃化超低温脱毒体系各关键因素,每个处理选用10 个茎尖,3 次重复。超低温茎尖(+LN)指经过预培养、加载、PVS2 处理、形成小滴、液氮冷冻、卸载和再生培养阶段的茎尖,对照茎尖(-LN)指经过其他几个阶段但不经液氮冷冻的茎尖。超低温处理7 d 后统计成活率,底部褐色,分生组织绿色的蝴蝶兰茎尖(见图1c)记为成活茎尖,整体褐色的蝴蝶兰茎尖(见图1d)记为死亡茎尖,长出叶片的茎尖视为再生。
8周统计再生率:
再生率(%)=(再生茎尖数/总茎尖数)×100%(2)
数据采用SPSS 25.0 版进行单因素方差分析和t检验,数据为平均值±标准误,同列数据中不同字母代表最小显著性P<0.05,采用Sigmaplot 14.0版进行制图。
2 结果与分析
2.1 不同浓度的蔗糖预培养
成活的超低温茎尖在21 d 可观察到明显的再生(见图1e),两个月形成类原球茎(见图1f)。不同浓度的蔗糖预培养对超低温茎尖的成活率和再生率具有显著影响(见表1)。随着蔗糖浓度的增加,超低温茎尖的成活率和再生率出现先增加后降低的趋势。经BM+0.6 mol·L-1蔗糖处理1 d 后经过超低温脱毒处理,超低温茎尖的成活率为76.7%,与0.8~1.0 mol·L-1蔗糖的成活率差异不显著,再生率为56.7%,显著高于其他处理。对照茎尖在0.3~0.6 mol·L-1蔗糖范围内的成活率和再生率均高于0.8~1.0 mol·L-1蔗糖的两个处理。
2.2 不同培养时间的蔗糖预培养
随着蔗糖预培养时间的延长,对照茎尖和超低温处理茎尖的成活率和再生率均出现了下降的趋势(见表2)。蔗糖预处理1~3 d,对照茎尖和超低温茎尖的成活率、对照茎尖的再生率并未显著差异,但蔗糖预培养1~2 d,超低温处理茎尖的再生率分别为56.7%和53.3%,显著高于3~4 d 处理。当蔗糖预培养为4 d 时,超低温处理的茎尖降至6.7%。

表1 蔗糖浓度对茎尖(对照、超低温)成活率和再生率的影响Table 1 Effect of sucrose concentration in preculture medium on survival rate and regrowth rate of shoot tips(-LN and+LN)
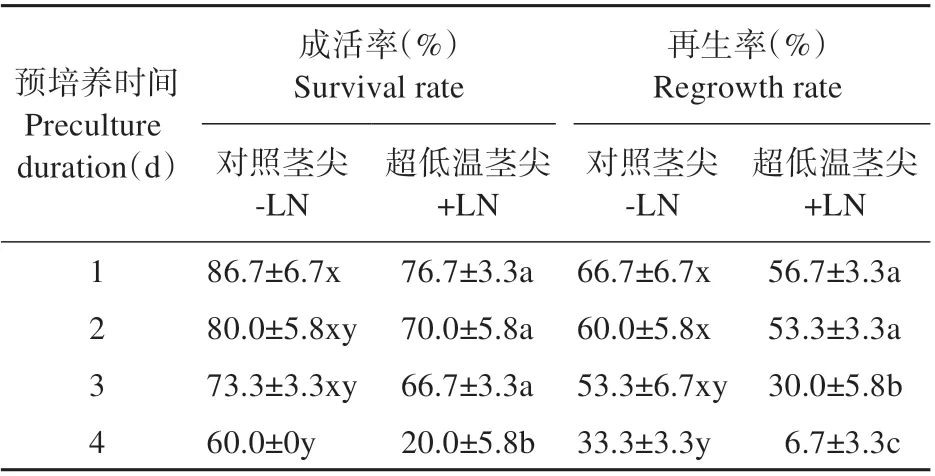
表2 蔗糖预培养天数对茎尖(对照、超低温)成活率和再生率的影响Table 2 Effect of sucrose duration in preculture medi‐um on survival rate and regrowth rate of shoot tips(-LN and+LN)
2.3 PVS2处理时间
对照茎尖的成活率和再生率随着PVS2 处理时间的延长呈逐渐下降趋势(见图2)。对于超低温茎尖而言,PVS2 处理时间对成活率和再生率影响显著,随着PVS2 处理时间的延长,成活率和再生率均出现先升高再下降的趋势。PVS2 处理60-90 min,超低温茎尖的成活率和再生率分别为66.7%~63.3% 和46.7%~43.3%,显 著 高 于 其 他时间。
筛选出最佳蔗糖预培养浓度、时间和PVS2 处理时间三个关键因素,将类原球茎分割继续培养成苗后,通过RT-PCR 进行CymMV 的检测,阴性结果的植株进行增殖(见图1g)和生根(见图1h)。
2.4 蝴蝶兰茎尖小滴玻璃化超低温脱毒体系对CymMV的脱除情况
将超低温脱毒前、超低温脱毒后的再生植株先后进行RT-PCR 病毒检测,结果显示,超低温脱毒前植株全部携带CymMV(见图3a),超低温脱毒处理后的再生植株有一半未检测到CymMV(见图3b),脱毒率为50%。
3 讨论
本研究建立了蝴蝶兰品种‘满天红’茎尖小滴玻璃化超低温脱毒体系,最佳的蔗糖预培养是BM+0.6 mol·L-1蔗糖的培养基上暗培养1~2 d;最优的PVS2 处理时间是60~90 min。超低温脱毒处理后的再生植株经RT-PCR 检测,CymMV 的脱毒率为50%。
在茎尖培养脱毒研究中,茎尖大小与成活率成正比,但与脱毒率成反比。Lim,et al.[12]报道采用病毒唑结合茎尖培养,0.1 mm 的茎尖不能成活和再生,1 mm 的茎尖可以成活但不能脱除Cym⁃MV。目前在CymMV 的脱毒研究中,主要采用药剂处理结合茎尖培养或热处理结合茎尖培养,所取的茎尖大小为1~2 mm,剥取难度大,褐化的风险增大[10,13~14];其次,脱除效率因检测手段不同而差异很大,贺嘉[4]报道药剂结合茎尖培养采用含6 g·L-1板蓝根的培养基上培养后剥取茎尖培养、38/32℃处理35 d后剥取茎尖培养和茎尖在50 mg·L-1病毒唑的培养基上培养4周三种方法进行脱毒,再生植株经RT-PCR 检测,脱毒率分别为77.3%、46.7%和33.3%;许传俊等[25]将幼苗转至含40 mg·L-1病毒唑的培养基上培养3 个月,再剥取茎尖进行培养,再生植株经ELISA 检测,脱毒率为30%;李正民[26]报道腋芽在含1.0 mg·L-1氨基寡糖素或30 mg·L-1病毒唑的增殖培养基上培养60 d,试纸条检测再生植株,氨基寡糖素和病毒唑的的脱毒率均为83.3%;刘福秀等[27]报道花梗组织培养结合5~15 mg·L-1病毒A,再生植株经DAS-ELISA 和RTPCR 检测,脱毒率分别为89.6%~100%和63.5%~74%。可以看出,DAS-ELISA 的灵敏度不够,部分研究仅采用ELISA 对脱毒苗进行检测,假阴性结果多,脱毒率比RT-PCR 检测的结果要高,因此在脱毒研究中应采用RT-PCR 方法进行检测,保证结果的可靠性。本研究中CymMV 的脱毒率为50%,与部分研究结果接近,证明超低温疗法对于脱除CymMV 是有效的,而且本研究中所取的茎尖大小为5~6 mm,大大降低茎尖剥取的难度,有效避免了褐化造成不易成活的问题。
超低温脱毒目前已经应用于李[28]、香蕉[29~30]、葡萄[31~32]、马铃薯[33~35]等多种植物,成功脱除多种病毒、类病毒、植原体和细菌。研究者们报道了品种的差异对脱毒率有很大影响,如感染了苹果褪绿叶斑病毒(Apple chlorotic leaf spot virus,ACLSV)的6 个品种经超低温处理后,脱毒率最低为60%,最高为100%[36];马铃薯10 个品种经超低温处理后,马铃薯S 病毒(Potato Virus S,PVS)的脱毒率为60%~100%[37]。植物茎尖细胞经液氮处理后,绝大部分细胞被冻死,仅有分生组织顶端几层细胞和第一、二叶原基的部分细胞能成活,病毒侵染茎尖能力不同,对于不能侵染到茎尖顶端分生组织和第一、二叶原基的病毒,超低温脱毒的脱除效率很高[38]。感染菊花B 病毒(Chrysanthemum Virus B,CVB)的茎尖经超低温处理后,经石蜡切片观察,顶端分生组织和第1~3 片叶原基细胞成活,其余区域死亡,60%的茎尖大部分区域均有CVB 的分布,包括顶端分生组织和第1~2 片叶原基,40%的茎尖顶端分生组织和第1~2 片叶原基没有检测到病毒的存在,CVB的脱毒率为30.8%[39]。目前超低温脱毒应用于脱除CymMV 的研究尚未见报道,本研究仅对蝴蝶兰一个品种开展了超低温脱毒研究,不同品种之间是否存在脱毒差异的现象、超低温脱毒对CymMV 的脱除机理等还有待进一步研究。

