支气管哮喘靶向治疗的研究进展
朱桂萍 叶伶 金美玲
复旦大学附属中山医院呼吸与危重症医学科,上海200032
支气管哮喘 (哮喘)是一种复杂的慢性气道炎症性疾病,其临床表现为反复发作的气喘、胸闷或咳嗽,伴有可逆的气流受限和气道高反应性,随着病程的延长可导致气道重塑[1]。尽管目前已有包括吸入糖皮质激素在内的很多治疗哮喘的方法,但仍有许多哮喘患者未得到完全控制。随着对哮喘研究的不断深入,目前认为哮喘是一种异质性疾病,具有不同的临床表型。个体化的治疗更加有利于哮喘的控制[2]。
目前,根据辅助性T 细胞 (Th细胞)引起的炎症过程将哮喘分为两种亚型 (高Th2 型、低Th2 型)[1]。高Th2型哮喘表现为嗜酸粒细胞性炎症,由细胞因子IL-4、IL-5 和 IL-13 等 介 导, 可 引 起 免 疫 球 蛋 白 E(i mmunoglobulin E,Ig E)升高。此外,在过敏原刺激的免疫应答中,呼吸道上皮细胞产生诸如胸腺基质淋巴生成素 (thy mic stro mal ly mphopoietin,TSLP)、IL-25和IL-33等细胞因子,这些分子通过激活树突状细胞,诱导CD4+祖细胞向CD4+Th2细胞方向成熟,从而增强Th2免疫应答。低Th2型哮喘主要表现为中性粒细胞性炎症,在某些情况下是少粒细胞性,包括Th1 [由干扰素γ (interferonγ,IFN-γ)、肿瘤坏死因子 (tu mor necrosis factor,TNF)、IL-1、IL-6 介导]或Th17 (由IL-17、IL-22 介导)等类型[1,3]。目前,已研发出多种针对炎症介质的单克隆抗体或小分子化学合成药物用于治疗哮喘,使得哮喘迈入靶向治疗时代。现对哮喘靶向治疗的进展给予综述 (图1、表1)。
1 高Th2型哮喘的靶向治疗进展
1.1 抗Ig E治疗进展 Ig E在过敏和变应性哮喘的炎症级联中起着关键的上游调控作用,在症状控制不佳的哮喘患者中,大约有2/3的患者是Ig E 介导的过敏性哮喘。高亲和力的Ig E受体 (FcεRⅠ)在肥大细胞和嗜碱粒细胞表面表达,Ig E与高亲和力受体结合,释放多种促炎介质,包括白三烯、IL-3、IL-4、IL-5、粒细胞-巨噬细胞集落刺激因子 (granulocyte-macrophage colony stimulating factor,GMCSF),这些分子促进嗜酸粒细胞和其他炎症细胞的聚集。低亲和力受体 (FcεRⅡ、CD23)表达于多种细胞,包括T细胞、巨噬细胞、B 细胞、嗜酸粒细胞和血小板。Ig E 与FcεRⅡ结合后介导并调节Ig E 的产生、B 细胞的分化以及抗原的递呈[4]。CD23在气道上皮细胞表达,B细胞局部产生的Ig E被气道上皮细胞顶端膜上的受体识别,Ig E-变应原复合物通过气道黏膜屏障,被肥大细胞和嗜碱粒细胞表面FcεRⅠ识别,导致炎症介质的脱颗粒和释放,在下呼吸道可导致嗜酸粒细胞增多,黏液分泌增多,平滑肌收缩力增强。Ig E-变应原复合物也可以被树突状细胞捕获和处理,进而促进Th2细胞的表达[5-6]。
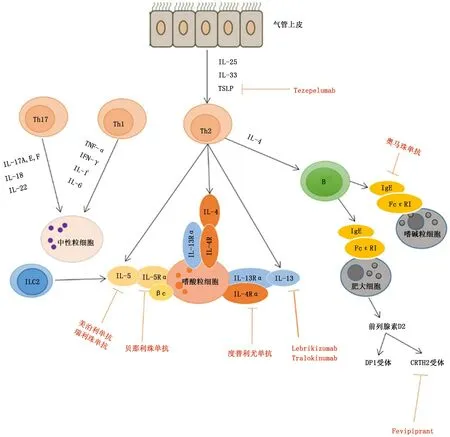
图1 参与哮喘发病机制的主要炎症介质及对应的靶向药物
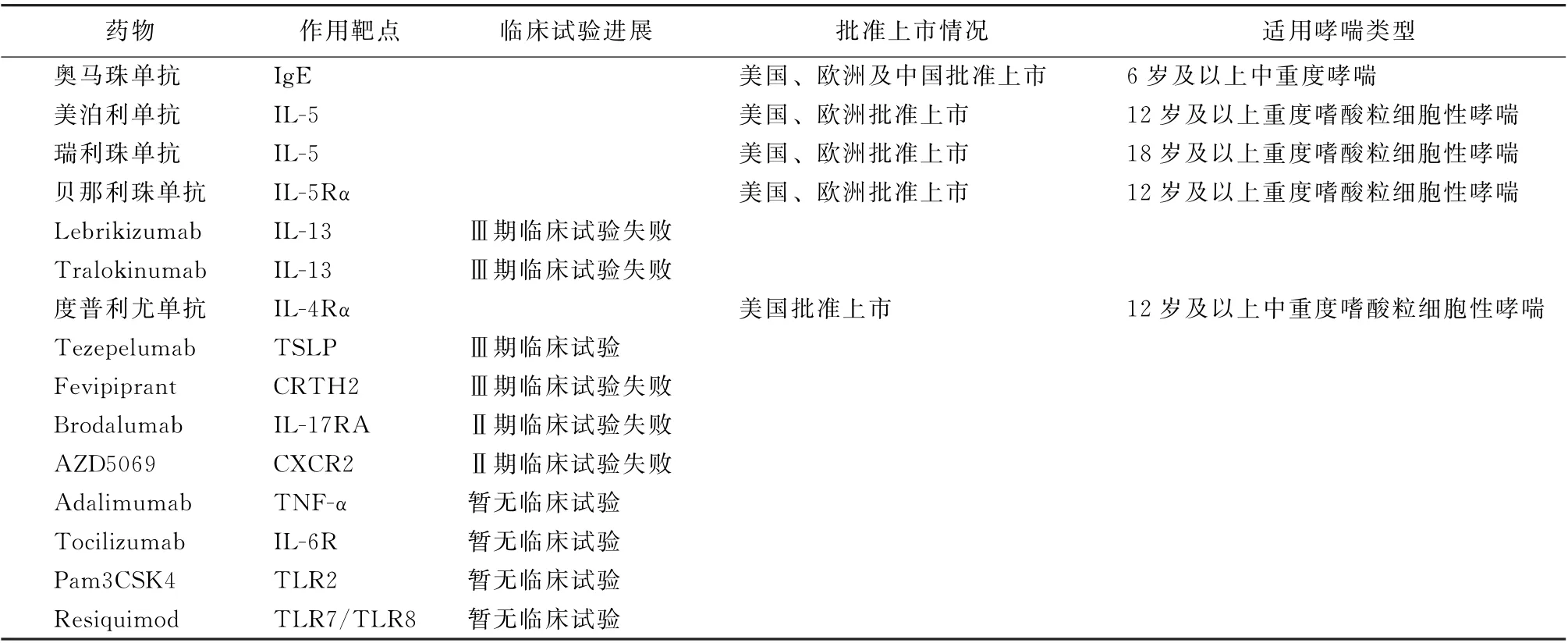
表1 哮喘的靶向治疗药物
奥马珠单抗(Omalizu mab)是针对Ig E的人源化单克隆抗体,它与活化B 细胞分泌的Ig E 的Cε3 结构域结合,阻止其与肥大细胞、嗜酸粒细胞、嗜碱粒细胞和树突状细胞上高亲和力FcεRⅠ受体的相互作用,从而阻止过敏性炎症级联反应[6]。奥马珠单抗是首个用于哮喘的生物靶向药物,在国外自2003 年上市至今已广泛用于重症过敏性哮喘,在国内自2018年上市后两年多亦有大量的临床应用病例,其有效性和安全性已得到证明。一篇纳入42项研究的系统综述证明了短期 (1年)和长期 (4年)使用奥马珠单抗治疗重度过敏性哮喘的有效性及安全性,奥马珠单抗显著减少病情恶化、缓解哮喘症状,改善肺功能,提高生活质量,减少急诊和住院次数[7]。国内关于奥马珠单抗治疗中重度过敏性哮喘患者的有效性及安全性分析中,奥马珠单抗能有效控制哮喘及过敏症状,减少哮喘急性发作次数和口服激素用量,改善患者肺功能,且不良反应发生率低,以局部风团、头晕、乏力、嗜睡为主[8]。此外,研究发现奥马珠单抗对非特应性哮喘也有较好的疗效,可显著减少患者支气管黏膜Ig E+细胞数,改善肺功能[9],为非特应性哮喘患者带来福音。
1.2 针对IL-5 的靶向治疗 IL-5 在嗜酸粒细胞的分化、成熟、活化和抑制细胞凋亡中起重要作用[10-11],IL-5主要由2型固有淋巴细胞、Th2细胞、肥大细胞、自然杀伤细胞和嗜酸粒细胞自身产生,通过与靶细胞特异性IL-5受体(IL-5 receptor,IL-5R)结合发挥作用。IL-5R 由一个IL-5受体α亚基 (alpha subunit of IL-5 receptor,IL-5Rα)和一个共同的受体β亚基 (βc)构成。IL-5特异性识别IL-5Rα,募集βc与之结合,IL-5Rα/βc调控了骨髓嗜酸粒细胞分化和成熟,细胞迁移至过敏性炎症部位,导致炎性介质的释放。βc也是IL-13 和GM-CSF 的信号转导分子,IL-13 和GM-CSF与βc结合,通过核因子κB 诱导的Bcl-xl途径介导嗜酸粒细胞存活,抑制其凋亡[12]。因此,靶向IL-5 或IL-5 R 是治疗重度嗜酸粒细胞性哮喘的一种有效方法。
针对IL-5在哮喘中的重要作用,研制出两种针对IL-5的人源化单克隆抗体:美泊利单抗 (Mepolizu mab)和瑞利珠单抗 (Reslizu mab)以及针对IL-5Rα链的贝那利珠单抗(Benralizu mab)。美泊利单抗的疗效与基线血嗜酸粒细胞密切相关,血嗜酸粒细胞>150个/μl时,美泊利单抗可显著降低哮喘急性加重发作[13]。且美泊利单抗作为重度嗜酸性哮喘患者的附加治疗,可明显改善患者的生活质量,其安全性与安慰剂相似[14]。瑞利珠单抗与IL-5 对应的氨基酸89-92区域结合,从而阻断IL-5与IL-5Rα结合,抑制IL-5诱导的细胞增殖[11],研究证明瑞利珠单抗在血嗜酸粒细胞计数升高的哮喘患者中有较好的疗效,安全性也得到了验证[15]。贝那利珠单抗通过结合IL-5 Rα抑制IL-5与之结合,增强了抗体依赖性细胞介导的细胞毒性作用,诱导嗜酸粒细胞在体外凋亡,从而降低外周血嗜酸粒细胞计数,同时抑制骨髓嗜酸粒细胞的数量[16]。数项针对贝那利珠单抗的Ⅲ期临床研究中,患者每4周或每8周接受皮下注射贝那利珠单抗30 mg,可明显减少哮喘急性加重,减少激素的使用,且长期用药 (48周以上)哮喘患者第1秒用力呼气容积 (forced expiratory volu me in the first second,FEV1)显著提升[17-19]。一项为期1年的延长的Ⅲ期临床试验证明了长期使用贝那利珠单抗的有效性及安全性[20]。
1.3 针对IL-4/IL-13的靶向治疗 IL-4和IL-13是与哮喘相关的Th2细胞因子,在Th2 反应中起着至关重要的作用。IL-4刺激B细胞产生针对特定过敏原的Ig E,并刺激Th2细胞增殖和细胞因子的产生[10]。IL-13是Th2炎症免疫反应的重要调节因子,在气道炎症和上皮重建的各个方面,包括杯状细胞化生和上皮间质信号转导中起关键作用[16,21]。IL-4和IL-13通过共同的受体成分和信号通路发挥作用。IL-4与IL-4Rα结合后,IL-4Rα既可与γ链配对形成Ⅰ型受体,主要负责IL-4信号转导,也可与IL-13受体α1 (IL-13 receprorα1,IL-13 Rα1)配对形成Ⅱ型受体。IL-13与其受体IL-13Rα1结合后可诱导与IL-4 Rα结合,形成与IL-4相同的Ⅱ型受体。IL-4和IL-13与受体结合导致Janus家族酪氨酸激酶的激活,从而导致信号转导与转录激活基因6的募集和酪氨酸磷酸化。信号转导与转录激活基因6形成二聚体并转移至细胞核,在细胞核中调控IL-4/IL-13应答基因的转录,进一步调控CD4+T 细胞向Th2细胞分化、B细胞产生特异性Ig E、加重气道炎症等[22]。
Lebrikizu mab是一种Ig G4 人源化抗IL-13 单克隆抗体,可以阻断IL-13 与IL-4Rα/IL-13 Rα1 的结合,从而阻断IL-13的活性。然而,Lebrikizu mabⅢ期临床试验结果疗效并不确切[23]。Tralokinu mab 是一种抗IL-13 单克隆抗体,可以中和IL-13,但不影响IL-4 的活性。但是该药物两项Ⅱ期临床研究结果显示Tralokinu mab 疗效并不确定[24-25];两项Ⅲ期临床试验同样未能证明Tralokinu mab对治疗哮喘有效[26],因此,Lebrikizu mab和Tralokinu mab在治疗哮喘的有效性方面没有得到验证。度普利尤单抗(Dupilu mab)是一种针对IL-4 Rα的人源化单克隆抗体,可抑制IL-4/IL-13信号通路[6,22]。研究表明在糖皮质激素依赖的重度哮喘患者中,度普利尤单抗治疗减少了口服糖皮质激素的使用,降低哮喘急性加重率,并改善了FEV1[27]。一项Ⅲ期临床试验结果显示接受度普利尤单抗治疗的患者哮喘急性加重率明显降低,肺功能和哮喘控制也更好,且嗜酸粒细胞基线水平较高的患者获益更大。最常见不良反应为肺炎和注射部位反应[28]。由于度普利尤单抗同时阻断了IL-4/IL-13信号通路,显示了明显的临床疗效,是目前最有希望的针对IL-4/IL-13靶点的药物。
1.4 TSLP在哮喘中的作用 TSLP 是支气管上皮细胞来源的细胞因子,作用于树突状细胞、肥大细胞、2 型固有淋巴细胞和嗜酸粒细胞,促进Th2 细胞分化和分泌IL-4、IL-5、IL-13 等细胞因子,在过敏性炎症中发挥重要作用[29]。Tezepelu mab是一种人源化抗TSLP 单克隆抗体,可与人类TSLP结合并阻止其与受体的相互作用。在一项针对使用长效β2受体激动剂和中高剂量吸入糖皮质激素患者的Ⅱ期临床试验中,Tezepelu mab显著减少哮喘急性加重,且其疗效与基线血嗜酸粒细胞计数无关。此外,患者肺功能和哮喘控制情况也明显改善[30]。目前正在进行Ⅲ期临床研究。
1.5 趋化因子受体同源分子 (chemoattractant receptorho mologous molecule, CRT H2)/前 列 腺 素 D2(prostaglandin D2,PGD2)在哮喘中的作用 PGD2 由肥大细胞脱颗粒释放,在过敏性炎症的调节机制中起关键作用。PGD2的生物学效应是由前列腺素D1受体、前列腺素D2受体和凝血恶烷前列腺素受体介导的。前列腺素D1受体存在于多种细胞中,具有广泛的抗炎作用。CRTH2 选择性地表达于免疫细胞,特别是嗜酸粒细胞、嗜碱粒细胞、Th2细胞和2型固有淋巴细胞[31],介导细胞迁移和激活、黏附分子的上调以及促进Th2 细胞因子 (IL-4、IL-5、IL-13)的释放[32]。
Fevipiprant是CRT H2受体拮抗剂,可显著减少中重度哮喘患者痰嗜酸粒细胞计数[33]。一项针对轻至中度哮喘患者的Ⅱ期临床研究显示在一般研究人群中,未观察到Fevipiprant对肺功能的改善作用。然而亚组分析显示,气流受限更为严重的患者 (FEV1%pred<70%)在使用Fevipiprant后肺功能和哮喘控制均得到改善[34]。对低剂量吸入糖皮质激素无法控制的哮喘患者,Fevipiprant可显著提高FEV1[35]。然而Fevipiprant的Ⅲ期临床研究没有取得满意的结果,Fevipiprant可改善患者肺功能,但并未减少哮喘年急性加重率,哮喘控制情况和生活质量也仅轻微改善[36]。
2 低Th2型哮喘的靶向治疗进展
目前对低Th2型哮喘表型了解甚少,有证据表明,哮喘患者支气管壁或痰中中性粒细胞数量与疾病严重程度和哮喘加重有关。改变中性粒细胞功能的策略包括阻断趋化因子受体2 (CXC chemokine receptor 2,CXCR2)、抑制TNF-α、IL-1、IL-6、IL-8、IL-17和IL-23的作用以及激酶抑制剂等,然而这些方法仍处于研究阶段[37-38]。
2.1 靶向IL-17的哮喘治疗进展 IL-17是一种由Th17淋巴细胞产生的细胞因子,同时也由其他类型的细胞如肥大细胞产生。哮喘患者肺中IL-17 A 和IL-17F 表达增高,且与哮喘严重程度相关,这可能是由于IL-17受体A 介导了气道平滑肌收缩导致气道高反应。IL-25 (IL-17E)也通过IL-17受体传递信号,通过激活Th2 通路,增加IL-4、IL-5、IL-13等炎性细胞因子的分泌,从而引起哮喘[4,39]。
Brodalu mab是一种针对IL-17 受体A 的单克隆抗体,作用在气道平滑肌细胞上表达的IL-17 受体A。然而在一项针对302例常规吸入糖皮质激素未控制的中重度哮喘患者的研究中,使用Brodalu mab治疗并未改善受试者的哮喘控制问卷评分、FEV1、症状评分和无症状天数[39]。
2.2 靶向CXCR2 的哮喘治疗进展 IL-8 通过高亲和力CXCR2介导中性粒细胞活化和迁移至炎症部位。CXCR2拮抗剂的作用是减少中性粒细胞从骨髓进入血液和从体循环进入组织[40]。在一项为期6 个月的随机、双盲研究中,CXCR2拮抗剂 (AZD5069)并不能减少重度哮喘患者急性加重的频率,哮喘控制问卷评分、FEV1、症状评分也没有改善[40]。因而CXCR2拮抗剂在重度难治性哮喘中的作用尚未得到证实。
2.3 其他可能的靶向低Th2型哮喘的治疗位点 TNF-α是哮喘的重要炎症介质,诱导气道炎症、气道高反应性、黏液分泌[6]。哮喘患者血清TNF-α明显升高,且与哮喘加重有关[41]。在急性哮喘小鼠模型中,TNF-α单克隆抗体(Adali mu mab)可减少支气管和细支气管周围炎症细胞浸润,减轻肺泡壁炎症和肺泡壁厚度,提示TNF-ɑ可作为治疗的靶点[42]。IL-6是一种多效性细胞因子,IL-6与受体结合启动了酪氨酸激酶/信号转导与转录激活因子3 信号级联,同时激活了丝裂原活化蛋白激酶和磷脂酰肌醇3激酶通路。IL-6具有广泛的促炎活性,可以诱导C-反应蛋白、补体成分C3、纤维蛋白原和血清淀粉样蛋白A。在中性粒细胞型、肺功能较差的重度哮喘患者痰液中IL-6 受体mRNA 和IL-6蛋白水平升高[43]。在两项病例报告中,使用针对IL-6受体的单克隆抗体 (Tocilizu mab)治疗小儿严重持续性激素抵抗性哮喘,FEV1显著改善,且未出现严重不良反应,提示针对IL-6的治疗可能是有效的[44]。
3 其他潜在的哮喘靶向治疗位点
越来越多的证据表明Toll样受体 (Toll-like receptors,TLRs)与哮喘的慢性气道炎症有关。TLRs的信号通路有两条:髓样分化因子88 (myeloid differentiation factor,My D88)通路和β 干扰素TIR 结构域衔接蛋白 (TIR domain-containing adaptor inducing interferon-β,TRIF)通路,这两种途径都与固有免疫有关。My D88或TRIF 信号激活后,启动下游的核因子κB 和丝裂原活化蛋白激酶通路,分泌细胞因子如IL-4、IL-5、IL-13、IL-1β和IL-8等,诱导免疫应答。因此,TLRs靶向治疗可能发挥有效控制哮喘气道炎症的作用[45]。近年来,TLRs激动剂被认为是控制哮喘的有效药物。Pam3CSK4是一种合成的TLR2激动剂,可以减少哮喘动物模型Th2细胞因子的释放、Ig E水平、气道高反应和气道炎症。Resiqui mod 是TLR7/TLR8激动剂,该药能抑制实验动物肺部Th1和Th2细胞因子产生,降低肺嗜酸粒细胞数、杯状细胞增生和Ig E 水平[46]。但关于TLRs激动剂的有效性、安全性仍有待进一步的研究。
4 小结
随着对哮喘认识的不断深入,已研发出许多治疗哮喘的靶向药物。诸如奥马珠单抗、美泊利单抗、贝纳利珠单抗、度普利尤单抗等已被批准上市,且取得了较好的治疗效果;其他一些靶向药物也陆续进入临床试验阶段,有效性及安全性有待进一步评估。哮喘的靶向治疗不同于肺癌,后者依赖于基因的检测。针对某种哮喘靶向药物,哪些特定患者更为获益需要更多的大样本临床研究加以证实。此外,目前的这些药物主要是针对高Th2型哮喘,对低Th2型哮喘仍然缺乏有效的靶向治疗。相信未来随着对哮喘发病机制的进一步了解,将会研发出更多针对不同哮喘表型的靶向药物,通过精准治疗使重症哮喘患者的病情得到更好的控制。
利益冲突 所有作者均声明不存在利益冲突

