加贝酯对脑缺血再灌注损伤大鼠的影响及机制研究
乔建新 刘熙鹏 刘 明 王静辉 管超楠
1.河北北方学院附属第一医院神经外科,河北张家口 075000;2.河北北方学院附属第一医院核医学科,河北张家口 075000
脑缺血再灌注损伤是指缺血性脑血管病患者通过溶栓、介入手术等手段实现血流灌注后出现的缺血区脑组织损伤进一步加重的现象,严重影响着该类患者的治疗效果和生命健康,是临床上亟待解决的医学难题之一[1]。近年来,药理学研究发现许多合成或天然物质的神经保护剂经过实验研究,证明具有抗炎、抗氧化、抗凋亡等作用,但是由于动物与人类生理机制及耐受性等方面的差异以及脑缺血后级联反应的复杂性,单一阻断某一病理环节的药物可能难以奏效,多数神经保护剂未能在临床得到广泛应用,出现临床和理论的严重脱节。所以在目前的临床治疗中,理想的神经保护剂应该具备针对缺血再灌注损伤多个损伤环节发挥保护作用的特性[2-3]。加贝酯作为一种非肽类蛋白水解酶抑制剂,近年来在改善缺血方面的作用备受关注[4]。本研究重点探讨加贝酯是否对局灶性脑缺血再灌注损伤大鼠的保护作用并探讨其机制,形成科研成果,为加贝酯应用于脑缺血再灌注损伤的临床治疗提供临床前研究数据,为脑缺血再灌注损伤的治疗提供新的治疗方案,现报道如下:
1 材料与方法
1.1 材料
1.1.1 动物 选取河北北方学院动物实验室125 只实验用清洁级雄性SD 大鼠,鼠龄7 周,体质量200~2420 g,清洁级,室温环境饲养,自由进食水,由乾元浩生物股份有限公司提供。动物许可证号:SCXK(豫)2018-0001。本研究已通过河北北方学院附属第一医院伦理委员会的审核并得到批准[批准号(科)伦审第〔2019〕107 号]。
1.1.2 药品与试剂 加贝酯(常州四药制药有限公司,规格:0.1 g,批号:201936854);苏木精-伊红(HE)染色试剂盒购自碧云天生物技术研究所(批号:2013685),Tunel 检测试剂盒购自上海沪震实业有限公司(批号:2015227);丙二醛(MDA)水平采用酶联免疫吸附实验(ELISA)检测试剂盒美国CST(批号:2018429);相关基因[B 细胞淋巴瘤因子2(bcl-2)mRNA、水溶性相关蛋白(Bax)mRNA] 表达及相关蛋白[半胱氨酸蛋白酶3(Caspase-3)、核因子κB(NF-κB)] 试剂盒均购自美国Sigma-Aldrich 公司(批号:2016594)。
1.1.3 仪器 BX53M 光学显微镜购自日本Olympus 公司;Mini-Sub 电泳仪购自美国Bio-Rad 公司。
1.2 方法
1.2.1 模型构建 选取125 只实验用清洁级雄性SD 大鼠采用改良线栓法制备局灶性脑缺血再灌注大鼠模型,制备流程:2%戊巴比妥钠腹腔注射麻醉沙土鼠,5~10 min 后将动物固定于手术台上,沿腹部颈中线开一口,分离两侧腺体及颈肌,暴露气管及左右两颈动脉,将颈动脉与神经分离,穿线备用,双侧同时进行无创微动脉夹夹闭5 min,然后松开血夹恢复血流,再灌注72 h。
1.2.2 动物分组及给药方法 将大鼠按照随机数字表法分为假手术组、模型组、加贝酯高中低剂量组,每组25 只,其中加贝酯低、中、高剂量组分别经腹腔注射加贝酯25、50、75 mg 进行干预治疗。假手术组和模型组同步给予等体积生理盐水。
1.2.3 观察指标 治疗满疗程后,行盲法神经功能评分[5],取大鼠脑组织测定其含水量和梗死体积,石蜡包埋,切片处理后行HE 染色观察大鼠脑组织病理形态学变化;行TUNEL 染色观察大鼠神经细胞凋亡状况;测定大鼠脑组织中抗氧化酶[超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)] 的活性并测定MDA 水平,测定大鼠脑组织中炎症因子[肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)] 水平,测定大鼠脑组织凋亡相关基因(bcl-2 mRNA、Bax mRNA)表达及相关蛋白(Caspase-3、NF-κB)表达。
1.3 统计学方法
采用SPSS 13.0 软件进行数据处理,计量资料以均数±标准差()表示,两组间比较采用t 检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分和神经细胞凋亡率比较
模型组神经功能缺损评分低于假手术组,神经细胞凋亡率高于假手术组,差异有统计学意义(P <0.05)。加贝酯中、高剂量组神经功能缺损评分高于加贝酯低剂量组,神经细胞凋亡率低于加贝酯低剂量组,差异有统计学意义(P <0.05)。加贝酯高剂量组神经功能缺损评分高于加贝酯中剂量组,神经细胞凋亡率低于加贝酯中剂量组,差异有统计学意义(P <0.05)。加贝酯低、中、高剂量组神经功能缺损评分高于模型组,神经细胞凋亡率低于模型组,差异有统计学意义(P <0.05)。见表1。
表1 各组大鼠神经功能缺损评分和神经细胞凋亡率比较()

表1 各组大鼠神经功能缺损评分和神经细胞凋亡率比较()
注:与模型组比较,aP <0.05;与加贝酯低剂量组比较,bP <0.05;与加贝酯中剂量组比较,cP <0.05
2.2 各组大鼠脑组织病理形态学变化
与假手术组比较,模型组神经细胞萎缩,胞质与胞核、核仁均缩小、模糊,合并大量炎症细胞浸润;与模型组比较,加贝酯低、中剂量组的仍有大量神经细胞萎缩,胞质与胞核、核仁均缩小、模糊,且存在一定炎症细胞,但尚有小部分神经细胞功能正常;而加贝酯高剂量组仅有小部分神经细胞萎缩、模糊,大部分的神经细胞胞浆和细胞核正常,且炎症细胞浸润程度明显降低。见图1。
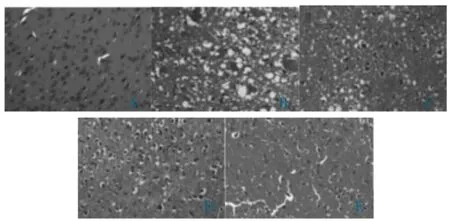
图1 各组大鼠脑组织病理形态学变化(HE 染色,100×)
2.3 各组大鼠脑组织MDA 和抗氧化酶活性比较
模型组MDA、SOD、CAT 水平高于假手术组,GSHPx 水平低于假手术组,差异有统计学意义(P <0.05)。加贝酯中、高剂量组MDA、SOD 水平高于加贝酯低剂量组,GSH-Px、CAT 水平低于加贝酯低剂量组,差异有统计学意义(P <0.05)。加贝酯高剂量组MDA、SOD 水平高于加贝酯中剂量组,GSH-Px、CAT 水平低于加贝酯中剂量组,差异有统计学意义(P <0.05)。加贝酯低、中、高剂量组MDA、SOD 水平高于模型组,CAT 水平低于模型组,差异有统计学意义(P <0.05)。加贝酯低剂量组GSH-Px 水平高于模型组,加贝酯中、高剂量组GSHPx 水平低于模型组,差异有统计学意义(P <0.05)。见表2。
2.4 各组大鼠脑组织炎症因子水平比较
模型组TNF-α、IL-1β、IL-6 水平均高于假手术组,差异有统计学意义(P <0.05)。加贝酯中、高剂量组TNF-α、IL-1β、IL-6 水平均低于加贝酯低剂量组,加贝酯高剂量组TNF-α、IL-1β、IL-6 水平均低于加贝酯中剂量组,差异有统计学意义(P <0.05)。加贝酯低、中、高剂量组TNF-α、IL-1β、IL-6 水平均低于模型组,差异有统计学意义(P <0.05)。见表3。
2.5 各组大鼠脑组织凋亡相关基因和蛋白表达比较
模型组Bax mRNA、Caspase-3、核NF-κB 均高于假手术组,bcl-2 mRNA、质NF-κB 均低于假手术组,差异有统计学意义(P <0.05)。加贝酯中、高剂量组Bax mRNA、Caspase-3、核NF-κB 均低于加贝酯低剂量组,bcl-2 mRNA、质NF-κB 均高于加贝酯低剂量组,差异有统计学意义(P <0.05)。加贝酯高剂量组Bax mRNA、Caspase-3、核NF-κB 均低于加贝酯中剂量组,bcl-2 mRNA、质NF-κB 均高于加贝酯中剂量组,差异有统计学意义(P <0.05)。加贝酯低、中、高剂量组bcl-2 mRNA、质NF-κB 均高于模型组,Bax mRNA、Caspase-3、核NF-κB 均低于模型组,差异有统计学意义(P <0.05)。见表4。
表2 各组大鼠脑组织MDA 和抗氧化酶活性比较()
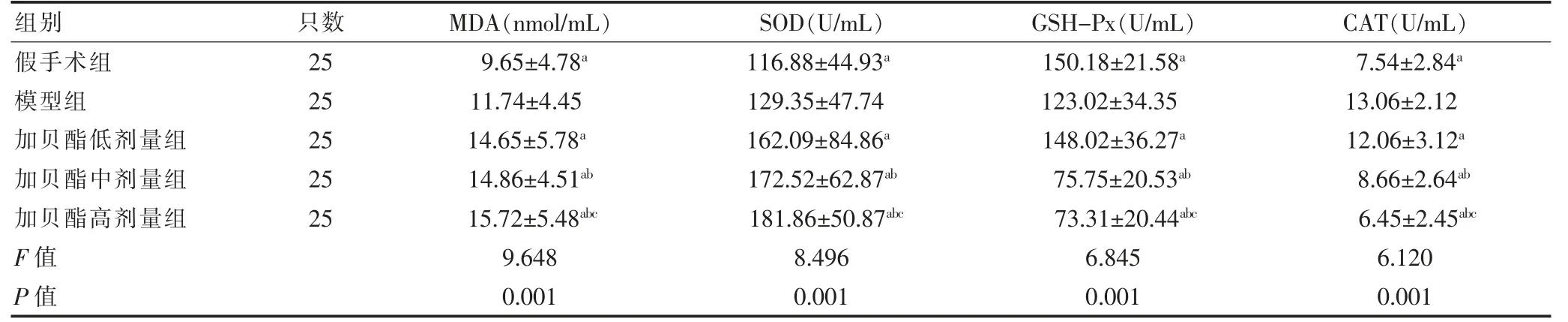
表2 各组大鼠脑组织MDA 和抗氧化酶活性比较()
注:与模型组比较,aP <0.05;与加贝酯低剂量组比较,bP <0.05;与加贝酯中剂量组比较,cP <0.05。MDA:丙二醛;SOD:超氧化物歧化酶;GSHPx:谷胱甘肽过氧化物酶;CAT:过氧化氢酶
表3 各组大鼠脑组织炎症因子水平比较()
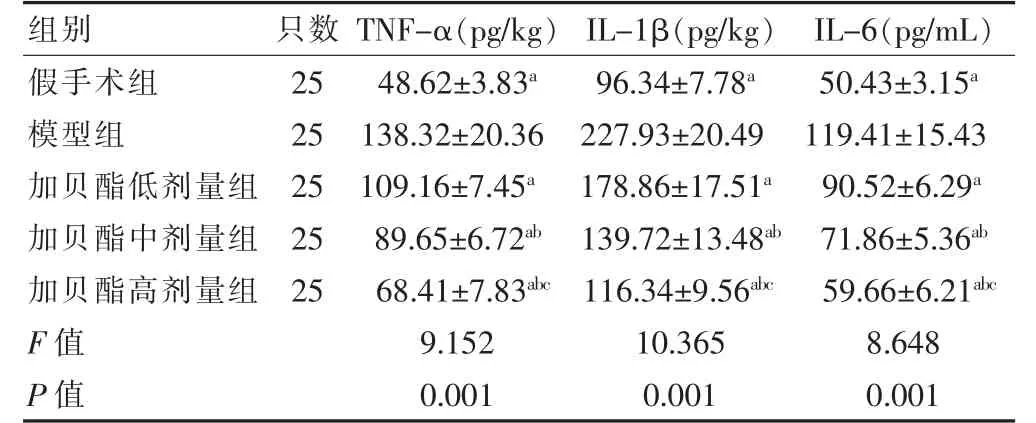
表3 各组大鼠脑组织炎症因子水平比较()
注:与模型组比较,aP <0.05;与加贝酯低剂量组比较,bP <0.05;与加贝酯中剂量组比较,cP <0.05。TNF-α:肿瘤坏死因子α;IL-1β:白细胞介素1β;IL-6:白细胞介素6
3 讨论
随着生活水平的提高、饮食结构的改变以及劳动强度的降低,尤其是高血压、高血脂、糖尿病、动脉粥样硬化等基础疾病患病人数的增多,脑血管病发病率逐年升高,尤其随着我国人口老龄化的加剧,我国脑血管病致死率已跃居疾病谱首位[6-7]。根据最新的流行病学资料显示[8],在我国每年新发生的250 万例脑血管病患者中,河北省是脑血管病发病大省。脑血管病分出血性和缺血性脑血管病两大类,其中缺血性脑血管病最为普遍(约占75%),缺血性脑血管病造成的死亡率仅次于心脏疾病,在我国国民的死亡原因统计中脑血管病已位列第2 位[9-10]。脑缺血梗死后可引起的认知功能障碍、血管性痴呆等并发症,存活者中约2/3致残,且5 年复发率高达41%,严重影响患者的生活质量,已逐渐发展成为危害人类生命健康的主要疾病之一,给患者家庭和社会带来沉重的负担,且近年来逐渐有年轻化的趋势[11-12]。
脑组织发生缺血后及时通过溶栓、介入手术等治疗手段恢复血供,挽救缺血半暗带区的神经细胞是治疗目的,也是目前临床上在缺血性脑血管病康复治疗中的首选治疗手段[13-14]。未接受溶栓治疗者脑组织中若脑血管出现自然再通有可能引起过度再灌注,而接受溶栓治疗者血管再通可达到部分有效再灌注,但部分患者在实现血流再灌注后不仅没有使组织功能恢复,反而使缺血所致的功能障碍和脑组织结构破坏进一步加重,即脑缺血再灌注损伤[15]。其主要由于微血管结构与功能完整性出现损伤,血脑屏障破坏、自身调节衰竭,同样可能发生瀑布式神经损伤级联反应所造成[3]。缺血再灌注并发症的存在严重影响缺血性脑血管病患者的预后,因此以抑制缺血再灌注损伤为切入点,研究降低脑缺血再灌注并发症损伤的药物及治疗方法,对于临床上解决脑缺血再灌注损伤具有积极推动意义[16-17]。缺血性脑血管病包括局灶性脑缺血和全脑缺血两种类型,以前者较为多见,多由脑血管栓塞所致,因此本研究选择局灶性脑缺血为研究疾病。而加贝酯是一种非肽类蛋白水解酶抑制剂,可抑制胰蛋白酶、激肽释放酶、纤维蛋白溶酶、凝血酶等蛋白酶的活性,从而制止这些酶所造成的病理生理变化,是临床上急性轻型(水肿型)胰腺炎的常用药物[18-19]。近年来药理学研究发现[20-21],加贝酯对肝脏、小肠、肺组织缺血再灌注损伤动物模型均具有一定的保护作用,具有良好的开发前景和广泛的临床应用价值,本研究结果发现,采用加贝酯的大鼠神经功能缺损评分升高,神经细胞凋亡率降低,脑组织病理损伤改善,提示加贝酯可降低神经损伤,对脑缺血后脑损伤有保护作用[22-23]。另外调查大鼠脑组织抗氧化酶活性及脂质氧化含量、炎症因子、凋亡相关基因和蛋白的研究发现,采用加贝酯的大鼠MDA、SOD、GSH-Px 均显著升高,TNF-α、IL-1β、IL-6、CAT 均显著降低,Bax mRNA、Caspase-3、核NF-κB 均显著降低,bcl-2 mRNA、质NF-κB 均显著升高。由于细胞凋亡是脑缺血疾病细胞死亡的主要原因[24],而本研究提示,加贝酯能抑制Caspase-3 凋亡通路激活,同时能抑制NF-κB 通路对缺血后脑损伤起保护作用。
表4 各组大鼠脑组织凋亡相关基因和蛋白表达比较()
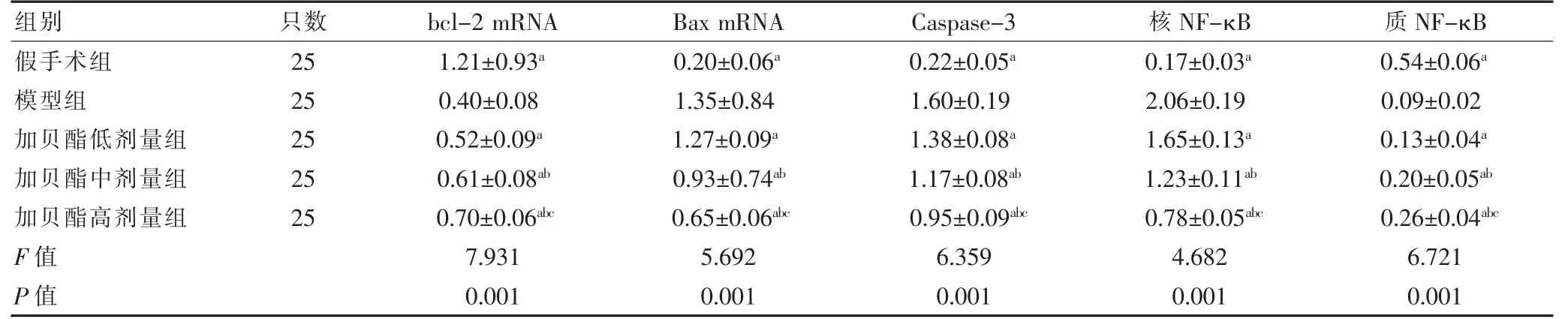
表4 各组大鼠脑组织凋亡相关基因和蛋白表达比较()
注:与模型组比较,aP <0.05;与加贝酯低剂量组比较,bP <0.05;与加贝酯中剂量组比较,cP <0.05。Caspase-3:半胱氨酸蛋白酶3;bcl-2:B 细胞淋巴瘤因子2;Bax:水溶性相关蛋白;NF-κB:核因子κB
综上所述,加贝酯能有效减轻大鼠脑缺血再灌注所致的病理损伤程度,能够抑制再灌注后脂质氧化反应,发挥保护作用,同时能够减轻炎症反应导致的损伤,而以上作用可能是通过抑制NF-κB 信号通路,提高抗氧化酶活性,以降低脑组织炎症损伤及神经细胞调亡所致。

